哺乳动物发情周期按卵泡发育、排卵和黄体形成的规律可分为卵泡期和黄体期,两者交替进行,主要受下丘脑-垂体-卵巢轴所分泌的激素调控[1]。黄体和卵泡的发育对于维持雌性动物正常的生殖至关重要。卵巢经历卵泡发育和黄体形成与退化等一系列动态变化过程,也是主要性激素和生长因子产生的场所。研究显示,卵巢能分泌雌激素、孕激素、雄激素、催产素、卵泡抑素、激活素及生长因子等物质[2]。卵泡和黄体的生理活动受神经激素的调节和外界环境条件的交互影响, 而卵泡发育主要以卵泡波的方式出现,依次经历原始卵泡、初级卵泡、次级卵泡、三级卵泡和成熟卵泡等阶段[3-4]。在卵泡的生长发育过程中,绝大多数的卵泡会发生闭锁和退化, 最终,只有少数卵泡能发育成熟至排卵[1, 3]。卵母细胞的发育状况与卵泡发育过程的命运密切相关,受内分泌激素的调节和卵巢内细胞因子生理作用的影响[5-6]。
藏绵羊长期在高寒低氧环境下繁衍生息,其繁殖率低下,产羔率只有105%[7]。目前认为,藏绵羊发情率和排卵率不高是造成其产羔率低的主要原因,另外也是环境及遗传因素交互影响的结果。目前,对于藏绵羊在卵巢发育过程中特别是卵泡及黄体的组织学变化,相关研究尚不多见。本研究采用解剖学和组织学方法,对藏绵羊的卵巢形态、卵泡和黄体的组织构造以及卵泡的超微形态进行观察,探讨组织学特征与其生理功能的关系,以揭示藏绵羊在发情期卵巢的组织学变化,为今后生产实践中采取合适的繁殖调控措施、提高产羔率提供理论依据,也可为高原家畜卵巢生理学研究提供基础资料。
1 材料与方法 1.1 试验材料2019年9月在甘肃省夏河县(海拔3 200 m)采集12只成年(2~3岁)、平均体重为38.3~46.4 kg的健康藏绵羊双侧卵巢,根据表面特征将样本分为卵泡期和黄体期卵巢,各12枚。卵泡期卵巢表面光滑、形状扁圆、颜色呈半透明、触感较软、富有弹性和波动感,表面有类似黄豆大小的红色斑块;黄体期卵巢表面粗糙且触感较硬,可见红色扁平状或锥形的突起,形状呈不规则的三角形,其大小占据卵巢体积的2/3。
1.2 主要仪器设备及试剂石蜡切片机(上海徕卡仪器有限公司RM2016);正置光学显微镜(日本尼康);游标卡尺(上海恒量量具有限公司,0~150 mm);自动脱水机、包埋机和冻台(武汉俊杰电子有限公司JJ-12 J、JB-P5、JB-L5);组织摊片机(浙江金华科迪仪器设备有限公司KD-P);波切片机(Leica UC7);透射电子显微镜(HITACHI HT770);烤箱(天津市莱玻瑞科仪器设备有限公司GFL-230);显微镜(Olympusdp-71)。苏木精染液(武汉谷歌生物科技有限公司);无水乙醇、二甲苯、盐酸和中性树胶(国药集团化学试剂有限公司);电镜固定液(Servicebio);812包埋剂(SPI)。
1.3 试验方法1.3.1 卵巢物理参数的测量和组织切片制作 分别测量左、右两侧卵巢的长、宽、厚并称重,取3 cm3 新鲜组织,置于4%甲醛固定液中固定,经脱水、透明、浸蜡、包埋、切片、粘片和烤片,脱蜡至水后将切片用苏木素染色,盐酸分化,氨水反蓝,水洗后依次投入梯度酒精中脱水,再入伊红染色,无水乙醇、二甲苯中透明,然后用中性树胶封片,镜检和采集图像。
1.3.2 透射电镜制片步骤 取新鲜卵巢皮质部组织块,进行修块,体积为1 mm3,迅速投入4 ℃电镜固定液中固定4 h。先用0.1 mol·L-1磷酸缓冲液漂洗3次,15 min·次-1,再用1%饿酸和0.1 mol·L-1磷酸缓冲液室温固定2 h,最后,再用0.1 mol·L-1 磷酸缓冲液漂洗3次,15 min·次-1。将组织依次从50%、70%、80%、90%、95%、100%的酒精、100%的丙酮中各脱水15 min。置于丙酮和包埋剂等体积混合稀释渗透2 h,丙酮和包埋剂按2∶1稀释渗透过夜,而在纯包埋剂中渗透7 h后置于包埋板中37 ℃过夜,60 ℃聚合48 h后, 用超薄切片机超薄切片,厚度为60~80 nm,进行铀铅双染色后(2%醋酸铀饱和酒精溶液,枸橼酸铅,各染色15 min),置于透射电子显微镜下进行图像采集与分析。
1.4 数据采集与分析组织切片制作完成后置于显微镜下观察并对重复3个以上的视野进行拍照,采集其整体或局部照片,运用Image pro plus 6.0软件测量卵泡的物理参数。用游标卡尺测定卵巢的长、宽、厚等指标。数值用SPSS 19.0进行T检验,分析差异显著性,其结果用“平均数±标准差”表示,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 藏绵羊卵巢的物理特征和组织形态卵巢发育阶段主要以卵泡和黄体的特征为划分依据,卵泡期卵巢主要由处在不同发育时期、大小不等的卵泡组成,大多数卵泡靠近卵巢表面呈石榴籽样(图 1A)。黄体期的卵巢呈椭圆状,其边缘有锥口形和火山口型的两种黄体类型(图 1C)。测定显示,卵泡期和黄体期卵巢的长度和重量无显著差异(P>0.05),而宽度和厚度差异显著(P < 0.05)。此外,卵巢皮质和髓质的面积分别占卵巢实质的面积比例也不同,卵泡期卵巢的皮质面积占比大于黄体期(表 1)。解剖时根据卵泡直径大小将其划分为3类,分为大(直径>5 mm)、中(3 mm < 直径 < 5 mm)、小(直径 < 3 mm)卵泡(图 1A)。切片观察显示,卵巢皮质有许多不同发育时期的卵泡,以及卵泡的副产物红体和黄体;卵巢基质中含有胶原纤维、网状纤维、平滑肌纤维及细小血管;中央髓质范围较小,主要由疏松结缔组织和丰富的血管构成(图 1E);卵巢门系膜处有许多上皮样细胞和静脉血管以及输卵管伞形成的大量小血管通过卵巢门进入卵巢髓质(图 1B、1D)。
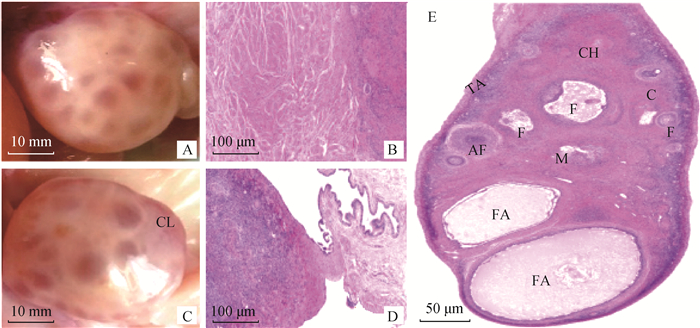
|
A. 卵泡期卵巢, 表面有大小不等的卵泡; B. 卵巢门处的上皮样细胞群和平滑肌; C. 暗红色的肉团状突起的黄体: CL.黄体; D. 卵巢门处的输卵管伞部特征; E. 卵巢组织结构横切图:F. 卵泡; TA. 白膜; CH. 红体; C. 皮质; M. 髓质; FA.卵泡腔; AF. 闭锁卵泡 A. Ovary at follicular phase, surface with follicles of different sizes; B. Epithelioid cells and smooth muscles at the hilum of the ovary; C. Dark red fleshy protuberant corpus luteum: CL. Corpus luteum; D. Features of fallopian tube umbrella at the hilum of ovary; E. Cross-sectional view of ovarian tissue structure: F. Follicle; TA. Tunica albuginea; CH. Corpus haemorrhagicum; C. Cortex; M. Medulla; F. Follicle; AF. Atresia follicle 图 1 藏绵羊卵巢组织解剖图和切片横切图 Fig. 1 Anatomy and section crosscut of ovarian tissue of Tibetan sheep |
|
|
表 1 卵巢组织的物理学参数 Table 1 Physical parameters of ovarian tissue |
观察可见,卵泡内膜和颗粒细胞发生黄体化时先形成红体(图 2A)。卵泡内膜的毛细血管逐渐伸入腔内,颗粒细胞体积增大,卵泡液逐渐消失且卵泡腔出现许多黄体小梁(图 2B、D)。卵泡颗粒细胞黄体化后形成颗粒黄体细胞,卵泡内膜细胞变圆,形成膜黄体细胞,并成团聚集分布于皱褶处(图 2C)。随着黄体进一步发育成熟,结缔组织和小梁消失,两种细胞开始增生且结构明显,颗粒黄体细胞体积显著增大呈椭圆形,直径约为50 μm,胞质呈深红色,胞核大而圆,核仁染色浅且位于黄体中央。膜黄体细胞主要分布在黄体的周边部,随着结缔组织深入,分散于颗粒黄体细胞之间,数量相对较少,胞质和核染色深,胞体小呈纺锤状,直径约为22 μm。此时,黄体内形成丰富的毛细血管且参差交替在其中,颗粒黄体细胞间也存在丰富的网状纤维和血管,尤其是以血管为中心呈条带状和放射状分布(图 2E、F)。
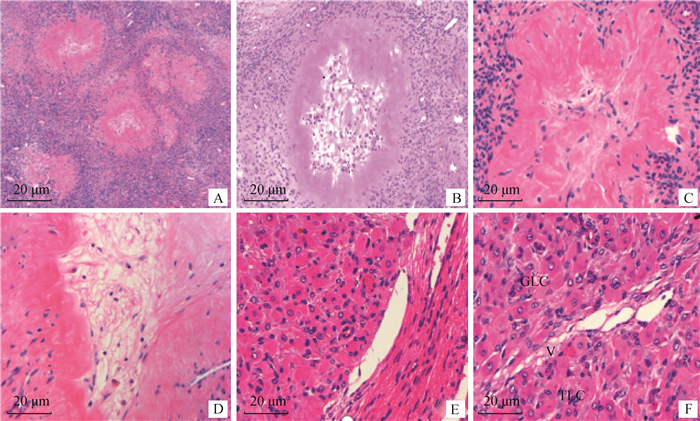
|
A.卵泡形成早期红体; B. 血管破裂形成红体; C. 红体黄体化; D. 红体发生纤维化形成黄体小梁; E. 黄体组织结构特征; F. 黄体的结构特点: V. 血管; GLC. 颗粒黄体细胞; TLC. 膜黄体细胞 A. Early follicular formation of the corpus haemorrhagicum; B. Blood vessel ruptures to form corpus haemorrhagicum; C. Corpus haemorrhagicum luteinized; D. The corpus haemorrhagicum was fibrotic and formed luteal trabeculae; E. Structural features of corpus luteum; F. Structural characteristics of corpus luteum: V. Vessel; GLC. Granular luteal cells; TLC. Theca luteal cells 图 2 黄体形成的组织学切片观察 Fig. 2 Histological section observation of luteal formation |
研究显示,原始卵泡数量多且排列于皮质浅层,体积较小,直径为36.4~38.4 μm,面积为1 366.4~ 1 768.2 μm2,卵泡细胞与周围的结缔组织以薄层基膜相隔(图 3A)。原始卵泡中的初级卵母细胞染色质细小且染色浅,核仁明显呈扁圆形,直径为8.3~10.2 μm。初级卵泡的直径为60.3~70.2 μm,面积为4 202.2~4 313.9 μm2,卵母细胞的直径为28.6~ 35.6 μm,初级卵泡中的卵泡细胞呈明、暗交替分布,明细胞数量占绝大数,胞核呈扁圆形或圆形,着色深,胞质饱满,暗细胞则相反(图 3B)。观察发现,有些处在发育期的初级卵泡,其卵泡细胞层分布不均匀,一侧为多层,另一侧仅有一层,而卵母细胞多位于间隙密的一侧(图 3C)。次级卵泡的周围由两层卵泡膜包裹,而卵泡外膜和内膜内部有毛细血管渗透于内外之间,这一时期的卵泡直径和面积分别为91.4~95.7 μm和5 382.7~8 277.2 μm2,当卵泡细胞增殖到6~12层,卵泡细胞由扁平形变成立方形,此时,透明带出现且厚度约3.5 μm(图 3D)。三级卵泡的颗粒细胞间出现一些含液体的不规则腔隙且呈月牙形,随着卵泡发育,一侧的小腔逐渐融合成较大的半月形腔,腔内充满大量卵泡液,此时,卵泡直径为95.7~221.5 μm,透明带厚度为4 μm,卵泡腔增大促使卵母细胞及周围的颗粒细胞被挤压于一侧形成卵丘结构,其余的颗粒细胞被挤压则紧贴腔面周围,形成壁层颗粒细胞(图 3E)。成熟卵泡体积达到最大,其直径为4.4~5.6 mm、面积可达1.5~2.3 mm2,但数量极少, 此时,卵泡液占据整个卵泡腔,使颗粒细胞层变薄而细胞间隙增大,放射冠与周围颗粒细胞之间联系松弛,卵泡内外膜分层更为明显,卵丘-卵母细胞复合物靠近卵泡腔一侧且紧贴卵泡内膜(图 3F)。
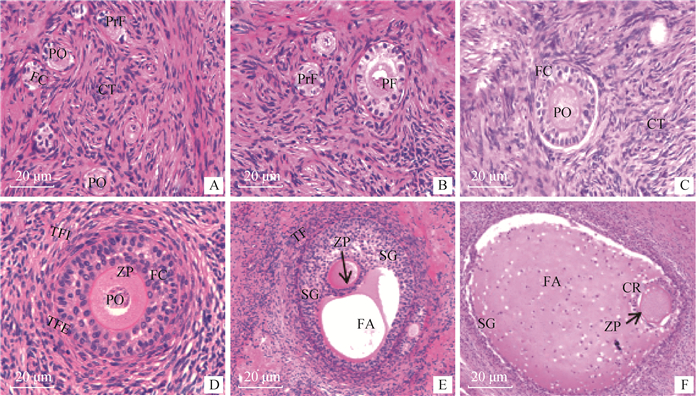
|
A. 原始卵泡; B、C. 初级卵泡; D.次级卵泡; E. 三级卵泡; F. 成熟卵泡。PO. 初级卵母细胞; FC. 卵泡细胞; CT. 结缔组织; ZP. 透明带; TFI. 卵泡内膜; TFE. 卵泡外膜; TF. 卵泡膜; SG.颗粒层; FA. 卵泡腔; CR. 放射冠 A. Primordial follicular; B, C. Primary follicles; D. Secondary follicular; E. Tertiary follicle; F. Mature follicle. PO. Primary oocytes; FC. Follicular cells; CT. Connective tissue; ZP. Zona pellucida; TFI. Theca folliculi interna; TFE.Theca folliculi externa; TF. Theca folliculi; SG. Stratum granulosum; FA. Follicular antrum; CR. Corona radiata 图 3 不同阶段卵泡发育的组织学特征 Fig. 3 Histological features of follicular development at different stages |
结果显示,在初级卵泡和次级卵泡的闭锁过程中,卵母细胞会退化或消失,而卵泡壁细胞也发生退化(图 4A)。生长卵泡的闭锁存在两种不同形态,分别是实心卵泡和囊状卵泡。实心卵泡的颗粒层和卵泡膜都向内收缩、增生且向内伸展而占据整个卵泡腔(图 4D、E)。囊状卵泡首先是颗粒层和卵泡膜萎缩,或仅是颗粒细胞发生萎缩而卵泡膜黄体化、透明化或纤维化,卵泡腔内维持原状(图 4B、C)。观察发现,卵泡壁细胞在闭锁过程中的明显特征是核固缩和细胞质扩散,颗粒层的基膜即卵泡内膜发生皱褶、加厚,还会发生透明化和纤维化,另外,颗粒细胞在卵泡腔有明显的残余(图 4F)。
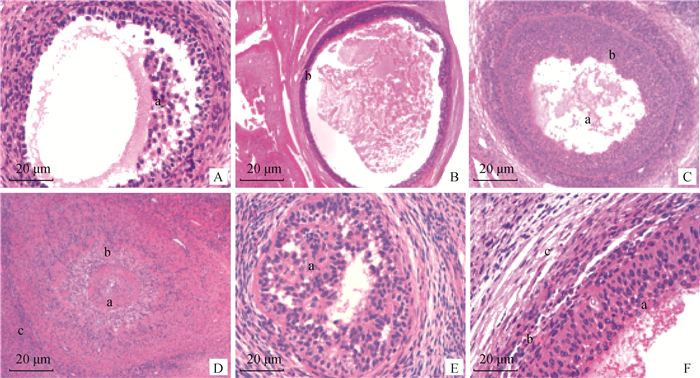
|
A. 卵泡内膜纤维化; 其中有颗粒细胞的残余(a); B. 卵泡膜内膜(b)发生纤维化; C. 囊状卵泡的闭锁, 其中颗粒细胞层发生肥大萎缩(b), 卵泡腔发生皱缩(a); D. 实心卵泡闭锁, 卵泡膜致密化(c), 颗粒层萎缩内折占据卵泡腔(b), 卵母细胞闭锁(a); E. 闭锁早期的卵泡, 颗粒细胞固缩或萎缩(a), 颗粒层和卵泡膜纤维化; F. 颗粒细胞发生固缩(a), 卵泡内膜发生肥大(b), 卵泡膜外膜发生透明化(c) A. Endometrial fibrosis; in which granular cells were remained (a); B. Fibrosis occurred in the intima of the follicular membrane (b); C. Follicular atresia, in which hypertrophy and atrophy occurred in granulosa layer (b) and follicular cavity (a); D. Solid follicular atresia, follicular membrane densification (c), granular layer atrophy and inner fold occupy follicular cavity (b), oocyte atresia (a); E. Follicles at the early stage of atresia, granulosa cell consolidation or atrophy (a), granulosa layer and follicular membrane fibrosis; F. The granulosa cells were condensed (a), the inner membrane of the follicle was hypertrophy (b), the outer membrane of the follicle was hyalinized (c) 图 4 卵泡发育中不同类型的闭锁 Fig. 4 Different types of atresia in follicular development |
通过透射电镜观察发现,卵泡主要由大量卵泡细胞呈环绕状排列在周围,可见明、暗类型的细胞交替存在,其明细胞的数量明显高于暗细胞,卵泡细胞为单层扁平细胞,卵泡细胞及其核均呈扁圆形,核质染色深且大,与长管状的膜细胞通过缝隙相连(图 5A、C)。随着卵泡的发育,细胞器数量也逐渐增加,核左侧的分布多于右侧。胞质中可见成束的微丝,早期卵泡的线粒体为圆形且数量较少,而到达生长卵泡时,线粒体呈长扁形且数量较多, 与周围的粗面内质网紧密相连,还见少量的溶酶体、高尔基体和核糖体分布于此(图 5D、5E)。细胞质中出现一些体积较小的多腔空泡,也可见从细胞核分泌的分泌物进入胞质(图 5F)。颗粒细胞增生多层时,细胞呈多边形或立方形,胞质中细胞器丰富,细胞核染色较深。观察发现,早期线粒体呈圆形,后期直径变小,形状呈哑铃型,含大量的嵴,有时与内质网和高尔基体相连接。观察发现,不同阶段卵泡细胞中高尔基体和核糖体的数量较少(图 5E)。胞质中可见脂滴,染色较浅,有时可见卵泡细胞之间通过细胞膜突触连接,其内靠近卵母细胞的卵泡细胞通过微绒毛可深入穿越于透明带,与其卵母细胞通过桥粒和缝管连接,卵母细胞和卵泡细胞接触区域存在吞饮小泡(图 5B)。
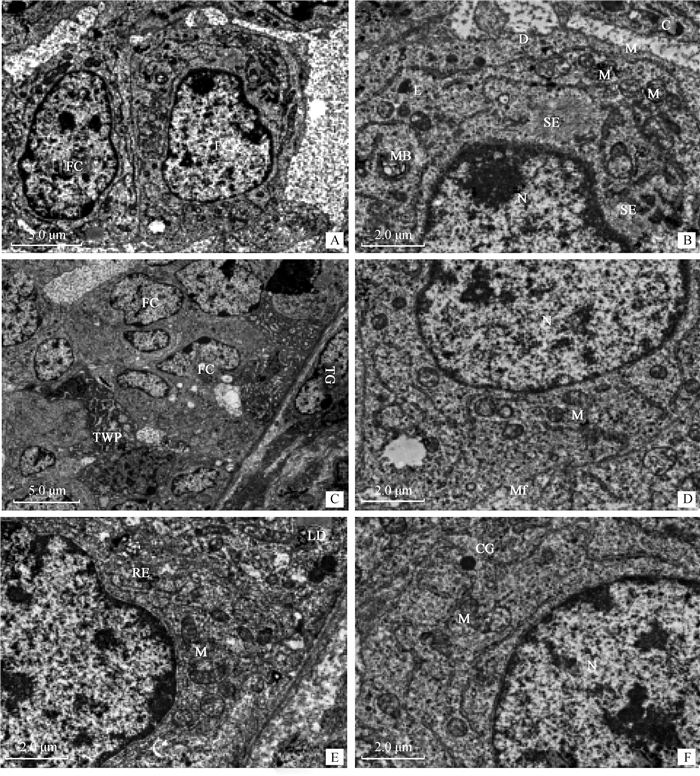
|
A. 卵泡细胞; B. 初级卵泡的一部分; C. 卵泡细胞和卵泡膜; D. 早期卵泡中的线粒体; E. 初级卵母细胞的一部分; F. 初级卵母细胞核及分泌颗粒。FC. 卵泡细胞; LY. 溶酶体; D. 桥粒; CG. 皮质颗粒; Mv. 微绒毛; M. 线粒体; SER. 滑面内质网; MB. 多泡体; N. 细胞核; TC. 膜细胞; Mf. 微丝; LD. 脂滴; RER. 粗面内质网; M.线粒体; G. 高尔基体 A. Follicular cell; B. Partial primary follicle; C. Follicular cells and follicular theca; D. Mitochondria in early follicular; E. Partial primary oocyte; F. Primary oocyte nucleus and secretory granules. FC. Follicular cell; LY. Lysosome; D. Desmosomes; CG. Cortical granules; Mv. Microvilli; M. Mitochondria; SER. Smooth endoplasmic reticulum; MB. Multivesicular body; N. Nucleus; TC. Theca cells; Mf. Microfilaments; LD. Lipid droplets; RER. Rough endoplasmic reticulum; M. Mitochondria; G. Golgi complex 图 5 卵泡细胞的微观结构特点 Fig. 5 Microstructural characteristics of follicular cells |
本研究发现,藏绵羊卵巢组织学特征和卵泡超微结构与其他哺乳动物基本相似,但藏绵羊卵巢卵泡和卵母细胞的直径与其他山羊存在差异[8],分析可能是不同饲养方式和品种的遗传特性与环境互作的结果。藏绵羊原始卵泡和初级卵泡随着发育程度的提高,其位置越靠近卵巢内部,而次级卵泡位于皮质和髓质交界区域,卵泡膜血管丰富,这与其他对低海拔山羊的报道相似[9]。有学者研究人胚胎卵巢发现,一旦第一个卵泡形成,则意味着卵泡的发育开始[10],还有学者认为,原始卵泡发育过程中有任何改变, 将会对雌性生育和健康产生重要影响[11]。本研究发现,藏绵羊原始卵泡数量多且呈动态变化,大多会发生闭锁;有些则会出现两个细胞核,而只有少数卵泡会进一步发育成初级卵泡。另外,在藏绵羊初级卵泡中发现, 有明、暗两种卵泡细胞类型,该现象也出现在水貂[12]、金色仓鼠[13]及人[3]的卵巢中,推测可能是一种卵泡的退化现象。
相关研究证实,卵泡闭锁受多种因素的综合调节,其中颗粒细胞的凋亡是卵泡闭锁的重要原因[14-15],本研究发现,不同阶段卵泡中都存在卵泡闭锁。产羔数较少的绵羊最终发育到成熟阶段的卵泡相对卵泡总数而言, 数量很少,而藏绵羊卵泡发育过程中能够发育成熟的卵泡数量更少,这可能与优势卵泡的形成机制有关。另外,有学者观察到,山羊透明带自生长卵泡初期开始形成,随着卵泡发育而逐渐增厚,这与藏绵羊透明带的出现时间和厚度变化的研究结论相似[8]。而在牛、人以及其他哺乳动物中,卵泡透明带出现的时期迥异[3, 16],这可能反映了种间差异及环境互作的不同。有研究认为,藏绵羊卵巢微血管在卵巢门处螺旋程度更高,包裹更紧密,该特征可调节卵巢内的血流速度,被认为是藏绵羊适应高原低氧环境的一个重要形态学特点[17]。本研究也发现,在藏绵羊的卵巢门处,有大量小血管进入卵巢髓质,之后,呈小分枝放射状进入皮质部,然后,分生出许多毛细血管以供给卵巢的养分需要。
研究表明,家畜黄体细胞分泌的孕酮能够抑制垂体所分泌的促卵泡素,对母畜发情起负反馈作用[18-19]。牛、绵羊、猪、大鼠、兔、猴和人均在形态和生化上有明显不同的合成类固醇激素的黄体细胞[3-4]。本研究显示,藏绵羊黄体由颗粒黄体细胞和膜黄体细胞构成,其形态特征明显,直径大小显著,其组织学特征与其他羊的基本相似[20]。另有研究表明,东北梅花鹿、东北细毛羊卵泡细胞中的细胞器主要位于细胞核两侧的胞质中,这与本研究中藏绵羊卵泡胞质中细胞器的分布特征一致[21-22]。藏绵羊卵泡膜位于外周胞质中可见游离的线粒体、核糖体和内质网聚集在核的两侧。有学者研究发现, 在豚鼠胚胎的卵泡细胞之间可观察到缝隙连接, 但卵泡细胞与卵母细胞之间没有发现[23],这与本研究的结果类似,即在藏绵羊的卵泡细胞之间也存在缝隙连接,而卵泡细胞与卵母细胞之间是通过桥粒相连。因此推测,这种结构可能是两者进行物质交换和信息交流的枢纽。另外本研究发现,随着卵泡的发育,细胞核逐渐靠近质膜,其核仁是合成、加工核糖体亚单位的装配场所[24-25],本研究观察到,胞质中有分泌的皮质颗粒,这也进一步证实了核仁具有重要生理功能。相关研究显示,在山羊和猪的卵巢中,随着卵泡的发育, 胞质基质的电子致密度逐步增大,线粒体、核糖体和粗面内网等的致密度也显著增加,说明卵母细胞的生长发育与周围的卵泡细胞密切相关[22, 26],这与本研究的结果相似,随着卵泡的发育,藏绵羊卵母细胞胞质中的线粒体、高尔基体、内质网的形态也发生相应变化,其致密化程度增强。但藏绵羊作为低氧适应家畜,虽然其卵泡发育过程中的细胞学变化与其他动物基本一致,但其适应高原低氧环境、维持卵泡发生与排卵的细胞学机理仍不明朗,有待继续深入研究。
4 结论本研究显示,藏绵羊的卵巢形态与组织学特征、卵泡的超微形态与绵、山羊的类似,但随着血管的增生, 藏绵羊的卵泡发育和黄体形成较快,卵泡闭锁在各个时期均有发生;本研究发现,在藏绵羊初级卵泡中有明、暗两种卵泡细胞类型,卵巢门处有大量的微血管供血方式;随着卵泡的发育,胞质中细胞器形态发生改变且致密化程度增加。本研究表明,藏绵羊的卵泡系统、黄体组织学特点及卵泡的超微形态能够保障卵巢在高原低氧环境中机能的正常发挥。
| [1] |
王凌燕, 王树迎, 侯衍猛, 等. 哺乳动物下丘脑-垂体-卵巢轴的研究进展[J]. 动物医学进展, 2005, 26(7): 8–11.
WANG L Y, WANG S Y, HOU Y M, et al. Progress on mammalian hypothalamus-pituitary-ovary axis[J]. Progress in Veterinary Medicine, 2005, 26(7): 8–11. (in Chinese) |
| [2] |
冒韵东. 卵巢旁/自分泌及降调节对其的影响[J]. 生殖医学杂志, 2014, 23(12): 944–949.
MAO Y D. Will ovarian paracrine/autocrine be affected by GnRH agonist/GnRH antagonist down-regulation?[J]. Journal of Reproductive Medicine, 2014, 23(12): 944–949. DOI: 10.3969/j.issn.1004-3845.2014.12.004 (in Chinese) |
| [3] |
成令忠.
组织学[M]. 2版. 北京: 人民卫生出版社, 1994: 1396-1442.
CHENG L Z. Histology[M]. 2nd ed. Beijing: People's Medical Publishing House, 1994: 1396-1442. (in Chinese) |
| [4] |
德尔曼, 布朗. 兽医组织学[M]. 秦鹏春, 聂其灼, 译. 2版. 北京: 农业出版, 1989: 280-290.
DELLMANN H D, BROWN E M. Textbook of vetcriuary histoiogy[M]. QIN P C, NIE Q Z, trans. 2nd ed. Beijing: Agricultural Press, 1989: 280-290. (in Chinese) |
| [5] |
马青年, 马蒲生, 倪江, 等. 下丘脑—垂体—(眼前房)卵巢轴的激素调节[J]. 生殖与避孕, 1981(1): 11–16.
MA Q N, MA P S, NI J, et al. Hormone regulation of hypothalamus-pituitary-(anterior chamber) ovarian axis[J]. Reproduction & Contraception, 1981(1): 11–16. (in Chinese) |
| [6] |
许爱霞, 汪雁, 徐良全, 等. 卵泡发育中相关基因的调控[J]. 生殖与避孕, 2008, 28(12): 745–750.
XU A X, WNAG Y, XU L Q, et al. The regulation of genes on follicular development[J]. Reproduction & Contraception, 2008, 28(12): 745–750. (in Chinese) |
| [7] |
赵有璋.
羊生产学[M]. 3版. 北京: 中国农业出版社, 2011: 125-127.
ZHAO Y Z. Sheep and goats production[M]. 3rd ed. Beijing: China Agricultural Press, 2011: 125-127. (in Chinese) |
| [8] |
谭景和, 孙青原, 杨增明, 等. 山羊卵母细胞发育的超微结构研究[J]. 解剖学报, 1992, 23(1): 106–110.
TAN J H, SUN Q Y, YANG Z M, et al. Ultrastructural studies on the goat oogenesis[J]. Acta Anatomica Sinica, 1992, 23(1): 106–110. (in Chinese) |
| [9] | ISLAM M R, KHANDOKER M A M Y, AFROZ S, et al. Qualitative and quantitative analysis of goat ovaries, follicles and oocytes in view of in vitro production of embryos[J]. J Zhejiang Univ Sci B, 2007, 8(7): 465–469. DOI: 10.1631/jzus.2007.B0465 |
| [10] | PETERS H, BYSKOV A G, GRINSTED J. Follicular growth in fetal and prepubertal ovaries of humans and other primates[J]. Clin Endocrinol Metab, 1978, 7(3): 469–485. DOI: 10.1016/S0300-595X(78)80005-X |
| [11] | ERICKSON G F, SHIMASAKI S. The physiology of folliculogenesis: the role of novel growth factors[J]. Fertil Steril, 2001, 76(5): 943–949. DOI: 10.1016/S0015-0282(01)02859-X |
| [12] |
曹满园, 许保增, 冯怀亮. 貉不同发育阶段卵泡及黄体超微结构[J]. 中国兽医学报, 2019, 39(7): 1347–1354, 1365.
CAO M Y, XU B Z, FENG H L. Ultrastructural study on follicles and corpus luteum of raccoon dog at different developmental stages[J]. Chinese Journal of Veterinary Science, 2019, 39(7): 1347–1354, 1365. (in Chinese) |
| [13] | WEAKLEY B S. Electron microscopy of the oocyte and granulosa cells in the developing ovarian follicles of the golden hamster (Mesocricetus auratus)[J]. J Anat, 1966, 100: 503–534. |
| [14] | MANABE N, GOTO Y, MATSUDA-MINEHATA F, et al. Regulation mechanism of selective atresia in porcine follicles: regulation of granulosa cell apoptosis during atresia[J]. J Reprod Dev, 2004, 50(5): 493–514. DOI: 10.1262/jrd.50.493 |
| [15] | ALONSO-POZOS I, ROSALES-TORRES A M, ÁVALOS-RODRÍGUEZ A, et al. Mechanism of granulosa cell death during follicular atresia depends on follicular size[J]. Theriogenology, 2003, 60(6): 1071–1081. DOI: 10.1016/S0093-691X(03)00123-7 |
| [16] |
王海龙. 鲁北白山羊早期卵泡发育及子宫输卵管的组织学研究[D]. 哈尔滨: 东北农业大学, 2003.
WANG H L. Studies on the early follicles development of Lubei white goat and histological structure of uterus and oviduct[D]. Harbin: Northeast Agricultural University, 2003. (in Chinese) |
| [17] |
王彪, 杨雅楠, 刘成泽, 等. 不同生态环境不同品种绵羊卵巢微动脉解剖学特征[J]. 中国兽医学报, 2019, 39(10): 2006–2010.
WANG B, YANG Y N, LIU C Z, et al. Comparison of anatomical characteristics of ovarian arterioles among sheep breeds in different ecological environments[J]. Chinese Journal of Veterinary Science, 2019, 39(10): 2006–2010. (in Chinese) |
| [18] | WEISS J M, HANCKE K, WORIEDH M, et al. Physiologie der lutealphase[J]. Gynäkol Endokrinol, 2008, 6(3): 143–146. |
| [19] |
张正红, 刘召远, 张经伟, 等. 家畜黄体新生血管形成的分子机制及其意义[J]. 家畜生态学报, 2020, 41(3): 81–85.
ZHANG Z H, LIU Z Y, ZHANG J W, et al. Molecular mechanism and its importance of the formation of luteal neovascularization in domestic animals[J]. Journal of Domestic Animal Ecology, 2020, 41(3): 81–85. (in Chinese) |
| [20] | O'SHEA J D, RODGERS R J, WRIGHT P J. Cellular composition of the sheep corpus luteum in the mid-and late luteal phases of the oestrous cycle[J]. J Reprod Fertil, 1986, 76(2): 685–691. |
| [21] |
马泽芳, 张林媛, 郑丁团, 等. 东北梅花鹿初级卵母细胞的超微结构[J]. 兽类学报, 2006, 26(1): 59–63.
MA Z F, ZAHNG L Y, ZHENG D T, et al. Ultrastructure of the primary oocyte in Northeast sika deer (Cervus nippon hortulorum)[J]. Acta Theriologica Sinica, 2006, 26(1): 59–63. (in Chinese) |
| [22] |
刘云波, 黄贺, 胡鹏飞, 等. 东北细毛羊胎羊卵巢卵泡超微结构研究[J]. 河北农业大学学报, 2006, 29(5): 81–85.
LIU Y B, HUANG H, HU P F, et al. Study on ultrastructure of Northeast China fine-fleece sheep fetal follicles[J]. Journal of Agricultural University of Hebei, 2006, 29(5): 81–85. (in Chinese) |
| [23] | JEPPESEN T. The ultrastructure of follicle cells in fetal guinea-pig ovaries[J]. Anat Rec, 1977, 189(4): 649–667. |
| [24] | CHOUINARD L A. A light- and electron-microscope study of the oocyte nucleus during development of the antral follicle in the prepubertal mouse[J]. J Cell Sci, 1975, 17(3): 589–615. |
| [25] |
霍中和.
细胞生物学[M]. 北京: 高等教育出版社, 2000: 135-138.
HUO Z H. Cell biology[M]. Beijing: Higher Education Press, 2000: 135-138. (in Chinese) |
| [26] |
李云龙. 猪卵巢内卵母细胞发育的超微结构研究[J]. 畜牧兽医学报, 1985, 16(2): 73–82.
LI Y L. Ultrastructure studies on the development of oocytes in the ovaries of sows[J]. Acta Veterinaria et Zootechnica Sinica, 1985, 16(2): 73–82. (in Chinese) |



