2. 美国华盛顿州立大学动物科学系, 美国华盛顿州普尔曼 99164-6310
2. Department of Animal Sciences, Washington State University, Pullman WA 99164-6310, USA
随着社会经济的发展,消费者对肉品的来源需求日渐丰富,并对肉品质的要求也随之提高。广灵驴是中国优良的地方品种之一,其具备肉质鲜嫩,出肉率高和体格高大等多种优点,具有肉用开发潜能[1]。肌内脂肪(intramuscular fat, IMF)能影响肉质的嫩度、系水力、剪切力和风味[2-3],是消费者进行肉质品质鉴定的重要指标之一,其含量取决于发育过程中脂肪细胞的增生和肥大[4-5]。IMF主要是由甘油三酯和磷脂组成,磷脂中富含软脂酸、硬脂酸、油酸、亚油酸等多种脂肪酸,从而保证了肉质的风味[6-7]。IMF沉积主要受脂肪酸合成与分解共同作用的影响,另外,还受性别、年龄、品种、营养和遗传等多个因素的影响[8-9]。但是,由于IMF的含量只能在屠宰后才能测量,这对基于个体表型值和系谱的传统育种选择方法造成了很大的困难。因此,分子育种是克服该困难的一种重要方法。
近些年已经有应用RNA-Seq测序技术进行脂肪沉积方面的研究报道,Cesar等[10]对具有显著IMF含量差异表型的牛进行了RNA-Seq研究,确定了与IMF含量相关的差异表达基因和可能的转录因子。Wang等[11]研究了晋南牛与西门塔尔牛由于IMF含量不同而产生的差异表达基因。谢光杰等[12]通过对简州大耳羊肌内前体脂肪细胞进行研究,获得了与肌内脂肪细胞成脂分化相关的信号通路及可能发挥作用的候选基因。代谢组学(metabolomics)是对特定细胞或组织在某一特定生理状态产生的所有代谢产物的定量描述及其对内外环境改变作出反应的规律性科学[13]。目前已广泛应用于肉品质的研究[14]。Ueda等[15]通过代谢组学对日本黑牛中IMF的脂肪酸组成进行研究发现,癸酸、尿酸、反油酸以及甘油-3-磷酸是IMF的潜在生物标志物。Liu等[16]对不同年龄段的鸭进行代谢组分析发现,在年龄阶段较大的鸭中,其肉质嫩度和持水力有所下降,但其肌肉中的风味物质却逐渐上升。代谢组学和基因组学的首次联合应用发生于1997年,由Oliver[17]提出。不同的组学分析具有不同的特点,进行基因组和代谢组的联合分析可以有效地将基因表达与代谢产物相结合,能更深刻地了解基因的表达产物与代谢物产生之间的内在机制,有助于进一步解释脂肪沉积的分子机制。从已发表的文献来看,还没有以驴为研究对象进行脂肪沉积研究的相关报道。
本试验以广灵驴为研究对象,对肌内脂肪含量差异明显的广灵驴进行转录组测序及代谢组分析,主要目的是找出与IMF含量相关的差异表达基因,结合差异代谢物进行关联分析,从分子水平上揭示肌内脂肪含量差异明显的广灵驴个体的遗传差异。本研究所鉴定的候选基因有助于今后进一步探究驴体内IMF沉积的分子机制,为广灵驴的分子育种提供理论依据。
1 材料与方法 1.1 试验动物及样品选择以广灵驴为研究对象,从山西省忻州市繁峙县田园毛驴养殖科技发展有限公司驴场选择30头饲养条件相同、24~36月龄的广灵驴(平均体重236.10 kg,雌性)。于屠宰后30 min内无菌采集其背最长肌组织,随后立即冷冻于液氮中保存备用。使用索氏抽提法测定30头广灵驴的肌内脂肪含量,选取年龄一致、肌内脂肪含量最低的3头驴(L组)和肌内脂肪含量最高的3头驴(H组)的背最长肌组织,用于转录组和代谢组的测序分析。
1.2 主要试剂和仪器石油醚、TRIzol、甲醇、乙腈和2-氯苯丙氨酸均为Merck级别标准品(用70%甲醇稀释成不同浓度),预冷提取剂(70%的甲醇水溶液,以含1 μg·mL-1 的2-氯苯丙氨酸当作内标溶剂)。
索氏抽提器SXT-02(上海洪纪仪器设备有限公司);超高效液相色谱(Shim-pack UFLC CBM30A, SHIMADZU)和串联质谱(QTRAP® 6500+ LC-MS/MS System, SCIEX)。
1.3 广灵驴背最长肌组织总RNA文库构建与转录组测序用TRIzol法提取广灵驴背最长肌组织的总RNA,整个提取过程在超净工作台内操作。使用Nano Photometer分光光度计、Qubit 2.0荧光计以及gilent 2100生物分析仪检测RNA纯度、浓度和完整性。构建RNA文库,使用Agilent2100、Qubit2.0和Q-PCR方法对文库质量进行初步定量和有效浓度(文库有效浓度>2 nmol·L-1)检测,检测结果达到要求后采用Illumina NovaSeq测序系统测序,100 bp配对读取测序。试验设置3个生物学重复,同一组3个重复的样品取自3头不同的驴。
1.4 广灵驴背最长肌组织代谢物的UPLC-MS/MS检测取背最长肌组织50 mg,加入1 000 μL预冷提取剂,并加入预冷的钢珠,匀浆3 min,取出钢珠,涡旋1 min,12 000 r·min-1离心10 min,取上清至进样瓶内衬管中,用于UPLC-MS/MS分析。数据采集仪器系统主要包括超高效液相色谱(UPLC)和串联质谱(MS/MS),液相条件主要包括:Waters ACQUITY UPLCHSS T3 C18色谱柱(2.1 mm×100 mm, 1.8 μm);流动相(A相为超纯水;B相为乙腈。A相和B相均包含0.04%的乙酸)。质谱条件主要包括:电喷雾离子源温度设置为500 ℃;质谱电压为5 500 V(positive),-4 500 V(negative);离子源气体I(GSI)设置为55 psi,气体II(GSI)为60 psi;气帘气为25 psi。试验设置6个生物学重复,同一组6个样品取自2头不同的驴。
1.5 转录组和代谢组数据分析、关联分析以及相关性分析对获得的转录组数据进行统计与评估,并对获得标准化的代谢组数据进行主成分分析(PCA)和正交偏最小二乘法判别分析(OPLS-DA)。基于OPLS-DA结果,获得变量重要性投影(variable influence in the projection,VIP),初步筛选出不同组间的差异代谢物。同时可以结合P值(P-value)和差异倍数FC(fold-change)进一步筛选不同组间的差异代谢物。通常认为fold-change≥2和fold-change≤0.5且VIP≥1的代谢物的为差异显著。利用KEGG数据库进行差异表达基因和差异代谢物的通路联合富集分析,使用R中的cor程序计算差异表达基因和差异代谢物的皮尔逊相关系数(Pearson),并将Pearson相关系数大于0.8的差异表达基因和差异代谢物进行相关性分析。最后利用Pearson相关系数大于0.8的基因-代谢物对构建转录-代谢物网络。
2 结果 2.1 广灵驴肌内脂肪含量显著分析本研究测定了30头广灵驴背最长肌的IMF含量。IMF含量范围为2.23%~9.00%,分别选出IMF含量最低和最高的驴各3头,分为L组和H组。用GraphPad Prism 7软件对L组和H组的IMF含量进行显著性分析,结果如表 1所示,L组的肌内脂肪含量极显著低于H组(P < 0.000 1)。
|
|
表 1 广灵驴肌内脂肪含量分析 Table 1 Analysis of intramuscular fat content of Guangling donkey |
经测序每组最少得到5 760万条原始数据,过滤原始数据中带接头、低质量(Q≤5的碱基数超过该条reads碱基数的50%)及N含量超过该read碱基数10%的reads,每组高质量读数比例均高于98.00%(5 645万),Q30碱基百分比均在93.80%及以上。每个样品所产生的测序读数成功比对到广灵驴的参考基因组的比例都高于94%,表明文库的对比精确度很高。此外,每个样品的测序读数比对到基因组外显子中的比率均在78.70%以上,说明测序的建库工作质量良好,可进行后续试验,结果见表 2。
|
|
表 2 转录组测序产出及比对效率统计 Table 2 Statistics of sequence quality and alignment efficiency of transcriptome sequencing |
通过对样本进行PCA分析,可以初步了解组间样品的代谢物差异和组内样品之间的变异度大小。如图 1A所示,代谢组在L组和H组之间分离,表明两组之间的代谢物种类和数量存在着差异。但该方法对一些相关性不明显的变量不能有效提取。相比于PCA,OPLS-DA可以过滤不相关的差异,从而将L组和H组之间的区别变得最大。对样品进行OPLS-DA分析,如图 1B所示,可看出两组样品可以明显地分为两类,说明L组与H组的代谢物表型存在显著的差异。这些结果表明,样本具有足够的重现性,适合进一步定性和定量分析验证。
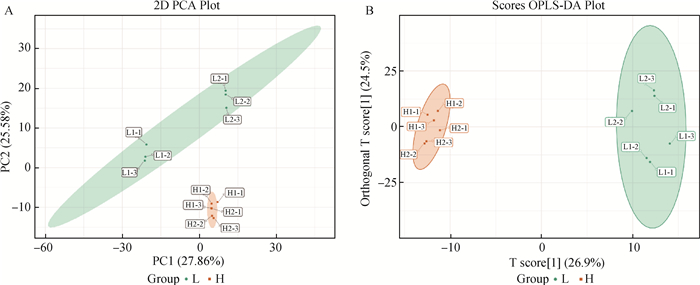
|
A. 对两组样本的PCA分析:L组为绿色,n=6, 包括L1-1、L1-2、L1-3、L2-1、L2-2、L2-3;H组为红色,n=6,包括H1-1、H1-2、H1-3、H2-1、H2-2、H2-3。B. 对两组样本进行OPLS-DA分析:L组为绿色,n=6;H组为红色,n=6 A.The PCA analysis for two groups of samples: green in group L, n=6, including L1-1, L1-2, L1-3, L2-1, L2-2 and L2-3; red in group H, n =6, including H1-1, H1-2, H1-3, H2-1, H2-2 and H2-3. B. OPLS-DA analysis was performed on two groups of samples: green in group L, n=6; red in group H, n=6 图 1 不同组广灵驴的PCA分析(A)及OPLS-DA得分图(B) Fig. 1 PCA analysis (A) and OPLS-DA score plots (B) of Guangling donkeys in different groups |
通过对同一组间平行样品进行相关性分析,可以有效地鉴定组内平行样品之间的重复性。如图 2A所示,其组间样品的Pearson相关系数接近,表明其重复样品间的相关性较强,试验数据可靠。经过代谢组学的定量分析,在L组和H组之间共鉴定出591种具有已知结构的代谢物。如图 2B所示,在591种代谢物中,有机酸(21%)、氨基酸(16%)、脂质(磷脂、氧化脂质和脂肪酸,13%)、核苷酸(10%)和碳水化合物(8%)占很大的比例。
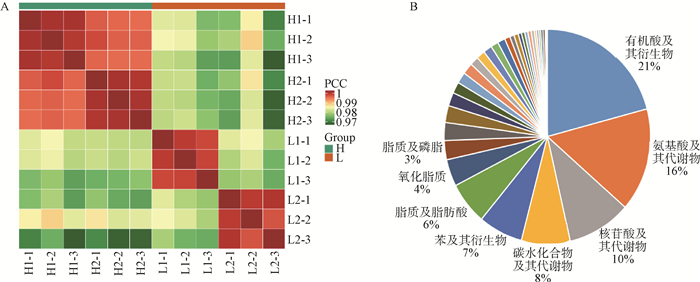
|
L组为红色,n=6, 包括L1-1、L1-2、L1-3、L2-1、L2-2、L2-3;H组为绿色,n=6,包括H1-1、H1-2、H1-3、H2-1、H2-2、H2-3 Group L is red, n=6, including L1-1, L1-2, L1-3, L2-1, L2-2 and L2-3; group H is green, n=6, including H1-1, H1-2, H1-3, H2-1, H2-2 and H2-3 图 2 代谢组学的Pearson相关系数(A)和代谢物的成分分析(B) Fig. 2 Pearson correlation coefficient (A) and composition analysis (B) of metabolites |
对L组与H组进行差异代谢物筛选,结果共鉴定出72个差异表达的代谢物(图 3A),其中有27个代谢物上调,占差异表达代谢物总数的37.5%;45个代谢物下调,占差异代谢物总数的62.5%。在L组和H组的差异累积代谢物中,脂质(脂质、磷脂、氧化脂质和脂肪酸,38%)、氨基酸(15%)、有机酸(14%)、核苷酸(13%)和碳水化合物(7%)代谢物最多(图 3B)。
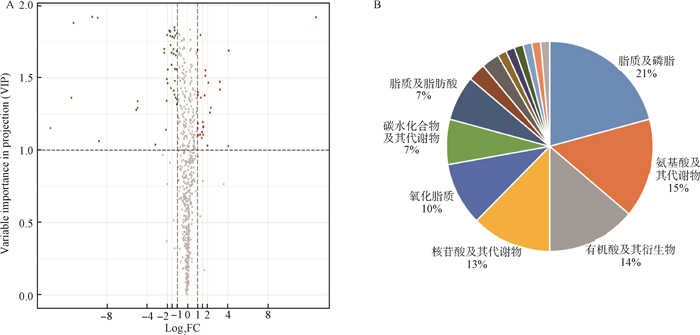
|
图 3 差异累积代谢物火山图(A)和差异累积代谢物饼状图(B) Fig. 3 Differential metabolites volcanic map(A) and differential metabolites pie chart(B) |
为了进一步了解脂肪沉积的分子机制,本研究进行了基于RNA-Seq的转录组分析,在L组和H组中检测显著差异表达基因,为了探讨与IMF沉积相关的基因与代谢物的代谢通路关系,将H组和L组间的差异表达基因和差异代谢物进行KEGG通路关联分析发现,共有35条共富集通路,39个差异基因和31种差异代谢物在这些通路中富集,其中,与IMF沉积相关的通路包括甘油酯代谢、甘油磷脂代谢、花生四烯酸代谢、亚油酸代谢和不饱和脂肪酸的生物合成5条通路,共有8个差异表达基因和15种差异代谢物在这5条通路中富集,如表 3所示,包括DGKA、DGAT2、PLA2G3、GPCPD1和SCD等差异表达基因以及甘油-3-磷酸(Glycerol-3-phosphate,G3P)、溶血卵磷脂酸16: 0(Lysophosphatidic acid,LPA)、溶血卵磷脂酰胆碱16: 0(Lysophosphatidylcholine,LPC)、二十二碳六烯酸(Docosahexaenoic acid, DHA)和花生四烯酸(Arachidonic acid, AA)等差异代谢物。
|
|
表 3 部分KEGG共富集通路 Table 3 The partial co-enrichment KEGG pathways |
对每组差异分组检测到的基因和代谢物进行相关性分析,使用R中的cor程序计算基因和代谢物的Pearson相关系数,通过九象限图展示每个差异分组里Pearson相关系数大于0.8的基因代谢物的差异倍数情况,生成九象限图(图 4):第3象限和第7象限所示的差异表达基因和差异代谢物正相关,且具有相似的一致性模式,而第1象限和第9象限所示的差异表达基因和差异代谢物负相关,且具有相反的模式。表 4显示了参与IMF沉积过程的部分差异表达基因和差异代谢物对应关系的详细信息。
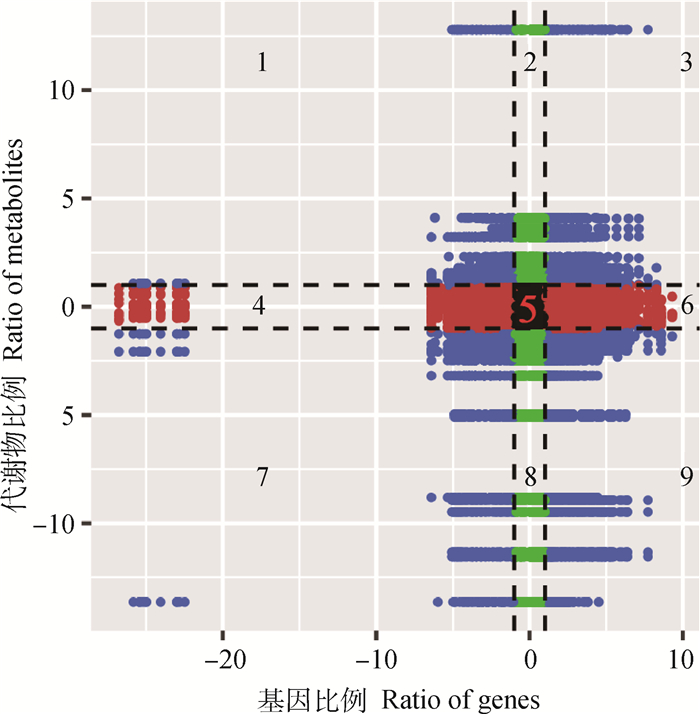
|
黑色虚线将图分成了9个象限,从左至右、从上至下,依次分为1~9个象限。1~3象限代表代谢物发生上调;7~9象限代表代谢物发生下调;3、6、9象限代表基因发生上调;1、4、7象限代表基因发生下调;第5象限代表基因和代谢物均非差异表达 The black dashed lines divide the graph into 9 quadrants, from left to right, top to bottom, and 1-9 quadrants in turn. Quadrants 1-3 represent up-regulation of metabolites; quadrants 7-9 represent down-regulation of metabolites; quadrants 3, 6, 9 represent up-regulation of genes; quadrants 1, 4, 7 represent down-regulation of genes; quadrant 5 represents genes and metabolites are not differentially expressed 图 4 相关性分析九象限图 Fig. 4 Quadrant diagram representing association of metabolomic and transcriptomic variation |
|
|
表 4 部分差异表达基因和差异代谢物对应关系的详细信息 Table 4 Detailed information on the corresponding relationship between partial DEGs and DAMs |
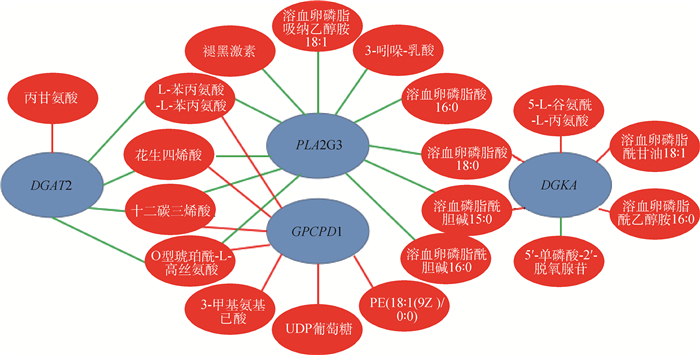
进一步通过网络图来表达代谢物和基因之间的关系,根据KEGG关联分析和九象限图分析结果,对甘油脂代谢和甘油磷脂代谢通路中相关性大于0.8的差异表达基因和差异代谢物作图,包括DGAT2、PLA2G3、GPCPD1和DGKA基因及甘油-3-磷酸、溶血卵磷脂酸16: 0、溶血卵磷脂酰胆碱16: 0和花生四烯酸等代谢物,构建了由23个节点,29个边组成的转录-代谢相关网络(图 5),13对是正相关,16对是负相关,说明甘油脂代谢通路和甘油磷脂代谢通路中的差异表达基因DGAT2、PLA2G3、GPCPD1和DGKA与它们相应的代谢产物是高度相关的。该结果有助于进一步了解驴肌内脂肪沉积的内在机制。
|
蓝色圆圈表示差异基因,红色圆圈表示差异代谢物,红线表示正相关,绿色表示负相关 Blue circles indicate differential genes, red circles indicate differential metabolites, red lines indicate positive correlation, and green lines indicate negative correlation 图 5 差异代谢物和差异表达基因的相关性网络图 Fig. 5 Correlation network diagram of differential metabolites and differentially expressed genes |
本研究结合转录组学RNA-Seq技术和代谢组学UPLC-MS/MS技术,研究H组和L组中代谢物的积累变化及基因调控规律,以揭示不同肌内脂肪含量的广灵驴体内代谢物变化内在机制,并进一步结合差异表达基因,寻找与差异代谢物密切相关的差异表达基因,根据基因的表达情况探究代谢物产生的内在规律,从而更好地理解肌内脂肪沉积的过程。代谢物检测结果显示,在L组和H组共有72个差异积累的代谢物(差异代谢物),其中脂质(脂质、磷脂、氧化脂质和脂肪酸)、氨基酸、有机酸、核苷酸和碳水化合物代谢物最多。这些数据表明,脂质和氨基酸在脂肪沉积过程中可能起着重要和特殊的作用。通过转录组和代谢组KEGG联合分析共发现35条共富集通路,与IMF沉积相关的5条通路包括甘油脂代谢、甘油磷脂代谢、花生四烯酸代谢、亚油酸代谢和不饱和脂肪酸的生物合成,共有8个差异表达基因在这5条通路中富集,包括SCD、DGAT2、GPCPD1、DGAK和PLA2G3等,这些基因在脂肪沉积过程中可能起着重要和特殊的作用,可能是IMF沉积的候选基因。
对L组和H组的脂质代谢物进行分析,结果表明,L组和H组的脂肪酸总含量差异显著,多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)含量在H组中的含量下调,以二十二碳六烯酸(DHA)和花生四烯酸(AA)含量变化最明显,而饱和脂肪酸(saturated fatty acid,SFA)和单不饱和脂肪酸(monounsaturated fatty acid,MUFA)的含量上调,包括二十烷酸(20: 0)和棕榈油酸(16: 1),该结果与Dinh等[18]对不同品种牛背最长肌中肌内脂肪和脂肪酸组成分析结果一致。二十二碳六烯酸是鱼油中的一种(n-3)多不饱和脂肪酸(PUFA),摄入鱼油可以增强脂肪β-氧化,减少脂肪组织中甘油三酯的积累从而限制脂肪细胞增大[19]。通过对差异代谢物和差异表达基因进行关联分析发现,二十二碳六烯酸和花生四烯酸的含量与SCD基因的表达成反比,这与Caputo等[20]关于人类细胞中的二十二碳六烯酸和花生四烯酸含量与SCD基因呈显著负相关的研究结果相一致。研究发现,SCD是催化SFA形成MUFA的关键酶[21],SCD基因对MUFA含量的累积具有促进作用,而对PUFA的累积具有抑制作用[22]。临床试验表明,PUFA能够抑制SCD基因的表达[23]。因此, SCD基因可作为调控驴脂肪酸组分的候选基因。
KEGG通路数据库富集分析发现了一些在甘油脂代谢和甘油磷脂代谢通路中富集的差异代谢物,其中包括溶血卵磷脂酰胆碱16: 0(LPC)、甘油-3-磷酸(G3P)和溶血卵磷脂酸16: 0(LPA),它们在H组中的含量均发生下调。这与Xu等[24]对高、低肌内脂肪含量猪的研究结果相似,其研究表明,甘油脂代谢和甘油磷脂代谢途径在脂肪沉积中发挥了重要作用。关联分析结果显示,这些差异代谢物与DGAT2、PLA2G3、GPCPD1和DGAK 基因显著相关。DGAT2是使甘油二酯(DAG)与脂肪酸酰基反应生成甘油三酯的关键酶[25]。朱武政等[26]研究发现,DGAT2基因与肉用山羊不同部位的IMF含量均呈正相关,说明DGAT2基因对IMF的沉积具有一定的调控作用。PLA2G3是分泌型磷脂酶A2(sPLA2)的一种亚型,可水解sn-2位的甘油磷脂,导致溶血磷脂的产生和游离脂肪酸的释放,是水解氧化型低密度脂蛋白(ox-LDL)产生溶血卵磷脂酰胆碱16: 0的关键酶[27-28]。溶血卵磷脂酰胆碱16: 0可以将胆碱和脂肪酸转运到组织中,也可以通过激活质膜上的4型葡萄糖转运蛋白(GLUT4)来刺激脂肪细胞吸收葡萄糖[29-30]。此外,溶血卵磷脂酰胆碱16: 0可以诱导血管平滑肌细胞内血管内皮生长因子(VECF),实现促增殖效应[31]。转录组的分析结果表明,与L组相比,PLA2G3基因在H组中的表达上调,VEGFA在H组中的表达较低,这与较早的报道一致,即在具有高肌内脂肪的伯克希尔猪中VEGFA的表达较低[32]。作为编码血管生成的关键分子,VEGFA的表达通过激活Src酪氨酸激酶信号传导,从而刺激内皮的增殖,进一步促进骨骼肌再生[33],从而促进肌肉的发育。GPCPD1能将甘油二磷酸酯水解为胆碱和甘油-3-磷酸。在本研究中,甘油-3-磷酸的含量与GPCPD1基因的表达量呈正比,这也与Marchan等[34]的研究结果一致。另外,Stewart等[35]研究显示,沉默GPCPD1基因会使溶血卵磷脂酸16: 0的含量降低。溶血卵磷脂酸16: 0是一种生物活性磷脂,通过G蛋白偶联受体(LPA1-6)影响细胞信号传导和功能,由分泌的自分泌运动素(ATX)产生[36]。研究表明,溶血卵磷脂酸16: 0是脂肪细胞生长和分化的调节剂,外源施用溶血卵磷脂酸16: 0可使前脂肪细胞的增殖速度加快[37-39],抑制甘油三酯积累和PPARγ基因表达,并能抑制脂肪细胞的分化[40]。DGKA可以催化1,2-二酰基甘油产生磷脂酸[41],而Nakano等[42]的研究表明,DGKA基因缺陷小鼠脂肪细胞的脂解活性较低,从而促进脂肪细胞脂肪堆积。因此DGAT2、PLA2G3、GPCPD1和DGKA基因可能是脂肪沉积的候选基因。
此外,本研究通过KEGG关联分析和相关性分析构建了由23个节点,29个边组成的转录-代谢相关网络,由此进一步了解甘油脂代解和甘油磷脂代谢通路中差异代谢物和差异表达基因之间的关系,其中13对是正相关,16对是负相关。包括上述的DGAT2、PLA2G3和DGKA等差异基因及甘油-3-磷酸、溶血卵磷脂酸16: 0、溶血卵磷脂酰胆碱16: 0和花生四烯酸等差异代谢物,说明甘油脂代谢通路和甘油磷脂代谢通路中的DGAT2、PLA2G3、GPCPD1和DGKA基因与它们相应的代谢产物是高度相关的。这些结果为深入探究基因及代谢物产物的互作关系,进一步了解脂肪沉积的内在机制奠定了理论基础。
4 结论研究利用转录组学和代谢组学结合的方式比较鉴定了IMF含量极高和极低驴的差异表达基因和差异代谢物。这些差异表达基因和差异代谢物主要在甘油脂代谢、甘油磷脂代谢、花生四烯酸代谢、亚油酸代谢和不饱和脂肪酸的生物合成通路中富集。在这5条通路还筛选出了与差异代谢物密切相关的差异表达基因,包括DGKA、DGAT2、PLA2G3、GPCPD1和SCD。通过KEGG关联分析和相关性分析结果构建的网络图进一步说明甘油脂代谢和甘油磷脂代谢通路中DGAT2、PLA2G3、GPCPD1和DGKA基因与它们相应的代谢产物是高度相关的。本研究所鉴定的差异表达基因可作为IMF沉积相关的潜在候选基因,为今后进一步探究驴IMF沉积的分子调控机制和驴肉品质的分子育种提供了理论依据。
| [1] |
梁全. 广灵驴品种的保护与开发[J]. 中国畜牧业, 2015(8): 53–54.
LIANG Q. Protection and development of Guangling donkey[J]. China Animal Industry, 2015(8): 53–54. DOI: 10.3969/j.issn.2095-2473.2015.08.026 (in Chinese) |
| [2] | VERBEKE W, VAN OECKEL M J, WARNANTS N, et al. Consumer perception, facts and possibilities to improve acceptability of health and sensory characteristics of pork[J]. Meat Sci, 1999, 53(2): 77–99. DOI: 10.1016/S0309-1740(99)00036-4 |
| [3] | WOOD J D, ENSER M, FISHER A V, et al. Fat deposition, fatty acid composition and meat quality: A review[J]. Meat Sci, 2008, 78(4): 343–358. DOI: 10.1016/j.meatsci.2007.07.019 |
| [4] | HOCQUETTE J F, GONDRET F, BAÉZA E, et al. Intramuscular fat content in meat-producing animals: development, genetic and nutritional control, and identification of putative markers[J]. Animal, 2010, 4(2): 303–319. DOI: 10.1017/S1751731109991091 |
| [5] | PÓVILO C, BENÍTEZ R, FERNÁNDEZ A, et al. Longissimus dorsi transcriptome analysis of purebred and crossbred Iberian pigs differing in muscle characteristics[J]. BMC Genomics, 2014, 15: 413. DOI: 10.1186/1471-2164-15-413 |
| [6] |
李鹤琼, 罗海玲. 反刍动物肌内脂肪及脂肪酸调控研究进展[J]. 中国畜牧杂志, 2019, 55(8): 1–5, 12.
LI H Q, LUO H L. Advances in regulation of intramuscular fat and fatty acids in ruminants[J]. Chinese Journal of Animal Science, 2019, 55(8): 1–5, 12. (in Chinese) |
| [7] |
袁倩, 王宇, 苏琳, 等. 饲养方式对苏尼特羊肌内脂肪沉积途径AMPK-ACC-CPT1通路和肉品品质的影响[J]. 食品科学, 2019, 40(1): 31–36.
YUAN Q, WANG Y, SU L, et al. Effects of different feeding systems on intramuscular fat deposition pathway AMPK-ACC-CPT1 and meat quality in Sunit lamb[J]. Food Science, 2019, 40(1): 31–36. (in Chinese) |
| [8] |
张海波, 官久强, 周建旭, 等. 牦牛不同肌肉组织的肌内脂肪含量与脂肪代谢相关基因表达的相关性分析[J]. 中国畜牧杂志, 2020, 56(8): 73–77.
ZHANG H B, GUAN J Q, ZHOU J X, et al. Correlation analysis of intramuscular fat content and fat metabolism related gene expression in different muscle tissues of Yaks[J]. Chinese Journal of Animal Science, 2020, 56(8): 73–77. (in Chinese) |
| [9] | WANG H, WANG J, YANG D D, et al. Expression of lipid metabolism genes provides new insights into intramuscular fat deposition in Laiwu pigs[J]. Asian-Australas J Anim Sci, 2020, 33(3): 390–397. DOI: 10.5713/ajas.18.0225 |
| [10] | CESAR A S M, REGITANO L C A, REECY J M, et al. Identification of putative regulatory regions and transcription factors associated with intramuscular fat content traits[J]. BMC Genomics, 2018, 19(1): 499. DOI: 10.1186/s12864-018-4871-y |
| [11] | WANG X, ZHANG Y Q, ZHANG X Z, et al. The comprehensive liver transcriptome of two cattle breeds with different intramuscular fat content[J]. Biochem Biophys Res Commun, 2017, 490(3): 1018–1025. DOI: 10.1016/j.bbrc.2017.06.157 |
| [12] |
谢光杰, 王永, 许晴, 等. 简州大耳羊肌内脂肪细胞成脂分化差异表达基因的筛选与鉴定[J]. 畜牧兽医学报, 2020, 51(7): 1525–1536.
XIE G J, WANG Y, XU Q, et al. Selection and validation of the differentially expressed genes during the adipogenic differentiation of Jianzhou Da'er goat intramuscular adipocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(7): 1525–1536. (in Chinese) |
| [13] |
纪勇, 郭盛磊, 杨玉焕. 代谢组学方法研究进展[J]. 安徽农业科学, 2015(25): 21–23, 48.
JI Y, GUO S L, YANG Y H. Research progress of metabolomics strategies[J]. Journal of Anhui Agricultural Sciences, 2015(25): 21–23, 48. DOI: 10.3969/j.issn.0517-6611.2015.25.007 (in Chinese) |
| [14] |
秦泽宇, 王浩, 温荣欣, 等. 基于核磁共振的代谢组学技术在肉品科学中的应用[J]. 食品工业科技, 2019, 40(2): 312–315, 320.
QIN Z Y, WANG H, WEN R X, et al. Application of metabolomics based on nuclear magnetic resonance (NMR) in meat science[J]. Science and Technology of Food Industry, 2019, 40(2): 312–315, 320. (in Chinese) |
| [15] | UEDA S, IWAMOTO E, KATO Y, et al. Comparative metabolomics of Japanese Black cattle beef and other meats using gas chromatography-mass spectrometry[J]. Biosci Biotechnol Biochem, 2019, 83(1): 137–147. DOI: 10.1080/09168451.2018.1528139 |
| [16] | LIU C L, PAN D D, YE Y F, et al. 1H NMR and multivariate data analysis of the relationship between the age and quality of duck meat[J]. Food Chem, 2013, 141(2): 1281–1286. DOI: 10.1016/j.foodchem.2013.03.102 |
| [17] | OLIVER S G. Yeast as a navigational aid in genome analysis[J]. Microbiology, 1997, 143(5): 1483–1487. DOI: 10.1099/00221287-143-5-1483 |
| [18] | DINH T T N, BLANTON J R, RILEY D G, et al. Intramuscular fat and fatty acid composition of longissimus muscle from divergent pure breeds of cattle[J]. J Anim Sci, 2010, 88(2): 756–766. DOI: 10.2527/jas.2009-1951 |
| [19] | FLACHS P, HORAKOVA O, BRAUNER P, et al. Polyunsaturated fatty acids of marine origin up-regulate mitochondrial biogenesis and induce Î2-oxidation in white fat[J]. Diabetologia, 2005, 48(11): 2365–2375. DOI: 10.1007/s00125-005-1944-7 |
| [20] | CAPUTO M, ZIRPOLI H, TORINO G, et al. Selective regulation of UGT1A1 and SREBP -1c mRNA expression by docosahexaenoic, eicosa-pentaenoic, and arachidonic acids[J]. J Cell Physiol, 2011, 226(1): 187–193. DOI: 10.1002/jcp.22323 |
| [21] | MILANESI E, NICOLOSO L, CREPALDI P. Stearoyl CoA desaturase (SCD) gene polymorphisms in Italian cattle breeds[J]. J Anim Breed Genet, 2008, 125(1): 63–67. DOI: 10.1111/j.1439-0388.2007.00697.x |
| [22] | WANG W, XUE W D, JIN B Q, et al. Candidate gene expression affects intramuscular fat content and fatty acid composition in pigs[J]. J Appl Genet, 2013, 54(1): 113–118. DOI: 10.1007/s13353-012-0131-z |
| [23] | PÉREZ-HERAS A M, MAYNERIS-PERXACHS J, COFÁN M, et al. Long-chain n-3 PUFA supplied by the usual diet decrease plasma stearoyl-CoA desaturase index in non-hypertriglyceridemic older adults at high vascular risk[J]. Clin Nutr, 2018, 37(1): 157–162. DOI: 10.1016/j.clnu.2016.11.009 |
| [24] | XU J W, WANG C L, JIN E H, et al. Identification of differentially expressed genes in longissimus dorsi muscle between Wei and Yorkshire pigs using RNA sequencing[J]. Genes Genomics, 2018, 40(4): 413–421. |
| [25] | CASES S, STONE S J, ZHOU P, et al. Cloning of DGAT2, a second mammalian diacylglycerol acyl-transferase, and related family members[J]. J Biol Chem, 2001, 276(42): 38870–38876. |
| [26] |
朱武政, 林亚秋, 江明锋, 等. 肉用山羊脂代谢相关基因与肌内脂肪含量的相关性分析[J]. 畜牧兽医学报, 2016, 47(7): 1333–1341.
ZHU W Z, LIN Y Q, JIANG M F, et al. Association analysis of intramuscular fat content and the expression of genes related to lipid metabolism in meat goat[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(7): 1333–1341. (in Chinese) |
| [27] | DENNIS E A, CAO J, HSU Y H, et al. Phospholipase A2 enzymes: physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention[J]. Chem Rev, 2011, 111(10): 6130–6185. |
| [28] | GHESQUIERE S A I, GIJBELS M J J, ANTHONSEN M, et al. Macrophage-specific over-expression of group Ⅱa sPLA2 increases athero-sclerosis and enhances collagen deposition[J]. J Lipid Res, 2005, 46(2): 201–210. |
| [29] | CROSET M, BROSSARD N, POLETTE A, et al. Characterization of plasma unsaturated lysophospha-tidylcholines in human and rat[J]. Biochem J, 2000, 345(1): 61–67. |
| [30] | YEA K, KIM J, YOON J H, et al. Lyso-phosphatidylcholine activates adipocyte glucose uptake and lowers blood glucose levels in murine models of diabetes[J]. J Biol Chem, 2009, 284(49): 33833–33840. |
| [31] | YIN L L, WU X W, GONG Y Y, et al. OX-LDL up-regulates the vascular endothelial growth factor-to-pigment epithelium-derived factor ratio in human retinal pigment epithelial cells[J]. Curr Eye Res, 2011, 36(4): 379–385. |
| [32] | LIM K S, LEE K T, PARK J E, et al. Identification of differentially expressed genes in longissimus muscle of pigs with high and low intramuscular fat content using RNA sequencing[J]. Anim Genet, 2017, 48(2): 166–174. |
| [33] | ARSIC N, ZACCHIGNA S, ZENTILIN L, et al. Vascular endothelial growth factor stimulates skeletal muscle regeneration in vivo[J]. Mol Ther, 2004, 10(5): 844–854. |
| [34] | MARCHAN R, BVTTNER B, LAMBERT J, et al. Glycerol-3-phosphate Acyltransferase 1 promotes tumor cell migration and poor survival in ovarian carcinoma[J]. Cancer Res, 2017, 77(17): 4589–4601. |
| [35] | STEWART J D, MARCHAN R, LESJAK M S, et al. Choline-releasing glycerophosphodiesterase EDI3 drives tumor cell migration and metastasis[J]. Proc Natl Acad Sci USA, 2012, 109(21): 8155–8160. |
| [36] | BROWN A, HOSSAIN I, PEREZ L J, et al. Lysophosphatidic acid receptor mRNA levels in heart and white adipose tissue are associated with obesity in mice and humans[J]. PLoS One, 2017, 12(12): e0189402. |
| [37] | FEDERICO L, REN H M, MUELLER P A, et al. Autotaxin and its product lysophosphatidic acid suppress brown adipose differentiation and promote diet-induced obesity in mice[J]. Mol Endocrinol, 2012, 26(5): 786–797. |
| [38] | PAGÈS, DAVIAUD D, AN S Z, et al. Endothelial differentiation gene-2 receptor is involved in lyso-phosphatidic acid-dependent control of 3T3F442A preadipocyte proliferation and spreading[J]. J Biol Chem, 2001, 276(15): 11599–11605. |
| [39] | NOBUSUE H, KONDO D, YAMAMOTO M, et al. Effects of lysophosphatidic acid on the in vitro proliferation and differentiation of a novel porcine preadipocyte cell line[J]. Comp Biochem Physiol B Biochem Mol Biol, 2010, 157(4): 401–407. |
| [40] | SIMON M F, DAVIAUD D, PRADÈRE J P, et al. Lysophosphatidic acid inhibits adipocyte differentiation via lysophosphatidic acid 1 receptor-dependent down-regulation of peroxisome proliferator-activated receptor γ2[J]. J Biol Chem, 2005, 280(15): 14656–14662. |
| [41] | KONG Y, ZHENG Y, JIA Y F, et al. Decreased LIPF expression is correlated with DGKA and predicts poor outcome of gastric cancer[J]. Oncol Rep, 2016, 36(4): 1852–1860. |
| [42] | NAKANO T, SEINO K, WAKABAYASHI I, et al. Deletion of diacylglycerol kinase ε confers suscepti-bility to obesity via reduced lipolytic activity in murine adipocytes[J]. FASEB J, 2018, 32(8): 4121–4131. |



