2. 东北林业大学 野生动物与自然保护地学院, 哈尔滨 150040
2. College of Wildlife and Protected Area, Northeast Forestry University, Harbin 150040, China
肝是哺乳动物最大的实质器官,具有加工储存营养物质、代谢药物毒物、分泌胆汁、合成蛋白质等重要功能。肝缺血再灌注损伤(hepatic ischemia reperfusion injury, HIRI)是外科手术常见的一种临床综合征[1]。20世纪90年代,出现腹腔镜肝切除术,腹腔镜技术可以减少腹壁神经和肌肉的损伤,减少出血,加快术后恢复,具有广阔的发展前景[2]。尽管采用微创外科手术,在肝切除、肝移植等临床手术中仍不可避免的出现HIRI,严重会导致肝炎、肝功能衰竭[3]。而炎症反应是HIRI重要的病理生理过程[4],肝缺血再灌注后,引起炎性因子的释放以及炎症通路的激活,肝组织微循环紊乱造成细胞损伤,各种炎性因子的聚集导致血供受阻,进一步加重肝细胞的损伤甚至出现局部坏死。目前用于研究HIRI的实验动物包括小鼠[5]、大鼠[6]、新西兰大白兔[7]、犬[8]等,这些动物虽易于管理、重复性强,但动物体积、肝解剖结构、新陈代谢和人相差很大,得到的研究结果应用到人类也受到限制[9],而小型猪与人的同源性相近,研究获得的数据更有价值,在临床上易于转化,是研究HIRI较好的实验动物选择[10-11]。
近年来,随着干细胞治疗技术研究的深入,越来越多的研究支持干细胞旁分泌学说是干细胞疗效的关键机制[12-13]。Lee等[14]首次描述了无细胞疗法在临床前动物模型中对肝疾病的应用,也有研究表明,间充质干细胞条件培养基(mesenchymal stem cells condition medium, MSCs-CM)可以起到优于干细胞本身的治疗效果[15]。干细胞受微环境细胞和细胞分泌物的作用,分泌细胞因子、生长因子和趋化因子进入微环境中,并能招募其他干细胞,作用于受损的组织细胞[16]。目前,已有多项研究证明,干细胞的条件培养基在疾病治疗方面的疗效,包括心肌梗塞[17]、骨关节炎[18]、败血症[19]等。所以,本研究旨在通过建立小型猪肝缺血再灌注合并肝部分切除模型,探究脂肪间充质干细胞条件培养基(adipose-derived mesenchymal stem cells condition medium, ADSC-CM)对肝缺血再灌注合并肝部分切除损伤炎症反应的作用,为比较医学开展肝病治疗,拓宽ADSC-CM移植领域提供研究依据。
1 材料与方法 1.1 试验仪器与试剂高清内窥镜摄像系统、内窥镜冷光源(深圳市神州医疗设备有限公司),全自动气腹机、高频智能电刀、腹腔镜手术器械(日本Olympus公司),动物呼吸麻醉机(美国SurgiVet公司),血细胞分类计数仪(日本光电工业),酶标仪(美国BIOTEK有限公司),组织研磨仪(上海净信实业发展有限公司),qRT-PCR仪(瑞士Roche公司)。
硫酸阿托品注射液(山西省芮城科龙兽药有限公司),痛立定托芬那酸注射液(巍隆贸易有限公司),丙泊酚乳状注射液(西安力邦制药有限公司),异氟烷(河北一品制药有限公司生产),DMEM低糖培养基(美国Invitrogen有限公司),胎牛血清(美国CLARK公司),反转录试剂盒(TaKaRa生物技术有限公司),荧光定量PCR染料(湖南Innovagene科技有限公司),C反应蛋白(CRP)、透明质酸(HA)、皮质醇(COR)试剂盒(上海酶联生物科技有限公司)。
1.2 脂肪间充质干细胞条件培养基的制备小型猪麻醉后于无菌条件下从腹部获取脂肪组织,使用无菌的眼科剪将脂肪组织剪碎,加入Ⅰ型胶原酶充分消化后,使用含血清的培养基终止消化,用200目铜网过滤,滤液离心(1 500 r·min-1,10 min) 后,弃去上清,用完全培养基(10% FBS,1%青链霉素,1%谷氨酰胺)重悬细胞并接种在25 cm2的培养瓶中,于培养箱(37 ℃,50 mL·L-1 CO2)中培养。待细胞密度生长至80%时传代,细胞传至第4代进行条件培养基的制备。弃去原培养基,无菌PBS清洗,换用无血清的基础培养基饥饿培养48 h。收集细胞培养液离心(1 500 r·min-1,10 min),将上清液用无菌滤器过滤,滤液用3 KD超滤管离心浓缩后,储存在-80 ℃冰箱,供后续试验使用。
1.3 实验动物分组及手术处理实验动物为24头广西巴马小型猪,4~6月龄,体重20~25 kg,饲养管理条件在整个试验过程中保持一致,经临床整体和一般检查、各系统检查和实验室血液常规检查无异常后随机分为4组:模型组(IRI)、DMEM对照组(DMEM)、ADSCs-CM治疗组(CM)和ADSCs治疗组(ADSCs),每组6只。小型猪注射硫酸阿托品后,耳缘静脉注射丙泊酚诱导麻醉,使用异氟烷进行呼吸麻醉,麻醉过程中,异氟烷浓度维持在2.5%~4.0%。4组均通过腹腔镜技术建立小型猪肝缺血再灌注合并肝部分切除模型[20],肝右叶持续缺血60 min后再灌注,然后使用高频电刀离断肝左叶,将注射的细针经腹腔镜套管口进入,在距离肝断端1~2 cm处,4组分别经肝实质注射不同的物质,IRI组:生理盐水,DMEM组:浓缩的基础培养基,CM组:浓缩的脂肪间充质干细胞培养基,ADSCs组:脂肪间充质干细胞。其中,ADSCs使用剂量为1×106个细胞·kg-1,ADSCs-CM使用剂量为按照体重计算等量干细胞获得的条件培养基浓缩液,DMEM和生理盐水的使用剂量与ADSCs-CM体积相同。术后肌内注射痛立定,并将小型猪放在隔离圈舍单独护理。试验流程示意如图 1。
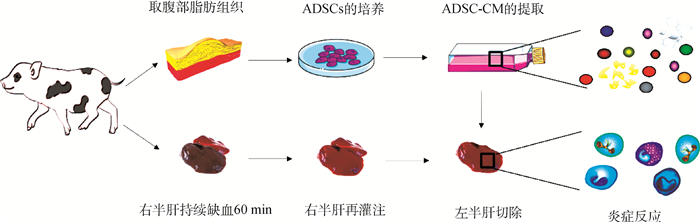
|
图 1 试验流程图 Fig. 1 Experimental process diagram |
1.4.1 样本采集 样本采集分为术前、术后1、3、7 d 4个时间点。血液样本经小型猪前腔静脉采集,离心(3 000 r·min-1,10 min)后获取血清;组织样本通过腹腔镜手术采集,样本均保存在-80 ℃。
1.4.2 肝组织病理结构观察 将肝组织样本经4%多聚甲醛固定后,按常规步骤进行石蜡包埋,苏木精-伊红染色后在光学显微镜下读片,观察肝细胞是否存在变性、坏死,重点观察炎性细胞浸润的病理变化。
1.4.3 血液常规指标检测 使用血细胞计数仪对各组血液样本进行检测,包括术前,术后1、3、7 d静脉血中的白细胞(WBC)、中性粒细胞(NE)、淋巴细胞(LY)。
1.4.4 血清指标ELISA检测 检测前从-80 ℃冰箱取出冻存的血清样本,按照C反应蛋白(CRP)、皮质醇(COR)、透明质酸(HA)试剂盒说明书,使用酶标仪检测各组不同时间点CRP、COR、HA的表达水平。
1.4.5 肝组织炎症相关基因水平检测 使用qRT-PCR检测肝组织炎症相关基因在各个时间点表达水平。用Trizol试剂提取总RNA,Prime ScriptTM RT试剂盒反转录。引物如表 1所示。qRT-PCR反应的体系:2 μL cDNA,0.8 μL上、下游引物,6.4 μL H2O和10 μL Taq SYBR® Green qPCR PreMix。使用Roche 480 qRT-PCR仪检测,95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s重复40个循环,最后进行融解反应。根据2-ΔΔCt法计算炎症相关基因IL-1β、IL-6、TNF-α、IL-10 mRNA相对β-actin的表达量。
|
|
表 1 qRT-PCR引物序列 Table 1 qRT-PCR Primers sequences |
使用Graphpad Prism 7软件进行统计分析,结果表示为“平均数±标准差(x±s) ”,差异显著性分析使用单因素方差分析方法(one-way ANOVA),使用LSD方法进行事后检验,各组之间采用多重比较,P < 0.05具有统计学意义。
2 结果 2.1 肝组织病理结构观察显微镜观察各组切片,术后1、3 d病理变化明显,出现较多炎性细胞,结果如图 2所示:术后1 d,IRI组与DMEM组肝组织出现坏死灶,肝细胞索排列结构紊乱,可见大量炎性细胞浸润,而CM组与ADSCs组的肝细胞肿胀轻微,炎性细胞数量较IRI组与DMEM组少;术后3 d,IRI组与DMEM组仍可见较多的炎性细胞浸润,而CM组与ADSCs组有少量的炎性细胞,细胞肿胀情况较IRI组与DMEM组轻微,肝小叶结构基本恢复。即肝缺血再灌注合并肝部分切除后,ADSCs与ADSCs-CM移植能减少炎性细胞的浸润。
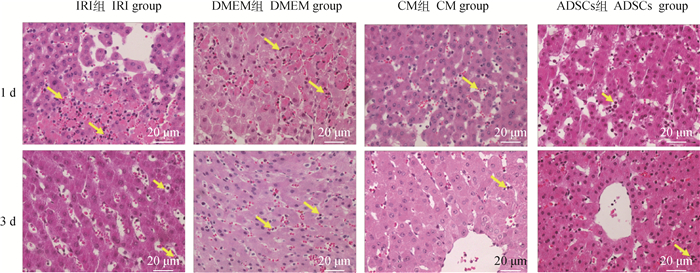
|
黄色箭头表示炎性细胞;红色箭头表示坏死灶 Yellow arrows indicate inflammatory cells; red arrows indicate necrotic foci 图 2 肝组织病理变化(400×) Fig. 2 Pathological changes of liver tissue(400×) |
结果显示,WBC、NE、LY在4组都呈现先升高后降低的趋势。图 3A为WBC结果分析:术后1 d,与IRI组相比,CM组极显著(P < 0.01)、ADSCs组显著(0.01 < P < 0.05)降低WBC的水平,CM组与DMEM组差异极显著(P < 0.01);术后3 d,CM组、ADSCs组显著降低WBC的表达(0.01 < P < 0.05),CM组与DMEM组差异显著(0.01 < P < 0.05)。图 3B为NE结果分析:术后1、3 d,与IRI组相比,CM组、ADSCs组极显著(P < 0.01)降低NE的水平,CM组与DMEM组差异极显著(P < 0.01)。图 3C为LY结果分析:术后1 d,与IRI组相比,CM组显著(0.01 < P < 0.05)、ADSCs组极显著(P < 0.01)降低LY的水平,CM组与DMEM组差异极显著(P < 0.01);术后3 d,与IRI组相比,CM组、ADSCs组极显著(P < 0.01)降低LY水平;CM组与DMEM组差异显著(0.01 < P < 0.05)。术后7 d,WBC、NE、LY在各组之间差异不显著(P>0.05),且DMEM组与IRI组、CM组与ADSCs组在各个时间点均无显著性差异(P>0.05),即CM组与ADSCs组可以降低血液中WBC、NE、LY的升高程度。
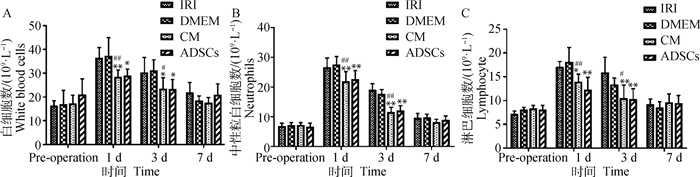
|
各时间点DMEM组、CM组、ADSCs组与IRI组比较,*.0.01 < P < 0.05,差异显著;**.P < 0.01,差异极显著;各时间点CM组与DMEM组比较,#.0.01 < P < 0.05,差异显著;##.P < 0.01,差异极显著。下图同 DMEM group, CM group, ADSCs group were compared with IRI group at each time point, *.0.01 < P < 0.05, significantly different; **.P < 0.01, extremely significant different; CM group were compared with DMEM group at each time point, #.0.01 < P < 0.05, significantly different; ##.P < 0.01, extremely significantly different. The same as below 图 3 血液指标检测结果 Fig. 3 The results of blood parameters |
肝缺血再灌注合并部分切除后,血清中CRP、COR、HA表达如图 4所示。术后1 d,与IRI组相比,CM组、ADSCs组均显著降低了CRP、COR、HA的表达水平(P < 0.01),CM组与DMEM组具有统计学意义(CRP、HA P < 0.01,COR 0.01 < P < 0.05);术后3 d,与IRI组相比,CM组显著降低了CRP与HA的表达水平(0.01 < P < 0.05),而对COR作用不显著,但ADSCs显著降低COR的表达水平(0.01 < P < 0.05),CM组与DMEM组具有统计学意义(CRP、HA P < 0.01);术后7 d各组无显著性差异(P>0.05)。DMEM组与IRI组、CM组与ADSCs组在各个时间点均无显著性差异(P>0.05)。
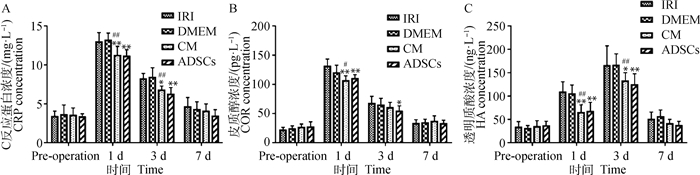
|
图 4 血清指标检测结果 Fig. 4 The results of serum parameters |
肝组织炎症相关基因表达水平见图 5所示。图 5A为IL-6 mRNA表达水平:与IRI组相比,CM组和ADSCs组在术后1、3 d极显著降低IL-6 mRNA水平(P < 0.01);术后1、3 d CM组与DMEM组差异极显著(P < 0.01)。图 5B为IL-1β mRNA表达水平:与IRI组相比,CM组和ADSCs组术后1 d极显著(P < 0.01)、3 d显著(0.01 < P < 0.05)降低IL-1β mRNA水平;CM组与DMEM组,术后1 d差异极显著(P < 0.01)、3 d差异显著(0.01 < P < 0.05)。图 5C为TNF-α mRNA表达水平:CM组与IRI组相比,术后1、3 d极显著(P < 0.01)降低了TNF-α mRNA水平;ADSCs组与IRI相比,术后1 d显著降低(0.01 < P < 0.05)、3 d极显著降低(P < 0.01)了肝组织TNF-α mRNA水平;CM组与DMEM组术后1 d差异极显著(P < 0.01),3 d差异显著(0.01 < P < 0.05)。图 5D为IL-10 mRNA表达水平:与IRI组相比,CM组和ADSCs组IL-10 mRNA水平在术后1、3 d极显著提高(P < 0.01);CM组与DMEM组相比,术后1和3 d差异极显著(P < 0.01)。DMEM组与IRI组、CM组与ADSCs组的各个指标所有时间点均无显著性差异(P>0.05)。即CM组与ADSCs组可以降低术后肝组织中IL-6、IL-1β、TNF-α mRNA的升高程度,提高IL-10 mRNA的表达。
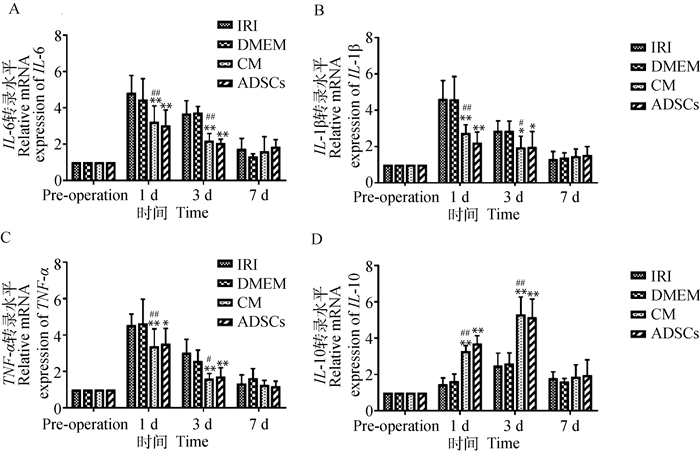
|
图 5 炎症相关基因转录水平 Fig. 5 Transcription levels of inflammation-related genes |
肝缺血再灌注损伤涉及多种炎症因子以及通路,是一个复杂的病理生理过程。肝缺血再灌注后,肝组织微循环紊乱,黏附在肝窦壁的WBC逐渐增多,WBC的聚集和活化导致肝细胞的损伤。缺血早期NE被激活,TNF-α能刺激NE的黏附并外渗,NE的聚集导致血供受阻,进一步加重肝细胞的损伤而致肝局部出现坏死灶。LY通过分泌IL-17促进NE的迁移与黏附来激活补体系统[21],同时分泌各种可溶性的细胞因子和化学因子,促进炎症反应发生。这也是肝缺血再灌注后通过病理切片能够观察到明显的炎性细胞浸润以及局部坏死现象的原因。本研究结果显示,ADSCs组和CM组减少了炎性细胞的浸润并降低了WBC、NE、LY的表达,提示ADSCs和ADSC-CM均具有抗炎效果。研究表明,其他MSCs-CM对炎症反应有明显的治疗作用,Lee等[22]使用人的ADSCs-CM显著改善了小鼠肝缺血再灌注损伤后的病理组织学评分;Kim等[23]使用扁桃体的MSCs-CM治疗四氯化碳(CCl4)诱导小鼠肝损伤,结果证实其治疗显着减少了CCl4损伤小鼠肝的炎症和肝组织病理损伤。
CRP是第一个被发现的机体急性期反应蛋白,也是公认的炎症生物标志物。肝缺血再灌注损伤后,肝细胞合成并分泌大量CRP,血液中CRP的浓度几乎与组织损伤程度成正比,因此,能够在血清中检测到大量的CRP[24]。由于肝细胞损伤以及炎症反应,下丘脑-垂体-肾上腺皮质神经轴系(HPA)紊乱导致血清COR含量上升[25]。肝缺血再灌注会引起肝窦内皮细胞的损伤,肝窦内皮细胞可以通过HA的特异性受体介导内吞作用除去超过90%外周血中HA的含量[26]。因此,可以通过外周血中的HA水平衡量肝损伤肝窦内皮细胞的功能障碍[27]。在本研究中,肝缺血再灌注合并部分肝切除引起IRI组、DMEM组术后血清CRP、COR和HA含量迅速升高,而经过ADSCs和ADSC-CM治疗的两组,有效减缓了CRP和COR的升高程度,抑制HA的升高。在Chen等[28]的研究中,MSCs-CM预处理明显缓解肝照射后血清HA水平,与本研究结果一致。
肝缺血再灌注可引起各种炎性细胞因子基因的表达,如TNF-α、IL-1β、IL-6等。TNF-α不仅参与炎症的反应,还参与免疫应答,过量的TNF-α还会和IL-1β激活肝细胞、内皮细胞,诱导大量ROS的产生以及脂质过氧化反应,进而引起肝组织微循环障碍,导致肝细胞的凋亡和坏死。微循环障碍又反过来诱导炎症的级联反应,IL-6、IL-8等炎症介质的释放扩大了炎症的效应。因此,促炎因子IL-6在肝缺血再灌注的炎症反应中较TNF-α和IL-1β晚,但也促进了炎症反应的发生。IL-10是一种由巨噬细胞产生的能够拮抗炎症反应的炎性介质。在正常生理情况下,促炎因子与抑炎因子处于动态平衡,肝缺血再灌注后,引起大量促炎因子分泌激发过度炎症反应,抑炎因子IL-10含量随之上升。IL-10能够抑制单核巨噬细胞释放炎症介质(如TNF-α、IL-1β、IL-6等),此外,还能增强其他抗炎性因子的释放,如IL-1受体拮抗剂和溶解性TNF-α受体。已有研究表明,使用骨髓干细胞的条件培养基治疗体外辐射诱导大鼠的肝损伤模型,基因检测结果显示,条件培养基给药组显著降低肝中TNF-α、IL-1β和IL-6的mRNA表达水平,并增加IL-10 mRNA表达水平[28]。本研究显示ADSCs组和CM组促炎症因子TNF-α、IL-1β、IL-6升高程度受到抑制,而抑炎因子IL-10的升高程度被增强。本研究通过qRT-PCR方法对基因层面进行mRNA的检测,基因从转录到翻译还有复杂的过程,而ELISA检测的是翻译后的蛋白,对mRNA的检测从炎症早期证明,ADSC-CM能够通过抑制促炎症因子的表达,促进抑炎因子的表达来减轻肝缺血再灌注后的炎症反应。
本研究中,ADSCs与ADSC-CM作用效果没有显著差异,即在不移植干细胞的情况下,移植干细胞的条件培养基可以起到等效的替代作用。目前,干细胞的临床应用仍面临诸多挑战,有研究表明,只有不到3%的间充质干细胞能够在移植后持续存活2周[29],且移植后的干细胞仍然存在免疫排斥反应[30]。而无细胞疗法从源头上避免干细胞移植的风险,因此,间充质干细胞条件培养基的研究与临床应用正逐渐开展。
4 结论本试验探究了ADSCs和ADSC-CM对小型猪肝缺血再灌注合并肝部分切除炎症反应的疗效,发现二者均能够缓解缺血再灌注造成的病理学损伤,降低血液中炎性细胞数量及肝组织中促炎因子表达,并提高抑炎因子表达,缓解术后炎症反应。移植ADSC-CM对炎症反应的作用效果与ADSCs无显著差异,因此,基于无细胞疗法很可能成为未来干细胞移植的替代疗法。
| [1] |
何剑戈, 任爱红, 施懿诚, 等. 肝缺血再灌注损伤的机制及其预防[J]. 河南科技大学学报: 医学版, 2012, 30(3): 235-237. HE J G, REN A H, SHI Y C, et al. Mechanism and prevention of hepatic ischemia-reperfusion injury[J]. Journal of Henan University of Science & Technology: Medical Science, 2012, 30(3): 235-237. DOI:10.3969/j.issn.1672-688X.2012.03.030 (in Chinese) |
| [2] |
REICH H, MCGLYNN F, DECAPRIO J, et al. Laparoscopic excision of benign liver lesions[J]. Obstet Gynecol, 1991, 78(5 Pt 2): 956-958. |
| [3] |
PANISELLO-ROSELLÓ A, ROSELLÓ-CATAFAU J. Molecular mechanisms and pathophysiology of ischemia-reperfusion injury[J]. Int J Mol Sci, 2018, 19(12): 4093. DOI:10.3390/ijms19124093 |
| [4] |
JIAO Z H, MA Y J, LIU X N, et al. Adipose-derived stem cell transplantation attenuates inflammation and promotes liver regeneration after ischemia-reperfusion and hemihepatectomy in swine[J]. Stem Cells Int, 2019, 2019: 2489584. |
| [5] |
李仕来, 尚丽明, 秦权林, 等. 橘皮苷通过激活Nrf2/HO-1通路增强自噬保护肝脏缺血再灌注损伤[J]. 中华中医药学刊, 2021, 39(4): 105-108. LI S L, SHANG L M, QIN Q L, et al. Hesperidin induces autophagy to protect against liver ischemia/reperfusion injury via activation of the Nrf2/HO-1 pathway[J]. Chinese Archives of Traditional Chinese Medicine, 2021, 39(4): 105-108. (in Chinese) |
| [6] |
高伟东, 冯赞杰, 彭慈军, 等. 杜仲不同部位及不同提取方法的提取物对大鼠肝脏缺血再灌注损伤的保护作用[J]. 中国普通外科杂志, 2020, 29(8): 958-965. GAO W D, FENG Z J, PENG C J, et al. Protective effects of extracts from different parts of Eucommia ulmoides and by different extraction methods against hepatic ischemia-reperfusion injury in rats[J]. Chinese Journal of General Surgery, 2020, 29(8): 958-965. (in Chinese) |
| [7] |
王双龙, 于美, 吕镔, 等. 声脉冲辐射力成像定量评估兔肝缺血再灌注损伤实验研究[J]. 陕西医学杂志, 2020, 49(2): 140-143, 147. WANG S L, YU M, LV B, et al. Quantitative assessment of hepatic ischemia reperfusion injury with acoustic radiation force impulse in rabbit[J]. Shaanxi Medical Journal, 2020, 49(2): 140-143, 147. DOI:10.3969/j.issn.1000-7377.2020.02.003 (in Chinese) |
| [8] |
董婧, 温吉昱, 陈玉婷, 等. 丙泊酚对老年犬心肌缺血再灌注损伤的影响[J]. 沈阳农业大学学报, 2018, 49(2): 209-213. DONG J, WEN J Y, CHEN Y T, et al. The effects of propofol on myocardial ischemia reperfusion injury in aged canines[J]. Journal of Shenyang Agricultural University, 2018, 49(2): 209-213. (in Chinese) |
| [9] |
ABDO E E, CUNHA J E M, DELUCA P, et al. Protective effect of N2-mercaptopropionylglycine on rats and dogs liver during ischemia/reperfusion process[J]. Arq Gastroenterol, 2003, 40(3): 177-180. DOI:10.1590/S0004-28032003000300008 |
| [10] |
张千振, 葛延松, 焦智慧, 等. 小型猪腹腔镜肝缺血再灌注合并肝部分切除对肝细胞凋亡及相关基因影响的研究[J]. 中国兽医杂志, 2018, 54(4): 22-25, 28. ZHANG Q Z, GE Y S, JIAO Z H, et al. Effect of laparoscopic ischemia reperfusion combined with partial hepatectomy on hepatocyte apoptosis and related gene expression in miniature pigs[J]. Chinese Journal of Veterinary Medicine, 2018, 54(4): 22-25, 28. (in Chinese) |
| [11] |
JIAO Z H, LIU X N, MA Y J, et al. Adipose-derived stem cells protect ischemia-reperfusion and partial hepatectomy by attenuating endoplasmic reticulum stress[J]. Front Cell Dev Biol, 2020, 8: 177. DOI:10.3389/fcell.2020.00177 |
| [12] |
NAHAR S, NAKASHIMA Y, MIYAGI-SHIOHIRA C, et al. Cytokines in adipose-derived mesenchymal stem cells promote the healing of liver disease[J]. World J Stem Cells, 2018, 10(11): 146-159. DOI:10.4252/wjsc.v10.i11.146 |
| [13] |
JIAO Z H, MA Y J, ZHANG Q Z, et al. The adipose-derived mesenchymal stem cell secretome promotes hepatic regeneration in miniature pigs after liver ischaemia-reperfusion combined with partial resection[J]. Stem Cell Res Ther, 2021, 12(1): 218. DOI:10.1186/s13287-021-02284-y |
| [14] |
LEE S K, LEE S C, KIM S J. A novel cell-free strategy for promoting mouse liver regeneration: utilization of a conditioned medium from adipose-derived stem cells[J]. Hepatol Int, 2015, 9(2): 310-320. DOI:10.1007/s12072-014-9599-4 |
| [15] |
VAN POLL D, PAREKKADAN B, CHO C H, et al. Mesenchymal stem cell-derived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo[J]. Hepatology, 2008, 47(5): 1634-1643. DOI:10.1002/hep.22236 |
| [16] |
CURTIS T M, HANNETT J M, HARMAN R M, et al. The secretome of adipose-derived mesenchymal stem cells protects SH-SY5Y cells from arsenic-induced toxicity, independent of a neuron-like differentiation mechanism[J]. Neurotoxicology, 2018, 67: 54-64. DOI:10.1016/j.neuro.2018.04.009 |
| [17] |
LI X T, MA T, SUN J C, et al. Harnessing the secretome of adipose-derived stem cells in the treatment of ischemic heart diseases[J]. Stem Cell Res Ther, 2019, 10(1): 196. DOI:10.1186/s13287-019-1289-7 |
| [18] |
NIADA S, GIANNASI C, GOMARASCA M, et al. Adipose-derived stromal cell secretome reduces TNFα-induced hypertrophy and catabolic markers in primary human articular chondrocytes[J]. Stem Cell Res, 2019, 38: 101463. DOI:10.1016/j.scr.2019.101463 |
| [19] |
AKHONDZADEH F, KADKHODAEE M, SEIFI B, et al. Adipose-derived mesenchymal stem cells and conditioned medium attenuate the memory retrieval impairment during sepsis in rats[J]. Mol Neurobiol, 2020, 57(9): 3633-3645. DOI:10.1007/s12035-020-01991-6 |
| [20] |
李辉, 葛延松, 白鸽, 等. 富氢生理盐水干预小型猪肝脏缺血再灌注合并肝脏部分切除损伤中内质网应激影响的研究[J]. 中国畜牧兽医, 2018, 45(6): 1692-1699. LI H, GE Y S, BAI G, et al. Hydrogen-rich saline protects effect against liver ischemia-reperfusion injury and hepatectomy by inhibiting endoplasmic reticulum stress in miniature pig[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(6): 1692-1699. (in Chinese) |
| [21] |
UCHIDA Y, KE B B, FREITAS M C S, et al. The emerging role of T cell immunoglobulin mucin-1 in the mechanism of liver ischemia and reperfusion injury in the mouse[J]. Hepatology, 2010, 51(4): 1363-1372. DOI:10.1002/hep.23442 |
| [22] |
LEE S C, KIM J O, KIM S J. Secretome from human adipose-derived stem cells protects mouse liver from hepatic ischemia-reperfusion injury[J]. Surgery, 2015, 157(5): 934-943. DOI:10.1016/j.surg.2014.12.016 |
| [23] |
KIM Y H, CHO K A, PARK M, et al. Conditioned medium from tonsil-derived mesenchymal stem cells relieves CCl4-induced liver fibrosis in mice[J]. Tissue Eng Regen Med, 2019, 16(1): 51-58. DOI:10.1007/s13770-018-0160-8 |
| [24] |
葛延松. 小型猪ADSCs对腹腔镜肝脏I/R合并部分切除损伤保护作用的研究[D]. 哈尔滨: 东北农业大学, 2019. GE Y S. Study of the protective effect of miniature pig adipose derived stem cells on hepatic ischemia-reperfusion combined with laparoscopic hepatectomy Injury[D]. Harbin: Northeast Agricultural University, 2019. (in Chinese) |
| [25] |
张华. 腹腔镜技术建立小型猪肝损伤模型及肝脏环境变化的研究[D]. 哈尔滨: 东北农业大学, 2015. ZHANG H. Study of the establishment of liver injury models by laparoscopic technique in miniture pigs and the changes of liver enviroment[D]. Harbin: Northeast Agricultural University, 2015. (in Chinese) |
| [26] |
FRASER J R E, ALCORN D, LAURENT T C, et al. Uptake of circulating hyaluronic acid by the rat liver: cellular localization in situ[J]. Cell Tissue Res, 1985, 242(3): 505-510. |
| [27] |
GEORGE J, STERN R. Serum hyaluronan and hyaluronidase: very early markers of toxic liver injury[J]. Clin Chim Acta, 2004, 348(1-2): 189-197. DOI:10.1016/j.cccn.2004.05.018 |
| [28] |
CHEN Y X, ZENG Z C, SUN J, et al. Mesenchymal stem cell-conditioned medium prevents radiation-induced liver injury by inhibiting inflammation and protecting sinusoidal endothelial cells[J]. J Radiat Res, 2015, 56(4): 700-708. DOI:10.1093/jrr/rrv026 |
| [29] |
ABAZOV V M, ABBOTT B, ACHARYA B S, et al. Precision measurement of the ratio B(t→Wb)/B(t→Wq) and extraction of Vtb[J]. Phys Rev Lett, 2011, 107(12): 121802. DOI:10.1103/PhysRevLett.107.121802 |
| [30] |
ZANGI L, MARGALIT R, REICH-ZELIGER S, et al. Direct imaging of immune rejection and memory induction by allogeneic mesenchymal stromal cells[J]. Stem Cells, 2009, 27(11): 2865-2874. DOI:10.1002/stem.217 |
(编辑 白永平)



