2. 农业部畜禽细菌病防治制剂创制重点实验室, 武汉 430064;
3. 畜禽病原微生物学湖北省重点实验室, 武汉 430064
2. Key Laboratory of Prevention and Control Agents for Animal Bacteriosis (Ministry of Agriculture), Wuhan 430064, China;
3. Hubei Provincial Key Laboratory of Livestock and Poultry Pathogen Microbiology, Wuhan 430064, China
H9亚型禽流感病毒(avian influenza virus, AIV)在自然界中广泛存在与传播,给养禽业造成严重经济损失的同时,也严重影响到了公共卫生安全。H9亚型AIV属于低致病性禽流感病毒(low-pathogenic AIV, LPAIV),家禽对其高度易感,能够造成呼吸道疾病、产蛋量急剧下降等,但死亡率不高,与其他病原体混合感染后,发病及死亡率会显著提升[1-5]。
目前在全世界流行的H9亚型AIV主要分为北美和欧亚两大谱系,欧亚谱系进一步发展形成不同的病毒群,如A/chicken/Beijing/1/1994(BJ/94- like),A/duck/Hong Kong/Y280/1997(Y280-like),A/ quail/Hong Kong/G1/1997(G1-like),A/duck/Hong Kong/Y439/1997(Y439-like)和A/chicken/Shanghai/ F/1998(F/98-like)等[6-8]。与中亚和中东地区的H9亚型AIV相比,中国分离株在HA和NA基因的进化树中属于独立分支[8]。在我国,G1-like主要在南方地区的鹌鹑中流行,BJ/94-like和F/98-like分别在北方和东部地区鸡群中流行[8-9]。国内对H9亚型AIV的防控以免疫预防为主,目前市场上的H9禽流感疫苗以灭活疫苗为主[10],尽管有很多H9亚型禽流感灭活疫苗在应用,但H9亚型禽流感疫情仍然没有得到有效控制。近年来,H9N2亚型AIV在免疫鸡群中有较高的分离率,病毒在免疫压力、自身变异等多因素作用下发生了抗原漂移,导致现有疫苗的免疫保护效力降低[11-14]。H9亚型AIV的基因重组、变异不仅给当前禽流感的防控工作带来了困难,也对人类健康构成了潜在的威胁[15-16],迫切需要研发一种具有广泛交叉保护作用的H9亚型禽流感疫苗。
马赛克(mosaic)疫苗主要是针对抗原表位多变的病毒免疫原性蛋白,设计抗原表位覆盖率高的免疫原性蛋白基因序列,以实现对高度变异的病毒产生通用免疫保护作用[17]。该技术利用遗传算法将所有目的蛋白序列中潜在的抗原表位整合至一条新的目的蛋白序列,使其可提供比其他野生型蛋白更为广泛的流行变异株免疫保护。本研究设计并合成了H9亚型AIV HA基因的mosaic序列,采用反向遗传操作技术,以mosaic HA序列替换H1N1亚型流感病毒PR8株的HA片段,获得了重组禽流感病毒rPR8-HAm/H9株,并在SPF雏鸡上评价了其作为灭活疫苗的免疫保护效果,为后续H9亚型禽流感通用疫苗的开发提供了新的思路和方法,可为广谱禽流感疫苗的研发提供参考。
1 材料与方法 1.1 菌(毒)株、载体、细胞及实验动物H9N2亚型禽流感毒株A/chicken/JM0305/2017(简称JM0305)为本实验室分离鉴定保存;DH5α感受态细胞购自TaKaRa公司;表达质粒PHW2000及包含有H1N1亚型流感病毒PR8株7个基因的重组质粒PHW2000-PB2、PHW2000-PB1、PHW2000-PA、PHW2000-NP、PHW2000-NA、PHW2000-M和PHW2000-NS均由本实验室构建保存;犬肾细胞(MDCK)和人源胚胎肾细胞(HEK-293T)由本实验室保存;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;SPF鸡由本实验室孵化,隔离器饲养。
1.2 主要试剂2×Phata Max Master Mix,2 ×Rapid Taq Master Mix,ClonExpress Ⅱ DNA连接酶,HiScript Ⅱ Q Select RT SuperMix均购自诺唯赞公司;Sma Ⅰ、BamH Ⅰ、Sca Ⅰ、Dpn Ⅰ等限制性内切酶均购自TaKaRa公司;LipofectamineTM3000转染试剂、DMEM培养基、胎牛血清(FBS)均购自Gibco公司;胶回收试剂盒、质粒提取盒均购自OMEGA公司;动物免疫佐剂MERCKINADE SDA25购自美国默凯纳-万诺公司。
1.3 Mosaic HA序列(HAm/H9)的设计与合成从NCBI数据库(https://www.ncbi.nlm.nih.gov/)下载了总计3 957条H9亚型AIV的HA氨基酸序列,剔除不完整和多余的序列,最终将2 219条序列上传至马赛克疫苗设计网站(https://www.hiv.lanl.gov/content/sequence/MOSAIC/makeVaccine.html),设计Mosaic HA序列[18],参数选项中Cocktail Size设置为“1”,以产生一个单一的肽,即为HAm/H9。阈值设置为“3”,表位长度参数被设置为12-mer,与天然T细胞表位的长度匹配[19]。利用BepiPred 1.0 Serve和NetTepi 1.0 Serve分别预测HAm/H9序列及H9亚型AIV各分支代表株HA序列的B细胞表位和T细胞表位。将HAm/H9基因由生工生物公司进行密码子优化并合成。
1.4 重组质粒的构建与病毒拯救将HAm/H9序列插入至PHW2000表达质粒,参照HAm/H9和PHW2000的序列,采用Primer 5.0软件设计特异性引物,通过引物延伸PCR方法,在插入片段HAm/H9的两端分别引入其与PHW2000质粒连接处的同源臂(长度为15 bp),利用In-fusion克隆连接技术,构建并获得重构质粒PHW2000-HAm/H9。
利用LipofectamineTM3000将质粒PHW2000-PB2、PHW2000-PB1、PHW2000-PA、PHW2000-HAm/H9、PHW2000-NP、PHW2000-NA、PHW2000-M、PHW2000-NS共转染至混合培养有MDCK和HEK-293T细胞的6孔板中,48 h后收取细胞培养基上清,反复冻融后接种9日龄SPF鸡胚,收取HA阳性的样品进行RT-PCR扩增与测序分析,将鉴定正确的重组病毒命名为rPR8-HAm/H9。
1.5 重组病毒生长曲线测定将重组病毒以0.1 MOI接种于MDCK细胞,于12、24、36、48、60、72 h收取细胞上清测定病毒滴度,记录细胞病变情况,按照Reed-Muench公式计算病毒的TCID50,绘制病毒的生长曲线。
1.6 重组病毒的免疫原性测定1.6.1 灭活疫苗的制备与免疫 将重组病毒rPR8-HAm/H9株及JM0305株病毒尿囊液稀释至108EID50·0.1 mL-1,以终浓度为0.1%的甲醛灭活。灭活完全的病毒液以3∶1质量比加入动物免疫佐剂,低速搅拌至灭活疫苗完全乳化。
选取1周龄SPF雏鸡,分为A、B、C、D、E、F组,每组12羽。A组和B组通过肌内注射的方式免疫JM0305株,注射剂量0.1 mL·只-1;C组和D组以相同方式和剂量的免疫rPR8-HAm/H9株。E组和F组为PBS对照组。首免两周后,每组随机采集血清5份,同时对所有试验组进行加强免疫,接种途径和剂量不变。加强免疫后14 d,每组随机采集血清5份。
1.6.2 血凝抑制(HI)抗体测定 分别以rPR8-HAm/H9株及JM0305株配制四单位抗原,测定采集血清的HI抗体水平。
1.6.3 中和抗体测定 将血清进行连续2倍梯度稀释,与等体积病毒液(100 TCID50·0.1 mL-1)混合,置于适当的条件下感作一段时间后,取混合液0.2 mL接种生长在96孔板的MDCK细胞,观察记录接种细胞的病变情况,计算出能够使50%的细胞培养孔不发生病变的血清最高稀释度,即为该血清的中和效价。
1.6.4 攻毒保护效果 加强免疫后14 d,采取滴鼻点眼方式,分别用rPR8-HAm/H9株(A、C、E组)及JM0305株(B、D、F组)进行攻毒试验,攻毒剂量为106EID50·只-1。攻毒后,观察SPF鸡健康状况,如出现精神沉郁、嗜睡,采食量、饮水量减少、腹泻等状况,则判定其感染发病。分别于攻毒后第3、5、7天从各组随机采集10只雏鸡的喉头、泄殖腔拭子,作除菌处理后以100 μL·枚-1接种9日龄SPF鸡胚3枚,置37 ℃培养72 h,收取尿囊液,测定HA效价,以3枚之一出现HA≥24作为攻毒不保护的判定标准,对病毒感染为阴性的鸡胚尿囊液应该盲传一代,再次确认HA效价。
2 结果 2.1 HAm/H9序列抗原表位预测分析从NCBI数据库中下载得到2 219条完整的H9亚型AIV HA基因序列,以其作为背景蛋白集,通过在线设计的方式,优化设计并合成了一条H9亚型AIV的mosaic HA基因序列HAm/H9。利用在线软件BepiPred 1.0 Serve及NetTepi 1.0 Serve,预测了HAm/H9蛋白序列的B细胞表位和T细胞表位,将其在HAm/H9蛋白序列中进行了标注(图 1)。同时,对H9亚型AIV的各进化分支代表毒株的HA基因抗原表位也进行了预测。结果如表 1所示,相较于其他代表毒株,HAm/H9涵盖了最多的潜在抗原表位,其中B细胞表位有36个,T细胞表位有45个。

|
图 1 HAm/H9蛋白的抗原表位分析结果 Fig. 1 The map of HAm/H9 protein epitopes |
|
|
表 1 H9亚型禽流感病毒的HA及HAm/H9序列的抗原表位比较 Table 1 Prediction of epitopes about HAm/H9 and HA genes of representative strains |
通过PCR扩增获得插入片段HAm/H9和载体片段PHW2000,以1%琼脂糖凝胶电泳,回收目的条带,目的条带大小与预期相符,分别为1 700和3 090 bp(图 2)。通过In-fusion克隆方式,将插入片段与载体片段连接,并转化感受态细胞,挑取阳性克隆,提取质粒,测序结果正确,重组表达质粒PHW2000-HAm/H9构建成功。
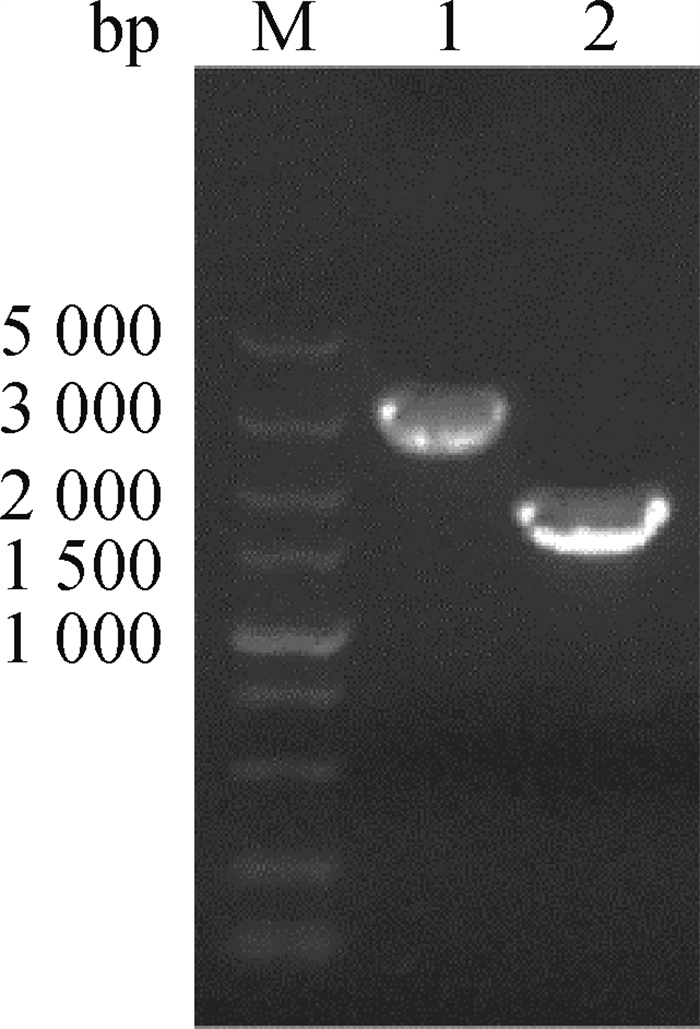
|
M. DL5000 DNA相对分子质量标准; 1. PHW2000; 2. HAm/H9 M. DL5000 DNA marker; 1. PHW2000; 2. HAm/H9 图 2 线性化载体PHW2000和插入片段HAm/H9的扩增 Fig. 2 Amplification of PHW2000 and HAm/H9 |
采用“7+1”反向遗传操作系统,将PHW2000-HAm/H9重组质粒与PR8株的7个基因(除HA外)表达质粒共转染至HEK-293T和MDCK混养细胞,待细胞产生病变,收取细胞反复冻融,接种9日龄SPF鸡胚,RT-PCR方法检测HA阳性尿囊液中重组病毒的HAm/H9基因,目的条带大小约为1 800 bp(图 3),与预期一致,测序结果正确,表明重组病毒拯救成功,命名为rPR8-HAm/H9。
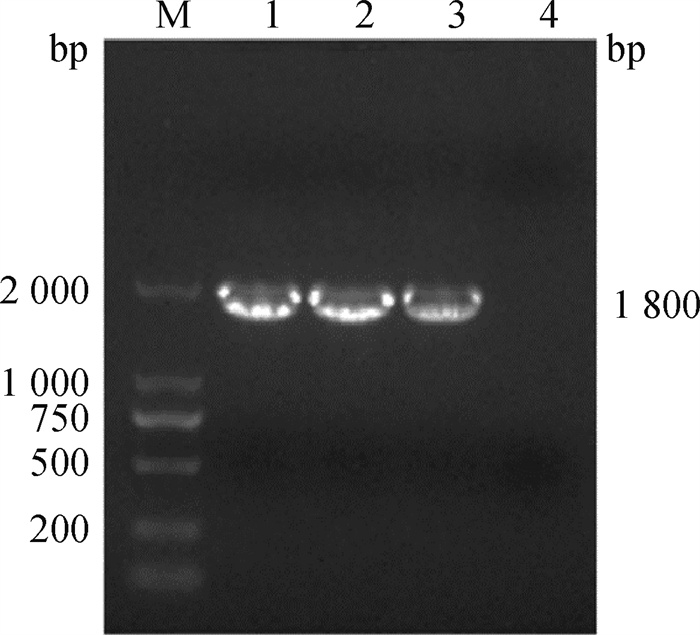
|
M. DL2000 DNA相对分子质量标准; 1~3. 不同HA阳性尿囊液PCR扩增结果; 4. 阴性对照 M. DL2000 DNA marker; 1-3. PCR amplification of HA positive allantoic fluid; 4. Negative control 图 3 RT-PCR鉴定重组病毒rPR8-HAm/H9 Fig. 3 Identification of recombinant virus rPR8-HAm/H9 by RT-PCR |
将重组病毒rPR8-HAm/H9株及PR8亲本株分别以0.1 MOI接种于含有MDCK单层细胞的96孔板,分别于12、24、36、48、60、72 h取上清测定病毒滴度,绘制两株病毒的生长曲线。结果显示,重组病毒rPR8-HAm/H9株和PR8亲本株在感染MDCK细胞后60~72 h达到平台期,滴度分别是106.0、105.4TCID50· mL-1(图 4),重组病毒的细胞增殖滴度略高于PR8亲本株。
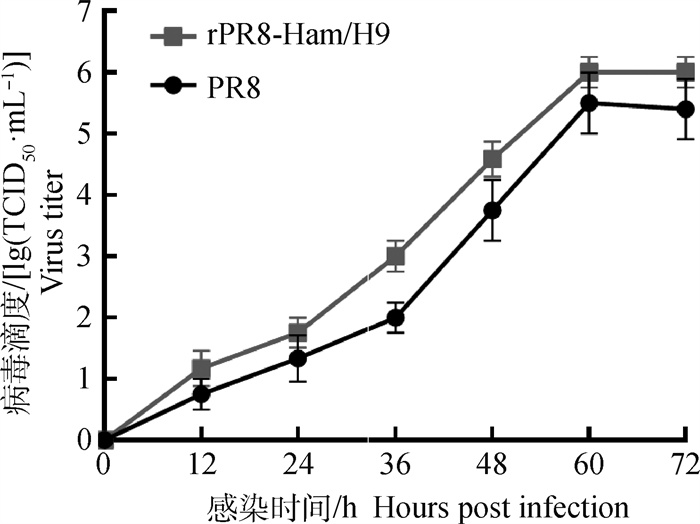
|
图 4 rPR8-HAm/H9及PR8株在MDCK细胞的生长曲线 Fig. 4 Growth kinetics of rPR8-HAm/H9 and PR8 in MDCK cell |
评估了重组病毒作为H9亚型禽流感灭活疫苗在SPF鸡上的免疫原性,分别在首免(primary immune)和二免(secondary immune)两周后采集血清,用两种病毒的四单位抗原以HI法测定血清的抗体水平,同时检测免疫血清的中和抗体水平,并在二免后2周分别用rPR8-HAm/H9和JM0305进行攻毒试验,统计攻毒后的发病情况和排毒情况,综合分析重组病毒灭活疫苗的免疫原性。
2.4.1 HI抗体 分别以两种病毒(rPR8-HAm/H9株和JM0305株)配制四单位抗原,以HI法测定各试验组鸡血清的AIV HI抗体水平,结果如图 5所示,rPR8-HAm/H9灭活疫苗加强免疫2周后,以两种抗原测定的HI结果分别为25.6(rPR8-HAm/H9)和24(JM0305)。JM0305灭活疫苗加强免疫2周后血清抗体水平分别为26(JM0305)和23(rPR8-HAm/H9)。与首次免疫的抗体水平相比,JM0305免疫组针对rPR8-HAm/H9的抗体结果没有显著变化。结果表明rPR8-HAm/H9免疫组的血清与JM0305株具有较好的交叉反应。
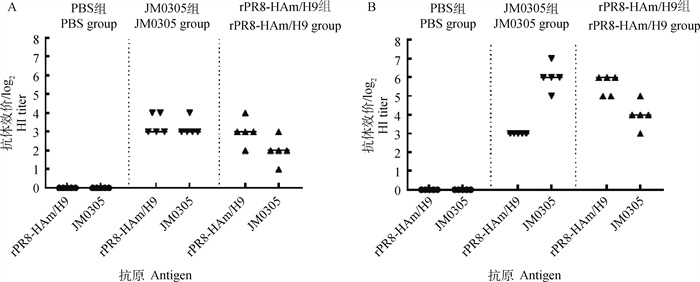
|
A.首免;B.二免 A.Primary immune; B.Secondary immune 图 5 rPR8-HAm/H9及JM0305灭活疫苗免疫后抗体水平 Fig. 5 HI antibody after immunization of rPR8-HAm/H9 and JM0305 inactivated vaccine |
2.4.2 中和抗体 采取固定病毒稀释血清的方法测定各试验组血清的中和抗体效价,结果如表 2所示,rPR8-HAm/H9灭活疫苗免疫组的血清对自身中和抗体效价达到1∶22,对JM0305株的中和抗体效价为1∶10。JM0305株的血清对自身中和抗体效价为1∶16,对rPR8-HAm/H9株的血清中和抗体效价为1∶2。结果表明rPR8-HAm/H9免疫组可产生针对JM0305株的中和抗体。
|
|
表 2 灭活疫苗免疫鸡的中和抗体效价 Table 2 Titer of neutralizing antibody in inactivated vaccine immunized chicken |
2.4.3 攻毒保护效果 H9N2 AIV属于低致病性禽流感病毒,感染后不会引起试验鸡死亡,rPR8-HAm/H9免疫组用rPR8-HAm/H9株攻毒,所有SPF雏鸡均未出现发病症状;用JM0305株攻毒,75%SPF雏鸡未发病。JM0305免疫组分别使用JM0305和rPR8-HAm/H9攻毒时,SPF雏鸡的发病率分别为10%和70%。排毒结果如表 3所示,rPR8-HAm/H9免疫组用rPR8-HAm/H9及JM0305攻毒后仅在第3天的喉头和泄殖腔有少量排毒,保护率分别为70%和80%。JM0305免疫组对rPR8-HAm/H9和JM0305的攻毒保护率分别为10%和50%。PBS对照组对rPR8-HAm/H9和JM0305的攻毒无保护作用,均可分离到病毒。综上,无论是以同源还是异源病毒攻击,rPR8-HAm/H9免疫后均可显著降低雏鸡的发病率和攻毒排毒率,提供了较好的交叉保护作用。
|
|
表 3 攻毒后排毒检测结果 Table 3 The results of virus shedding post-challenge |
H9N2亚型禽流感病毒属于低致病性禽流感病毒,可持续在野禽和家禽种群内和群间传播,具有高度的遗传多样性,虽然此类病毒在家禽中的发病率和死亡率通常较低,但是会引起禽类产蛋下降、混合感染和继发感染,造成严重的经济损失[20]。另外有研究表明,LPAIV通过基因重组增加了高致病性禽流感病毒的遗传多样性,甚至可能由于HA蛋白裂解位点碱性氨基酸的插入或者替换造成毒株致病力的增强[21-22],因此降低H9N2 AIV的传播对于禽流感防控具有重要意义。研究表明使用与当地的流行株匹配性不佳的疫苗株也可能会促进AIV的变异进化[23-25]。因此,为了更好地防控H9亚型禽流感,亟需研发具有较好交叉保护效果的高效、通用疫苗。
近些年,一种新的mosaic疫苗制备技术首先被应用到人类免疫缺陷病毒(HIV)疫苗学领域,与自然分离株的基因序列相比,人工设计合成的mosaic HIV-1 Gag、Pol和Env序列扩大了细胞免疫的广度和深度,提供了更广泛交叉保护[17, 26]。其原因在于该技术分析选择并整合所有的潜在抗原表位于一条完整基因序列中,以9~12个氨基酸为一个完整的抗原表位多肽,最大程度地覆盖了病毒群体的抗原表位。据推测,这种拼接方法可以保留更多的结构保守序列,使得mosaic序列具有更多的构象表位[18, 27]。该技术同样适用于高度变异的禽流感病毒,已有研究证实mosaic H5 HA在小鼠和猴子体内具有较好的免疫原性,可以预防H5N1亚型AIV多个分支毒株的感染[28-30]。
本研究优化设计了1条mosaic H9 HA序列,以其替换PR8株的HA基因,拯救获得1株重组H9N1禽流感病毒rPR8-HAm/H9株。将以重组病毒制备的灭活疫苗免疫SPF雏鸡,加强免疫后进行攻毒试验,检测了免疫后的血清HI抗体、中和抗体及攻毒保护效果。结果表明,与自然分离的JM0305株灭活疫苗相比,rPR8-HAm/H9株灭活疫苗在交叉保护上显示出较大的优势,它既可以对同源病毒rPR8-HAm/H9产生免疫保护,又可以对异源JM0305株产生保护,可显著抑制攻毒后的排毒,保护率分别为70%和80%,具有较好的交叉保护效果。而JM0305株灭活疫苗免疫后虽然可以产生针对rPR8-HAm/H9株的HI抗体,但交叉保护效果差。
4 结论本研究制备了一种基于mosaic HA序列的H9亚型禽流感灭活疫苗,可对异源H9N2亚型AIV JM0305株提供较好的攻毒保护,表明其可作为潜在的H9亚型通用疫苗候选株,后续将通过毒株优化和佐剂筛选,进一步增强其免疫原性,应用更多的异源毒株测定其通用保护效果,为广谱禽流感疫苗研发提供思路和参考。
| [1] |
BISWAS P K, CHRISTENSEN J P, AHMED S S U, et al. Avian influenza outbreaks in chickens, Bangladesh[J]. Emerg Infect Dis, 2008, 14(12): 1909-1912. DOI:10.3201/eid1412.071567 |
| [2] |
DUCATEZ M F, WEBSTER R G, WEBBY R J. Animal influenza epidemiology[J]. Vaccine, 2008, 26(S4): D67-D69. |
| [3] |
NAGARAJAN S, RAJUKUMAR K, TOSH C, et al. Isolation and pathotyping of H9N2 avian influenza viruses in Indian poultry[J]. Vet Microbiol, 2009, 133(1-2): 154-163. DOI:10.1016/j.vetmic.2008.06.013 |
| [4] |
PEACOCK T, REDDY K, JAMES J, et al. Antigenic mapping of an H9N2 avian influenza virus reveals two discrete antigenic sites and a novel mechanism of immune escape[J]. Sci Rep, 2016, 6(1): 18745. DOI:10.1038/srep18745 |
| [5] |
ZHANG S X, YU J L, HE L, et al. Molecular characteristics of the H9N2 avian influenza viruses in live poultry markets in Anhui Province, China, 2013 to 2018[J]. Health Sci Rep, 2021, 4(1): e230. |
| [6] |
LU J H, LIU X F, SHAO W X, et al. Phylogenetic analysis of eight genes of H9N2 subtype influenza virus: a Mainland China strain possessing early isolates' genes that have been circulating[J]. Virus Genes, 2005, 31(2): 163-169. DOI:10.1007/s11262-005-1790-1 |
| [7] |
XU K M, SMITH G J D, BAHL J, et al. The genesis and evolution of H9N2 influenza viruses in poultry from southern China, 2000 to 2005[J]. J Virol, 2007, 81(19): 10389-10401. DOI:10.1128/JVI.00979-07 |
| [8] |
FUSARO A, MONNE I, SALVIATO A, et al. Phylogeography and evolutionary history of reassortant H9N2 viruses with potential human health implications[J]. J Virol, 2011, 85(16): 8413-8421. DOI:10.1128/JVI.00219-11 |
| [9] |
LIU H Q, LIU X F, CHENG J, et al. Phylogenetic analysis of the hemagglutinin genes of twenty-six avian influenza viruses of subtype H9N2 isolated from chickens in China during 1996-2001[J]. Avian Dis, 2003, 47(1): 116-127. DOI:10.1637/0005-2086(2003)047[0116:PAOTHG]2.0.CO;2 |
| [10] |
SUN Y P, LIU J H. H9N2 influenza virus in China: a cause of concern[J]. Protein Cell, 2015, 6(1): 18-25. DOI:10.1007/s13238-014-0111-7 |
| [11] |
丛彦龙, 钟颖, 孙艺学, 等. H9N2亚型禽流感病毒流行病学及其疫苗的研究进展[J]. 中国兽医学报, 2017, 37(2): 386-392. CONG Y L, ZHONG Y, SUN Y X, et al. Advance on epidemiology and vaccine of H9N2 avian influenza virus[J]. Chinese Journal of Veterinary Science, 2017, 37(2): 386-392. (in Chinese) |
| [12] |
ZHANG P H, TANG Y H, LIU X W, et al. Characterization of H9N2 influenza viruses isolated from vaccinated flocks in an integrated broiler chicken operation in eastern China during a 5 year period (1998-2002)[J]. J Gen Virol, 2008, 89(12): 3102-3112. DOI:10.1099/vir.0.2008/005652-0 |
| [13] |
PARK K J, KWON H I, SONG M S, et al. Rapid evolution of low-pathogenic H9N2 avian influenza viruses following poultry vaccination programmes[J]. J Gen Virol, 2011, 92(1): 36-50. DOI:10.1099/vir.0.024992-0 |
| [14] |
SUN Y P, PU J, FAN L H, et al. Evaluation of the protective efficacy of a commercial vaccine against different antigenic groups of H9N2 influenza viruses in chickens[J]. Vet Microbiol, 2012, 156(1-2): 193-199. DOI:10.1016/j.vetmic.2011.10.003 |
| [15] |
SUN Y P, BI Y H, PU J, et al. Guinea pig model for evaluating the potential public health risk of swine and avian influenza viruses[J]. PLoS One, 2010, 5(11): e15537. DOI:10.1371/journal.pone.0015537 |
| [16] |
KINGSTAD-BAKKE B A, CHANDRASEKAR S S, PHANSE Y, et al. Effective mosaic-based nanovaccines against avian influenza in poultry[J]. Vaccine, 2019, 37(35): 5051-5058. DOI:10.1016/j.vaccine.2019.06.077 |
| [17] |
BAROUCH D H, O'BRIEN K L, SIMMONS N L, et al. Mosaic HIV-1 vaccines expand the breadth and depth of cellular immune responses in rhesus monkeys[J]. Nat Med, 2010, 16(3): 319-323. DOI:10.1038/nm.2089 |
| [18] |
FISCHER W, PERKINS S, THEILER J, et al. Polyvalent vaccines for optimal coverage of potential T-cell epitopes in global HIV-1 variants[J]. Nat Med, 2007, 13(1): 100-106. DOI:10.1038/nm1461 |
| [19] |
GOGOLÁK P, SIMON Á, HORVÁTH A, et al. Mapping of a protective helper T cell epitope of human influenza A virus hemagglutinin[J]. Biochem Biophys Res Commun, 2000, 270(1): 190-198. DOI:10.1006/bbrc.2000.2384 |
| [20] |
LI Y, LIU M D, SUN Q Q, et al. Genotypic evolution and epidemiological characteristics of H9N2 influenza virus in Shandong Province, China[J]. Poult Sci, 2019, 98(9): 3488-3495. DOI:10.3382/ps/pez151 |
| [21] |
SUAREZ D L, SENNE D A, BANKS J, et al. Recombination resulting in virulence shift in avian influenza outbreak, Chile[J]. Emerg Infect Dis, 2004, 10(4): 693-699. DOI:10.3201/eid1004.030396 |
| [22] |
MONNE I, FUSARO A, NELSON M I, et al. Emergence of a highly pathogenic avian influenza virus from a low-pathogenic progenitor[J]. J Virol, 2014, 88(8): 4375-4388. DOI:10.1128/JVI.03181-13 |
| [23] |
READ A F, BAIGENT S J, POWERS C, et al. Imperfect vaccination can enhance the transmission of highly virulent pathogens[J]. PLoS Biol, 2015, 13(7): e1002198. DOI:10.1371/journal.pbio.1002198 |
| [24] |
LEE D H, FUSARO A, SONG C S, et al. Poultry vaccination directed evolution of H9N2 low pathogenicity avian influenza viruses in Korea[J]. Virology, 2016, 488: 225-231. DOI:10.1016/j.virol.2015.11.023 |
| [25] |
孙华鹏, 崔新鑫, 潘亮奇, 等. 中国H9N2亚型禽流感病毒的流行现状[J]. 畜牧兽医学报, 2021, 52(5): 1218-1229. SUN H P, CUI X X, PAN L Q, et al. The Epidemiology of H9N2 Avian Influenza Virus in China[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1218-1229. (in Chinese) |
| [26] |
ZOU C C, MURAKOSHI H, KUSE N, et al. Effective suppression of HIV-1 replication by cytotoxic T lymphocytes specific for Pol epitopes in conserved mosaic vaccine immunogens[J]. J Virol, 2019, 93(7): e02142-18. |
| [27] |
LIU M K P, HAWKINS N, RITCHIE A J, et al. Vertical T cell immunodominance and epitope entropy determine HIV-1 escape[J]. J Clin Invest, 2012, 123(1): 380-393. |
| [28] |
KAMLANGDEE A, KINGSTAD-BAKKE B, ANDERSON T K, et al. Broad protection against avian influenza virus by using a modified Vaccinia ankara virus expressing a mosaic Hemagglutinin gene[J]. J Virol, 2014, 88(22): 13300-13309. DOI:10.1128/JVI.01532-14 |
| [29] |
KAMLANGDEE A, KINGSTAD-BAKKE B, OSORIO J E, et al. Mosaic H5 Hemagglutinin provides broad Humoral and cellular immune responses against influenza viruses[J]. J Virol, 2016, 90(15): 6771-6783. DOI:10.1128/JVI.00730-16 |
| [30] |
FLOREK N W, KAMLANGDEE A, MUTSCHLER J P, et al. A modified vaccinia Ankara vaccine vector expressing a mosaic H5 hemagglutinin reduces viral shedding in rhesus macaques[J]. PLoS One, 2017, 12(8): e0181738. DOI:10.1371/journal.pone.0181738 |
(编辑 白永平)



