糖尿病(diabetes mellitus)是一种以高血糖为特征的代谢性疾病,长期的血糖增高,会引起微血管病变、心血管疾病和肾功能衰竭等一系列并发症[1-2]。2019年,全球糖尿病患病率估计为9.3%(4.63亿),到2030年预计上升至10.2%(5.78亿),到2045年预计上升至10.9%(7亿)[1, 3]。糖尿病分为I型糖尿病和II型糖尿病,I型糖尿病是由于胰岛β细胞被破坏而导致胰岛素分泌绝对不足,II型糖尿病是由于外周胰岛素耐受而导致胰岛素分泌相对不足[4-6]。
目前,对大鼠、仓鼠等小型糖尿病动物模型研究较多[7-10],造模技术已较为成熟[11-14],但对犬等大型糖尿病动物模型研究较少[15-18]。小型糖尿病动物模型虽广泛用于糖尿病药物或技术的研发,但因其体型、寿命等局限性,对糖尿病的临床治疗试验参考意义有限[19]。为对糖尿病的发病机制和治疗做进一步研究,亟需建立合适的大型动物的糖尿病模型。目前,已有在猪、猴、犬等大型动物中建立糖尿病模型的记录[19-24]。犬自发性糖尿病以I型糖尿病为主,患病率约为0.005%~1.5%,尤其老年犬和母犬易发[25]。绝大多数犬糖尿病属于胰岛素依赖性糖尿病,类似于人的I型糖尿病,是人的I型糖尿病治疗研究的良好动物模型[26]。Black等[15]、Issekutz等[18]和Anderson等[27]曾在上世纪用链脲佐菌素或四氧嘧啶素建立犬糖尿病模型,但均未研究不同浓度药物对犬肝肾毒性的影响,以及探索两者联合注射的最佳建模剂量。因此,本试验选取犬作为实验动物,采用链脲佐菌素和四氧嘧啶联合注射建立I型糖尿病模型,旨在探索建模的最佳注射剂量,为糖尿病药物或技术的研发提供一种合适的动物疾病模型。
1 材料与方法 1.1 试验动物与试验材料健康的9~12月龄中华田园犬18只,平均体重为(5.09±0.30)kg,均购自西北农林科技大学实验动物中心。链脲佐菌素、四氧嘧啶、柠檬酸钠缓冲液和0.22 μm一次性过滤器均购自索莱宝生物科技公司;血糖仪和血糖试纸购自上海罗氏血糖健康医护公司;舒泰购自法国维克公司;盐酸赛拉嗪注射液购自吉林省华牧公司。
1.2 试验设计18只中华田园犬每天9:00和18:00各饲喂一次,自由饮水,饲养7 d后开始试验。将18只中华田园犬随机分成6组,每组设3个重复,每个重复1只犬。禁食12 h,按链脲佐菌素和四氧嘧啶不同剂量混合分组,其中Ⅰ组(20 mg·kg-1 / 40 mg·kg-1)、Ⅱ组(30 mg·kg-1 /50 mg· kg-1)和Ⅲ组(40 mg·kg-1 /60 mg·kg-1)进行单次经头静脉注射;Ⅳ组(10 mg·kg-1 /20 mg·kg-1)、Ⅴ组(15 mg·kg-1 /25 mg·kg-1)和Ⅵ组(20 mg·kg-1 / 30 mg·kg-1)进行两次静脉注射,两次注射间隔为24 h。注射后12 h内,每隔2 h检测1次血糖,在此期间,若血糖低于4 mmol · L-1,可按0.5 g·kg-1剂量静脉注射20%葡萄糖解救。本试验在西北农林科技大学动物医学院实验动物饲养管理和使用委员会的批准下执行。
1.3 空腹血糖含量测定和静脉葡萄糖耐量试验(IVGTT)给药后,每天早上8点测定空腹血糖含量,连续7 d。试验前和试验后第7天分别进行静脉葡萄糖耐量试验。犬禁食12 h,20%葡萄糖按0.5 g · kg-1的剂量经头静脉注射。分别在注射后15、30、45、60、75、90、105和120 min测定血糖值。
1.4 血液生理和生化指标的测定试验前和试验后第7天从头静脉或隐静脉采血,进行生理和生化指标的测定。采用海力孚HF-3800动物血常规分析仪测定白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、血小板(PLT)、中性粒细胞、淋巴细胞和单核细胞;采用PA8000V动物免疫分析仪测定C反应蛋白(CRP);采用库贝尔IChem-735全自动生化分析仪测定丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、肌酐(CREA)、尿素(UREA)和淀粉酶(AMY)。
1.5 胰腺组织HE染色试验后第7天,舒泰和盐酸赛拉嗪注射液1∶1比例混合,按0.1 ml·kg-1剂量进行肌肉注射麻醉。沿腹中线切开,找到并充分暴露胰腺,切除胰腺并浸泡于4%多聚甲醛组织固定液中,缝合。胰腺组织经脱水透明和石蜡包埋后制成5 μm的切片。用二甲苯和梯度乙醇脱蜡后进行苏木精-伊红(hematoxylin-eosin staining,HE)染色,中性树脂封片,显微镜观察并拍照。
1.6 数据整理和统计分析试验数据采用Excel 2010进行整理,利用SPSS 22.0进行统计和分析。Graphpad Prism绘制血糖变化曲线图。用配对样本t检验给药前后差异,P < 0.01表示差异极显著,P < 0.05表示差异显著,P>0.05表示差异不显著,结果均以“平均值±标准差”表示。
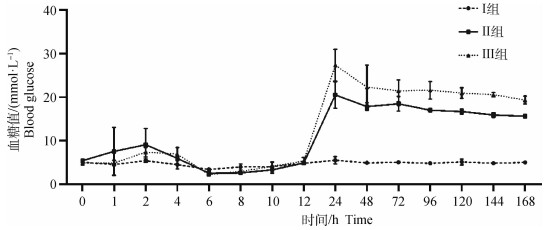
2 结果 2.1 血糖变化如图 1所示,Ⅰ组、Ⅱ组、Ⅲ组按各组药物剂量注射6 h后,均出现血糖下降。注射24 h后,Ⅰ组血糖处于正常生理水平(3.89~6.11 mmol·L-1),含量为(5.53±0.85)mmol·L-1,Ⅱ组和Ⅲ组血糖严重升高,含量分别为(20.50±3.03)mmol·L-1和(27.37±3.60)mmol·L-1。之后连续7 d,Ⅰ组空腹血糖始终处于正常水平,Ⅱ组和Ⅲ组空腹血糖持续高于15 mmol·L-1。
|
图 1 注射药物后Ⅰ组、Ⅱ组和Ⅲ组连续7 d的血糖变化 Fig. 1 Changes of blood glucose in group I, II, and III for 7 consecutive days after drug injection |
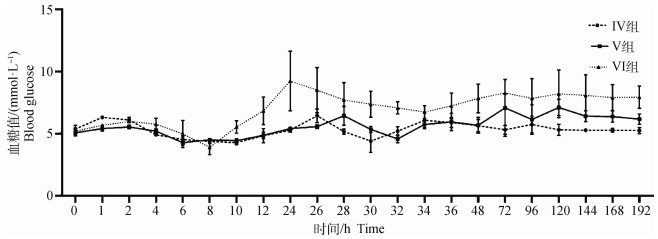
如图 2所示,Ⅳ组、Ⅴ组和Ⅵ组按各组药物剂量注射两次后,Ⅳ组空腹血糖始终处于正常生理水平,Ⅴ组和Ⅵ组虽有上升,但在试验期间均未超过10 mmol·L-1。
|
图 2 注射药物后Ⅳ组、Ⅴ组和Ⅵ组连续7 d血糖变化 Fig. 2 Changes of blood glucose in group IV, V, and VI after injection for 7 consecutive days |
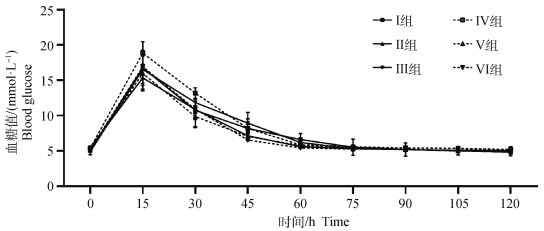
如图 3所示,试验前对各组犬的静脉注射葡萄糖,各组的血糖变化趋势一致。注射15 min后,各组血糖均升高至峰值,其中Ⅳ组最高,可达(18.87±1.62)mmol·L-1。随后各组血糖逐渐开始下降,并在注射后75 min恢复至正常生理水平(约5 mmol·L-1)。此结果说明各组均表现良好的葡萄糖耐受能力。
|
图 3 试验前静脉注射葡萄糖后各组120 min内血糖变化 Fig. 3 Changes of blood glucose in each group within 120 minutes after intravenous glucose injection before the experiment |
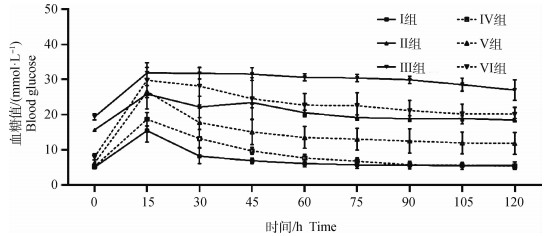
如图 4所示,试验后对各组犬的静脉注射葡萄糖,15 min后,各组血糖均升高至峰值。之后Ⅰ组和Ⅳ组在90 min恢复至注射前水平;Ⅴ组的血糖虽逐渐下降,但120 min仍未达到注射前水平;Ⅱ组、Ⅲ组和Ⅵ组持续保持高血糖状态(18 mmol·L-1以上),在120 min时仍未见明显下降。
|
图 4 试验后静脉注射葡萄糖后各组120 min内血糖变化 Fig. 4 Changes of blood glucose in each group within 120 minutes after intravenous glucose injection after the experiment |
血常规结果表明,各组试验前后各项指标均处于正常生理范围内,C反应蛋白值小于5 mg·L-1,未有炎症反应(数据未显示)。
由表 1可知,与试验前相比,试验后Ⅰ组的ALT和ALP显著升高(P < 0.05);Ⅱ组和Ⅲ组的ALT极显著升高(P < 0.01),AST和ALP显著升高(P < 0.05);Ⅵ组的AST和ALP显著升高(P < 0.05)。其中Ⅲ组的ALT、AST和ALP均超过正常生理范围(ALT:10~100 U·L-1;AST:0~50 U·L-1;ALP:23~212 U·L-1),此结果说明,试验后Ⅲ组的肝功能严重受损。其余各组试验后的ALT、AST或ALP虽出现显著性变化,但均处于正常生理范围内。
|
|
表 1 各组药物对肝功能相关指标的影响 Table 1 The impact of drugs on indexes related to liver function in each group |
由表 2可知,与试验前相比,试验后Ⅱ组、Ⅲ组和Ⅵ组的UREA显著升高(P < 0.05);Ⅲ组和Ⅴ组的CREA显著升高(P < 0.05)。其中Ⅲ组的UREA和CREA均超过正常生理范围(UREA:2.5~9.6 mmol·L-1;CREA:44~159 μmol·L-1),此结果说明,试验后Ⅲ组的肾功能受到损伤。其余各组试验后的UREA和CREA虽出现显著性变化,但均处于正常生理范围内。
|
|
表 2 各组药物对肾功能相关指标的影响 Table 2 The impact of drugs on indexes related to renal function in each group |
由表 3可知,试验前后各组的AMY均无显著性差异(P>0.05),且处于正常生理范围(500~1 000 U·L-1),表明各组胰腺外分泌部均未受到明显损伤。
|
|
表 3 各组药物对胰功能相关指标的影响 Table 3 The impact of drugs on index related to pancreatic function in each group |
如图 5所示,试验后Ⅰ组胰岛边缘整齐,形态正常(图 5A);Ⅱ组胰岛萎缩,结构松散,中央出现空泡,部分胰岛细胞核浓染、固缩(图 5B);Ⅲ组胰岛结构严重受损,其形态不规则,边缘不整齐,胰岛内部出现大片空泡化(图 5C);Ⅳ组和Ⅴ组胰岛轮廓圆润,形态正常(图 5D、E);Ⅵ组胰岛结构松散,但内部细胞未被严重破坏(图 5F);各组除胰岛外,其它部位没有明显的病理学变化。

|
A. Ⅰ组胰岛形态正常;B. Ⅱ组胰岛中央出现空泡;C. Ⅲ组胰岛空泡化严重;D. Ⅳ组胰岛形态正常;E. Ⅴ组胰岛形态正常;F. Ⅵ组胰岛结构松散 A. Islets in group I are normal; B. Vacuoles appear in the center of the islets in group Ⅱ; C. Iislets with severe vacuolation in group Ⅲ; D. Islets in group IV are normal; E. Islets in group V are normal; F. Loose islet structure in group VI 图 5 试验后各组胰腺组织HE染色 Fig. 5 HE staining of pancreatic tissue in each group after the experiment |
目前犬糖尿病模型的判定标准不一,空腹血糖、葡萄糖耐量、胰岛素水平和C肽水平等都可以作为评价标准。朱愉和多秀瀛[28]认为,若犬连续2 d空腹血糖值大于11.1 mmol·L-1或IVGTT效果显著,则成功建立犬糖尿病模型。但仅以2 d的空腹血糖测量值作为建模标准,犬后期存在转归的可能。同时,本研究发现,Ⅵ组犬试验期间空腹血糖值未超过10 mmol·L-1,但试验后糖耐量受损,故认为不能仅以IVGTT效果作为建模标准。I型糖尿病动物的胰腺会有明显的病理变化,最常见的是胰岛形态萎缩,表现为细胞皱缩,呈条束状,核致密,胞浆少。极少部分病例胰岛增生肥大,表现为细胞较大,外形规则清晰,核较大。急性糖尿病常见胰岛细胞空泡变性,特点为细胞浆变空甚至细胞凋亡。本试验将连续7 d空腹血糖值大于15 mmol·L-1作为成功建立犬I型糖尿病的标准,同时通过IVGTT检测犬调控高血糖能力,并根据生理和生化指标的测定判定不同剂量药物对犬的肝、肾、胰毒性,通过胰腺组织切片观察胰岛结构变化,最终确定链脲佐菌素和四氧嘧啶联合注射建立犬I型糖尿病模型的最佳剂量。
手术切除胰腺可建立犬糖尿病模型,但存在风险大、技术要求高和不易操作等缺点[16-17, 29-31]。因此,可考虑通过一些损伤胰腺的药物建立糖尿病模型,研究最多的药物是链脲佐菌素和四氧嘧啶[32]。链脲佐菌素和四氧嘧啶均可通过II型葡萄糖转运蛋白(GLUT2)在胰岛β细胞积累[33],链脲佐菌素主要通过烷基化对β细胞造成损伤[34-35],四氧嘧啶则主要通过形成活性氧选择性损伤β细胞[36-37]。由于不同物种β细胞的GLUT2表达存在差异,链脲佐菌素和四氧嘧啶对β细胞的毒性存在种间差异[38-39]。50 mg·kg-1的链脲佐菌素即可在大鼠中造成不可逆的糖尿病,但在食蟹猴、猪中需要150 mg·kg-1的剂量[40-41]。链脲佐菌素在犬中的建模剂量一般在40~50 mg·kg-1之间,接近或稍微超过半数致死量,而四氧嘧啶一般为50~75 mg·kg-1。Black等[15]选择30 mg·kg-1链脲佐菌素和50 mg·kg-1四氧嘧啶,Anderson等[27]则使用35 mg·kg-1链脲佐菌和40 mg·kg-1四氧嘧啶联合注射,均取得了不错的效果,但都未研究不同剂量药物的造模效果和对犬肝肾毒性的影响。Anderson等[27]还发现,幼犬比成年犬更易造模成功,因此,本试验选取9~12月龄的犬作为试验对象。四氧嘧啶价格便宜但肝肾毒性较大,且链脲佐菌素和四氧嘧啶对β细胞破坏作用的原理不同,因此,本研究采用联合注射链脲佐菌素和四氧嘧啶,在降低药物剂量和减轻肝肾毒性的同时,提高对β细胞特异破坏作用。
本试验设置3个链脲佐菌素和四氧嘧啶(20 mg· kg-1/40 mg·kg-1;30 mg·kg-1/50 mg·kg-1;40 mg·kg-1/60 mg·kg-1)单次联合注射梯度。低剂量组空腹血糖未显著升高,试验后糖耐量正常,胰腺组织形态正常(图 5 A),同时药物未造成肝肾损伤。中剂量组和高剂量组空腹血糖值均连续7 d大于15 mmol·L-1,同时糖耐量受损严重,胰岛受到严重破坏(图 5B、C),但高剂量组对犬肝肾造成严重损伤。
大剂量药物单次注射可迅速破坏β细胞造成永久的胰岛损伤,但可能存在严重的肝肾毒性。与大剂量单次注射方式比,小剂量多次注射可不断刺激自身免疫反应,破坏免疫机制,形成更加稳定的糖尿病模型。因此,本试验同时设置3个链脲佐菌素和四氧嘧啶(10 mg·kg-1 /20 mg·kg-1;15 mg·kg-1 /25 mg·kg-1;20 mg·kg-1/30 mg·kg-1)两次联合注射梯度。3组空腹血糖均达到造模标准,药物也均未造成肝肾损伤,但高剂量组的糖耐量受损,胰岛虽未被破坏但结构松散(图 5F)。后续可继续改进小剂量多次注射方案,如加大注射剂量、缩小时间间隔和增加注射次数等,摸索小剂量多次注射建立犬I型糖尿病模型的可能性。
4 结论30 mg·kg-1链脲佐菌素和50 mg·kg-1四氧嘧啶对犬联合单次静脉注射,血糖值连续7 d大于15 mmol·L-1,糖耐量受损,未造成严重的肝肾毒性,可有效建立I型糖尿病模型。
| [1] |
WILLIAMS R, KARURANGA S, MALANDA B, et al. Global and regional estimates and projections of diabetes-related health expenditure: results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Res Clin Pract, 2020, 162: 108072. DOI:10.1016/j.diabres.2020.108072 |
| [2] |
COLE J B, FLOREZ J C. Genetics of diabetes mellitus and diabetes complications[J]. Nat Rev Nephrol, 2020, 16(7): 377-390. |
| [3] |
SAEEDI P, PETERSOHN I, SALPEA P, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045:results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Res Clin Pract, 2019, 157: 107843. DOI:10.1016/j.diabres.2019.107843 |
| [4] |
ROEP B O, THOMAIDOU S, VAN TIENHOVEN R, et al. Type 1 diabetes mellitus as a disease of the β-cell (do not blame the immune system?)[J]. Nat Rev Endocrinol, 2021, 17(3): 150-161. |
| [5] |
NYAGA D M, VICKERS M H, JEFFERIES C, et al. The genetic architecture of type 1 diabetes mellitus[J]. Mol Cell Endocrinol, 2018, 477: 70-80. |
| [6] |
CHENG F F, CARROLL L, JOGLEKAR M V, et al. Diabetes, metabolic disease, and telomere length[J]. Lancet Diabetes Endocrinol, 2021, 9(2): 117-126. |
| [7] |
何清华, 周迎生, 王征, 等. 2型糖尿病大鼠模型制备的影响因素及其特点[J]. 中国实验动物学报, 2007, 15(6): 425-429. HE Q H, ZHOU Y S, WANG Z, et al. Influencing factors in the development of rat model of type 2 diabetes mellitus and their characteristics[J]. Acta Laboratorium Animalis Scientia Sinica, 2007, 15(6): 425-429. DOI:10.3969/j.issn.1005-4847.2007.06.007 (in Chinese) |
| [8] |
MADSEN M S A, GRØNLUND R V, EID J, et al. Characterization of local gut microbiome and intestinal transcriptome responses to rosiglitazone treatment in diabetic db/db mice[J]. Biomed Pharmacother, 2021, 133: 110966. |
| [9] |
董建中, 杜斌. 四氧嘧啶诱导兔妊娠期糖尿病模型的建立及相关研究[J]. 吉林医学, 2021, 42(4): 776-779. DONG J Z, DU B. Establishment of gestational diabetes rabbits model induced by alloxan and related research[J]. Jilin Medical Journal, 2021, 42(4): 776-779. (in Chinese) |
| [10] |
江霞, 钱豪杰, 魏迅, 等. 斑马鱼糖尿病模型的构建及应用进展[J]. 实验动物与比较医学, 2020, 40(6): 547-552. JIANG X, QIAN H J, WEI X, et al. Research progress in construction and application of diabetes model in zebrafish[J]. Laboratory Animal and Comparative Medicine, 2020, 40(6): 547-552. (in Chinese) |
| [11] |
唐艺丹, 王鲜忠, 张姣姣. Ⅱ型糖尿病动物模型构建的研究进展[J]. 中国实验动物学报, 2020, 28(6): 870-876. TANG Y D, WANG X Z, ZHANG J J. Research progress in the construction of type Ⅱ diabetes animal models[J]. Acta Laboratorium Animalis Scientia Sinica, 2020, 28(6): 870-876. (in Chinese) |
| [12] |
陆少君, 曾伟斌, 臧林泉. 2型糖尿病大鼠模型制备实验研究[J]. 广东药科大学学报, 2017, 33(5): 624-628. LU S J, ZENG W B, ZANG L Q. Experimental study on the preparation of type 2 diabetic rats[J]. Journal of Guangdong Pharmaceutical University, 2017, 33(5): 624-628. (in Chinese) |
| [13] |
罗云, 葛文秀, 孙桂波, 等. 糖尿病视网膜病实验动物模型的研究进展[J]. 中国药理学通报, 2021, 37(3): 297-301. LUO Y, GE W X, SUN G B, et al. Research advances in animal models of diabetic retinopathy[J]. Chinese Pharmacological Bulletin, 2021, 37(3): 297-301. (in Chinese) |
| [14] |
程瑶, 牟文博, 辛华. 用于糖尿病研究的人源化鼠类模型概述[J]. 化工时刊, 2021, 35(2): 40-43. CHENG Y, MOU W B, XIN H. Overview of humanized rodent models for diabetes research[J]. Chemical Industry Times, 2021, 35(2): 40-43. (in Chinese) |
| [15] |
BLACK H E, ROSENBLUM I Y, CAPEN C C. Chemically induced (streptozotocin-alloxan) diabetes mellitus in the dog.Biochemical and ultrastructural studies[J]. Am J Pathol, 1980, 98(2): 295-310. |
| [16] |
ENGERMAN R L, KRAMER J W. Dogs with induced or spontaneous diabetes as models for the study of human diabetes mellitus[J]. Diabetes, 1982, 31(S1): 26-29. |
| [17] |
TSCHOEPE D, JOB F P, HUEBINGER A, et al. Combined subtotal pancreatectomy with selective streptozotocin infusion-a model for the induction of insulin deficiency in dogs[J]. Res Exp Med (Berl), 1989, 189(2): 141-152. |
| [18] |
ISSEKUTZ B Jr, ISSEKUTZ T B, ELAHI D, et al. Effect of insulin infusions on the glucose kinetics in alloxan-streptozotocin diabetic dogs[J]. Diabetologia, 1974, 10(4): 323-328. |
| [19] |
RENNER S, DOBENECKER B, BLUTKE A, et al. Comparative aspects of rodent and nonrodent animal models for mechanistic and translational diabetes research[J]. Theriogenology, 2016, 86(1): 406-421. |
| [20] |
IONUT V, LIU H W, MOORADIAN V, et al. Novel canine models of obese prediabetes and mild type 2 diabetes[J]. Am J Physiol Endocrinol Metab, 2010, 298(1): E38-E48. |
| [21] |
KOOPMANS S J, SCHUURMAN T. Considerations on pig models for appetite, metabolic syndrome and obese type 2 diabetes: from food intake to metabolic disease[J]. Eur J Pharmacol, 2015, 759: 231-239. |
| [22] |
RENNER S, BRAUN-REICHHART C, BLUTKE A, et al. Permanent neonatal diabetes in INSC94Y transgenic pigs[J]. Diabetes, 2013, 62(5): 1505-1511. |
| [23] |
BREMER A A, STANHOPE K L, GRAHAM J L, et al. Fructose-fed rhesus monkeys: a nonhuman primate model of insulin resistance, metabolic syndrome, and type 2 diabetes[J]. Clin Transl Sci, 2011, 4(4): 243-252. |
| [24] |
WOLF E, BRAUN-REICHHART C, STRECKEL E, et al. Genetically engineered pig models for diabetes research[J]. Transgenic Res, 2014, 23(1): 27-38. |
| [25] |
谢伟东. 犬糖尿病发病情况调查与临床诊疗研究[D]. 南京: 南京农业大学, 2013. XIE W D. A investigation on morbidity and clinical diagnosis and treatment of canine diabetes mellitus[D]. Nanjing: Nanjing Agricultural University, 2003. (in Chinese) |
| [26] |
MOSHREF M, TANGEY B, GILOR C, et al. Concise review: canine diabetes mellitus as a translational model for innovative regenerative medicine approaches[J]. Stem Cells Transl Med, 2019, 8(5): 450-455. |
| [27] |
ANDERSON H R, STITT A W, GARDINER T A, et al. Induction of alloxan/streptozotocin diabetes in dogs: a revised experimental technique[J]. Lab Anim, 1993, 27(3): 281-285. |
| [28] |
朱愉, 多秀瀛. 实验动物的疾病模型[M]. 天津: 天津科技翻译出版公司, 1997. ZHU Y, DUO X Y. Disease models in experimental animals[M]. Tianjin: Tianjin Science & Technology Translation & Publishing Corp., 1997. (in Chinese) |
| [29] |
艾昭东, 刘晟, 叶斌, 等. 狗胰腺次全切除制作1型糖尿病模型研究[J]. 现代医药卫生, 2008, 24(21): 3169-3171. AI Z D, LIU S, YE B, et al. Study on create dog diabetic model by subtotal resection of pancreas[J]. Modern Medicine & Health, 2008, 24(21): 3169-3171. (in Chinese) |
| [30] |
袁晖, 李汝权, 梁达晃, 等. 犬糖尿病模型制作和胰腺移植的实验[J]. 中华器官移植杂志, 1998, 19(3): 188. YUAN H, LI R Q, LIANG D H, et al. Experimental study of canine diabetes model and pancreas transplantation[J]. Chinese Journal of Organ Transplantation, 1998, 19(3): 188. (in Chinese) |
| [31] |
SALIS A I, PETERSON R G, STECKER M S, et al. Suprarenal intraarterial infusion of alloxan and streptozotocin during balloon occlusion of the juxtarenal abdominal aorta: a simple technique for inducing diabetes mellitus in canines with reduced mortality[J]. Acad Radiol, 2001, 8(6): 473-477. |
| [32] |
REES D A, ALCOLADO J C. Animal models of diabetes mellitus[J]. Diabet Med, 2005, 22(4): 359-370. |
| [33] |
LENZEN S. The mechanisms of alloxan-and streptozotocin-induced diabetes[J]. Diabetologia, 2008, 51(2): 216-226. |
| [34] |
BOLZÁN A D, BIANCHI M S. Genotoxicity of streptozotocin[J]. Mutat Res, 2002, 512(2-3): 121-134. |
| [35] |
KISACAM M A, KOCAMUFTUOGLU G O, UFAT H, et al. The evaluation of early stage oxidative status in streptozotocin induced diabetes in rats[J]. Arch Physiol Biochem, 2020, 1-5. |
| [36] |
TAKASU N, KOMIYA I, ASAWA T, et al. Streptozocin-and alloxan-induced H2O2 generation and DNA fragmentation in pancreatic islets: H2O2 as mediator for DNA fragmentation[J]. Diabetes, 1991, 40(9): 1141-1145. |
| [37] |
AL-AWAR A, KUPAI K, VESZELKA M, et al. Experimental diabetes mellitus in different animal models[J]. J Diabetes Res, 2016, 2016: 9051426. |
| [38] |
PANDEY S, DVORAKOVA M C. Future perspective of diabetic animal models[J]. Endocr Metab Immune Disord Drug Targets, 2020, 20(1): 25-38. |
| [39] |
TYRBERG B, ANDERSSON A, BORG L A H. Species differences in susceptibility of transplanted and cultured pancreatic islets to the β-cell toxin alloxan[J]. Gen Comp Endocrinol, 2001, 122(3): 238-251. |
| [40] |
KING A J F. The use of animal models in diabetes research[J]. Br J Pharmacol, 2012, 166(3): 877-894. |
| [41] |
DUFRANE D, VAN STEENBERGHE M, GUIOT Y, et al. Streptozotocin-induced diabetes in large animals (pigs/primates): role of GLUT2 transporter and β-cell plasticity[J]. Transplantation, 2006, 81(1): 36-45. |
(编辑 范子娟)



