弓形虫病是由弓形虫引起的一种重要的人兽共患寄生虫病,弓形虫(Toxoplasma gondii)能感染包括人在内的所有温血动物,甚至包括一些冷血动物,并且能寄生于动物机体的所有有核细胞内[1-3]。弓形虫病不仅严重影响人类的健康,还造成了巨大的经济损失。当前对于弓形虫病的治疗主要依赖基于乙胺嘧啶的化学疗法,该方法虽然可以有效地控制弓形虫的急性感染,但普遍存在毒副作用大、治疗周期长、易复发和对弓形虫组织包囊缺乏疗效等缺点[4-5]。因此,筛选和研发出安全且高效的抗弓形虫药物任重而道远。萜类化合物作为天然产物中最多的一部分,已发现具有多种生物活性,其中包括抗弓形虫作用,比如青蒿素、熊果酸、百里酚和穿心莲内酯等在体内和体外都表现出了良好的抗弓形虫活性[6-9]。本试验选择了26个萜类化合物进行抗弓形虫活性的筛选,并对筛选出的化合物桧烯进行了一系列体外活性评价。桧烯是一种单萜类化合物,已作为香料添加剂使用,正在探索作为下一代飞机燃料的成分[10]。目前已知桧烯具有多种生物活性,但对弓形虫的研究未见报道,本研究对其作为抗弓形虫先导化合物具有一定的参考意义。
1 材料与方法 1.1 材料1.1.1 细胞和弓形虫 非洲绿猴肾细胞(Vero)购自中国科学院细胞库;弓形虫RH-2F购自美国典型菌种保藏中心(ATCC);弓形虫Ⅰ型虫株RH和Ⅱ型虫株Pru速殖子由中国农业科学院兰州兽医研究所提供,其中RH-2F是表达了β-半乳糖苷酶的弓形虫RH株,Ⅰ型虫株RH是强毒株,致死率较高,一般发生急性感染;而Ⅱ型Pru是弱毒株,毒力相对较弱,一般经过急性感染期后在组织内形成包囊而转为慢性感染。
1.1.2 药物与试剂 26个萜类化合物购自源叶、麦克林和迈瑞尔等多家公司。CCK-8试剂购自MCE公司,二甲基亚砜(DMSO)购自Sigma公司。DMEM培养基、胎牛血清(FBS)以及双抗等添加剂均购自英潍捷基公司。台盼蓝染色液购自索莱宝公司,Beta-Glo®检测试剂购自普洛麦格公司,所有抗体均购自Abcam公司。
1.2 细胞培养和弓形虫的培养与纯化Vero细胞培养于含10% FBS、1% NEAA、1% Glutamax、1% Sodium pyruvate和1%双抗的DMEM培养基中。3种虫株用含3%FBS的DMEM培养基于Vero细胞中培养和传代。弓形虫多数溢出细胞时用细胞刮把细胞刮下,27 G针头反复抽吸两次,200×g离心5 min后,用5 μm孔径的滤膜过滤上清,1 500×g离心10 min,获得纯化后的速殖子,速殖子用培养基重悬,台盼蓝染色,血细胞计数板计数后用于后续试验与传代[11]。
1.3 萜类化合物活性的初步筛选26种萜类化合物(表 1)用DMSO溶解成20 mg·mL-1的原液待用。RH速殖子3×105个·mL-1接种于有单层Vero细胞的12孔板中,8 h后试验组分别加入用培养基配制的高(40 μg·mL-1)、低(5 μg·mL-1)两个浓度的不同化合物孵育。对照组仅感染RH但未做其他处理,用只含细胞和培养基的孔作为空白组,每组设置3个复孔,分别于24、48和72 h时于倒置显微镜下观察。按与对照组相比视野中弓形虫数量减少60%以上的标准初步筛选出活性化合物。
|
|
表 1 萜类化合物初筛结果 Table 1 Preliminary screening results of terpenoids |
对于初步筛选得到的活性化合物,采用CCK-8法测定其对Vero细胞的毒性。Vero细胞1×105个·mL-1,接种于96孔板,培养12 h后,加入各浓度的化合物。以未加化合物的孔为对照组,只含培养基的孔为空白组。培养24 h后加入CCK-8试剂,作用1~2 h后于酶标仪内测定各孔D450 nm值,独立的试验重复3次。用Graph Pad Prism 8.3绘图并计算95%的细胞存活率,以此作为化合物对Vero细胞的最大安全浓度[12]。
1.5 活性化合物对弓形虫增殖的影响12孔板的单层细胞中加入浓度为2×105个·mL-1的RH速殖子。入侵8 h后加入各浓度为安全浓度的活性化合物孵育,并以0.25% DMSO为对照组,分别于培养24、48和72 h时Giemsa染色观察结果[13]。
1.6 桧烯对RH-2F的抑制作用用表达β-半乳糖苷酶的弓形虫RH-2F株用于生长抑制测定[14]。从Vero细胞中收获新鲜活力强的RH-2F速殖子,调整RH-2F的浓度为1×105个·mL-1。以此配制各浓度的桧烯,以0.25%DMSO为对照组,只含培养基的为空白组。培养12 h后加入Beta-Glo®检测试剂,作用30 min后于光度计中检测发光值[15-16]。
1.7 桧烯对细胞内RH的抗增殖作用将1×105个·mL-1的RH速殖子接种于有单层Vero细胞的12孔板爬片中,入侵4 h后,加入桧烯作用24和48 h,0.25%DMSO为阴性对照组,10 μg·mL-1的乙胺嘧啶为阳性对照。用4%多聚甲醛固定,抗原修复,10%山羊血清封闭,0.2%Triton X-100通透,选择用兔抗弓形虫多克隆抗体对弓形虫进行标记,二抗为山羊抗兔lgG H&L(Alexa Fluor® 488),DAPI染核[17]。染色封片后于共聚焦显微镜下观察拍照。
1.8 桧烯对细胞内Pru的抗增殖作用1.8.1 Giemsa染色 6孔板的单层细胞中加入浓度为1.5×105个·mL-1的Pru速殖子。入侵12 h,用DPBS洗去未入侵的速殖子,并加入浓度为80 μg·mL-1的桧烯,同时设置阳性对照和阴性对照。分别于培养24和48 h时Giemsa染色观察结果。
1.8.2 细胞免疫荧光 将1×105个·mL-1的Pru速殖子接种于12孔板中的单层Vero细胞的爬片中,入侵6 h后加入桧烯作用24 h,同时设置阳性对照和阴性对照。固定、封闭,通透和染色。小鼠抗弓形虫单克隆抗体为一抗,二抗为山羊抗小鼠lgG H&L(Alexa Fluor® 647),DAPI染核。封片后于共聚焦显微镜下观察拍照。
1.9 桧烯对RH的抗入侵作用将含有各浓度桧烯的1×105个·mL-1的RH速殖子在培养箱中处理1 h后接种于单层Vero细胞中,0.25%DMSO为阴性对照组,10 μg·mL-1的乙胺嘧啶为阳性对照。入侵2 h后,尽量用PBS将未入侵的速殖子洗去。固定、抗原修复和封闭后用小鼠抗弓形虫单克隆抗体对细胞外的弓形虫进行标记,二抗为山羊抗小鼠lgG H&L(Alexa Fluor® 647)。0.2%Triton X-100通透后选择用兔抗弓形虫多克隆抗体对细胞内的弓形虫进行标记,二抗为山羊抗兔lgG H&L(Alexa Fluor® 488),DAPI染核[18-19]。封片后于共聚焦显微镜下随机选择10个视野观察拍照并计数。按公式入侵率(%)=试验组细胞内弓形虫数/阴性对照组细胞内弓形虫数×100%计算。
1.10 结果统计及分析用GraphPad Prism 8.3进行IC50的计算及绘图,并检验(t检验)组间数据的显著性,安全浓度于GraphPad官网计算。细胞免疫荧光图片使用软件ZEN 2.6进行处理。**.P<0.01、***.P<0.001和****.P<0.000 1都代表相同时间点试验组与对照组比较存在极显著差异。
2 结果 2.1 26个萜类化合物抗弓形虫活性的初步筛选26个萜类化合物以高浓度(40 μg·mL-1)和低浓度(5 μg·mL-1)两个浓度进行初步筛选,与对照组相比视野中弓形虫数量减少60%以上判定为有效。结果如表 1,初步筛选出了桧烯、莪术烯和环黄芪醇3个活性化合物。
2.2 活性化合物的细胞毒性筛选得到的桧烯、莪术烯和环黄芪醇对Vero细胞的IC50分别为147.3、31.32和104.7 μg·mL-1 (图 1)。根据GraphPad Prism 8.3拟合的曲线斜率和IC50值计算出各个化合物对Vero细胞的最大安全浓度,桧烯、莪术烯和环黄芪醇的最大安全浓度依次为81.74、17.38和50.15 μg·mL-1。选择以桧烯80 μg·mL-1、莪术烯17 μg·mL-1和环黄芪醇50 μg·mL-1用于后续试验。

|
图 1 活性化合物的细胞毒性 Fig. 1 Cytotoxicity of active compounds |
Giemsa染色分析发现莪术烯(17 μg·mL-1)、环黄芪醇(50 μg·mL-1)和桧烯(80 μg·mL-1)3个化合物中桧烯对弓形虫的作用显著,虽然在24和48 h时桧烯组仍然可观察到少量的纳虫泡,但是72 h时桧烯组细胞中未观察到纳虫泡和速殖子,而对照组中已无细胞结构,视野中全是RH速殖子(图 2 A3 )。莪术烯和环黄芪醇虽然可以抑制RH的增殖,但是在24、48 h时细胞中都存在纳虫泡或速殖子,72 h时速殖子已从细胞内逸出,遍布细胞外(图 2)。
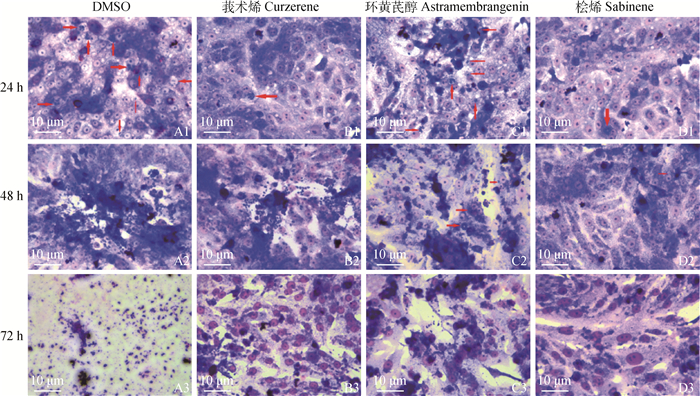
|
红色箭头所指为RH速殖子或纳虫泡,放大倍数为400× The red arrow points to Pru tachyzoites or parasitophorous vacuole, and the magnification is 400× 图 2 萜类活性化合物对弓形虫RH株增殖的影响 Fig. 2 Effect of terpenoid active compound on the proliferation of T. gondii RH strain |
桧烯对RH-2F的IC50为90.76 μg·mL-1,桧烯256 μg·mL-1作用12 h时RH-2F的存活率仅为16.87%。随着剂量的递减,存活率递增,桧烯对RH-2F的作用呈剂量依赖性(图 3)。
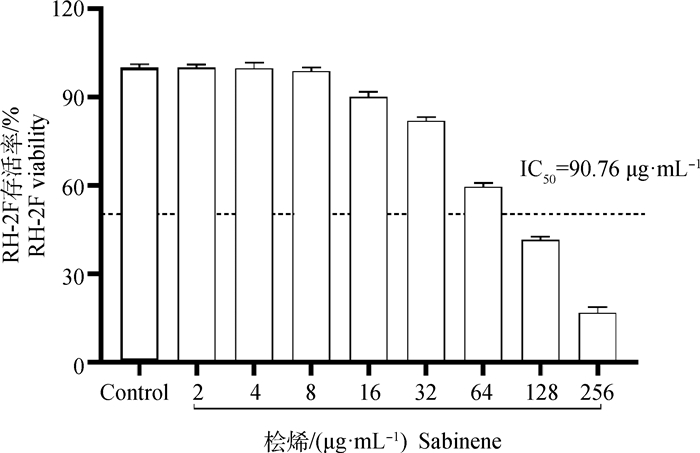
|
图 3 桧烯对RH-2F的抑制作用 Fig. 3 Inhibitory effect of sabinene on RH-2F |
24 h时与DMSO组相比RH明显减少,虽未见散在速殖子,但多见纳虫泡(图 4 B1)。48 h时与DMSO相比只有很少的RH速殖子,未观察到纳虫泡(图 4 B2)。同乙胺嘧啶相比,桧烯虽然在24 h时活性更差,但在48 h时活性相当(图 4)。
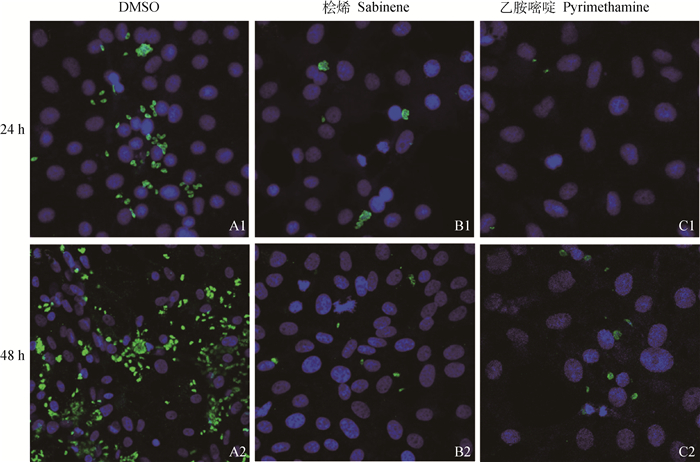
|
蓝色荧光为细胞核,绿色荧光为RH,放大倍数为400× The blue fluorescence is the nucleus, the green fluorescence is Pru, and the magnification is 400× 图 4 桧烯对细胞内弓形虫RH株增殖的影响 Fig. 4 Effect of sabinene on the proliferation of intracellular T. gondii RH strain |
2.6.1 Giemsa染色观察 24 h时Giemsa染色结果与DMSO相比桧烯组中弓形虫明显减少,但仍可见少量虫体。48 h时乙胺嘧啶中可观察到小的纳虫泡,但在桧烯中未发现,而此时DMSO视野中已被大大小小的纳虫泡和虫体占据(图 5)

|
红色箭头所指为Pru速殖子或纳虫泡,放大倍数为400× The red arrow points to Pru tachyzoites or parasitophorous vacuole, and the magnification is 400× 图 5 桧烯对细胞内弓形虫Pru株增殖的影响(Giemsa染色) Fig. 5 Effect of sabinene on the proliferation of intracellular T. gondii Pru strain(Giemsa staining) |
2.6.2 细胞免疫荧光观察 24 h时的细胞免疫荧光结果表明,桧烯对细胞内的弓形虫Ⅱ型虫株Pru的抗增殖效果显著,可以抑制Pru纳虫泡的形成。DMSO组中随处可见纳虫泡,桧烯组视野中只有极少零星散在的Pru,与乙胺嘧啶相比数量和大小都小得多(图 6)。
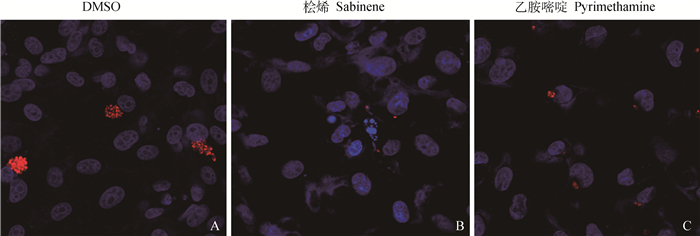
|
蓝色荧光为细胞核,红色荧光为Pru,放大倍数为400× The blue fluorescence is the nucleus, the red fluorescence is Pru, and the magnification is 400× 图 6 桧烯对细胞内弓形虫Pru株增殖的影响(细胞免疫荧光) Fig. 6 Effect of sabinene on the proliferation of intracellular T. gondii Pru strain(cellular immunofluorescence) |
桧烯对RH具有极显著的抗入侵作用(P<0.001),并且呈剂量依赖性,40 μg·mL-1时入侵率为63.22%,120 μg·mL-1时入侵率为19.50%,都比阳性对照乙胺嘧啶(Pyr)的72.99%要低(图 7)。

|
**.P<0.01; ***.P<0.001; ****.P<0.000 1 图 7 桧烯对RH的入侵抑制作用 Fig. 7 Inhibition effect of sabinene on RH invasion |
弓形虫病是世界上最具破坏性的人畜共患病之一,全球约有20亿人感染[20]。因预防手段的有限,当前对于弓形虫病的措施主要是化学疗法,但是当前的治疗药物存在诸多缺陷[5]。基于疟原虫和弓形虫拥有共同的祖先和相似的生物学特性,治疗弓形虫病新药的一个潜在来源就是重新利用针对疟疾开发的药物[21]。当前已有很多研究表明,很多对疟原虫有效的化合物,同时也对弓形虫有效,如磺胺嘧啶、乙胺嘧啶、青蒿素、本芴醇和阿托伐醌等化合物[21-24]。萜类化合物是天然产物中最大的一类,近期对于其在抗癌和抗真菌, 尤其是抗疟疾方面引起了广泛的关注[25]。因此,本研究首先以高低两个浓度从26个萜类化合物中初步筛选出了桧烯、莪术烯和环黄芪醇这3个具有抗弓形虫活性的化合物。经细胞毒性试验确定3个化合物的安全浓度范围,以安全浓度进行抗弓形虫活性评价。3个化合物的细胞毒性都呈剂量依赖性,其中桧烯的细胞毒性最小,安全浓度范围最广,同时桧烯的抗弓形虫活性最好。
桧烯是重要的天然双环单萜,可以用作调味剂、香料添加剂、精细化学品和高级生物燃料,同时也具有抗真菌、抗炎和预防骨骼肌萎缩等生物活性[26-28]。虽然桧烯具有杀虫作用,桧烯对赤拟谷盗(Tribolium castaneum Herbst)和玉米象(Sitophilus zeamais)等昆虫具有显著的驱避作用和熏蒸毒性,但没有关于桧烯对弓形虫有活性的研究报道[29]。本研究通过Giemsa染色、细胞免疫荧光和生物化学发光等方法证明了桧烯对弓形虫有显著活性,但未对桧烯的抗弓形虫作用机制进行探究。有研究表明桧烯是鼠伤寒沙门菌(Salmonella Typhimurium)靶蛋白L-天冬酰胺酶的有效抑制剂,可以通过抑制L-天冬酰胺酶的活性对鼠伤寒沙门菌起作用[30]。L-天冬酰胺酶催化天冬酰胺水解为天冬氨酸和氨。另外,L-天冬酰胺酶参与氨基酸(如赖氨酸、蛋氨酸和苏氨酸)的生物合成[31]。除人类外,L-天冬酰胺酶存在于各种生物中,如动物、植物和各种微生物,其中就包括弓形虫[32-33]。但桧烯是否是通过抑制L-天冬酰胺酶来抑制弓形虫的增殖和入侵还未得知,有必要进行进一步的研究以阐明抑制机制。
4 结论从萜类化合物中筛选出了抗弓形虫活性化合物桧烯,桧烯不仅对Vero细胞有较低的毒性,对弓形虫的强毒Ⅰ型虫株(RH)和弱毒Ⅱ型虫株(Pru)都有显著的抗增殖作用,而且对Ⅰ型虫株(RH)的入侵有极显著的抑制作用,桧烯可作为潜在的抗弓形虫先导化合物。
致谢: 由衷地感谢原中国农业科学院兰州兽医研究所朱兴全研究员和贺君君博士馈赠的弓形虫RH和Pru虫株。
| [1] |
ALMERIA S, DUBEY J P. Foodborne transmission of Toxoplasma gondii infection in the last decade. An overview[J]. Res Vet Sci, 2021, 135: 371-385. DOI:10.1016/j.rvsc.2020.10.019 |
| [2] |
高俊莹, 张东超, 李璇, 等. 弓形虫表面抗原SAG1黏附宿主细胞表面硫化肝素的特性研究[J]. 畜牧兽医学报, 2019, 50(9): 1874-1881. GAO J Y, ZHANG D C, LI X, et al. The characteristic study of Toxoplasma gondii surface antigen SAG1 adhering to heparan sulfate on the host cell surface[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(9): 1874-1881. (in Chinese) |
| [3] |
MILNE G, WEBSTER J P, WALKER M. Toxoplasma gondii: an underestimated threat?[J]. Trends Parasitol, 2020, 36(12): 959-969. DOI:10.1016/j.pt.2020.08.005 |
| [4] |
ELSHEIKHA H M, MARRA C M, ZHU X Q. Epidemiology, pathophysiology, diagnosis, and management of cerebral toxoplasmosis[J]. Clin Microbiol Rev, 2020, 34(1): e00115-19. |
| [5] |
ALDAY P H, DOGGETT J S. Drugs in development for toxoplasmosis: advances, challenges, and current status[J]. Drug Des Devel Ther, 2017, 2017: 273-293. |
| [6] |
FENG X C, CAO S J, QIU F, et al. Traditional application and modern pharmacological research of Artemisia annua L[J]. Pharmacol Ther, 2020, 216: 107650. DOI:10.1016/j.pharmthera.2020.107650 |
| [7] |
CHOI W H, LEE I A. The mechanism of action of ursolic acid as a potential anti-Toxoplasmosis agent, and its immunomodulatory effects[J]. Pathogens, 2019, 8(2): 61. DOI:10.3390/pathogens8020061 |
| [8] |
OLIVEIRA C B S, MEURER Y S R, MEDEIROS T L, et al. Anti-Toxoplasma activity of estragole and thymol in murine models of congenital and noncongenital toxoplasmosis[J]. J Parasitol, 2016, 102(3): 369-376. DOI:10.1645/15-848 |
| [9] |
GOZALBES R, GÁLVEZ J, GARCíA-DOMENECH R, et al. Molecular search of new active drugs against Toxoplasma gondii[J]. SAR QSAR Environ Res, 1999, 10(1): 47-60. DOI:10.1080/10629369908039165 |
| [10] |
ZHANG H B, LIU Q, CAO Y J, et al. Microbial production of sabinene-a new terpene-based precursor of advanced biofuel[J]. Microb Cell Fact, 2014, 13: 20. DOI:10.1186/1475-2859-13-20 |
| [11] |
SI H F, XU C Y, ZHANG J L, et al. Licochalcone A: an effective and low-toxicity compound against Toxoplasma gondii in vitro and in vivo[J]. Int J Parasitol: Drugs Drug Resist, 2018, 8(2): 238-245. DOI:10.1016/j.ijpddr.2018.02.006 |
| [12] |
QIAN W F, WANG H, SHAN D, et al. Activity of several kinds of drugs against Neospora caninum[J]. Parasitol Int, 2015, 64(6): 597-602. DOI:10.1016/j.parint.2015.08.002 |
| [13] |
ZHANG J L, SI H F, LI B, et al. Myrislignan exhibits activities against Toxoplasma gondii RH strain by triggering mitochondrial dysfunction[J]. Front Microbiol, 2019, 10: 2152. DOI:10.3389/fmicb.2019.02152 |
| [14] |
JANETKA J W, HOPPER A T, YANG Z P, et al. Optimizing pyrazolopyrimidine inhibitors of calcium dependent protein kinase 1 for treatment of acute and chronic toxoplasmosis[J]. J Med Chem, 2020, 63(11): 6144-6163. DOI:10.1021/acs.jmedchem.0c00419 |
| [15] |
MURAKOSHI F, BANDO H, SUGI T, et al. Nullscript inhibits Cryptosporidium and Toxoplasma growth[J]. Int J Parasitol: Drugs Drug Resist, 2020, 14: 159-166. DOI:10.1016/j.ijpddr.2020.10.004 |
| [16] |
HAN Y M, ADEYEMI O S, KABIR M H B, et al. Screening of compound libraries for inhibitors of Toxoplasma growth and invasion[J]. Parasitol Res, 2020, 119(5): 1675-1681. DOI:10.1007/s00436-020-06673-9 |
| [17] |
LU Y N, ZHAO X D, XU X, et al. Arctigenin exhibits hepatoprotective activity in Toxoplasma gondii-infected host through HMGB1/TLR4/NF-κB pathway[J]. Int Immunopharmacol, 2020, 84: 106539. DOI:10.1016/j.intimp.2020.106539 |
| [18] |
LI J X, GUO H P, GALON E M, et al. Hydroxylamine and carboxymethoxylamine can inhibit Toxoplasma gondii growth through an aspartate aminotransferase-independent pathway[J]. Antimicrob Agents Chemother, 2020, 64(3): e01889-19. |
| [19] |
GUO H P, GAO Y, JIA H L, et al. Characterization of strain-specific phenotypes associated with knockout of dense granule protein 9 in Toxoplasma gondii[J]. Mol Biochem Parasitol, 2019, 229: 53-61. DOI:10.1016/j.molbiopara.2019.01.003 |
| [20] |
SMITH N C, GOULART C, HAYWARD J A, et al. Control of human toxoplasmosis[J]. Int J Parasitol, 2021, 51(2-3): 95-121. DOI:10.1016/j.ijpara.2020.11.001 |
| [21] |
RADKE J B, BURROWS J N, GOLDBERG D E, et al. Evaluation of current and emerging antimalarial medicines for inhibition of Toxoplasma gondii growth in vitro[J]. ACS Infect Dis, 2018, 4(8): 1264-1274. DOI:10.1021/acsinfecdis.8b00113 |
| [22] |
ROSENBERG A, LUTH M R, WINZELER E A, et al. Evolution of resistance in vitro reveals mechanisms of artemisinin activity in Toxoplasma gondii[J]. Proc Natl Acad Sci U S A, 2019, 116(52): 26881-26891. DOI:10.1073/pnas.1914732116 |
| [23] |
WANG D W, XING M G, El-ASHRAM S, et al. Determination of lumefantrine as an effective drug against Toxoplasma gondii infection - in vitro and in vivo study[J]. Parasitology, 2021, 148(1): 122-128. DOI:10.1017/S0031182020002036 |
| [24] |
YAMAMOTO M, ICHINOHE T, WATANABE A, et al. The antimalarial compound Atovaquone inhibits zika and dengue virus infection by blocking E protein-mediated membrane fusion[J]. Viruses, 2020, 12(12): 1475. DOI:10.3390/v12121475 |
| [25] |
KHALID A, TAKAGI H, PANTHEE S, et al. Development of a terpenoid-production platform in Streptomyces reveromyceticus SN-593[J]. ACS Synth Biol, 2017, 6(12): 2339-2349. DOI:10.1021/acssynbio.7b00249 |
| [26] |
CAO Y J, ZHANG H B, LIU H, et al. Biosynthesis and production of sabinene: current state and perspectives[J]. Appl Microbiol Biotechnol, 2018, 102(4): 1535-1544. DOI:10.1007/s00253-017-8695-5 |
| [27] |
RYU Y, LEE D, JUNG S H, et al. Sabinene prevents skeletal muscle atrophy by inhibiting the MAPK-MuRF-1 pathway in rats[J]. Int J Mol Sci, 2019, 20(19): 4955. DOI:10.3390/ijms20194955 |
| [28] |
PARK B I, KIM B S, KIM K J, et al. Sabinene suppresses growth, biofilm formation, and adhesion of Streptococcus mutans by inhibiting cariogenic virulence factors[J]. J Oral Microbiol, 2019, 11(1): 1632101. DOI:10.1080/20002297.2019.1632101 |
| [29] |
ZHOU S X, WEI C X, ZHANG C, et al. Chemical composition, phytotoxic, antimicrobial and insecticidal activity of the essential oils of Dracocephalum integrifolium[J]. Toxins, (Basel), 2019, 11(10): 598. DOI:10.3390/toxins11100598 |
| [30] |
VIMAL A, PAL D, TRIPATHI T, et al. Eucalyptol, sabinene and cinnamaldehyde: potent inhibitors of salmonella target protein L-asparaginase[J]. 3 Biotech, 2017, 7(4): 258. DOI:10.1007/s13205-017-0891-6 |
| [31] |
GUO J, COKER A R, WOOD S P, et al. Structure and function of the thermostable L-asparaginase from Thermococcus kodakarensis[J]. Acta Crystallogr D Struct Biol, 2017, 73(Pt 11): 889-895. |
| [32] |
CACHUMBA J J M, ANTUNES F A F, PERES G F D, et al. Current applications and different approaches for microbial L-asparaginase production[J]. Braz J Microbiol, 2016, 47(Suppl 1): 77-85. |
| [33] |
ZHANG Y, LAI B S, JUHAS M. Deactivation and mislocalization of Toxoplasma gondii rhoptry protein 18 induced by a single amino acid mutation on the proton transport catalytic aspartic acid[J]. Microbiol Res, 2020, 230: 126352. DOI:10.1016/j.micres.2019.126352 |
(编辑 白永平)



