2. 农业农村部动物疫病病原生物学重点实验室东北科学观测实验站, 哈尔滨 150030
2. Northeast Scientific Inspection Observation Station, Key Laboratory of Animal Pathogen Biology of Ministry of Agriculture and Rural Affairs, Harbin 150030, China
猪沙门菌病(又称猪副伤寒),主要由猪霍乱沙门菌(S.Cholerasuis)、鼠伤寒沙门菌(S. Tyobimurium),德尔卑沙门菌(S. Derby)和肠炎沙门菌(S.enteritidis)等血清型引起[1-2]。由猪霍乱沙门菌引起的沙门菌病[3],以1~4月龄多发,临床上可分为急性败血症、亚急性和慢性三种类型[4],本病常引起较高的死亡率,其中败血型病死率达90%,慢性型病死率达25%~50%[5-6],在仔猪中导致代价高昂的腹泻病,给养猪业造成巨大的经济损失[7]。在过去的几十年中,抗生素经常被用于预防感染[8]。但是,由于抗生素耐药性的潜在发展,畜牧业减少或停止添加这些兽药的压力越来越大。因此,如何提高断乳仔猪的免疫力是一个亟待解决的问题[9]。
乳铁蛋白肽(lactoferricin and lactoferrin ampin, LFCA)是乳铁蛋白在酸性环境条件下经胃蛋白酶作用,从其N端释放的具有活性的多肽,其杀菌、抗氧化,调节免疫系统等功能要高于未发生酶解的乳铁蛋白[10-13]。在动物生产中使用乳铁蛋白活性肽,可以降低仔猪的缺铁性贫血发病率、提高断乳仔猪的免疫机能并改善其肠道微生态环境[14],促进断乳仔猪健康生长,可作为养殖生产中理想的饲用抗生素替代品候选制剂[15]。罗伊氏乳酸杆菌作为动物体内广泛分布的正常菌群,具有良好的益生功能和较强的黏附能力[16-17]。
本研究利用实验室构建的表达牛乳铁蛋白肽(LFCA)的无抗性重组菌pPG-LFCA-E/LR-CO21,通过蛋白质印迹技术证实乳铁蛋白肽的表达,并初步评价重组菌对断乳仔猪生长的影响和对其感染猪霍乱沙门菌的保护作用,为pPG-LFCA-E/LR-CO21作为断乳仔猪微生态制剂替代饲用抗生素提供坚实的理论依据与物质基础。
1 材料与方法 1.1 材料1.1.1 菌株 表达牛乳铁蛋白肽的重组猪源罗伊氏乳酸杆菌pPG-LFCA-E/LR-CO21,猪霍乱沙门菌Salmonella Choleraesuis CVCC79102,金黄色葡萄球菌Staphylococcus aureus CVCC546与大肠杆菌Escherichia coli CVCC10141,由东北农业大学微生物与免疫学实验室保存,所有试验均以指数生长期的细胞进行。
1.1.2 主要试剂 琼脂粉、氯霉素、溶菌酶等购自北京索莱宝生物公司。IgG、IL-2、IL-4、IL-12、IL-6的细胞因子ELISA检测试剂盒购自酶免公司;罗氏染料LightCycler 480 SYBR Green I Master购自上海罗氏有限公司;LB培养基(酵母提取物0.5 g、胰蛋白胨1 g和氯化钠1 g,定容至100 mL);MRS培养基购自青岛海博生物技术有限公司;小量质粒DNA提取试剂盒购自天根生化科技(北京)有限公司
1.1.3 设备仪器 落地式超净工作台(Froma Scientific 1829型);紫外分光光度计(Thermo Fisher);立式高压蒸汽灭菌锅(SANYO);恒温摇床(上海知楚仪器有限公司);-40 ℃超低温冰箱(Revco公司);凝胶成像系统(Life Science公司Champ Gel 6000);转膜仪(BIO-RAD);切片机(Leica公司RM2235型);荧光定量PCR仪(ABI PrismⓇ 7300型荧光定量PCR仪)
1.1.4 实验动物 54只28日龄杜长大断乳仔猪,购自东北农业大学阿城实验实习基地。
1.2 目的蛋白的表达鉴定及定量分析取重组菌pPG-LFCA-E/LR-CO21、空菌pPG/LR-CO21发酵液在MRS固体培养基上划线培养,选取线上单个菌落于MRS液体培养基进行扩大培养,再以1∶100接入含有MRS培养基的发酵罐中扩大培养。发酵时发酵罐转速为50 r·min-1,温度37 ℃,pH5.5,提取菌液上清与菌体沉淀蛋白,经SDS-PAGE电泳和NC转膜。一抗孵育1∶200稀释的牛乳铁蛋白肽单克隆抗体4E10,二抗孵育1∶5 000脱脂乳稀释的HRP标记山羊抗鼠IgG抗体,ECL显色。
另外利用已知浓度(2 μg·mL-1)人工合成的牛乳铁蛋白肽作为阳性标准品,用PBS稀释后检测蛋白浓度,将蛋白包被96孔酶标板,设3个平行,3次重复试验,1∶200比例稀释制备的牛乳铁蛋白肽单克隆抗体4E10作一抗,TMB显色后,测定OD450 nm数值,绘制牛乳铁蛋白肽浓度的标准曲线。将培养时间为8、10、12、14、16、18、20、22、24 h的重组罗伊氏乳酸杆菌pPG-LFCA/LR-CO21上清和菌体进行ELISA,根据标准曲线计算重组菌表达牛乳铁蛋白肽的含量,最终得到重组菌表达牛乳铁蛋白肽的最佳条件。
1.3 抗菌肽体外抑菌活性的测定采用牛津杯法测定体外抑菌活性,以东北农业大学微生物与免疫学实验室保存的S. aureus CVCC546、S. Choleraesuis CVCC79102与E. coli CVCC10141为试验菌株,将3种细菌悬浮液(OD600 nm=0.5)200 μL分别均匀铺与于LB平板上。将牛津杯置于培养基表面轻轻按压,以防漏液。通过将上清液过滤(0.22 μm)以获得无细胞悬浮液(CFS),向牛津杯中加入200 μL重组菌pPG-LFCA-E/LR-CO21无细胞上清液或200 μL空菌pPG/LR-CO21无细胞上清液。根据不同细菌最适生长温度分别培养12 h。利用游标卡尺测量抑菌圈直径。
1.4 实验动物分组及饲喂程序将54头28日龄断乳仔猪,随机分成4组,前3组每组12个重复(公、母各半),第4组18个重复。第1组重组菌组(LR-LFCA),饲喂基础日粮+1.2× 1010CFU·kg-1[18]表达乳铁蛋白肽的重组罗伊氏乳酸杆菌;第2组为空菌组(LR-CON),饲喂基础日粮+ 1.2×1010CFU·kg-1转入空载体质粒的罗伊氏乳酸杆菌;第3组为抗生素组(AB),饲喂基础日粮+硫酸新霉素,抗生素的添加量为每日口服200 mg·kg-1的硫酸新霉素;第4组为对照组(CON),饲喂基础日粮+MRS液体培养基。饲喂21 d后,于每个组中随机挑选6头,使断乳仔猪口服感染猪霍乱沙门菌10 mL(4.72×109CFU·mL-1),连续口服3 d,设置观察期,连续观察7 d。记录试验分组为重组菌组(SC+LFCA),空菌组(SC+LR-CON),抗生素组(SC+AB),感染组(SC)与对照组(CON)。记录每组断乳仔猪的精神状况,采食量以及临床症状,发病情况。以评价表达牛乳铁蛋白肽的重组罗伊氏乳酸杆菌对断乳仔猪的生长性能以及抗感染性能的影响。
1.5 实验日粮与日常饲养管理饲养实验在东北农业大学阿城实验基地进行,仔猪饲喂基础日粮,基础日粮的组成以及营养成分参考文献[18]。饲喂21 d后,移至隔离屏障系统内饲养,观察各试验组断乳仔猪的精神状态,采食情况及发病情况。
1.6 测定指标与方法1.6.1 生长性能与腹泻率 通过向四组仔猪饲料分别添加重组菌pPG-LFCA-E/LR-CO21、空菌pPG/LR-CO21、硫酸新霉素、MRS。仔猪自由采食,自由饮水,饲喂21 d。期间记录每天体重,平均日增重、料重比、腹泻率来判定对仔猪生长性能的影响。
所耗标准饲料量与增重之比,称为耗料增重比,简称料重比。反映饲料的质量与饲喂效果。计算公式:料重比=饲养期内所耗标准饲料量(kg)÷同期增重(kg)
1.6.2 仔猪免疫器官指数 连续饲喂21 d后处死仔猪24头,取出仔猪免疫器官胸腺、脾称量质量,计算每组的免疫器官指数。
胸腺指数=胸腺质量(g)/仔猪的质量(kg)
脾指数=脾质量(g)/仔猪的质量(kg)
1.6.3 血清与肠黏液免疫指标 在对断乳仔猪口服21 d重组菌pPG-LFCA-E/LR-CO21后,进行连续3 d的猪霍乱沙门菌的感染,设置观察期7 d,对5组仔猪,每组6个重复,共30头仔猪进行样品采集。用无添加剂真空采血管采集仔猪血液,37 ℃孵育2 h,4 ℃孵育12 h,3 000 r·min-1离心10 min,收取上层血清,-40 ℃保存。刮取仔猪十二指肠、空肠、回肠肠黏液,-80 ℃保存。
检测仔猪血清中IgG,十二指肠、空肠、回肠中sIgA与炎症因子IL-4、IL-2、IL-12、IL-6含量。按照武汉酶免生物科技有限公司所生产的酶联免疫分析试剂盒说明书步骤进行,采用酶联免疫吸附测定法(ELISA)检测sIgA、IgG与炎症因子IL-4、IL-2、IL-12、IL-6水平。
1.6.4 仔猪肠道紧密连接蛋白基因转录水平 取猪霍乱沙门菌感染后5组仔猪十二指肠、空肠、回肠组织样品(样品来源同“1.6.3”),提取总RNA,经反转录后获得cDNA,经过Real-time PCR检测十二指肠、空肠、回肠紧密连接蛋白Claudin-1和ZO-1的基因转录水平以及TLR4、Myd88和MLCK的基因转录水平。
1.6.5 肠道组织病理切片 在仔猪感染猪霍乱沙门菌后第7天对仔猪安乐死。收集5组仔猪十二指肠中间、空肠中间和回肠远端的肠段(样品来源同“1.6.3”)及肺、肝、脾组织,HE染色的具体操作步骤参照参考文献[19]。
1.6.6 感染后仔猪肠道黏膜中猪霍乱沙门菌定植量 取实验室已构建好的Salmonella Choleraesuis标准质粒,以质粒拷贝数的对数为纵坐标,以Ct值为横坐标制作标准曲线。用DEPC水将标准质粒10倍递增稀释,各稀释度取2 μL用于荧光定量PCR检测。将测得的样品阈值(cycle threshold,Ct)利用标准曲线计算出质粒拷贝数,再转换成菌数,乘以稀释倍数即得肠黏液中的猪霍乱沙门菌菌数。
质粒拷贝数=[质粒质量(g)/质粒分子碱基数×324.5×2]×6.02×1023
1.7 动物试验伦理严格按照中国疾病预防控制中心《实验动物使用和护理指南》和中国卫生部《医学实验动物规则》(1998)的规定[20],经东北农业大学动物保护和使用委员会批准。
1.8 数据统计利用Excel对数据初处理,GraphPad Prism 8.0.2.263对数据处理及图像绘制, Two-way ANOVA对数据进行因素分析。统计学结果由Rversion 3.5.3分析获得。P < 0.05表示差异有显著性意义,P < 0.01表示差异极显著[21]。
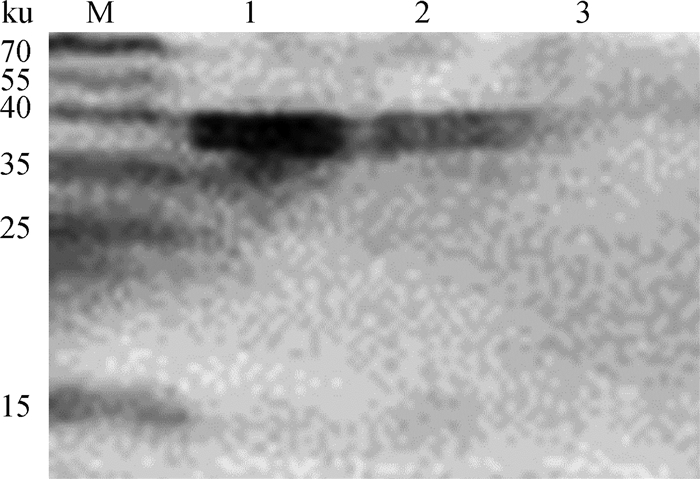
2 结果 2.1 目的蛋白的表达鉴定及定量分析重组菌pPG-LFCA-E/LR-CO21经37 ℃发酵培养16~18 h,制备蛋白样品,Western blot鉴定发现,约在38 ku处出现特异性反应条带,如图 1,说明融合蛋白LFCA-EGFP在重组菌中成功表达。
|
M.预染蛋白质相对分子质量标准;1.重组菌菌体沉淀;2.重组菌菌体上清;3.阴性对照 M.Prestained protein marker; 1.Recombinant cell precipitation; 2.Recombinant cell supernatant; 3.Negative control 图 1 重组菌表达蛋白的Western blot鉴定 Fig. 1 Identification of protein expressed in recombinant Lactobacillus reuteri by Western blot |
用ELISA方法制作牛乳铁蛋白肽的标准曲线,用于牛乳铁蛋白肽的定量。根据结果,绘制牛乳铁蛋白肽标准曲线。检测培养至不同时间点的重组菌对牛乳铁蛋白肽的表达量,根据牛乳铁蛋白肽标准曲线,检测发现重组菌培养18 h后牛乳铁蛋白肽的表达量最大,菌体的最大表达量为1.41 μg·mg-1,上清的最大表达量为0.81 μg·mL-1,结果如表 1所示。
|
|
表 1 重组菌表达乳铁蛋白肽的ELISA检测(x±s) Table 1 Identification of LFCA expressed in pPG-LFCA-E/LR-CO21 by ELISA (x±s) |
利用牛津杯法测定重组菌pPG-LFCA-E/LR-CO21的抑菌活性,对于金黄色葡萄球菌、猪霍乱沙门菌与大肠杆菌,重组菌pPG-LFCA-E/LR-CO21抑菌圈直径分别为1.250、0.860和0.960 cm,与空菌pPG/LR-CO21抑菌圈直径存在显著差异(P < 0.05),证明重组菌表达的牛乳铁蛋白肽对所检测的致病菌均有不同程度的抑制作用,具有抑菌活性。
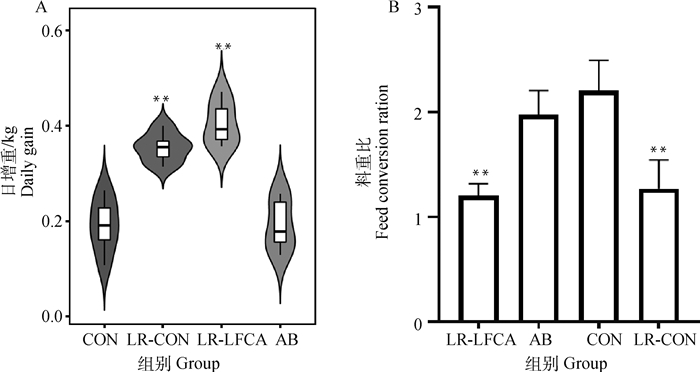
2.3 重组菌pPG-LFCA-E/LR-CO21对断乳仔猪生长性能的影响将断乳仔猪连续口服重组菌21 d,检测重组菌对仔猪生长性能的影响,结果如图 2A,结果表示,与CON组相比,LFCA组仔猪日增重极显著增高(P < 0.01)。如图 2B,与CON组相比,LFCA组仔猪料重比极显著降低(P < 0.01),AB组与CON组差异不明显(P>0.05)。由此可得,在断乳仔猪饲料中添加pPG-LFCA-E/LR-CO21,可对断乳仔猪的生长性能起到一定的促进作用。
|
*.P < 0.05 vs CON;**.P < 0.01 vs CON 图 2 重组罗伊氏乳杆菌对断乳仔猪生长的影响 Fig. 2 Effect of recombinant Lactobacillus reuteri on the growth of weaned piglets |
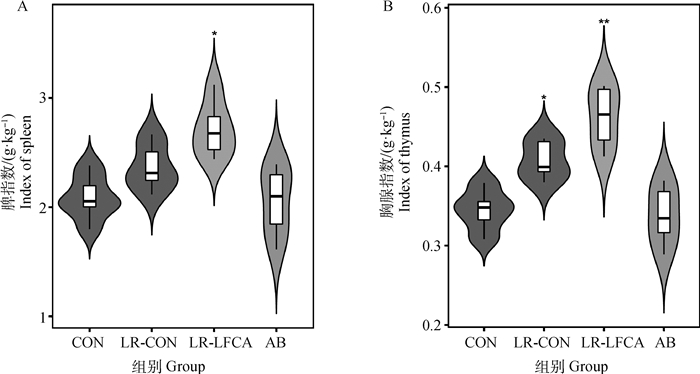
在对断乳仔猪连续口服21 d pPG-LFCA-E/LR-CO21后,每组随机抽取3头仔猪,剖检取其脾与胸腺,检测四组仔猪的免疫器官指数。由图 3A得知,LR-LFCA组脾指数相对于CON组显著增高(P < 0.05)。LR-CON组、AB组与CON组无显著差异。由图 3 B可得,LR-LFCA组胸腺指数相对于CON组极显著增高(P < 0.01),LR-CON组相对于CON显著组增高(P < 0.05),AB组与CON组相比无明显差异(P>0.05)。表明重组菌可以促进仔猪的生长及免疫器官的发育。
|
*.P < 0.05 vs CON;**.P < 0.01 vs CON 图 3 重组罗伊氏乳杆菌对断乳仔猪免疫器官指数的影响 Fig. 3 Effect of recombinant Lactobacillus reuteri on immune organ index of weaned piglets |
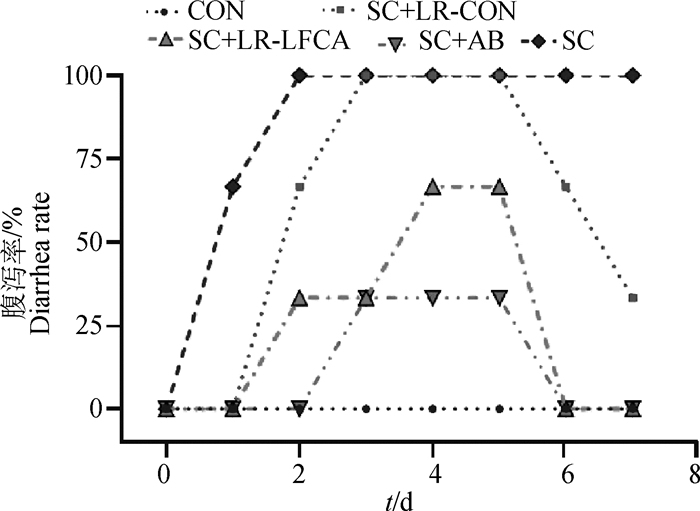
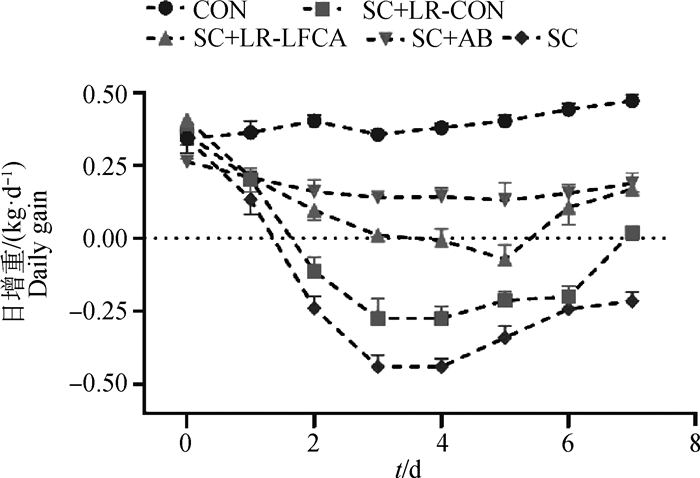
2.5.1 重组菌对感染后仔猪腹泻率的影响 在对断乳仔猪口服21 d重组菌pPG-LFCA-E/LR-CO21后,对仔猪进行连续3 d的猪霍乱沙门菌的感染,设置观察期,观察7 d,由图 4可知,在断乳仔猪均感染猪霍乱沙门菌后,试验组与对照组均出现不同程度的发病症状。SC组仔猪精神沉郁状态及腹泻情况最为严重,出现水样腹泻。SC+LR-CON组与SC+LR-LFCA组仔猪状况呈现不同程度的减轻,SC+LR-LFCA组仔猪在感染6 d时腹泻率为0,与SC组相比大幅度降低。由图 5可知,在断乳仔猪感染猪霍乱沙门菌后,SC+LR-LFCA,SC+LR-CON与SC组断乳仔猪日增重均呈现不同程度的降低。且SC+LR-LFCA组仔猪日增重降低幅度最小,达到接近抗生素组效果。
|
图 4 重组罗伊氏乳杆菌对感染猪霍乱沙门菌仔猪腹泻率变化的影响 Fig. 4 Effect of recombinant Lactobacillus reuteri on diarrhea rate of weaned piglets |
|
图 5 重组罗伊氏乳杆菌对感染猪霍乱沙门菌仔猪日增重变化的影响 Fig. 5 Effect of recombinant Lactobacillus reuteri on daily gain of weaned piglets |
以上结果表明,在饲料中添加pPG-LFCA-E/LR-CO21,可显著降低断乳仔猪的腹泻率,提高断乳仔猪的日增重。证实了pPG-LFCA-E/LR-CO21对断乳仔猪感染猪霍乱沙门菌的保护作用。
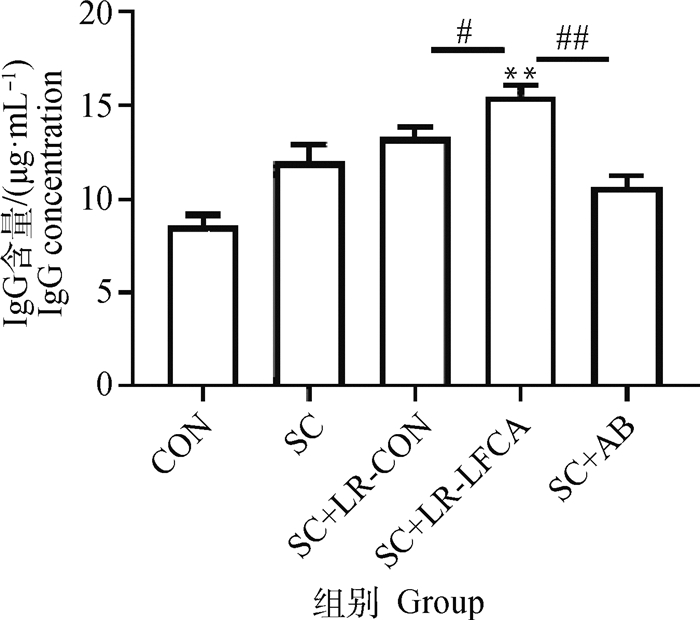
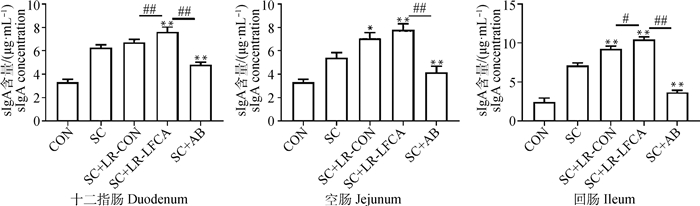
2.5.2 重组菌对感染后仔猪肠黏液sIgA以及血清中IgG的影响 在对断乳仔猪口服21 d重组菌pPG-LFCA-E/LR-CO21后,对仔猪进行连续3 d的猪霍乱沙门菌的感染,观察7 d后检测仔猪血清中IgG与十二指肠、空肠、回肠中sIgA含量。IgG抗体水平标准曲线为:y=11.526x-0.677 6;sIgA抗体水平标准曲线为:y=22.712x-1.291 7。如图 6可得,重组菌可以有效地提高免疫球蛋白的含量,其中SC+LR-LFCA组血清总IgG的抗体水平较SC组差异极显著(P < 0.01),和SC+AB组相比极显著提高IgG的抗体水平(P < 0.01)。由结果图 7可得,SC+LR-LFCA组十二指肠、空肠、回肠黏液中sIgA抗体水平较SC组差异极显著(P < 0.01),和SC+AB组相比极显著提高sIgA的抗体水平(P < 0.01)。这表明重组菌pPG-LFCA-E/LR-CO21能够显著提高断乳期仔猪的黏膜免疫能力。
|
**.P < 0.01 vs SC;#.P < 0.05 vs SC+LR-LFCA;##.P < 0.01 vs SC+LR-LFCA 图 6 仔猪感染Salmonella Choleraesuis后血清IgG含量 Fig. 6 Serum IgG levels in piglets infected with Salmonella Choleraesuis |
|
**.P < 0.01 vs SC;*.P < 0.05 vs SC;#.P < 0.05 vs SC+LR-LFCA;##.P < 0.01 vs SC+LR-LFCA 图 7 仔猪感染Salmonella Choleraesuis后肠黏液中sIgA含量 Fig. 7 sIgA content in intestinal mucus of piglets infected with Salmonella Choleraesuis |
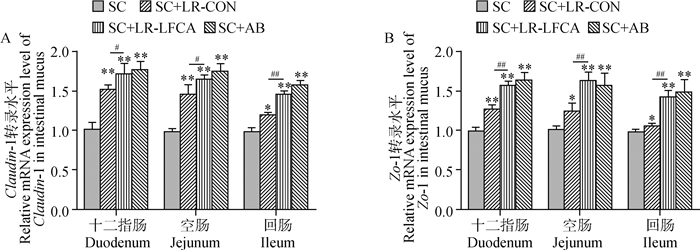
2.5.3 重组菌对感染后仔猪肠道紧密连接蛋白基因转录水平的影响 利用Real-time PCR检测十二指肠、空肠、回肠组织中紧密连接蛋白Claudin-1和ZO-1的基因转录水平,结果如图 8 A、B所示,发现仔猪感染SC后回肠紧密连接蛋白ZO-1和Claudin-1的基因转录水平降低。与SC组相比,SC+LR-CON组和SC+LR-LFCA组仔猪十二指肠、空肠、回肠紧密连接蛋白ZO-1和Claudin-1的基因转录水平显著增加(*P < 0.05;**P < 0.01),但是SC+LR-LFCA组优于SC+LR-CON组。且SC+LR-LFCA组与SC+AB组无明显差异(P>0.05)。
|
**.P < 0.01 vs SC;*.P < 0.05 vs SC; #.P < 0.05 vs SC+LR-LFCA;##.P < 0.01 vs SC+LR-LFCA 图 8 仔猪感染Salmonella Choleraesuis后肠黏液中紧密连接蛋白的基因转录水平 Fig. 8 Transcription levels of tight junction proteins in the intestinal mucus of piglets infected with Salmonella Choleraesuis |
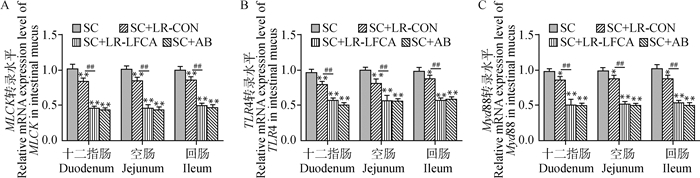
2.5.4 重组菌对感染后仔猪肠道TLR4、Myd88和MLCK基因转录水平的影响 肠上皮细胞与细胞之间的紧密连接蛋白的表达受到多种信号通路的调控,包括: Rho/Rho激酶通路、蛋白激酶C(protein kinase C,PKC)通路、MLCK(myosin Light chain kinase,MLCK)通路和MAPK(mitogen-activated protein kinase, MAPK)通路等。
经过Real-time PCR检测,与SC组相比,SC+LR-LFCA组显著降低了致病菌导致的仔猪肠道TLR4基因的转录水平升高,进而降低了Myd88基因转录水平,最终降低了MLCK基因转录水平(P < 0.05,P < 0.01)。且SC+LR-LFCA组效果与SC+AB组相近,表明pPG-LFCA-E/LR-CO21可作为一种断乳仔猪的替代抗生素的有前途的饲料添加剂。SC+LR-CON组也可以降低致病菌导致的TLR4、Myd88和MLCK基因转录水平的升高,但是没有达到SC+LR-LFCA组水平,结果如图 9A、B、C图。表明重组菌pPG-LFCA-E/LR-CO21组有效调控MLCK信号通路,断乳期仔猪口服pPG-LFCA-E/LR-CO21显著缓解了致病菌感染导致的这一现象。
|
**.P < 0.01 vs SC;*.P < 0.05 vs SC; #.P < 0.05 vs SC+LR-LFCA;##.P < 0.01vs SC+LR-LFCA 图 9 仔猪感染Salmonella Choleraesuis后肠黏液中TLR4、Myd88和MLCK的基因转录水平 Fig. 9 TLR4, Myd88 and MLCK gene transcription levels in the intestinal mucus of piglets infected with Salmonella Choleraesuis |
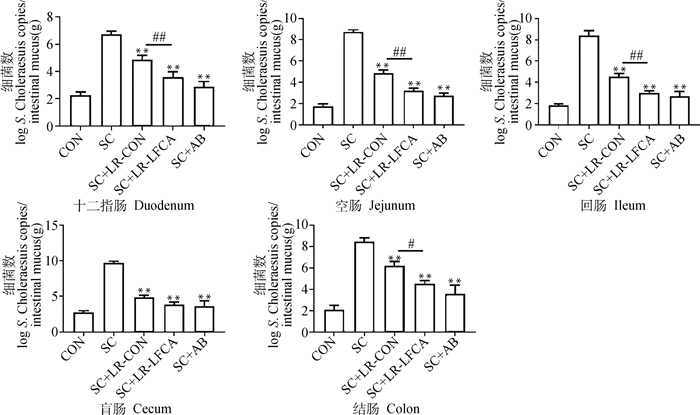
2.5.5 重组菌对感染后仔猪肠道黏膜中猪霍乱沙门菌定植量的影响 取实验室已构建好的S.Choleraesuis标准质粒,以质粒拷贝数的对数为纵坐标,以Ct值为横坐标制作标准曲线,Real-time PCR方法检测结果如图 10。SC+LR-LFCA组与SC+LR-CON组肠黏液中猪霍乱沙门菌数量极显著低于SC组(P < 0.01),SC+LR-LFCA与SC+LR-CON组相比前者效果更明显,在十二指肠、空肠,回肠中SC+LR-LFCA组极显著低于SC+LR-CON组(P < 0.01),结肠中SC+LR-LFCA组显著低于SC+LR-CON组(P < 0.05)。盲肠中SC+LR-LFCA组与SC+LR-CON组无明显差异,但SC+LR-LFCA组肠黏液中猪霍乱沙门菌数量低于SC+LR-CON组。且在十二指肠、空肠、回肠、结肠、盲肠中,SC+LR-LFCA组猪霍乱沙门菌定植量与SC+AB组相近且差异不明显(P>0.05)。
|
**.P < 0.01 vs SC;*.P < 0.05 vs SC; #.P < 0.05 vs SC+LR-LFCA;##.P < 0.01vs SC+LR-LFCA 图 10 肠黏液中Salmonella Choleraesuis数 Fig. 10 The number of Salmonella Choleraesuis in intestinal mucus |
2.5.6 重组菌对感染后仔猪肠道炎症因子表达量的影响 按照剂量加入试剂盒中提供标准品,读取OD450 nm的数值,根据数值绘制炎症因子IL-4、IL-2、IL-12、IL-6含量与OD450 nm的阳性标准曲线,制得标准曲线回归方程:y=41.377x-2.049 5(IL-4);y=133.09x-17.711(IL-2);y=150.3x-22.778(IL-12);y=449.88x-201.6(IL-6)。
与SC组相比,SC+LR-LFCA组十二指肠中仔猪肠黏液中IL-4含量差异不显著(P>0.05),但有上升的趋势,空肠与回肠中仔猪肠黏液中IL-4含量极显著提高(P < 0.01)。且空肠与回肠中SC+LR-LFCA组与SC+AB组无明显差异。
与SC组相比,SC+LR-LFCA组空肠中仔猪肠黏液中IL-2含量极显著降低(P < 0.01),回肠与十二指肠中仔猪肠黏液中IL-2含量无明显差异(P>0.05)。但在空肠中,SC+LR-LFCA组与SC+AB组IL-2含量差异不明显且含量较相近。
与SC组相比,SC+LR-LFCA组十二指肠、回肠中仔猪肠黏液中IL-12含量极显著降低(P < 0.01),空肠中仔猪肠黏液中IL-12含量显著降低(P < 0.05)。且SC+LR-LFCA组与SC+AB组IL-12含量差异不明显且含量较相近(P>0.05)。
与SC组相比,SC+LR-LFCA组十二指肠、空肠、回肠中仔猪肠黏液中IL-6含量极显著降低(P < 0.01),且十二指肠中SC+LR-LFCA组与SC+AB组IL-12含量差异不明显且含量较相近(P>0.05)。
这些结果表明断乳期仔猪口服pPG-LFCA-E/LR-CO21可以提高仔猪肠黏液中抑炎因子的含量,降低仔猪肠黏液中促炎因子的含量,提高仔猪的抗炎能力。
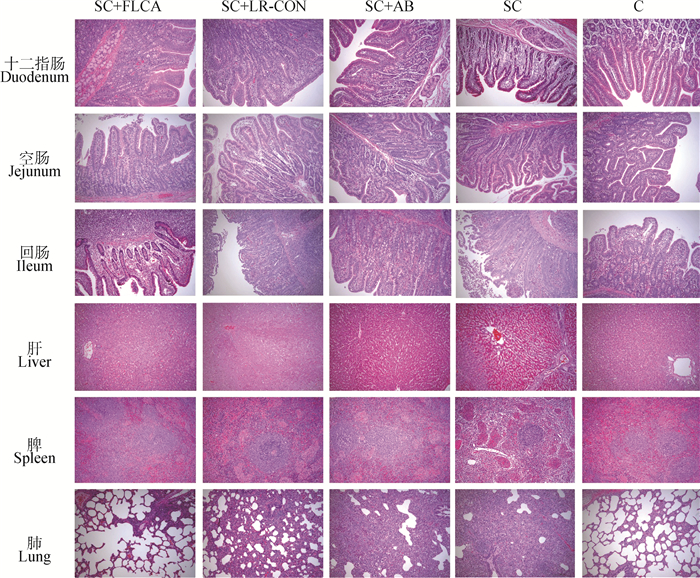
2.5.7 重组菌对感染后仔猪肠黏膜组织病理学影响 在观察期结束后处死仔猪,剖检取出主要病变组织,肺、肝、脾和十二指肠、空肠、回肠。4%多聚甲醛固定做石蜡切片及HE染色以观察各组主要组织器官的病理组织学变化情况见图 11。由图 11可知,SC+LFCA组与SC+AB组少量炎性细胞及嗜酸性粒细胞浸润,SC+LR-CON组及SC组固有层较多炎性细胞浸润,黏膜上皮细胞部分变性坏死。
|
图 11 仔猪感染Salmonella Choleraesuis后的组织病理切片(100×) Fig. 11 Histopathological section of piglets infected with Salmonella Choleraesuis (100×) |
SC组、SC+LR-CON组、SC+AB组肺均出现不同程度的炎性细胞浸润与肺泡上皮细胞增生的情况,SC+LFCA组增生及浸润情况均较轻。SC组脾淋巴细胞轻度减少,SC+LR-CON组、SC+AB组未见病变。肝组织出现不同程度的肝细胞变性萎缩的情况,且SC组可见窦状隙可见少量嗜中性粒细胞浸润,肝细胞大面积变性萎缩,SC+AB组与SC+LFCA组部分肝细胞轻度变性。
感染后仔猪空肠皱缩,回肠肠绒毛严重破损,重组菌组肠绒毛的破损情况较轻,保持了肠绒毛的完整性。空菌组一定程度上也缓解了SC对肠绒毛造成的损伤,但没有重组菌效果显著。表明重组菌可有效改善肠黏膜绒毛表面的破损情况。
3 讨论我国是养猪生产大国,生猪养殖规模占全球的50%左右[22]。据统计,仔猪断乳前后因腹泻死亡量占总死亡量的49.11%,饲用促生长抗生素在养殖业作为药物饲料添加剂使用在过去数十年间曾成为动物健康的保障,并发现给动物饲喂低剂量的抗生素可以刺激生长。但抗生素滥用可能带来耐药菌、致畸、致癌等严重后果[23]。根据农业农村部194号文件,自2021年1月1日,饲料中全面禁止添加促生长类药物饲料添加剂(中药类除外)的商品饲料[24],以维护食品安全及公共卫生。在动物生产中,少用、限用或禁用抗生素已成必然趋势,饲用抗生素替代品的生产与使用迫在眉睫。近年来研究发现,饲料中添加抗菌肽可以缓解断乳仔猪腹泻,提高断乳仔猪生长性能[25]。牛乳铁蛋白肽作为抗菌肽的一种,对乳酸杆菌的生长具有一定程度的促进作用[26-27]。乳酸菌除本身具有的益生特性外,还可以作为外源基因的递呈载体,具有可以直接饲喂不需要纯化的优点[28-31]。罗伊氏乳酸杆菌作为动物体内广泛分布的正常菌群,具有良好的益生功能和较强的黏附能力[17, 32]。
本实验室利用前期构建的将EGFP与牛乳铁蛋白肽LFcin和Lfampin进行融合表达的表达质粒pPG612-LFCA-EGFP,并将其电转入从仔猪肠道内分离得到的具有较好的抗逆性和较强黏附性的罗伊氏乳酸杆菌LR-CO21中,获得了表达EGFP连牛乳铁蛋白肽(LFCA-EGFP)融合蛋白的重组菌pPG-LFCA-E/LR-CO21。本研究利用构建好的重组菌对断乳仔猪口服该重组菌,通过分析仔猪日增重、料重比及免疫器官指数来评价重组菌对新生仔猪生长性能的影响。结果表明重组菌组的仔猪日增重、胸腺指数极显著高于正常对照组(P < 0.01),料重比极显著降低(P < 0.01),脾指数显著提高(P < 0.05),且与抗生素组无明显差异(P>0.05)。表明口服重组菌促进仔猪生长发育。赵东方[33]的试验也表明本实验室分离到的罗伊氏菌株具有促进仔猪发育的特性。
同时,体外抑菌试验结果显示,重组菌对S. Choleraesuis CVCC10141、E. coli CVCC10141与S. aureus CVCC546的生长都有一定的抑制作用,这与于淑媛等[34]所叙述的牛乳铁蛋白肽在宿主菌中表达了抑菌活性相一致。乳铁蛋白肽虽然具有广谱的抑菌作用,但由于其抑菌机制与铁离子有关,因此对铁离子需求低的乳酸杆菌基本不抑制。在给断乳仔猪口服重组菌后感染猪霍乱沙门菌,发现给断乳仔猪口服重组菌显著缓解了感染猪霍乱沙门菌引起的仔猪体重的降低,而且显著降低的仔猪的腹泻率,与抗生素组差异不显著。断乳仔猪口服空菌虽然可以降低仔猪腹泻率,但是与感染组相比,并未达到显著水平。Yi等[35]的研究也证实给仔猪饲喂抗菌肽Cathelicidin-WA可以降低仔猪感染致病菌后的腹泻率。
免疫球蛋白是哺乳动物发生免疫应答所产生的效应因子[36],通过促进单核巨噬细胞的吞噬作用,中和细菌内毒素以及中和病毒抗原,在抗感染中发挥主要作用,能够反映机体特异性免疫水平。细菌感染引起的炎症反应往往与细胞膜表面模式识别受体(PRR)TLRs有关,细菌或者LPS可以通过激活TLRs,进而激活NF-κB信号通路,引起下游的多种促炎因子表达。近些年研究发现,抗菌肽可能通过TLRs调控免疫反应,多种抗菌肽(Lfcin B、LL-37、LFP-20和pBD2等)可以通过阻断细菌或者LPS激活TLR,抑制下游炎症反应[37]。高彦华[38]的研究表明,猪抗菌肽PR-39可以提高仔猪免疫球蛋白IgA和IgG水平。赵雪芹[39]的研究发现,抗菌肽可有效抵御小鼠感染沙门菌,降低沙门菌感染介导的炎性因子IL-2、IL-6、TNF-α的释放,具有良好的抗炎效果。本研究通过检测仔猪血清中IgG含量和肠黏膜中sIgA含量发现,与空菌组以及抗生素组相比,给断乳仔猪口服pPG-LFCA-E/LR-CO21显著增加了仔猪血清中IgG水平和肠黏液中sIgA、IL-4水平,并显著降低了炎症因子IL-2、IL-12、IL-6的量。说明重组菌可以通过调节炎性因子的分泌调节机体炎症,激活机体免疫系统,增强机体黏膜免疫的免疫能力。
肠道形态和结构的完整性与肠道健康密切相关。有研究表明猪霍乱沙门菌感染会引起仔猪肠绒毛萎缩甚至造成肠黏膜坏死。Tang等[40]研究表明在仔猪饲料中添加由巴斯德毕赤酵母(KM71)XS10表达乳铁蛋白肽(由中国科学院亚热带农业研究所生产)可以增加仔猪肠绒毛高度,提高饲料转化率。本研究发现断乳仔猪感染猪霍乱沙门菌后,仔猪空肠、回肠绒毛皱缩并且表面破损严重,而在口服重组菌后使仔猪感染猪霍乱沙门菌,仔猪的回肠绒毛脱落、缩短和表面破损情况显著缓解,说明给断乳仔猪口服重组菌能有效改善仔猪断乳后感染猪霍乱沙门菌造成的肠道损伤,从而有利于促进仔猪的生长。
综上表明,断乳仔猪口服重组菌pPG-LFCA-E/LR-CO21提高仔猪抗猪霍乱沙门菌感染的能力,维护了断乳仔猪的肠道微生态健康,同时增强仔猪免疫功能,这表明分泌牛乳铁蛋白肽的猪源罗伊氏乳酸杆菌pPG-LFCA-E/LR-CO21作为微生态制剂替代饲用抗生素具有一定的应用前景。
4 结论饲料中添加表达牛乳铁蛋白肽的重组猪源罗伊氏乳酸杆菌pPG-LFCA-E/LR-CO21可提高断奶仔猪平均日增重,降低料重比及腹泻率,提高免疫器官指数及机体的免疫应答能力,对断奶仔猪的生长具有一定的促进作用;还可抵抗猪霍乱沙门菌的感染,对肠道黏膜具有保护作用,增强断奶仔猪的抵抗力。
| [1] |
岂晓鑫. 1950-2009年动物源沙门菌的分型、耐药性及致病性研究[D]. 扬州: 扬州大学, 2018. QI X X. Typing, drug resistance and pathogenicity of Salmonella isolates from animal during 1950-2009 in China[D]. Yangzhou: Yangzhou University, 2018. (in Chinese) |
| [2] |
王克. 猪沙门氏菌病的临床症状与防治[J]. 养殖与饲料, 2020(4): 71-72. WANG K. Clinical symptoms and prevention of swine salmonellosis animals[J]. Animals Breeding and Feed, 2020(4): 71-72. DOI:10.3969/j.issn.1671-427X.2020.04.026 (in Chinese) |
| [3] |
OSCAR T. Salmonella prevalence alone is not a good indicator of poultry food safety[J]. Risk Anal, 2021, 41(1): 110-130. DOI:10.1111/risa.13563 |
| [4] |
张锦, 李庆贺, 郑麦青, 等. 沙门菌感染雏鸡调节性T细胞变化的分析[J]. 畜牧兽医学报, 2019, 50(11): 2302-2308. ZHANG J, LI Q H, ZHENG M Q, et al. Analysis of regulatory T cells changes in chicks infected with Salmonella[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(11): 2302-2308. DOI:10.11843/j.issn.0366-6964.2019.11.014 (in Chinese) |
| [5] |
LONGO A, LOSASSO C, VITULANO F, et al. Insight into an outbreak of Salmonella choleraesuis var. Kunzendorf in wild boars[J]. Vet Microbiol, 2019, 238: 108423. DOI:10.1016/j.vetmic.2019.108423 |
| [6] |
MOLINO M G, PÉREZ D R, BLANCO P G, et al. Outbreaks of antimicrobial resistant Salmonella Choleraesuis in wild boars piglets from central-western Spain[J]. Transbound Emerg Dis, 2019, 66(1): 225-233. DOI:10.1111/tbed.13003 |
| [7] |
宋德平. 新现和再现猪主要肠道腹泻病毒及腹泻猪肠道微生物群落宏基因组学研究[D]. 南昌: 江西农业大学, 2016. SONG D P. Studies on Important emerging and re-emerging porcine diarrheal viruses and metagenomics of gut microflora of diarrheal pigs[D]. Nanchang: Jiangxi Agricultural University, 2016. (in Chinese) |
| [8] |
GIRARD M, BEE G. Invited review: tannins as a potential alternative to antibiotics to prevent coliform diarrhea in weaned pigs[J]. Animal, 2020, 14(1): 95-107. DOI:10.1017/S1751731119002143 |
| [9] |
BAQUERO F, NEGRI M C. Strategies to minimize the development of antibiotic resistance[J]. J Chemother, 1997, 9(S3): 29-37. |
| [10] |
MENG L X, XU G L, LI J S, et al. Bovine lactoferricin P13 triggers ROS-mediated caspase-dependent apoptosis in SMMC7721 cells[J]. Oncol Lett, 2017, 13(1): 511-517. DOI:10.3892/ol.2016.5415 |
| [11] |
TU M L, XU S Q, XU Z, et al. Identification of dual-function bovine lactoferrin peptides released using simulated gastrointestinal digestion[J]. Food Biosci, 2021, 39: 100806. DOI:10.1016/j.fbio.2020.100806 |
| [12] |
BIASIBETTI E, RAPACIOLI S, BRUNI N, et al. Lactoferrin-derived peptides antimicrobial activity: an in vitro experiment[J]. Nat Prod Res, 2020, 1-5. |
| [13] |
ELNAGDY S, ALKHAZINDAR M. The potential of antimicrobial peptides as an antiviral therapy against COVID-19[J]. ACS Pharmacol Transl Sci, 2020, 3(4): 780-782. DOI:10.1021/acsptsci.0c00059 |
| [14] |
WANG Y, BEKHIT A E D A, MASON S L, et al. Lactoferrin isolation and hydrolysis from red deer (Cervus elaphus) milk and the antibacterial activity of deer lactoferrin and its hydrolysates[J]. Foods, 2020, 9(11): 1711. DOI:10.3390/foods9111711 |
| [15] |
WEINBERG E D. Antibiotic properties and applications of lactoferrin[J]. Curr Pharm Des, 2007, 13(8): 801-811. DOI:10.2174/138161207780363095 |
| [16] |
MILLER F P, VANDOME A F, MCBREWSTER J. Lactobacillus reuteri[M]//Lactobacillus Reuteri. Alphascript Publishing, 2010.
|
| [17] |
HAN S K, KIM J K, JOO M K, et al. Lactobacillus reuteri NK33 and Bifidobacterium adolescentis NK98 alleviate Escherichia coli-induced depression and gut dysbiosis in mice[J]. J Microbiol Biotechnol, 2020, 30(8): 1222-1226. DOI:10.4014/jmb.2002.02058 |
| [18] |
KIM H B, ISAACSON R E. The pig gut microbial diversity: understanding the pig gut microbial ecology through the next generation high throughput sequencing[J]. Vet Microbiol, 2015, 177(3-4): 242-251. DOI:10.1016/j.vetmic.2015.03.014 |
| [19] |
GAO K, WANG C, LIU L, et al. Immunomodulation and signaling mechanism of Lactobacillus rhamnosus GG and its components on porcine intestinal epithelial cells stimulated by lipopolysaccharide[J]. J Microbiol Immunol Infect, 2017, 50(5): 700-713. DOI:10.1016/j.jmii.2015.05.002 |
| [20] |
段海涛. 高效调质低温制粒畜禽饲料加工工艺及其对生长育肥猪生长性能的影响研究[D]. 北京: 中国农业科学院, 2018. DUAN H T. Study on the high-efficiency condition and low-temperature pelleted processing technology and effects on growth performance of growing and fattening pigs[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese) |
| [21] |
MCORIST S, KHAMPEE K, GUO A. Modern pig farming in the People's Republic of China: growth and veterinary challenges[J]. Rev Sci Tech, 2011, 30(3): 961-968. DOI:10.20506/rst.30.3.2091 |
| [22] |
YANG Q L, HUANG X Y, WANG P F, et al. Longitudinal development of the gut microbiota in healthy and diarrheic piglets induced by age-related dietary changes[J]. MicrobiologyOpen, 2019, 8(12): e923. |
| [23] |
JAYARAMAN B, NYACHOTI C M. Husbandry practices and gut health outcomes in weaned piglets: a review[J]. Anim Nutr, 2017, 3(3): 205-211. DOI:10.1016/j.aninu.2017.06.002 |
| [24] |
VANGROENWEGHE F, POULSEN K, THAS O. Supplementation of a β-mannanase enzyme reduces post-weaning diarrhea and antibiotic use in piglets on an alternative diet with additional soybean meal[J]. Porc Health Manag, 2021, 7(1): 8. DOI:10.1186/s40813-021-00191-5 |
| [25] |
印遇龙, 杨哲. 天然植物替代饲用促生长抗生素的研究与展望[J]. 饲料工业, 2020, 41(24): 1-7. YIN Y L, YANG Z. Research and prospect of natural plant substitute for antibiotic growth promoters in feed[J]. Feed Industry, 2020, 41(24): 1-7. (in Chinese) |
| [26] |
CHEN H S, VELAYUDHAN D E, LI A, et al. Growth performance, gastrointestinal microbial activity, and immunological response of piglets receiving microencapsulated Enterococcus faecalis CG1. 0007 and enzyme complex after an oral challenge with Escherichia coli (K88)[J]. Canadian J Anim Sci, 2016, 96(4): 609-618. DOI:10.1139/cjas-2015-0051 |
| [27] |
CHAHARDOOLI M, NIAZI A, ARAM F, et al. Expression of recombinant Arabian camel lactoferricin-related peptide in Pichia pastoris and its antimicrobial identification[J]. J Sci Food Agric, 2016, 96(2): 569-575. DOI:10.1002/jsfa.7125 |
| [28] |
陈雷, 原现军, 郭刚, 等. 添加乳酸菌制剂和丙酸对全株玉米全混合日粮青贮发酵品质和有氧稳定性的影响[J]. 畜牧兽医学报, 2015, 46(1): 104-110. CHEN L, YUAN X J, GUO G, et al. The effects of lactic acid bacteria and propionic acid on the fermentation quality and aerobic stability of total mixed ration silages prepared with whole-crop corn in Tibet[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(1): 104-110. (in Chinese) |
| [29] |
CANO-GARRIDO O, SERAS-FRANZOSO J, GARCIA-FRUITÓS E, et al. Lactic acid bacteria: reviewing the potential of a promising delivery live vector for biomedical purposes[J]. Microb Cell Fact, 2015, 14(1): 137. DOI:10.1186/s12934-015-0313-6 |
| [30] |
KAUR T, BALGIR P P, KAUR B. Correction to: construction of a shuttle expression vector for lactic acid bacteria[J]. J Genet Eng Biotechnol, 2020, 18(1): 38. DOI:10.1186/s43141-020-00056-4 |
| [31] |
KAUR T, BALGIR P P, KAUR B. Construction of a shuttle expression vector for lactic acid bacteria[J]. J Genet Eng Biotechnol, 2019, 17(1): 10. DOI:10.1186/s43141-019-0013-4 |
| [32] |
王书博, 徐义刚, 陈秋艳, 等. 表达猪圆环病毒2型cap蛋白的重组罗伊氏乳酸杆菌在小鼠诱导的免疫应答分析[J]. 畜牧兽医学报, 2020, 51(9): 2238-2249. WANG S B, XU Y G, CHEN Q Y, et al. Analysis of immune response induced by recombinant Lactobacillus reuteri expressing cap protein of porcine circovirus type 2 in mice[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(9): 2238-2249. (in Chinese) |
| [33] |
赵东方. 罗伊氏乳酸杆菌的分离鉴定及其抵抗仔猪感染F4+ETEC效果的分析[D]. 哈尔滨: 东北农业大学, 2019. ZHAO D F. Isolation and identification of Lactobacillus reuteri and its effection on F4+ETEC infection piglets[D]. Harbin: Northeast Agricultural University, 2019. (in Chinese) |
| [34] |
于淑媛, 冀禹彤, 陈秋艳, 等. 乳酸乳球菌表达重组牛乳铁蛋白肽的抑菌活性分析[J]. 微生物学报, 2021, 61(2): 428-443. YU S Y, JI Y T, CHEN Q Y, et al. Antibacterial activity of the recombinant bovine lactoferrin peptide expressed by Lactococcus lactis[J]. Acta Microbiologica Sinica, 2021, 61(2): 428-443. (in Chinese) |
| [35] |
YI H B, HU W Y, CHEN S, et al. Cathelicidin-WA improves intestinal epithelial barrier function and enhances host defense against enterohemorrhagic Escherichia coli O157:H7 Infection[J]. J Immunol, 2017, 198(4): 1696-1705. DOI:10.4049/jimmunol.1601221 |
| [36] |
Gunter Sandra Argyll Biotechnologies LLC. Composition and method for immunomodulation in mammals: US, 6719984B1[P] 2004-04-13.
|
| [37] |
KIM J S, ELLMAN M B, YAN D Y, et al. Lactoferricin mediates anti-inflammatory and anti-catabolic effects via inhibition of IL-1 and LPS activity in the intervertebral disc[J]. J Cell Physiol, 2013, 228(9): 1884-1896. DOI:10.1002/jcp.24350 |
| [38] |
高彦华. 猪抗菌肽PR-39的表达特性和调控及免疫调节机制研究[D]. 杭州: 浙江大学, 2014. GAO Y H. The expression characteristics, regulation and the immunomodulatory mechanism of porcine antimicrobial peptide PR-39[D]. Hangzhou: Zhejiang University, 2014. (in Chinese) |
| [39] |
赵雪芹. 抗菌肽类似物JH-3抵御沙门氏菌感染的作用机制研究[D]. 新乡: 河南科技学院, 2018. ZHAO X Q. Mechanism of antimicrobial peptide analogue JH-3 against Salmonella[D]. Xinxiang: Henan Institute of Science and Technology, 2018. (in Chinese) |
| [40] |
TANG X S, TANG Z R, WANG S P, et al. Expression, purification, and antibacterial activity of bovine lactoferrampin-lactoferricin in Pichia pastoris[J]. Appl Biochem Biotechnol, 2010, 73(2): 132-139. |
(编辑 白永平)



