2. 农业部动物生物技术重点实验室, 杨凌 712100;
3. 陕西省动物胚胎工程技术研究中心, 杨凌 712100
2. Key Laboratory of Animal Biotechnology of the Ministry of Agriculture, Yangling 712100, China;
3. Shaanxi Animal Embryo Engineering Technology Research Center, Yangling 712100, China
性别控制对畜牧业生产有着重大意义,畜牧生产中很多重要的经济性状都与性别有关,如肉、蛋、乳、毛、茸等都需要特定性别的动物进行生产[1-2]。奶山羊以产奶为主,通过X、Y精子分离以后配种可提高母羊所占比例,加快母羊群体的扩繁,提高奶山羊饲养经济效益,在生产中具有重要意义[2]。X、Y精子分离是性别控制技术最常用的手段,而对于精子分离,无论是新方法的建立,还是原有方法的优化都离不开性控精液纯度的评价[3-4]。
国内外科研人员对X、Y精子之间的差异进行了研究,包括X、Y精子质量大小不同、所带电荷不同、所含DNA含量差异以及所包含受体种类不同,利用这些差异来分离不同染色体的精子[5-9]。目前,公开报道的精液分离方法有沉降法、密度梯度离心法、电泳法、流式细胞分离法、H-Y抗原抗体结合法等[3, 10-11],但是除了确认X、Y精子的DNA含量具有差异之外,其他方面的差异尚难以进行准确的量化区分,导致对分离的精液纯度存在争议[12-13]。分析分离精液中X、Y精子纯度的常用方法有实时荧光定量PCR法和分选型流式细胞仪重分析法[3, 14-17]。Parati等[14]以及侯胜奎等[15]以牛X和Y染色体特异基因PLP与SRY为靶基因,分别建立了可以计算精液中X和Y精子数量和纯度的实时荧光定量PCR探针法,以及可以评估性控精液纯度的实时荧光定量PCR染料法。流式细胞仪重分析法是当前公认的最佳评价精液分离纯度的方法[16-17],奶山羊X精子DNA含量比Y精子DNA含量多4.2%,理论上可以用流式细胞术进行分选及纯度分析[3],但是目前关于奶山羊精液的X、Y精子分选体系还不完善,没有一套成熟的分选参数系统可供参考,鉴于设备昂贵且需要专业人员操作,只有少数单位配置,无法满足一般科研院所的试验需求[2]。因此迫切需要建立可以准确、迅速、简便地对分离的性控精液纯度进行检测的技术方法,以满足性控精液新方法的研究和技术创新。
本研究的目的是建立一种可以计算奶山羊性控精液X和Y精子数量和比例的real-time PCR定量方法,有助于评价不同X和Y精子分离方法的效果,开发简化的、成本较低的、有利于生产应用的技术方法。
1 材料与方法 1.1 主要材料、试剂及仪器奶山羊商品化性控精液购自内蒙古赛科星生物技术有限公司,由本试验室保存;DNA Marker、DH5ɑ感受态细胞、质粒提取试剂盒、PMD19-T克隆载体等购自TaKaRa公司;AxyPrep DNA凝胶回收试剂盒购自Axygen公司。紫外分光光度计Cary50Probe (Vatian,美国);凝胶成像系统Doc2000(Bio-Rad,美国);高速冷冻离心机(Eppendorf,德国);实时荧光定量仪(Thermal Cycler CFX96 Real-Time System,美国)。
1.2 引物设计对GenBank中奶山羊X、Y染色体序列进行生物信息学分析,利用DNAMAN引物设计软件设计引物,针对X染色体选择特异基因F9设计检测引物,探针5′端用HEX发光基团,3′端用TAMRA淬灭基团;针对Y染色体选择特异基因ZFY设计检测引物,探针5′端用FAM发光基团,3′端用BHQ淬灭基团,引物序列见表 1,由生工生物工程有限公司合成。
|
|
表 1 real-time PCR检测方法的引物信息 Table 1 Primers information for real-time PCR assay |
将购买的商品化性控精液从冻存管中取出,加入10倍体积的生理盐水进行稀释混匀,4 000×g离心10 min弃上清,利用TIANGEN有限公司的快速DNA提取检测试剂盒(KG203)提取精液DNA,保存于-20 ℃。
1.4 F9、ZFY基因阳性标准品制备以X、Y精子基因组DNA为模板,分别用设计的检测引物进行PCR扩增,PCR产物经3%琼脂糖凝胶电泳鉴定,将与目的片段大小相近的条带进行胶回收,克隆转化并送生工生物工程有限公司测序。测序正确的阳性质粒分别作为F9、ZFY基因的阳性标准品,利用核酸蛋白检测仪测定其浓度,利用公式:(6.02 × 1023 copies·mol-1) × (阳性标准品核酸浓度,g·mL-1) / (阳性标准品平均分子量MW,g·mol-1) = copies·mL-1,换算成拷贝数。
1.5 荧光定量PCR反应体系及条件的优化qPCR反应体系为20 μL:F9、ZFY基因的阳性标准品各1 μL,对应的上、下游引物各0.5 μL,探针各0.5 μL,预混酶10 μL,ddH2O 5 μL。qPCR反应参数设置:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环扩增。用方阵法对引物、探针浓度、退火温度(58~62 ℃)及循环次数等反应条件进行优化。
1.6 荧光定量PCR方法标准曲线的建立将已知拷贝数的F9、ZFY基因的阳性标准品分别进行10倍连续梯度稀释,进行荧光定量PCR,同时设置阴性对照,以起始模板浓度的对数为横坐标,以循环中的Ct值为纵坐标,建立标准曲线。
1.7 荧光定量PCR方法特异性评价对已知纯度的商品化X、Y性控精液进行双重TaqMan荧光定量PCR检测,同时设置阴性对照,验证该方法的特异性。
1.8 荧光定量PCR方法敏感性评价以10倍连续梯度稀释的F9、ZFY基因的阳性标准品(1×101~1×1010)作为模板,同时设置阴性对照,进行双重TaqMan荧光定量PCR扩增,每个浓度做3个重复,确定检测方法的敏感性。
1.9 荧光定量PCR方法稳定性评价对不同稀释度(1×102、1×104、1×106)的F9、ZFY基因的阳性标准品混合物(相同稀释度混合)进行双重TaqMan荧光定量PCR检测,3次重复,用以评价方法的组内重复性;将上述不同稀释度的阳性标准品混合物在3 d后进行双重TaqMan荧光定量PCR检测,3次重复,用以评价方法的组间重复性。
1.10 荧光定量PCR方法准确性评价利用本试验建立的双重TaqMan荧光定量PCR方法对60支已知纯度的商品化性控精液进行分析(X、Y精液各30管),3次重复试验,计算X、Y精子数量以及比例,与所注明纯度进行显著性检验(利用SPSS统计分析软件),评估方法的准确性。
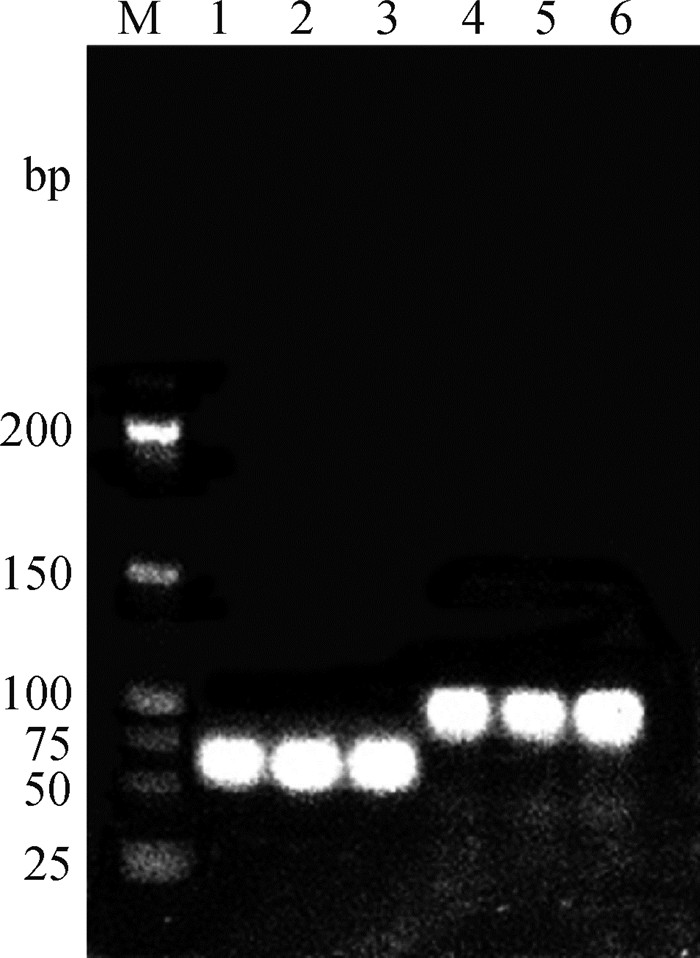
2 结果 2.1 荧光定量PCR引物的特异性用设计的两对引物分别以奶山羊精液DNA为模板进行PCR扩增(图 1),凝胶电泳出现单一条带且大小与预期结果相符,产物回收后连接转化测序,证明扩增的ZFY和F9基因片段长度分别为66和100 bp,与GenBank中ZFY和F9基因片段的相似性为100%,为Y染色体ZFY基因和X染色体F9基因的特异序列。
|
M. DNA相对分子质量标准;1~3. ZFY基因扩增条带66 bp;4~6. F9基因扩增条带100 bp M. DNA Marker 500; 1-3. ZFY gene amplified band 66 bp; 4-6. F9 gene amplified band 100 bp 图 1 引物扩增片段电泳鉴定 Fig. 1 Gel electrophoresis identification of amplified fragments by specific primers |
将表 1中的上、下游引物和探针采用矩阵法优化后,再优化Tm值,筛选最佳的双重TaqMan荧光定量PCR反应体系及条件。优化的20 μL反应体系:F9、ZFY基因的阳性标准品各1 μL,相应的上下游引物各0.5 μL,探针各0.4 μL,预混酶10 μL,ddH2O补足20 μL。反应条件:95 ℃ 30 s;95 ℃ 10 s,58 ℃ 30 s,40个循环扩增。
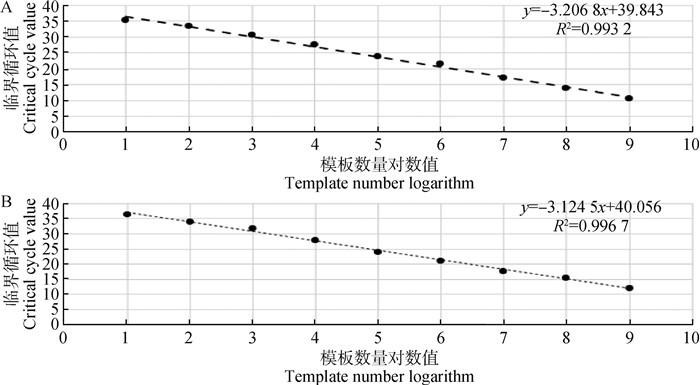
2.3 荧光定量PCR方法标准曲线的建立紫外分光光度计测得F9、ZFY基因的阳性标准品浓度分别为140和150 ng·μL-1,换算成拷贝数分别为4.7×1010和5.1×1010copies·μL-1。参照上述优化的反应条件进行扩增,检测F9基因阳性标准品浓度在4.7×101~4.7×109copies·μL-1之间,呈现良好的线性关系(图 2A),标准曲线为y= -3.206 8x+39.843,决定系数R2值为0.993 2,扩增效率为105%;检测ZFY基因阳性标准品浓度在5.1×101~5.1×109copies·μL-1之间,呈现良好的线性关系(图 2B),标准曲线为y=-3.124 5x+ 40.056,决定系数R2值为0.996 7,扩增效率为108%。说明检测X和Y精子的方法线性关系良好、扩增效率高。
|
A. F9基因标准曲线;B.ZFY基因标准曲线 A. The standard curve of F9 gene; B. The standard curve of ZFY gene 图 2 real-time PCR方法的标准曲线 Fig. 2 The standard curve of real-time PCR method |
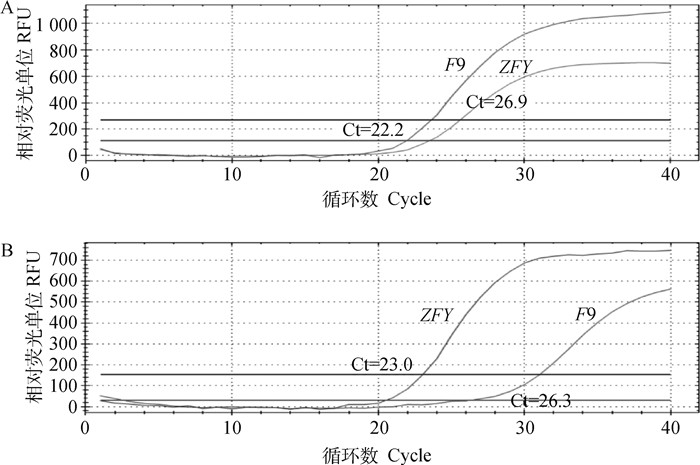
用所建立的双重TaqMan荧光定量PCR方法对已知纯度的商品化X(纯度为95.0%)和Y精液(纯度为92.0%)进行DNA检测。结果显示,在X精液DNA检测中出现两条扩增曲线,利用标准曲线计算F9和ZFY基因的拷贝数,F9与ZFY基因所占比例分别为94.8%和5.2%(图 3A),F9基因所占比例与X精子纯度极接近;在Y精液DNA检测中出现两条扩增曲线,利用标准曲线计算F9和ZFY基因的拷贝数,F9与ZFY基因所占比例分别为5.1%和94.9%(图 3B),ZFY基因所占比例与Y精子纯度极接近,由此可以看出,两对引物只特异性扩增了F9和ZFY基因,证明该方法具有良好的特异性。
|
A.检测X精子的特异性;B.检测Y精子的特异性 A. The specificity of detection of X sperm; B. The specificity of detection of Y sperm 图 3 real-time PCR方法的特异性 Fig. 3 The specificity of real-time PCR method |
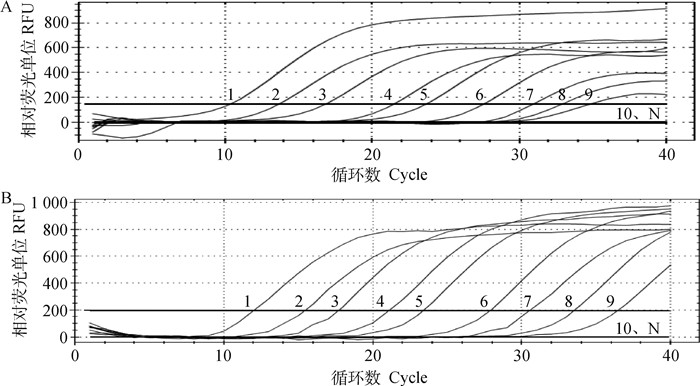
将F9、ZFY基因的阳性标准品经10倍梯度稀释,每个稀释度取1 μL混匀作为模板,进行荧光定量PCR扩增。根据建立的标准曲线计算,F9和ZFY基因的最小检出量分别为47和51 copies·μL-1 (图 4A、4B),证明该方法敏感性高。
|
A.检测F9基因的敏感性:1~10. 4.7×109~4.7×100copies·μL-1;B.检测ZFY基因的敏感性:1~10. 5.1×109~5.1×100 copies·μL-1;N.阴性对照 A. The sensitivity of F9 gene: 1-10. 4.7×109-4.7×100copies·μL-1; B. The sensitivity of ZFY gene: 1-10. 5.1×109-5.1×100copies·μL-1; N. Negative control 图 4 real-time PCR方法的敏感性 Fig. 4 The sensitivity of real-time PCR method |
所建立的双重TaqMan荧光定量PCR方法的批内变异系数CV为0.48%~1.94%,批间变异系数为0.52%~2.34%(表 2),表明该方法具有良好的稳定性。
|
|
表 2 重复性试验 Table 2 Crossing test of the experimental results |
利用本试验所建立的双重TaqMan荧光定量PCR方法对商品化的X和Y精液纯度进行分析,每个样本重复3次,将试验测得精液纯度与购买的商品化性控精液标签注明纯度利用SPSS软件进行差异显著性分析,所得P值均大于0.05,表明无显著差异(表 3),证明本试验建立的检测方法结果可靠。
|
|
表 3 准确性试验 Table 3 Significance test of the accuracy results |
目前,在自然状态下的奶山羊养殖中,雄性羔羊的价值远小于雌性羔羊[2, 18]。按照常规的生产方式,繁殖得到后代雌、雄比例各占50%,过多公羊的养殖会增加生产成本,降低饲养奶山羊的经济效益[19-20]。近年来,我国奶山羊养殖业得到快速发展,陕西省将奶山羊产业列为千亿元农业工程产业,繁殖母羊和产奶母羊的需求量大增,奶山羊数量不足,阻碍了该产业的发展[7, 21-23],快速增加奶山羊母羊的数量和比例,对于奶山羊产业的迅速发展具有重要意义。
为达到人为控制繁殖母畜后代的性别比例的目的,研究者们开发了较多分离X、Y精子的技术方法,如沉降法、密度梯度离心法、电泳法、流式细胞分离法、H-Y抗原抗体结合法等[3, 10-11],但是在生产中除了流式细胞分离技术外均未被广泛应用。目前,除了确认X、Y精子的DNA含量具有差异之外,其他方面的差异难以进行准确的量化区分,致使对分离的X、Y精子纯度存在争议[12-13]。目前,精子分离纯度的鉴定方法主要有实时荧光定量PCR方法和分选型流式细胞仪重分析法[3, 14-17]。Parati等[14]利用牛X和Y染色体特异基因PLP与SRY,通过条件优化成功建立了可以计算精液中X和Y精子数量和纯度的实时荧光定量PCR探针法;侯胜奎等[15]选择牛X、Y染色体特异基因PLP与SRY,通过标准曲线的建立以及不同质粒浓度的样本对方法进行验证,成功建立了可用于评估性控精液纯度的实时荧光定量PCR染料法。流式细胞仪通过对已经分选完成的精子进行第二次分选,用来计算其分离纯度的方法称为重分析法,是当前公认的最佳评价精液分离纯度的方法[13],动物X和Y精子DNA含量差异超过3%就可以进行纯度分析[3],奶山羊X精子DNA含量比Y精子DNA含量多4.2%,理论上可以用流式细胞术分选,但是目前关于奶山羊精液的X、Y精子分选体系还不完善,没有成熟的分选参数系统可供参考,仅有的研究报道,奶山羊精液分选速度为4 500个·s-1,无法满足每次输精剂量在千万级的输精要求,且精子活力经过染色及分选后均有下降趋势[2],鉴于设备昂贵且需要专业人员操作,只有少数单位配置,无法满足一般科研院所的试验需求。另外,当精液量少的情况下,采用流式细胞技术方法分离X、Y精子很难实现,同时对精子的损伤较大。开发一种新的成本低、对精子损伤小、简易的Y、Y精子分离方法具有重要的生产应用价值。因此建立一种方便且准确的实验室检测X和Y精子分离纯度的方法,为开发新的性控技术以及为生产应用提供了技术支撑。
本试验对奶山羊X和Y染色体上F9和ZFY基因进行生物信息学分析,选择X染色体上特异基因F9和Y染色体上特异基因ZFY的编码区设计了两对引物[24-25],分别扩增单一条带,经连接转化后测序为X染色体F9基因和Y染色体ZFY基因的特异序列,说明设计的引物特异性好;由于使用的是双重荧光定量PCR方法,因此需要采用矩阵法对上、下游引物和探针进行优化,通过对Tm值和循环数的优化;通过阳性标准品10倍稀释建立标准曲线,证明该方法线性关系良好、扩增效率高[26-28]。因为目前商品化的性控精液纯度不能达到100%,验证本试验所建立方法的特异性选择了商品化的已知纯度的性控X精子和Y精子进行定量分析,测得X精子、Y精子纯度与商品化性控精液注明纯度极接近[14-15, 29-30],表明本试验所建立的方法特异性良好;梯度稀释阳性标准品后进行扩增,测得该方法对F9和ZFY基因的最小检出量分别为47和51 copies·μL-1,平行试验测得批内变异系数CV<2%,批间变异系数CV<3%,表明该方法灵敏度高且稳定性好;对已知纯度的性控精液进行纯度检测,3次重复试验计算结果与已知纯度无显著性差异(P>0.05),说明该方法准确性高,结果可靠。由此可见,本试验成功建立了一种可以定量计算奶山羊精液中X、Y精子性别比的real-time PCR方法,有助于新的X、Y精子分离方法的开发,优化精子分离技术,降低奶山羊性别控制的生产成本和准确性,便于生产应用和普及,提高奶山羊的饲养效益,促进奶山羊产业的快速发展[31]。
4 结论本研究成功建立了基于TaqMan Probe的计算奶山羊精液中X、Y精子数量的real-time PCR方法,特异性和重复性好,灵敏度高,结果可靠,为检测分离的奶山羊精液X和Y精子纯度提供了可靠的方法,为新性控精液方法的开发提供了有力的技术支撑。
| [1] | CHOWDHURY M M R, XU L G, KONG R, et al. In vitro production of sex preselected cattle embryos using a monoclonal antibody raised against bull sperm epitopes[J]. Anim Reprod Sci, 2019, 205: 156–164. DOI: 10.1016/j.anireprosci.2018.11.006 |
| [2] |
幸宏超.奶山羊性控冷冻精液人工授精及胚胎移植效果的研究[D].杨凌: 西北农林科技大学, 2018.
XING H C.Study on artificial insemination using sex controlled frozen semen and embryo transfer in dairy goats[D].Yangling: Northwest A&F University, 2018.(in Chinese) |
| [3] |
侯胜奎, 陶晨雨, 胡慧艳, 等. 动物性控精液的分离及纯度评价方法的研究进展[J]. 中国畜牧杂志, 2019, 55(4): 12–16, 24.
HOU S K, TAO C Y, HU H Y, et al. Advances in separation and purity evaluation methods of sex-controlled of animal semen[J]. Chinese Journal of Animal Science, 2019, 55(4): 12–16, 24. (in Chinese) |
| [4] |
曾有权, 陆阳清, 杨小淦, 等. 使用流式细胞仪分离精子进行仔猪性别控制的研究[J]. 畜牧兽医学报, 2012, 43(7): 1163–1169.
ZENG Y Q, LU Y Q, YANG X G, et al. Sex-preselected piglets derived from sexed sperm by flow cytometry sorting[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(7): 1163–1169. (in Chinese) |
| [5] | SONG W H, MOHAMED E A, PANG W K, et al. Effect of endocrine disruptors on the ratio of X and Y chromosome-bearing live spermatozoa[J]. Reprod Toxicol, 2018, 82: 10–17. DOI: 10.1016/j.reprotox.2018.09.002 |
| [6] |
郑永富.奶牛X-Y精子特异性表达蛋白的筛选[D].阿拉尔: 塔里木大学, 2017.
ZHENG Y F.Screening differentially expressed proteins of X and Y sperms of dairy Cows[D].Alaer: Tarim University, 2017.(in Chinese) |
| [7] | MAICAS C, HUTCHINSON I A, CROMIE A R, et al. Characteristics of offspring derived from conventional and X-sorted bovine sperm[J]. J Dairy Sci, 2020, 103(8): 7509–7520. DOI: 10.3168/jds.2020-18178 |
| [8] | UMEHARA T, TSUJITA N, ZHU Z D, et al. A simple sperm-sexing method that activates TLR7/8 on X sperm for the efficient production of sexed mouse or cattle embryos[J]. Nat Protoc, 2020, 15(8): 2645–2667. DOI: 10.1038/s41596-020-0348-y |
| [9] | RAHMAN S, PANG M G. New biological insights on X and Y chromosome-bearing spermatozoa[J]. Front Cell Dev Biol, 2020, 7: 388. DOI: 10.3389/fcell.2019.00388 |
| [10] |
郭家明, 朱化彬, 王栋, 等. X、Y精子分离纯度评价方法的研究进展[J]. 遗传, 2008, 30(9): 1115–1120.
GUO J M, ZHU H B, WANG D, et al. Progress on methods for purity assessment of separated chromosome X- or Y-bearing sperm[J]. Hereditas (Beijing), 2008, 30(9): 1115–1120. DOI: 10.3321/j.issn:0253-9772.2008.09.004 (in Chinese) |
| [11] | LIU R J, LOW W Y, TEARLE R, et al. New insights into mammalian sex chromosome structure and evolution using high-quality sequences from bovine X and Y chromosomes[J]. BMC Genomics, 2019, 20(1): 1000. DOI: 10.1186/s12864-019-6364-z |
| [12] | CARVALHO J O, SILVA L P, SARTORI R, et al. Nanoscale differences in the shape and size of X and Y chromosome-bearing bovine sperm heads assessed by atomic force microscopy[J]. PLoS One, 2013, 8(3): e59387. DOI: 10.1371/journal.pone.0059387 |
| [13] |
宫昌海, 王惠娥, 高庆华, 等. 牛、梅花鹿和山羊X、Y精子头部面积差异分析[J]. 中国草食动物, 2011, 31(3): 9–11.
GONG C H, WANG H E, GAO Q H, et al. Analysis on the differences between X-and Y-sperm head area in bull, stag and goat[J]. China Herbivores, 2011, 31(3): 9–11. DOI: 10.3969/j.issn.2095-3887.2011.03.002 (in Chinese) |
| [14] | PARATI K, BONGIONI G, ALEANDRI R, et al. Sex ratio determination in bovine semen:a new approach by quantitative real time PCR[J]. Theriogenology, 2006, 66(9): 2202–2209. DOI: 10.1016/j.theriogenology.2006.07.007 |
| [15] |
侯胜奎, 陶晨雨, 胡慧艳, 等. 牛性控精液纯度快速评价方法研究[J]. 中国畜牧杂志, 2019, 55(8): 62–66.
HOU S K, TAO C Y, HU H Y, et al. Study on rapid evaluation method of bovine sex control semen purity[J]. Chinese Journal of Animal Science, 2019, 55(8): 62–66. (in Chinese) |
| [16] | GARNER D L, EVANS K M, SEIDEL G E.Sex-sorting sperm using flow cytometry/cell sorting[M]//CARRELL D T, ASTON K I.Spermatogenesis.Totowa: Humana Press, 2013: 279-295. |
| [17] |
李堃, 刘悦, 黄鹏, 等. 小鼠精原细胞分选方法改良的研究[J]. 中华男科学杂志, 2019, 25(11): 963–970.
LI K, LIU Y, HUANG P, et al. A modified method for spermatogonial cell sorting[J]. National Journal of Andrology, 2019, 25(11): 963–970. (in Chinese) |
| [18] | QIN Y, YANG S, XU J, et al. Deep insemination with sex-sorted Cashmere goat sperm processed in the presence of antioxidants[J]. Reprod Domest Anim, 2018, 53(1): 11–19. DOI: 10.1111/rda.13045 |
| [19] | BATHGATE R, MACE N, HEASMAN K, et al. Birth of kids after artificial insemination with sex-sorted, frozen-thawed goat spermatozoa[J]. Reprod Domest Anim, 2013, 48(6): 893–898. DOI: 10.1111/rda.12182 |
| [20] |
张自由, 吕小琳, 高继伟, 等. 奶山羊繁殖调控技术研究进展[J]. 中国奶牛, 2019(12): 38–41.
ZHANG Z Y, LV X L, GAO J W, et al. Advances in research on breeding control technology of dairy goats[J]. China Dairy Cattle, 2019(12): 38–41. (in Chinese) |
| [21] |
张芳, 张莉, 尚明玉, 等. 我国奶山羊产业发展现状与措施建议[J]. 中国乳业, 2020(5): 22–24.
ZHANG F, ZHANG L, SHANG M Y, et al. Current situation and measures of dairy goat industry in China[J]. China Dairy, 2020(5): 22–24. (in Chinese) |
| [22] | PERTEGHELLA S, VIGANI B, CRIVELLI B, et al. Sperm encapsulation from 1985 to date:technology evolution and new challenges in swine reproduction[J]. Reprod Domest Anim, 2015, 50(S2): 98–102. |
| [23] | LONERGAN P. Review:historical and futuristic developments in bovine semen technology[J]. Animal, 2018, 12(S1): S4–S18. |
| [24] | DONG Y, XIE M, JIANG Y, et al. Sequencing and automated whole-genome optical mapping of the genome of a domestic goat (Capra hircus)[J]. Nat Biotechnol, 2013, 31(2): 135–141. DOI: 10.1038/nbt.2478 |
| [25] | SOLEYMANI B, PARVANEH S, MOSTAFAIE A. Goat polyclonal antibody against the sex determining region Y to separate X- and Y-chromosome bearing spermatozoa[J]. Rep Biochem Mol Biol, 2019, 8(3): 326–334. |
| [26] |
史梦宇, 刘心仪, 朱慧欣, 等. 塞内卡病毒A和脑心肌炎病毒双重TaqMan荧光定量PCR检测方法的建立与应用[J]. 中国兽医科学, 2020, 50(7): 825–832.
SHI M Y, LIU X Y, ZHU H X, et al. Establishment and application of dual TaqMan fluorescent quantitative PCR assay for Senecavirus A and encephalomyocarditis virus[J]. Chinese Veterinary Science, 2020, 50(7): 825–832. (in Chinese) |
| [27] | LIU L, ZHANG Y, CUI P F, et al. Development of a duplex TaqMan real-time RT-PCR assay for simultaneous detection of newly emerged H5 N6 influenza viruses[J]. Virol J, 2019, 16(1): 119. DOI: 10.1186/s12985-019-1229-2 |
| [28] | ASSIS A S F, FUMIAN T M, MIAGOSTOVICH M P, et al. Adenovirus and rotavirus recovery from a treated effluent through an optimized skimmed-milk flocculation method[J]. Environ Sci Pollut Res Int, 2018, 25(17): 17025–17032. |
| [29] | NANIWA Y, SAKAMOTO Y, TODA S, et al. Bovine sperm sex-selection technology in Japan[J]. Reprod Med Biol, 2018, 18(1): 17–26. |
| [30] | MROWIEC J, TWARDOŃ J, BARTOSZEWICZ A, et al. Influence of bovine follicular fluid on thawed bovine spermatozoa - assessment by CASA system and flow cytometry[J]. Pol J Vet Sci, 2019, 22(2): 305–312. |
| [31] | SILVA E C B, PELINCA M A, ACOSTA A C, et al. Comparative study of DNA extraction methodologies from goat sperm and its effects on polymerase chain reaction analysis[J]. Genet Mol Res, 2014, 13(3): 6070–6078. |



