泰万菌素又称乙酰异戊酰泰乐菌素,是第3代大环内酯类广谱抗生素,对支原体、螺旋体、大部分革兰阳性菌和部分革兰阴性菌均有较强的抗菌活性[1-2],由泰乐菌素经3-乙酰基-4异戊酰基修饰而来,是泰乐菌素的衍生物,其抗菌和抗支原体活力均高于泰乐菌素[3-5]。泰万菌素由英国伊科动物保健品公司开发并研制,常见以酒石酸盐形式存在,即酒石酸泰万菌素,主要用于治疗家禽支原体感染和猪传染性支原体肺炎、喘气病等[6-8],是畜禽专用抗生素,且安全性高,无不良反应[9-11]。2012年7月,经由FDA批准泰万菌素用于预防由胞内劳森菌引起的猪增生性肠炎,其在中国畜牧业中的应用主要集中于酒石酸泰万菌素可溶性粉和酒石酸泰万菌素预混剂[12-13]。经国家兽药基础信息查询系统显示,目前,我国获得酒石酸泰万菌素及其制剂批准文号的生产企业共有57家,市场需求量大。
酒石酸泰万菌素质量标准收载于《兽药质量标准》2017年版化学药品卷[14]中,其中,含量测定项采用抗生素微生物检定法测定泰万菌素效价,需使用泰万菌素标准品。据了解,目前,各国药典均未收载该品种,均无泰万菌素国家标准品供应,调研发现,在企业内部质量控制过程中,多使用自制工作标准品。兽用化学药品国家标准物质是保证检验工作准确、高效、公正的标尺[15-16],因此,为了更好地对该品种进行质量控制,提高和保证兽药质量水平,本研究根据《中华人民共和国兽药典》2015年版[17]和《兽药质量标准》2017年版化学药品卷[14]的要求,以酒石酸泰万菌素为原料,研制了首批泰万菌素兽用国家标准品,对于酒石酸泰万菌素及其制剂的生产与质量控制具有重要意义。
1 材料与方法 1.1 仪器、试验材料与试剂北京普析TU 1901紫外分光光度计;意大利HANNA Instruments HI 9017酸度计;德国MMM Vacucell 55真空干燥箱;上海博迅SPX-250B-Z生化培养箱;北京先驱威锋ZY-300 IV抑菌圈测定仪;Waters 2695高效液相色谱仪(Empower 3色谱工作站);Waters 2998二极管阵列检测器;瑞士Mettller Toledo XS 205电子分析天平。
原始发明厂泰万菌素标准品(效价值:959.7 U·mg-1,批号:Q3254,英国伊科动物保健品公司);酒石酸泰万菌素精制原料(武汉回盛生物科技股份有限公司,批号:1711009);藤黄微球菌[CMCC(B)28001]购自中国食品药品检定研究院;抗生素Ⅱ号培养基、pH 8.0磷酸缓冲液均购自北京中海生物科技有限公司。乙腈为色谱纯,醋酸、醋酸铵均为分析纯。
1.2 方法根据《兽药质量标准》2017年版化学药品卷[14]中酒石酸泰万菌素质量标准及《中华人民共和国兽药典》2015年版一部[17]附录有关要求进行理化分析、均匀性评价及效价测定。
1.2.1 紫外鉴别 取本批标准品原料及原始发明厂标准品适量,加水制成25 μg·mL-1的供试品溶液,采用紫外-可见分光光度法进行测定,采集200~400 nm紫外光谱扫描曲线,检测其最大吸收波长。
1.2.2 酸度测定 取本批标准品原料0.5 g,加新沸并放冷的纯化水20 mL使溶解,用草酸盐标准缓冲液和苯二甲酸盐标准缓冲液校正仪器后测定pH。
1.2.3 干燥失重 取本批标准品原料,以五氧化二磷为干燥剂,在60 ℃减压干燥至恒重,测定减失重量。
1.2.4 泰万菌素A组分测定 酒石酸泰万菌素主要成分为泰万菌素A,采用高效液相色谱法对该项进行测定,并对该方法进行方法学验证。
1.2.4.1 色谱条件与系统适用性 用十八烷基硅烷键合硅胶为填充剂;以乙腈-0.15 mol·L-1醋酸铵溶液-醋酸(45:45:10)为流动相;流速为1.5 mL·min-1;检测波长为280 nm。理论板数按泰万菌素A峰计算不低于2 000。
1.2.4.2 测定法 取本品适量,精密称定,加流动相使溶解并稀释制成每1 mL中约含0.5 mg的溶液,精密量取10 μL,注入高效液相色谱仪,记录色谱图,按峰面积归一化法计算,含泰万菌素A应不低于80%。
1.2.4.3 方法验证 从以下方面进行验证。
a.专属性:依据上述方法,采集溶剂空白与酒石酸泰万菌素溶液色谱图,考察溶剂空白对泰万菌素A组分测定有无干扰。
b.检测限:将0.5 mg·mL-1的溶液用流动相进一步稀释为0.5 μg·mL-1的检测限溶液,采集色谱图,测定信噪比。
c.线性与范围:取本品适量,精密称定,配制成1 mg·mL-1的贮备液,用该贮备液经一系列精密稀释,分别制成500、100、40、10、5、2.5、1 μg·mL-1的溶液,采集色谱图,以峰面积与浓度作图,用最小二乘法进行线性回归。
d.溶液稳定性:将溶液于室温放置24 h,期间不同时间进样采集色谱图,考察峰面积变化情况。
e.耐用性:分别对柱温、流速、色谱柱等条件进行微调,考察其对测定结果的影响。
1.2.5 均匀性评价 采用“1.2.4”项下的色谱条件及测定法对本批原料进行均匀性测试,并采用单因子方差分析法进行统计检验。取样品10份,每份取样2次进行测定,样品间自由度为9,样品内自由度为10,在约定自由度水平α=0.05的显著水平下,计算临界值F0.05(9,10),计算结果与查表得到的F临界值3.02比较,若计算值小于3.02,则表明在α=0.05的显著水平下,样品是均匀的。
1.2.6 效价测定 英国伊科动物保健品公司为泰万菌素的原始发明厂,以该公司标准品为基准,采用抗生素微生物检定法中三剂量管碟法为本批标准品进行协作标定赋值,并对该方法进行方法学验证。
1.2.6.1 测定法 精密称取本品适量,加70%甲醇使溶解并定量稀释制成1 000 U·mL-1的溶液,再用灭菌磷酸盐缓冲液(pH 8.0)定量稀释制成浓度为2.5~10.0 U·mL-1的溶液。试验菌为藤黄微球菌,培养基为抗生素Ⅱ号培养基,pH 7.8~8.0。
1.2.6.2 方法验证 从以下方面进行验证。
a.专属性:根据上述方法配制空白溶液和标准品溶液,采用原液1%的菌悬液浓度测定,观察抑菌圈大小。
b.线性和范围:照抗生素微生物检定一剂量法测定,取标准品适量,精密称定,用70%甲醇溶解并稀释为1 000 U·mL-1的溶液,用灭菌磷酸盐缓冲液(pH8.0)将上述溶液稀释为2.05、2.56、3.20、4.00、5.00、6.25、7.81、9.77、12.21 U·mL-1的溶液,配制24个菌碟,分为8组,每组3个菌碟,每个菌碟6个钢管,其中,标准品的3个位置滴加4.00 U·mL-1的中间浓度溶液,供试品的3个位置每组分别滴加剩余8个浓度的溶液,测定抑菌圈直径,将抗生素浓度的对数值和每组直径平均值与4.00 U·mL-1的直径平均值之差进行线性回归,相关系数r应不小于0.99。
c.精密度:两名检验员,各平行配制5份100%浓度水平的溶液,采用上述方法进行效价测定。
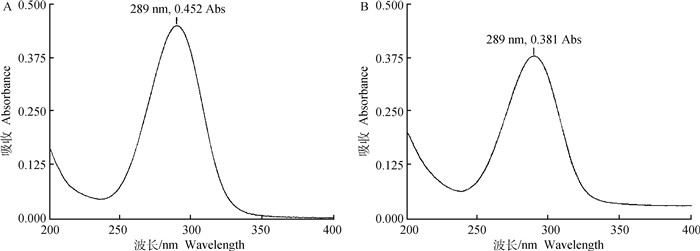
2 结果 2.1 紫外鉴别、酸度、干燥失重酒石酸泰万菌素原料紫外光谱图与原始发明厂泰万菌素标准品的紫外光谱图一致,二者均在289 nm的波长处有最大吸收(图 1)。原料0.5 g加新沸并放冷的纯化水20 mL溶解后,测得pH为3.5。分装后的原料在60 ℃减压干燥至恒重,测得减失重量为2.0%。《兽药质量标准》2017年版化学药品卷中酒石酸泰万菌素原料质量标准规定,本品应在289 nm的波长处有最大吸收,pH应为3.0~ 5.0,减压干燥至恒重后减失重量应不超过4.0%。试验结果表明,本批酒石酸泰万菌素原料理化分析结果均符合规定。
|
A.酒石酸泰万菌素原料;B.原始发明厂泰万菌素标准品 A. Tylvalosin tartrate raw material; B. Tylvalosin standard of the original invention factory 图 1 酒石酸泰万菌素紫外光谱图 Fig. 1 UV spectrum of tylvalosin tartrate |
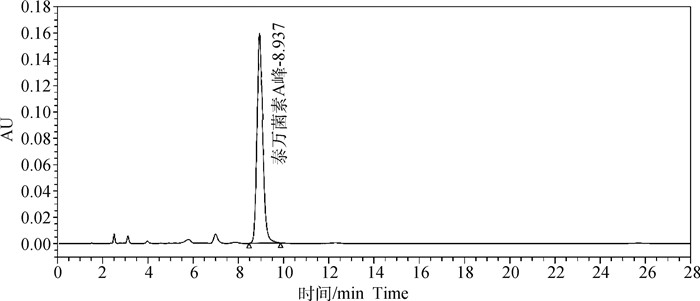
本批原料泰万菌素A组分测定结果为92%。
方法专属性:溶剂空白与酒石酸泰万菌素溶液色谱图见图 2~3,由图 2、3可知,溶剂空白对泰万菌素A组分测定无干扰,方法专属性良好。
|
图 2 溶剂空白液相色谱图 Fig. 2 Liquid chromatogram of solvent blank |
|
图 3 酒石酸泰万菌素原料液相色谱图 Fig. 3 Liquid chromatogram of tylvalosin tartrate raw material |
检测限:0.5 μg·mL-1的检测限溶液进样10 μL,信噪比为3.1,表明该方法泰万菌素A的检测限为0.5 μg·mL-1。
线性与范围:泰万菌素A峰面积与浓度线性方程:y=5 723.2x-3 185,r=1,该结果表明,其在1~1 000 μg·mL-1浓度与峰面积具有良好的线性关系。
溶液稳定性:泰万菌素A峰24 h内峰面积RSD为0.3%,小于2.0%,表明该溶液室温放置24 h稳定性良好(表 1)。
|
|
表 1 溶液稳定性结果 Table 1 Results of solution stability |
耐用性:对柱温、流速、色谱柱等条件进行微调,理论板数按泰万菌素A峰计算均不低于2 000,泰万菌素A峰与相邻杂质峰的分离度均大于1.5,表明该方法耐用性良好(表 2)。
|
|
表 2 方法耐用性结果 Table 2 Results of method durability |
均匀性:原料均匀性单因素方差分析结果统计量F为1.68,小于3.02,表明本批原料均匀性良好,符合国家标准品研制的要求。
2.3 泰万菌素效价测定方法验证及标定赋值方法专属性:空白溶液无抑菌圈,标准品中浓度溶液抑菌圈直径在15~18 mm,抑菌圈边缘清晰圆整。
线性与范围:线性回归方程为y=0.199 x+0.643,r=0.998 5,表明在2~12 U·mL-1泰万菌素浓度的对数与抑菌圈直径线性关系良好。
精密度:两名检验员分别测定5次,RSD均不超过2.0%,中间精密度结果良好(表 3)。
|
|
表 3 精密度结果 Table 3 Results of precision |
本批标准品由3家实验室协作标定赋值,每个实验室测定10次,共测得30次结果,最后将30次测定的结果进行3剂量合并计算,结果为试验结果均一,效价值821.65 U·mg-1,修约为822 U·mg-1(表 4)。
|
|
表 4 协作标定赋值结果 Table 4 Results of collaborative calibration assignment |
抗生素生物标准品是用于抗生素药品效价测定的标准物质,抗生素生物标准品原料的纯度相对较低,其中,除主要组分外还有其他具有生物活性的小组分存在[18],研制时应选用具有稳定固态结构的物质为原料[19]。由于泰万菌素主要以酒石酸盐形式存在,且目前我国获得批准文号的产品均为酒石酸泰万菌素及制剂,国内难以获得纯度较高的泰万菌素碱原料,因此选择稳定性好的酒石酸泰万菌素作为本批标准品的原料。国家兽药标准物质研制基本技术要求中规定,用于制备国家兽药标准物质的原料必须为符合相关质量标准规定的优质品或精制品,因此本批标准品原料由酒石酸泰万菌素粗品经精制而成,提高了其主要成分占比。
抗生素标准品的标定过程中,考虑最多的是标准品的连续性问题,通常采用协作标定的方法来保证标定结果具有连续性[20]。杨淑先等[21]利用国际标准品,采用微生物效价测定的三剂量法,协作标定了首批国家吉他霉素标准品。崔春英等[22]利用原始基准标准品,采用抗生素微生物检定法中三剂量法,进行了克拉霉素国家标准品的换批协作标定。酒石酸泰万菌素为兽医专用药,由于其为发酵产品,含有多种组分,因此本研究亦采用协作标定方式对标准品进行定值。
药品标准物质的稳定性是标准物质重要的基本性质之一,用来描述标准物质的特性量值随时间变化情况[23],国家兽用标准品使用中需特别注意稳定性问题[24-25]。长期稳定性是在规定贮存条件下,在较长周期内定期进行标准物质特性值的稳定性评估,考察标准物质的特性值保持在规定范围内的能力[26-27]。根据兽药标准物质研制技术规范要求,今后将对泰万菌素标准品进行长期稳定性考察,第1次考察时间为1年后,以后每年定期测定1次。原则上对泰万菌素效价进行考察,由1人进行测定,每次测定平行样不少于2份,稳定性考察测定的结果与原结果相对偏差应≤2.0%。
4 结论本研究研制的首批泰万菌素国家标准品符合国家兽用标准品研制的相关要求,已获得兽药标准物质化学药品专业委员会批准,可作为国家兽用标准品进行发放和使用,用于酒石酸泰万菌素及其制剂中泰万菌素的效价测定,并为其他抗生素生物标准品的质量分析及研究提供了依据。
| [1] |
冯言言, 田伟. 大环内酯类药物泰万菌素的研究进展[J]. 广东畜牧兽医科技, 2015, 40(6): 5–6, 12.
FENG Y Y, TIAN W. Research progress of macrolide tylvalosin[J]. Guangdong Journal of Animal and Veterinary Science, 2015, 40(6): 5–6, 12. (in Chinese) |
| [2] |
韩冰, 张荣飞, 晨光, 等. 泰万菌素对断奶仔猪生产性能的影响[J]. 黑龙江畜牧兽医, 2017(9): 197–198.
HAN B, ZHANG R F, CHEN G, et al. Effect of tylvalosin on the growth performance of weaning piglet[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(9): 197–198. (in Chinese) |
| [3] |
MOGES R, DE LAMACHE D D, SAJEDY S, 等.泰万菌素的抗炎效果分析[J].文丽, 李仕超, 译.猪业科学, 2018, 35(12): 24-28.
MOGES R, DE LAMACHE D D, SAJEDY S, et al. Analysis of anti-inflammatory effect of tylvalosin[J]. WEN L, LI S C, trans. Swine Industry Science, 2018, 35(12): 24-28. (in Chinese) |
| [4] |
朱晓娟, 王华丽, 齐鹏, 等. 酒石酸乙酰异戊酰泰乐菌素在猪体内的药代动力学研究[J]. 中国兽医杂志, 2013, 49(2): 73–75.
ZHU X J, WANG H L, QI P, et al. Pharmacokinetics of aivlosin in pigs[J]. Chinese Journal of Veterinary Medicine, 2013, 49(2): 73–75. (in Chinese) |
| [5] | MANCHESTER A C, WEBB C B, BLAKE A B, et al. Long-term impact of tylosin on fecal microbiota and fecal bile acids of healthy dogs[J]. J Vet Int Med, 2019, 33(6): 2605–2617. |
| [6] | PALLARÉS F J, LASA C, ROOZEN M, et al. Use of tylvalosin in the control of porcine enzootic pneumonia[J]. Vet Record Open, 2015, 2(1). |
| [7] | GARMYN A, VEREECKEN M, DE GUSSEM K, et al. Efficacy of tylosin and tilmicosin against experimental Mycoplasma gallisepticum infection in chickens[J]. Avian Dis, 2019, 63(2): 359–365. |
| [8] | TAVÍO M M, POVEDA C, ASSUNÇÃO P, et al. In vitro activity of tylvalosin against Spanish field strains of Mycoplasma hyopneumoniae[J]. Vet Record, 2014, 175(21): 539. |
| [9] | ZHU H J, WANG W H, LIU J H, et al. Immobilization of Streptomyces thermotolerans 11432 on polyurethane foam to improve production of acetylisovaleryltylosin[J]. J Ind Microbiol Biotechnol, 2015, 42(1): 105–111. |
| [10] | KUHNERT P, OVERESCH G. Molecular epidemiology of Mycoplasma hyopneumoniae from outbreaks of enzootic pneumonia in domestic pig and the role of wild boar[J]. Vet Microbiol, 2014, 174(1-2): 261–266. |
| [11] |
吴剑平, 张婧, 李丹妮, 等. 分散固相萃取法结合液相色谱串联质谱法检测鸡可食性组织中泰万菌素及3-乙酰泰乐菌素残留量[J]. 中国兽药杂志, 2017, 51(8): 30–39.
WU J P, ZHANG J, LI D N, et al. Determination of aivlosin and 3-acetyl tylosin in edible chicken tissues by dispersive solid phase extraction combined with liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Veterinary Drug, 2017, 51(8): 30–39. (in Chinese) |
| [12] |
张文刚, 姜芹, 孙冰清, 等. 抗生素微生物检定法测定酒石酸泰万菌素预混剂含量的不确定度分析[J]. 上海畜牧兽医通讯, 2018(2): 5–7.
ZHANG W G, JIANG Q, SUN B Q, et al. Analysis of uncertainty in the determination of tylvalosin tartrate premix by antibiotic microbiological assay[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2018(2): 5–7. (in Chinese) |
| [13] |
吴家鑫, 尚飞, 张国栋, 等. UPLC-Q-TPF-MS测定酒石酸泰万菌素可溶性粉中的泰万菌素[J]. 中国兽医杂志, 2016, 52(9): 108–110.
WU J X, SHANG F, ZHANG G D, et al. Determination of tylvalosin in tylvalosin tartrate soluble powder by UPLC-Q-TPF-MS[J]. Chinese Journal of Veterinary Medicine, 2016, 52(9): 108–110. (in Chinese) |
| [14] |
中国兽药典委员会.
兽药质量标准2017年版化学药品卷[M]. 北京: 中国农业出版社, 2017.
Chinese Veterinary Pharmacopoeia Commission. Veterinary drug quality standard 2017 chemical volume[M]. Beijing: China Agriculture Press, 2017. (in Chinese) |
| [15] |
张秀英, 陆连寿, 李翠, 等. 我国兽药标准物质供应现状分析与建议[J]. 中国兽药杂志, 2015, 49(1): 57–59.
ZHANG X Y, LU L S, LI C, et al. Analysis of supply status for veterinary durg reference standards[J]. Chinese Journal of Veterinary Drug, 2015, 49(1): 57–59. (in Chinese) |
| [16] |
王小慈, 张秀英, 李翠, 等. 美国化学药品标准物质管理情况概述及分析[J]. 中国兽药杂志, 2018, 52(10): 16–21.
WANG X C, ZHANG X Y, LI C, et al. USA chemical reference standard materials' management overview and analysis[J]. Chinese Journal of Veterinary Drug, 2018, 52(10): 16–21. (in Chinese) |
| [17] |
中国兽药典委员会.
中华人民共和国兽药典2015年版一部[M]. 北京: 中国农业出版社, 2016.
Chinese Veterinary Pharmacopoeia Commission. People's republic of China veterinary pharmacopoeia 2015 PartⅠ[M]. Beijing: China Agriculture Press, 2016. (in Chinese) |
| [18] |
胡昌勤. 2015年版《中国药典》有关抗生素的增修订及其质量控制方向[J]. 中国药学杂志, 2015, 50(20): 1764–1769.
HU C Q. Revision of specifications of antibiotic in the Chinese Pharmacopoeia 2015 and the trend of antibiotic quality control[J]. Chinese Pharmaceutical Journal, 2015, 50(20): 1764–1769. (in Chinese) |
| [19] |
陈桂良, 徐新元, 王依婷, 等. 新药开发研究过程中药品标准物质的标定[J]. 上海计量测试, 2002, 29(2): 18–20.
CHEN G L, XU X Y, WANG Y T, et al. The determination of pharmaceutical reference materials during new drug development and research[J]. Shanghai Measurement and Testing, 2002, 29(2): 18–20. (in Chinese) |
| [20] |
胡昌勤, 成双红. 抗生素生物标准品的确定[J]. 中国药事, 2001, 15(4): 263–265, 266.
HU C Q, CHENG S H. Determination of biological reference standards of antibiotics[J]. Chinese Pharmaceutical Affairs, 2001, 15(4): 263–265, 266. (in Chinese) |
| [21] |
杨淑先, 崔春英, 刘英, 等. 协作标定首批国家标准品吉他霉素[J]. 中国药师, 2005, 8(2): 170.
YANG S X, CUI C Y, LIU Y, et al. Cooperate to calibrate the first batch of national standard kitasamycin[J]. China Pharmacist, 2005, 8(2): 170. (in Chinese) |
| [22] |
崔春英, 杨淑先. 国家标准品克拉霉素的协作标定[J]. 临床医学, 2002, 22(10): 43.
CUI C Y, YANG S X. Collaborative calibration of clarithromycin[J]. Clinical Medicine, 2002, 22(10): 43. (in Chinese) |
| [23] |
陈亚飞, 肖新月, 何平, 等. 标准物质稳定性考察规范解读和有效期管理方式的研究[J]. 中国药事, 2018, 32(3): 317–322.
CHEN Y F, XIAO X Y, HE P, et al. Interpretation of reference material stability investigation requirements and study on expiry date management methods[J]. Chinese Pharmaceutical Affairs, 2018, 32(3): 317–322. (in Chinese) |
| [24] |
戴青, 韩宁宁, 赵晖, 等. 苄星氯唑西林国家对照品的研制[J]. 中国兽药杂志, 2019, 53(7): 18–24.
DAI Q, HAN N N, ZHAO H, et al. Development of benzathine cloxacillin as national reference[J]. Chinese Journal of Veterinary Drug, 2019, 53(7): 18–24. (in Chinese) |
| [25] | CASTRO L, MOREIRA E G, VASCONCELLOS M B A, et al. Stability assessment of a bovine kidney reference-material candidate[J]. J Radioanal Nucl Chem, 2018, 317(2): 1133–1139. |
| [26] |
马秋平, 王箐舟, 侯继锋, 等. 人免疫球蛋白甲型肝炎抗体国家标准品的研制[J]. 药物分析杂志, 2018, 38(2): 303–306.
MA Q P, WANG Q Z, HOU J F, et al. Preparation of national standard for anti-hepatitis A immunoglobulin[J]. Chinese Journal of Pharmaceutical Analysis, 2018, 38(2): 303–306. (in Chinese) |
| [27] |
刘莉莎, 邓利娟, 任雪, 等. 首批矛头蝮蛇血凝酶国家标准品及对照品的研制[J]. 中国药事, 2019, 33(12): 1456–1463.
LIU L S, DENG L J, REN X, et al. Development of the first batch of national reference material and the control material for hemocoagulase bothrops atrox[J]. Chinese Pharmaceutical Affairs, 2019, 33(12): 1456–1463. (in Chinese) |



