2. 重庆市兽医科学工程研究中心, 重庆 402460;
3. 重庆市畜牧科学院, 重庆 402460;
4. 甘肃农业大学动物医学院, 兰州 730070
2. Chongqing Veterinary Science Engineering Research Center, Chongqing 402460, China;
3. Chongqing Academy of Animal Science, Chongqing 402460, China;
4. College of Veterinary Medicine, Gansu Agricultural University, Lanzhou 730070, China
骨形态发生蛋白15(bone morphogenetic protein 15,BMP15)是转化生长因子β(transforming growth factor-beta,TGF-β)超家族成员之一,是卵母细胞分泌的一种生长因子,在结构上常以6个保守的半胱氨酸形成二硫键,连接两个成熟肽区构成具有生物活性的二聚体与卵母细胞周围的颗粒细胞膜上的TGF-β受体结合,进而磷酸化胞内的SMADs蛋白组成BMP15/TGF-β/SMADs信号通路,调控卵泡的发生发育、卵丘的扩散和卵母细胞的发育[1-4]。研究表明,小鼠BMP15通过TGF-β信号分子作为配体激活细胞膜上BMPR1B(ALK6)和BMPRⅡ受体,激活下游的SMAD2/3通路而调节基因表达[5-6]。Pangas等[1]研究发现,在小鼠优质卵母细胞及其卵泡液中BMP15含量明显升高;条件性敲除SMAD1、SMAD5、SMAD8基因的小鼠表现为排卵障碍和不育。卵泡颗粒细胞凋亡是卵泡闭锁的主要诱因,而颗粒细胞凋亡又受BMP15基因及其信号调控分子SMADs的影响[7-8]。研究表明,TGF-β有5个亚型,分别为TGF-β1、TGF-β2、TGF-β3、TGF-β4和TGF-β5,TGF-β受体(TGF-β R)研究比较清楚的为TGF-β RⅠ、TGF-β RⅡ和TGF-β R Ⅲ;SMADs蛋白分为受体调节型(SMAD1-3,SMAD5和SMAD8)、共同调节型(SMAD4)及抑制型(SMAD6和SMAD7),TGF-β受体及SMADs蛋白家族在TGF-β信号转导过程中发挥非常重要的作用[5-6]。BMP15是控制牛羊排卵数和多胎性状的主要基因,是卵泡发育和卵巢功能的重要调节因子[9]。人和绵羊中BMP15通过同源二聚体激活SMAD1/5/8信号通路,但在小鼠和大鼠中激活SMAD2/3信号通路,表明BMP15激活的SMADs信号通路在不同物种间存在差异[10]。荣昌猪是中国三大优良的地方猪种之一,具有“国宝猪”之称,已被列为国家一级保种资源,是我国推广范围最广的地方优良品种[11]。本课题组在前期研究中,对荣昌猪BMP15基因进行了克隆及序列分析,发现其在卵巢内特异性高表达特征[11],为进一步研究荣昌猪BMP15基因在卵泡内表达特征及其蛋白参与信号通路,本研究以1、3及5月龄荣昌猪卵巢为材料,对荣昌猪BMP15基因表达特征及其效应分子SMAD2、SMAD3、SMAD4、SMAD7、TGF-β1、TGF-β2、TGF-β3、TGF-β RⅠ及TGF-β RⅡ信号调控分子表达特征进行了初步研究,为荣昌猪BMP15基因的表达定位及确定其在卵泡发育中的作用奠定了基础。
1 材料与方法 1.1 主要试剂与仪器Trizol Reagent购自Invitrogen(美国)公司,PrimeScriptTM RT Reagent Kit反转录试剂盒、SYBR® Premix Ex TaqTMⅡ试剂盒均购自TaKaRa(大连)公司。抗体BMP15(Abcam, Mouse, ab231261),SMAD4(Abcam, Rabbit, ab40759),TGF-β1(Abcam, Rabbit, ab9758),TGF-β2(Abcam, Mouse, ab36495),TGF-β RⅠ(Abcam, Rabbit, ab31013),TGF-β RⅡ(Abcam, Mouse, ab78419)均购自Abcam公司;TGF-β receptorⅠ (TGF-β RⅠ)抑制剂Galunisertib (LY2157299,S2230)及TGF-β receptor typeⅠ/Ⅱ (TGF-β RⅠ/Ⅱ)双重抑制剂LY2109761(S2704)均购自Selleck公司;重组人BMP15蛋白购自R&D公司;辣根过氧化物酶标记山羊抗兔Ig(H+L)二抗(A0208),辣根过氧化物酶标记山羊抗鼠Ig(H+L)二抗(A0216)、Hoechst 33258染色液(C1017)及苏木素伊红(HE)染色试剂盒(C0105)、BCA蛋白浓度测定试剂盒(P0012)均购自碧云天生物技术公司;胎牛血清、DMEM培养基等购自Gibco公司;细胞培养板购自CORNING公司;倒置荧光显微镜LEICA DMi8购自德国LEICA公司,QuantStudio 3 Quantitative RT-PCR仪购自美国ABI公司,活组织切片机MD6000购自TSE公司,超高灵敏度化学发光检测仪FUSION FX-XT购自法国VILBER公司。
1.2 试验动物与样品采集2018年3月从重庆市畜牧科学院养猪研究所种猪场购买20日龄荣昌母猪12头,并随机分为3组,每组4头,采用全价饲料饲喂,饲养至1、3及5月龄时颈部放血处死,检查生殖器官形态正常,迅速取出两侧卵巢,剔除其余结缔组织,左侧卵巢置入液氮速冻保存;右侧卵巢组织,按Alabama R&D Tissue Slicer Owner’s Instruction Manual进行操作,用3%低熔点琼脂糖包埋后制备卵巢活组织切片,置于24孔细胞培养板中,参照文献[12]进行体外培养,其余置入4%多聚甲醛固定保存。
1.3 石蜡切片免疫荧光染色分析BMP15基因细胞定位采用常规方法制作5月龄荣昌猪卵巢石蜡切片,烤片2.5 h后,按免疫组化试剂盒操作步骤,二甲苯脱蜡,梯度酒精脱水,抗原修复后,加3% H2O2室温孵育消除内源性过氧化物酶活性,PBS洗涤后加封闭液,室温封闭30 min,甩掉多余封闭液,滴加鼠源一抗BMP15(1:1 000),PBS作为阴性对照,4 ℃孵育过夜,PBS洗涤后滴加二抗(羊抗鼠FITC)于37 ℃孵育30 min,PBS洗涤后进行Hoechst 33258染色、封片、荧光显微镜观察并摄像。
1.4 卵巢活组织培养与TGF-β受体抑制试验对制备的5月龄荣昌猪卵巢活组织切片样品,置于24孔细胞培养板内,分别用培养液A、B和C液在5% CO2和3% O2的37 ℃恒温恒湿培养箱内培养72 h,培养至48 h时换液1次,每一种培养液设3个重复试验组用于qRT-PCR分析BMP15及相关基因mRNA表达;另外,再用A、B和C液在5% CO2和3% O2的37 ℃培养箱内培养0、36和72 h后,制备蛋白样品用于TGF-β RⅠ、TGF-β RⅡ、SMAD4及GAPDH蛋白Western blot分析试验。参考文献[12-13]培养液A为DMEM/F12 +胎牛血清10%+青链霉素1%+100 ng·mL-1 BMP15+30 μmol·L-1 DMSO,培养液B为DMEM/F12 +胎牛血清10%+青链霉素1%+ 100 ng·mL-1 BMP15+30 μmol·L-1 LY2109761,培养液C为DMEM/F12 +胎牛血清10%+青链霉素1%+100 ng·mL-1 BMP15+10 μmol·L-1 LY2157299。
1.5 引物的设计与合成参考荣昌猪BMP15基因保守区序列,设计引物BMP15-F和BMP15-R;参考野猪SMAD1(NM_213965)、SMAD2(NM_001256148.1)、SMAD3(NM_214137.1)、SMAD4(NM_214072.1)、SMAD6(XM_003480446.4)、SMAD7(NM_001244175.1)、TGF-β1(NM_214015.2)、TGF-β2(L08375.1)、TGF-β3(NM_214198.1)、TGF-β RⅠ(NM_004612.4)、TGF-β RⅡ(EF396957.1)基因序列分别设计荧光定量PCR上下游引物;参考野猪GAPDH基因mRNA序列(NM_001206359.1)设计内参引物,引物序列见表 1,以上引物均由北京华大基因生物有限公司合成。
|
|
表 1 引物序列 Table 1 The main primers sequences |
取出液氮中保存的1、3、5月龄卵巢组织及A、B和C培养液培养72 h的卵巢活组织样品,按照RNeasy® Mini Kit Handbook操作说明从细胞组织中提取总RNA,以PrimeScriptTM RT Reagent Kit反转录试剂盒操作步骤反转录,合成cDNA,-20 ℃保存备用。
1.7 qRT-PCR分析BMP15基因及SMAD相关基因mRNA表达以3、5月龄卵巢组织及分别由A、B和C液培养后卵巢组织的cDNA为模板,分别以BMP15、SMAD1、SMAD2、SMAD3、SMAD4、SMAD6、SMAD7、TGF-β1、TGF-β2、TGF-β3、TGF-β RⅠ及TGF-β RⅡ基因为引物,参照宝生物SYBR Premix EX Taq (Perfect Real time)染料法试剂盒操作步骤进行qRT-PCR。反应体系:SYBR Premix Ex Taq12.5 μL,上下游引物各(10 μmol·L-1) 1 μL,ddH2O 8.5 μL,模板1 μL。应用ABI QuantStudio 3 Quantitative RT-PCR仪进行qRT-PCR反应,反应条件:95 ℃变性15 s,60 ℃退火30 s,68 ℃延伸20 s,共40个循环(60 ℃ 30 s末端收集信号)。
1.8 Western blot分析BMP15、TGF-β RⅠ及TGF-β RⅡ蛋白表达分别对A、B和C液培养后的卵巢组织样品,加入100 μL IP裂解缓冲液(含蛋白酶抑制剂PMSF),冰浴裂解30 min,13 000 r·min-1 4 ℃离心30 min后取上清,按碧云天BCA蛋白浓度测定试剂盒(P0012)Bradford法进行蛋白定量;加入20 μL的5×SDS上样缓冲液,沸水煮10 min,室温13 000 r·min-1离心5 min后进行Western blot分析。应用BMP15抗体(鼠,1:2 000),37 ℃孵育1 h;TBST漂洗6次,每次7 min。辣根过氧化物酶标记的山羊抗小鼠IgG(H+L)二抗(1:5 000),37 ℃轻摇孵育1 h,TBST漂洗后按化学发光检测试剂盒操作步骤进行显色,利用超高灵敏度化学发光检测仪FUSION FX-XT进行结果分析。抗体TGF-β RⅠ(兔)及TGF-β RⅡ(鼠)检测TGF-β RⅠ及TGF-β RⅡ蛋白,GAPDH抗体(1:5 000)检测内参蛋白。
1.9 数据分析根据荧光定量所得到的Ct值,采用2-ΔΔCt法进行结果分析,统计学分析3次重复试验的(平均值±标准误),用Student t测验进行差异显著性分析,P < 0.01差异极显著,0.01 < P < 0.05差异显著,P>0.05差异不显著。免疫荧光切片使用倒置荧光显微镜LEICA DMi8观察并拍照,比例尺为50 μm,使用Image Pro Plus 6.0图像分析软件分析图片。
2 结果 2.1 不同月龄荣昌猪卵巢BMP15基因的表达差异对采集的1、3、5月龄荣昌猪卵巢组织,以GAPDH为内参基因进行BMP15基因qRT-PCR与Western blot分析,结果显示:在不同发育阶段荣昌猪卵巢组织内,BMP15基因mRNA的表达量呈上调趋势;以1月龄BMP15基因表达量为参考,3月龄约为1月龄的1.8倍,差异显著(0.01 < P < 0.05),5月龄约为1月龄的12倍,差异极显著(P < 0.01)(图 1A);Western blot结果也显示随着月龄的增大,荣昌猪卵巢组织内BMP15蛋白也呈上调表达(图 1B)。
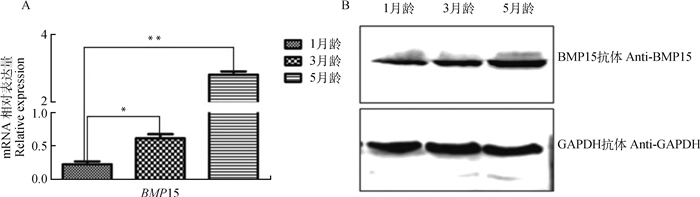
|
**.差异极显著(P < 0.01);*.差异显著(0.01 < P < 0.05) **.Shows extremely significant difference (P < 0.01), *. Shows significant difference (0.01 < P < 0.05) 图 1 不同月龄荣昌猪卵巢内BMP15基因mRNA和蛋白的表达差异 Fig. 1 The mRNA and protein expression differences of BMP15 gene in ovaries of Rongchang pigs at different ages |
通过石蜡切片免疫荧光染色法,荧光显微镜下观察,发现在5月龄荣昌猪卵巢卵母细胞周围颗粒细胞内发现强BMP15蛋白的绿色荧光信号,如图红色箭头所示(图 2)。
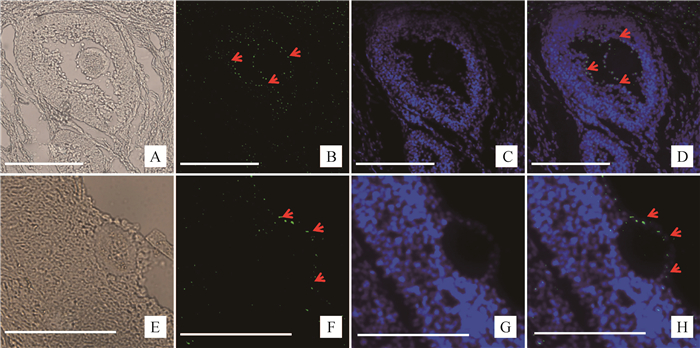
|
A.卵巢卵泡组织;B. BMP15蛋白FITC标记;C. Hoechst33258染色;D.叠加图;E.卵巢卵泡组织;F. BMP15蛋白FITC标记;G. Hoechst33258染色;H.叠加图;标尺示50 μm A. Follicular tissue of ovary; B. BMP15 protein staining by FITC; C. Hoechst33258 staining; D. Merged image; E. Follicular tissue of ovary; F. BMP15 protein staining by FITC; G. Hoechst33258 staining; H. Merged image; The bars represent 50 μm 图 2 荣昌猪5月龄卵巢内BMP15蛋白定位特征分析 Fig. 2 The localization analysis of BMP15 protein in ovary of 5 months old Rongchang pig |
对采集的荣昌猪3和5月龄卵巢组织,以GAPDH为内参基因进行BMP15、SMAD1、SMAD2、SMAD3、SMAD4、SMAD6、SMAD7、TGF-β1、TGF-β2、TGF-β3、TGF-β RⅠ及TGF-β RⅡ基因qRT-PCR分析,结果显示:在不同发育阶段荣昌猪卵巢组织内,BMP15、SMAD4、TGF-β1及TGF-β RⅡ基因mRNA呈上调趋势,SMAD2、TGF-β2及TGF-β RⅠ基因mRNA呈下降趋势,SMAD3、SMAD7基因mRNA表达无明显变化,SMAD1、SMAD6及TGF-β3基因mRNA几乎不表达。以3月龄各基因mRNA表达量为参考,BMP15、TGF-β1基因表达量上调,差异极显著(P < 0.01),SMAD4、TGF-β RⅡ基因表达量上调,差异显著(P < 0.05);而TGF-β RⅠ基因表达量下调,差异极显著(P < 0.01),SMAD2、TGF-β2基因表达量下调,差异显著(P < 0.05)(图 3)。
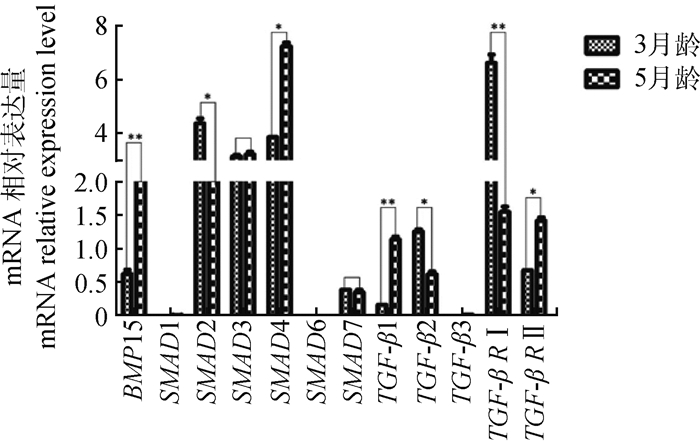
|
**.差异极显著(P < 0.01);*.差异显著(0.01 < P < 0.05) ** Show extremely significant difference (P < 0.01), * Show significant difference (0.01 < P < 0.05) 图 3 BMP15基因与SMADs信号相关基因mRNA表达差异 Fig. 3 mRNA expression difference analysis between BMP15 gene and SMADs signal related genes |
分别以A、B和C液培养的荣昌猪5月龄卵巢活组织切片样品的cDNA为模板,以GAPDH为内参基因,进行BMP15、SMAD3、SMAD4、TGF-β1、TGF-β2、TGF-β RⅠ及TGF-β RⅡ基因qRT-PCR分析,结果显示:在卵巢组织培养液中添加100 ng·mL-1重组人BMP15的条件下,在对照组中BMP15、SMAD3基因表达基本接近5月龄卵巢组织mRNA水平;相比于对照组,TGF-β RⅠ/Ⅱ受体抑制剂(LY2109761)组BMP15、SMAD4基因呈上调表达,而SMAD3、TGF-β2及TGF-β RⅠ基因呈下调表达,TGF-β1及TGF-β RⅡ表达无明显变化;TGF-β RⅠ受体抑制剂(LY2157299)组,SMAD4、TGF-β RⅡ基因呈上调表达,BMP15、SMAD3、TGF-β1基因表达水平同DMSO对照组。以DMSO对照组各基因mRNA表达量为参考,TGF-β RⅠ/Ⅱ受体抑制剂(LY2109761)组BMP15基因表达量差异不显著(P>0.05),SMAD3基因表达量下调,差异显著(P < 0.05),TGF-β RⅠ基因表达量下调,差异极显著(P < 0.01);TGF-β RⅠ受体抑制剂(LY2157299)组SMAD4、TGF-β RⅡ基因表达量上调,差异显著(P < 0.05),SMAD3及TGF-β1基因表达量几乎不变,差异不显著(P >0.05)(图 4)。
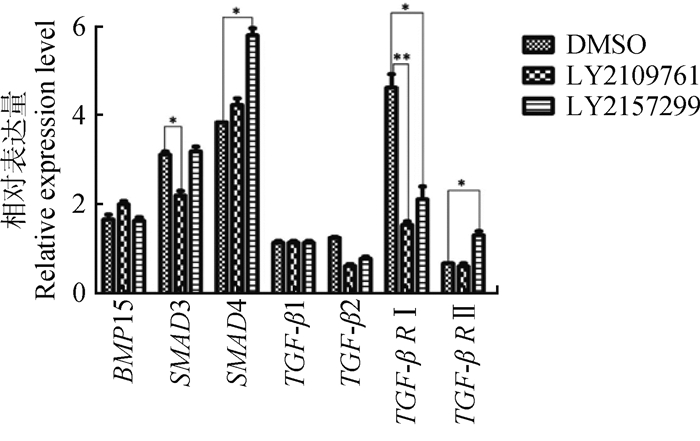
|
**.差异极显著(P < 0.01);*.差异显著(0.01 < P < 0.05) Comparison of different gene mRNA expression with DMSO control group:**Show very significant difference (P < 0.01), * Show significant difference (0.01 < P < 0.05) 图 4 TGF-β受体抑制条件下BMP15基因与SMADs信号相关基因mRNA表达差异 Fig. 4 mRNA expression difference analysis between BMP15 gene and SMADs signal related genes under TGF-β R inhibition |
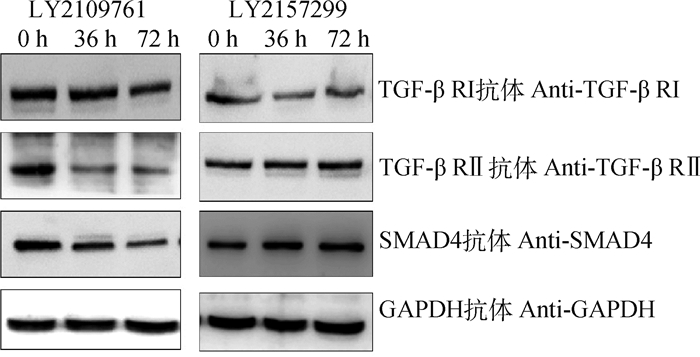
对采集的荣昌猪5月龄卵巢,分别用A、B和C液培养0、36和72 h的卵巢活组织蛋白样品,以GAPDH为内参蛋白进行SMAD4、TGF-β RⅠ及TGF-β RⅡ蛋白Western blot分析,结果表明:在TGF-β RⅠ/Ⅱ受体抑制剂LY2109761条件下,随着诱导时间的延长,TGF-β RⅠ、TGF-β RⅡ和SMAD4蛋白呈下调趋势;TGF-β RⅠ受体抑制剂LY2157299组,随着诱导时间的延长,TGF-β RⅠ蛋白呈下调趋势,而TGF-β RⅡ受体蛋白、SMAD4蛋白表达无明显变化(图 5),表明外源添加的BMP15蛋白在TGF-β RⅠ受体抑制的条件下,通过TGF-β RⅡ受体介导向SMAD4分子传导信号。
|
图 5 TGF-β受体抑制条件下TGF-β受体与SMADs信号蛋白表达差异 Fig. 5 Expression differences of TGF-β R and SMADs signaling proteins under TGF-β R inhibition |
研究表明,卵母细胞同外周的颗粒细胞和膜细胞共同组成卵巢上功能性单位——卵泡,卵泡发育受卵泡生殖细胞和体细胞间内分泌、自分泌、旁分泌的共同调控[14]。在卵母细胞中特异表达的BMP15蛋白具有促进颗粒细胞增殖、卵丘扩散、抑制颗粒细胞的凋亡和黄体化并参与调节颗粒细胞中孕酮等固醇类激素的生成[15]。在绵羊和人卵巢中,BMP15表达始于初级卵泡卵母细胞,而在小鼠中始于原始卵泡[16]。本研究结果表明,荣昌猪从3~5月龄生长过程中,卵巢内BMP15基因呈上调表达;在5月龄的卵巢组织卵母细胞周围颗粒细胞内表达量较高,可见荣昌猪卵母细胞分泌的BMP15蛋白通过某种分子通道而作用于其周围的颗粒细胞,从而在卵泡发育中发挥着重要的调控作用。
BMP15蛋白在卵母细胞中表达,并作为旁分泌因子被分泌到胞外,通过TGF-β信号分子作为配体激活细胞膜上两种不同的丝氨酸/苏氨酸激酶受体,从而激活细胞内SMADs,调节下游基因表达而参与卵泡发育调控[17-18]。本研究结果表明,荣昌猪从3~5月龄生长过程中,卵巢内BMP15、TGF-β1、TGF-β RⅡ及SMAD4基因在mRNA水平及BMP15在蛋白水平上都呈上调表达,这同小鼠BMP15基因通过TGF-β/SMADs信号通路调控相一致[19];在小鼠中BMP15协同GDF-9而激活SMAD2/3信号分子发挥重要生物学功能,本研究发现SMAD2、TGF-β2及TGF-β RⅠ基因在发育过程中呈下调表达,SMAD4呈上调表达,由此可见,在小鼠中受体调节型SMAD2/3激活下游效应分子,而在猪中则可能以共同调节型SMAD4蛋白通过BMP15/SMADs发挥更加重要的生物学功能。
在哺乳动物中卵泡从原始卵泡、初级卵泡、次级卵泡发育至成熟卵泡,是一个连续变化的过程[20-23]。卵泡的生长需要促卵泡激素(follicle stimulating hormone,FSH),还需要来自颗粒细胞、膜细胞和卵母细胞等分泌的调节因子,也就是FSH、卵母细胞-颗粒细胞-膜细胞等通过复杂的相互作用而调控卵泡发育[16-17, 23]。哺乳动物从出生到初情期前,是下丘脑-垂体-性腺轴及生殖系统的构建和逐步完善的时期,在这一时期促性腺激素对卵泡的发育影响较小,但是随着猪日龄的增大,原始卵泡和生长卵泡均呈先增后减的趋势,卵巢中均存在广泛的卵泡闭锁现象[23-25]。在这一时期卵母细胞发育的过程中,主要依赖于卵丘细胞来执行多种功能,卵母细胞通过局部分泌强效因子(oocyte-secreted factors,OSFs)和表皮生长因子(epidermal growth factor,EGF)来决定卵丘细胞的分化和作用,而OSF主要包括生长分化因子9 (GDF9)和BMP15及一些成纤维细胞生长因子(fibroblast growth factor,FGF)等[20-21]。BMP15蛋白通过结合TGF-β RⅠ和TGF-β RⅡ来激活细胞内的SMADs信号分子而发挥作用[22]。本研究结果表明,从3~5月龄的荣昌猪卵巢组织内BMP15、TGF-β1及TGF-β RⅡ mRNA及蛋白表达呈上调表达;通过卵巢组织添加外源重组人BMP15蛋白,表明外源添加的BMP15蛋白在TGF-β RⅠ受体抑制的条件下,可通过TGF-β RⅡ受体介导SMAD4分子传导信号,从而实现调控卵泡颗粒细胞的发育,而荣昌猪BMP15蛋白在各级卵泡内的分泌运输机制及其在SMAD4介导信号传导的详细机制有待于进一步研究。
4 结论荣昌猪性成熟前,随着卵泡的发育,荣昌猪BMP15、SMAD4、TGF-β RⅡ基因在卵巢组织内呈上调表达。卵母细胞分泌的BMP15蛋白通过颗粒细胞表面TGF-β RⅡ分子介导胞内SMAD4分子而调控颗粒细胞的发育,为进一步研究荣昌猪BMP15基因在卵泡发育中的作用奠定基础。
| [1] | PANGAS S A, LI X H, UMANS L, et al. Conditional deletion of Smad1 and Smad5 in somatic cells of male and female gonads leads to metastatic tumor development in mice[J]. Mol Cell Biol, 2008, 28(1): 248–257. |
| [2] | ZHAI B, LIU H Y, LI X, et al. BMP15 prevents cumulus cell apoptosis through CCL2 and FBN1 in porcine ovaries[J]. Cell Physiol Biochem, 2013, 32(2): 264–278. |
| [3] | GASPERIN B G, FERREIRA R, ROVAN M T, et al. Expression of receptors for BMP15 is differentially regulated in dominant and subordinate follicles during follicle deviation in cattle[J]. Anim Reprod Sci, 2014, 144(3-4): 72–78. DOI: 10.1016/j.anireprosci.2013.12.002 |
| [4] | MOORE R K, SHIMASAKI S. Molecular biology and physiological role of the oocyte factor, BMP-15[J]. Mol Cell Endocrinol, 2005, 234(1-2): 67–73. DOI: 10.1016/j.mce.2004.10.012 |
| [5] | MIYAZAWA K, SHINOZAKI M, HARA T, et al. Two major Smad pathways in TGF-β superfamily signalling[J]. Genes Cells, 2002, 7(12): 1191–1204. DOI: 10.1046/j.1365-2443.2002.00599.x |
| [6] | CUI X R, JING X, WU X Q, et al. Abnormal expression levels of BMP15/Smad1 are associated with granulosa cell apoptosis in patients with polycystic ovary syndrome[J]. Mol Med Rep, 2017, 16(6): 8231–8236. DOI: 10.3892/mmr.2017.7658 |
| [7] |
林鹏飞.猪有腔卵泡发育与闭锁的内分泌及分子细胞学变化研究[D].南京: 南京农业大学, 2010.
LIN P F.Study on endocrine and molecular cytological alterations of porcine antral follicles during development and atresia[D].Nanjing: Nanjing Agricultural University, 2010.(in Chinese) |
| [8] |
马鲜平, 毕俊萱, 龙安格, 等. 哺乳动物卵母细胞凋亡机制研究进展[J]. 中国畜牧兽医, 2016, 43(12): 3263–3267.
MA X P, BI J X, LONG A G, et al. Advance of apoptotic mechanism in mammalian oocyte[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(12): 3263–3267. (in Chinese) |
| [9] | CHEN H Y, LIU C, JIANG H, et al. Regulatory role of miRNA-375 in expression of BMP15/GDF9 receptors and its effect on proliferation and apoptosis of bovine cumulus cells[J]. Cell Physiol Biochem, 2017, 41(2): 439–450. |
| [10] |
翟博.BMP15调节猪卵丘细胞凋亡的信号通路研究[D].长春: 吉林大学, 2013.
ZHAI B.Study on BMP15 signal pathway to regulate the apoptosis of porcine cumulus cells[D].Changchun: Jilin University, 2013.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10183-1014130306.htm |
| [11] |
马鲜平, 朱涛, 龙安格, 等. 荣昌猪骨形态发生蛋白15基因克隆与表达谱分析[J]. 华北农学报, 2016, 31(S1): 458–462.
MA X P, ZHU T, LONG A G, et al. Sequence and transcripts analysis of the Bone Morphogenetic Protein 15 in Porcine of Rongchang[J]. Acta Agriculturae Boreali-Sinica, 2016, 31(S1): 458–462. DOI: 10.7668/hbnxb.2016.S1.078 (in Chinese) |
| [12] |
翟向玮.小鼠和家兔卵母细胞体外发生的培养体系与发育特征的研究[D].青岛: 青岛农业大学, 2008.
ZHAI X W.The culture system and developmental characteristic of oogenesis in vitro of mouse and rabbit[D].Qingdao: Qingdao Agricultural University, 2008.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2332726 |
| [13] |
冯怀亮, 秦鹏春, 杨庆章, 等. 貉卵巢卵母细胞体外培养的研究[J]. 东北农学院学报, 1992, 23(3): 306–308.
FENG H L, QIN P C, YANG Q Z, et al. Maturation of Racoon dog ovarian oocytes cultured in vitro[J]. Journal of Northeast Agricultural College, 1992, 23(3): 306–308. (in Chinese) |
| [14] |
李琴. microRNA对哺乳动物卵泡发育的影响[J]. 畜牧兽医学报, 2018, 49(12): 2558–2566.
LI Q. Roles of microRNA on mammalian follicle development[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(12): 2558–2566. DOI: 10.11843/j.issn.0366-6964.2018.12.004 (in Chinese) |
| [15] | FILATOV M, KHRAMOVA Y, PARSHINA E, et al. Influence of gonadotropins on ovarian follicle growth and development in vivo and in vitro[J]. Zygote, 2017, 25(3): 235–243. DOI: 10.1017/S0967199417000168 |
| [16] | ROY S, GANDRA D, SEGER C, et al. Oocyte-derived factors (GDF9 and BMP15) and FSH regulate AMH expression via modulation of H3K27AC in granulosa cells[J]. Endocrinology, 2018, 159(9): 3433–3445. DOI: 10.1210/en.2018-00609 |
| [17] | SHIMIZU K, NAKAMURA T, BAYASULA B, et al. Molecular mechanism of FSHR expression induced by BMP15 in human granulosa cells[J]. J Assist Reprod Genet, 2019, 36(6): 1185–1194. DOI: 10.1007/s10815-019-01469-y |
| [18] | KAMATO D, TA H, AFROZ R, et al. Mechanisms of PAR-1 mediated kinase receptor transactivation:smad linker region phosphorylation[J]. J Cell Commun Signal, 2019, 13(4): 539–548. DOI: 10.1007/s12079-019-00527-5 |
| [19] | LI X H, TRIPURANI S K, JAMES R, et al. Minimal fertility defects in mice deficient in oocyte-expressed Smad4[J]. Biol Reprod, 2012, 86(1): 1–6. |
| [20] | BELLI M, SHIMASAKI S. Molecular aspects and clinical relevance of GDF9 and BMP15 in ovarian function[J]. Vitam Horm, 2018, 107: 317–348. DOI: 10.1016/bs.vh.2017.12.003 |
| [21] | ALAM M H, LEE J, MIYANO T. GDF9 and BMP15 induce development of antrum-like structures by bovine granulosa cells without oocytes[J]. J Reprod Dev, 2018, 64(5): 423–431. DOI: 10.1262/jrd.2018-078 |
| [22] | DU X, PAN Z X, LI Q Q, et al. SMAD4 feedback regulates the canonical TGF-β signaling pathway to control granulosa cell apoptosis[J]. Cell Death Dis, 2018, 9(2): 151. DOI: 10.1038/s41419-017-0205-2 |
| [23] | CRAIG J, ORISAKA M, WANG H M, et al. Gonadotropin and intra-ovarian signals regulating follicle development and atresia:the delicate balance between life and death[J]. Front Biosci, 2007, 12: 3628–3639. DOI: 10.2741/2339 |
| [24] | PRESSING A, DIAL G D, ESBENSHADE K L, et al. Hourly administration of GnRH to prepubertal gilts:endocrine and ovulatory responses from 70 to 190 days of age[J]. J Anim Sci, 1992, 70(1): 232–242. |
| [25] |
梁学超, 蒋明, 罗玉茹, 等. 猪卵巢发育的组织学变化及卵泡闭锁规律研究[J]. 畜牧兽医学报, 2017, 48(10): 1863–1870.
LIANG X C, JIANG M, LUO Y R, et al. Study on histology and patterns of follicular atresia during ovarian development in pig[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(10): 1863–1870. DOI: 10.11843/j.issn.0366-6964.2017.10.009 (in Chinese) |



