2. 河北省牛羊胚胎工程技术研究中心, 保定 071000
2. Hebei Province Cattle and Sheep Embryo Engineering Technology Research Center, Baoding 071000, China
1994年在澳大利亚布鲁拉美利奴羊群基因组中发现了与多胎性状相关的FecB(fecundity booroola)基因[1],经克隆定位发现,其所处区域同人4号染色体上的骨形态发生蛋白受体IB(BMPR-IB)基因所处区域相同[2-3]。序列分析发现,BMPR-IB基因的第746位碱基发生由A→G(A746G)的突变,即为FecB突变。此突变作为绵羊品种的多羔主效基因[4-5],在肉用绵羊品种中却罕有发现,如杜泊、萨福克等品种,并未检测到FecB突变,仅有++基因型[6]。我国学者研究发现,FecB突变广泛存在于小尾寒羊[7]、湖羊[8-9]等多胎地方绵羊品种中,有BB、B+、++ 3种基因型,以一胎产多羔著称的湖羊均为BB型。因此,FecB基因作为多胎主效基因,在肉羊杂交生产中得到人们的广泛关注,陶滩寒杂种羊、小尾寒羊与萨福克[10]的杂交后代中均发现存在FecB突变,预示着利用FecB突变培育多胎肉羊新品种具有可行性。
随着基因组学与蛋白组学的出现,人们对FecB突变提高胎产羔数的机制进行了更加深入的研究,发现FecB突变引起基因所编码蛋白由谷氨酰胺变为精氨酸[2],可使BMPR-IB的胞内激酶结构域发生突变,从而部分失活。FecB突变在卵母细胞和颗粒细胞中广泛表达[11], 影响BMPR-IB的天然配体——生长分化因子5(GDF-5)[12]和骨形态发生蛋白4(BMP-4)发挥作用[13],导致对颗粒细胞类固醇分泌的抑制作用下降[14],从而使颗粒细胞分化加快,促进排卵,提高胎产羔数[15]。而BMPR-IB作为BMP的受体,在体细胞和生殖细胞中介导多种信号通路[16-17],这也使得A746G突变对繁殖力的提高是多水平多维度的:从细胞水平上,FecB突变极显著增加卵泡数量,降低卵泡直径[18],但对垂体促性腺激素和卵巢激素的分泌无显著影响[19];从蛋白水平上,卵巢蛋白组学的研究揭示了FecB突变与线粒体氧化功能相关蛋白的高表达相关[20-21], 子宫蛋白组学的研究也发现了许多与生殖性能相关的潜在信号通路和差异丰富蛋白[22];从分子水平上发现,FecB突变对卵泡液中的一些代谢小分子有显著影响,使卵泡液具有更强的抗氧化防御能力[23];从基因组转录水平上发现,FecB突变会使卵丘颗粒细胞上的LHCGR基因表达时间提前,从而影响卵丘颗粒细胞的增殖水平[24]。此突变还会通过影响BMP信号的传导,调控抗苗勒激素启动子的激活,影响抗苗勒激素Ⅱ型受体基因在垂体中的表达出现差异[15],从而调节原始卵泡的募集和FSH依赖性卵泡的发育[25]。瘦素基因在FecB突变纯合体中卵泡期表达显著高于野生型[26],与瘦素协同的瘦素受体的基因表达能够提早罗姆尼羊的初情期并提高其排卵数[27]。有研究对FecB突变个体的mRNA、lncRNA进行加权基因网络共表达分析[28],对差异基因进行功能富集,并筛选出网络中的关键基因,以探索FecB突变的高繁分子机制[29-30]。上述研究验证了FecB突变对绵羊胎产羔数具有正效应,为FecB突变作为分子标记进行多胎绵羊新品种的培育提供了理论基础。然而,目前将FecB突变应用于绵羊育种实践的报道较少,其关键问题是杂交育种过程中FecB基因的遗传规律及其对后代母羊的增羔效果尚无明确结论。
本研究团队于2000年开始,以杜泊羊为父本、小尾寒羊为母本,通过杂交、横交固定、自群繁育等过程,历经20余年培育形成了一个肉用绵羊新种群(暂定名“寒泊羊”),其在繁殖性能方面(胎产羔数、全年发情)较杜泊羊得到明显改善[31]。然而,目前寒泊羊每胎产单羔比例仍然较高(达46.6%),这在一定程度上制约了寒泊羊推广数量的进一步扩大。
为了揭示绵羊FecB突变的遗传规律及其对后代母羊的增羔效果,本研究以育种核心群的寒泊羊为试验动物,对纯合基因型(BB、++)母羊进行同期发情,用杂合基因型(B+)公羊的精液进行人工输精,对所生后代羔羊全部进行基因型鉴定,并结合近3年育种核心群母羊的产羔记录,统计分析绵羊FecB突变的群体遗传学规律及其对后代母羊的增羔效果,旨在探索利用绵羊FecB突变作为分子标记进行辅助育种提高胎产羔数这一经济性状的可行性,为今后绵羊育种实践中制定选种和选配方案提供理论依据。
1 材料与方法 1.1 试验动物和试剂 1.1.1 试验动物寒泊羊育种核心群的种公羊、繁殖母羊、羔羊共计1 267只。
1.1.2 主要试验试剂血液基因组柱式小量提取试剂盒(康为世纪)、2×ES Taq MasterMix(康为世纪)、Sangon Biotech生工引物(上游引物:5′-GTCGCTATGGGGAAGTTTGGATG-3′下游引物:5′-CAAGATGTTTTCATGCCTCATCAACA-CGGTC-3′)、AVa II酶。
1.1.3 同期发情药品羊炔诺酮阴道缓慢释放装置(CIDR)60 mg·枚-1,兽用孕马血清促性腺激素(PMSG)的规格为1 000 IU·支-1,氯前列醇注射液(PG)的规格为2 mL·支-1。
1.2 试验方法 1.2.1 种母羊同期发情对纯合基因型(BB、++)的试验母羊分批次进行同期发情处理,具体同期发情处理方法为:采用CIDR+PMSG+PG法进行同期发情,母羊埋植孕酮栓(CIDR)当日为同期发情处理的第0天在第10天时肌肉注射孕马血清促性腺激素(PMSG),第11天撤掉CIDR栓并颈部肌肉注射0.1 mL的氯前列醇注射液(PG)。
1.2.2 种公羊精液采集利用假阴道法采集基因型明确的种公羊精液,并在25 ℃环境下进行精液品质鉴定,合格的精液经4~5倍稀释后进行输精。
1.2.3 人工输精经同期发情处理的母羊,于撤掉CIDR栓的第48小时进行第一次人工输精,于第60小时进行第二次人工输精。输精方法采用阴道输精,输精部位为子宫颈外口内2~3 cm处,输精剂量为每只羊每次0.2 mL。
1.2.4 妊娠鉴定于母羊输精后的第40~45天,利用B超仪进行妊娠检查,确定妊娠与否。妊娠母羊加强饲养管理。
1.2.5 分娩羔羊的血样采集母羊于分娩后的第30~45天,采集羔羊的血样。新鲜血样放入含有柠檬酸钠抗凝剂的离心管中,于4 ℃冰箱运回实验室进行BMPR-IB基因检测。若血样需要长期存放,应置于-20 ℃环境保存。
1.2.6 DNA提取使用血液基因组柱式小量提取试剂盒进行DNA的提取。提取的DNA置于-20 ℃保存。
1.2.7 PCR扩增与产物检测PCR体系反应(25 μL):Mix 10 μL、上游引物0.4 μL、下游引物0.4 μL、ddH2O 13.2 μL、模板DNA 1 μL。使用1%的琼脂糖凝胶对PCR扩增产物进行电泳抽检,其中电泳电压为80 V,电流为200 mA, 时间为30 min。
1.2.8 PCR产物的酶切与RFLP分析酶切体系(10 μL):Buffer 1 μL、PCR产物3 μL、AVa Ⅱ 1 μL、ddH2O 5 μL。反应体系进行37 ℃水浴消化30 min,反应完毕进行电泳检测。使用3%的琼脂糖凝胶对酶切产物进行电泳,凝胶成像。其中电泳电压为120 V,电流为200 mA,时间为30 min。
1.2.9 基因型的判定根据酶切与RFLP分析结果,判定每只羔羊个体的基因型,并分析寒泊羊种群中BMPR-IB基因的后代遗传规律。
1.2.10 数据的处理调取近3年寒泊羊育种核心群分娩母羊的产羔记录,使用EXCEL软件整理数据,开展BMPR-IB基因型频率、等位基因频率、多态信息含量及其与胎产羔数的关联性分析。
1.3 数据处理与模型建立 1.3.1 群体遗传学参数的计算计算BMPR-IB基因的基因型频率、等位基因频率、多态信息含量(polymorphism information content,PIC)、杂合度(heterozygosity,He)、有效等位基因数(effective number of allele,Ne)。
| $ PIC=1-\sum\limits_{i=1}^{n}{P_{i}^{2}}-\sum\limits_{i=1}^{n-1}{\sum\limits_{j=i+1}^{n}{2}}P_{i}^{2}P_{j}^{2} $ | (1) |
式中,Pi为第i个等位基因频率,Pj为第j个等位基因频率,n为等位基因数。
| $ Ne=\frac{1}{\sum\limits_{i=1}^{n}{P_{i}^{2}}} $ | (2) |
式中,Pi为第i个等位基因频率,n为等位基因数。
| $ He=1-\sum\limits_{i=1}^{n}{P_{i}^{2}} $ | (3) |
式中,Pi为第i个等位基因频率,n为等位基因数。
1.3.2 线性回归模型的建立线性模型:Yijmk=μ+Pi+Gj+Am+eijmk,其中Yijmk为产羔数记录值,μ为群体均值,Pi为第i个胎次的固定效应(i=1, 2, 3, 4, 5, 6),Gj为第j种BMPR-IB基因型的固定效应(j=1, 2, 3),Am为第m种产羔季节的固定效应(m=1, 2, 3, 4),eijmk为随机残差效应。将产羔季节转换为虚拟变量(虚拟变量1、2、3的值分别为0、0、0时为春天;1、0、0时为夏天;0、1、0时为秋天;0、0、1时为冬天)。
1.4 数据统计与分析 1.4.1 Hardy-Weinberg平衡检验通过哈代温伯格定律公式,计算出x2值,检验其是否服从自由度为1的卡方分布,显著水平为0.05。
| $ {{x}^{2}}=\sum{\frac{{{(0-E)}^{2}}}{E}} $ | (4) |
式中,O为每种基因型观测数目,E为在Hardy-Weinberg平衡定律成立的假定下每种基因型的期望数目。
1.4.2 卡方检验将不同杂交组合后代的实际基因型比例与孟德尔理论比例进行卡方检验,显著水平为0.05。利用公式(5)[32]计算出+等位基因频率(Fn)随选育世代数的变化。此公式应用假设前提条件:群体中所有++纯合个体都被淘汰,并且杂合个体无表型优势而不被优先选择。利用公式(6)[28],可进一步计算出B等位基因频率随选育世代数的变化。
| $ {{F}_{n}}=\frac{{{F}_{0}}}{\left( 1+N*{{F}_{0}} \right)} $ | (5) |
式中,Fn为所有++个体被淘汰n代后+等位基因的频率,F0为淘汰++个体之前羊群中+等位基因频率,N为淘汰++个体的世代数。
| $ p ( + ) + p ( B ) = 1 $ | (6) |
式中p(+)为+等位基因频率,p(B)为B等位基因频率。
2 结果 2.1 PCR扩增产物与酶切产物的琼脂糖凝胶电泳检测结果PCR扩增产生的BMPR-IB基因片段大小为140 bp,电泳结果如图 1所示,PCR扩增产物的电泳条带清晰可见,表明PCR扩增产物质量较好。
|
M. DNA相对分子质量标准;1~6.样品1~6的PCR扩增产物 M. DNA marker; 1-6. PCR products of sample 1-6 图 1 BMPR-IB基因PCR扩增产物电泳结果 Fig. 1 Electrophoresis results of PCR products of BMPR-IB gene |
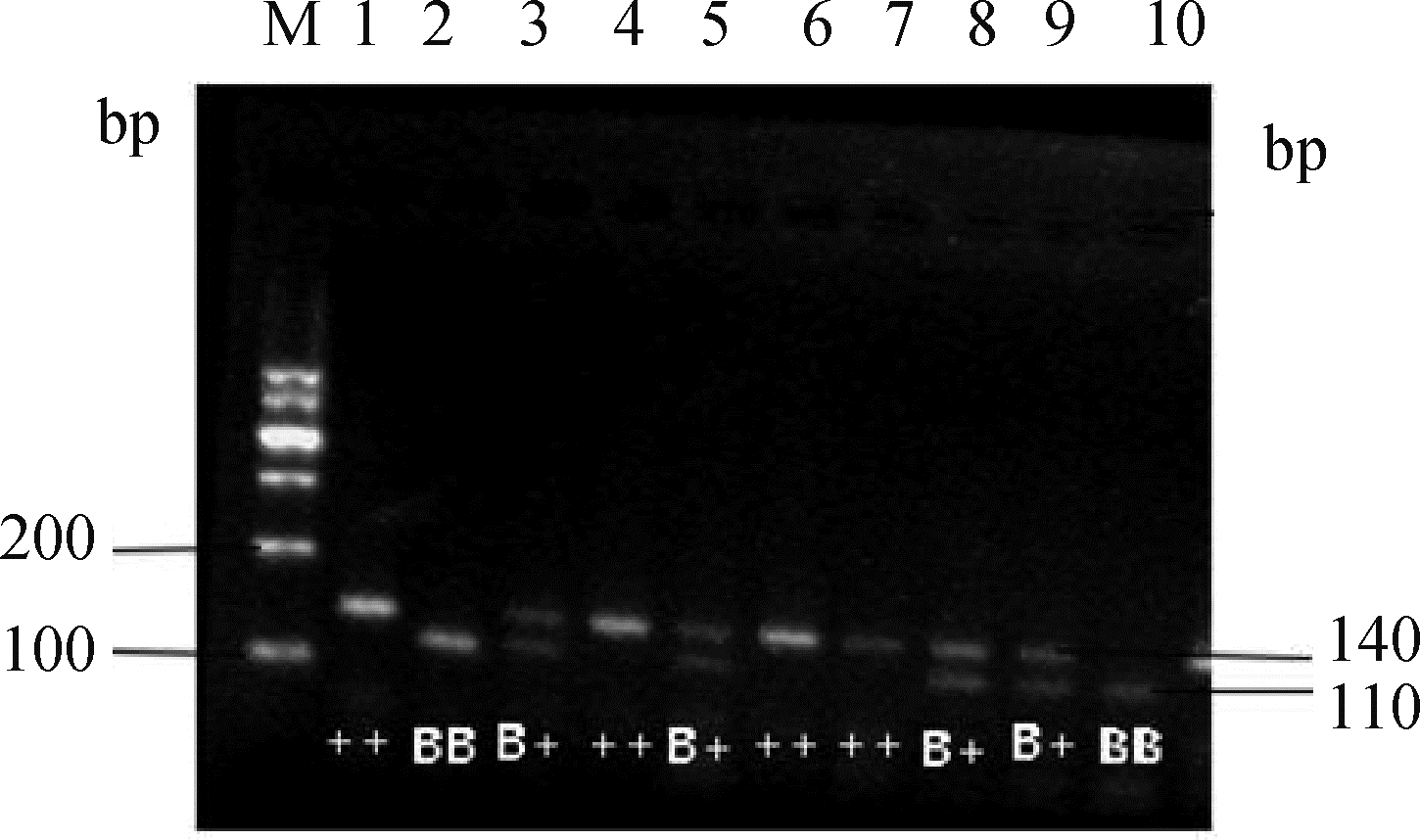
酶切产物电泳结果如图 2所示,电泳条带清晰。BB基因型仅在110 bp处有一条带;B+基因型有两条带,分别在110和140 bp处;++基因型(野生型)仅在140 bp处有一条带。
|
M. DNA相对分子质量标准;1~10.样品1~10的酶切产物。1、4、6、7. ++基因型;2、10. BB基因型;3、5、8、9. B+基因型 M. DNA marker; 1-10. Enzymatic digestion products of sample 1-10.1, 4, 6, 7. ++ genotype; 2, 10. BB genotype; 3, 5, 8, 9. B+ genotype 图 2 BMPR-IB基因AvaⅡ酶切产物电泳结果 Fig. 2 Electrophoresis results of BMPR-IB gene's Ava Ⅱ enzymatic digestion products |
BMPR-IB基因多态性结果如表 1所示,寒泊羊种群中有BB、B+和++3种基因型,其基因型频率分别为1.97%、73.40%和24.63%,各基因型所对应的平均胎产羔数分别为2.69、1.91和1.57只。
|
|
表 1 BMPR-IB基因型频率分布及平均胎产羔数 Table 1 Genotype frequency distribution of BMPR-IB and average lambing litter size |
对产羔记录信息完整的441只繁殖母羊(共计980胎次)的胎产羔数进行统计,寒泊母羊胎产羔分布情况如表 2所示,胎产1羔的比例为46.63%,胎产2羔的比例为41.74%,胎产3羔及以上的比例为11.63%。
|
|
表 2 寒泊母羊胎产羔分布情况 Table 2 Lambing litter size distribution of Hanper ewes |
BMPR-IB基因的群体遗传学分析结果见表 3,结果表明,B和+等位基因频率分别为38.67%和61.33%;BMPR-IB基因在寒泊羊群体中属于中度多态(0.25 < PIC < 0.5),有效等位基因数(Ne)为1.902,杂合度(He)为0.474;BMPR-IB基因在寒泊羊群体中处于Hardy-Weinberg不平衡状态(P < 0.05)。
|
|
表 3 BMPR-IB基因在寒泊羊群体中的群体遗传学分析 Table 3 Population genetic analysis of BMPR-IB gene in Hanper sheep population |
各变量之间的相关性分析结果如表 4所示。由表 4可知,胎产羔数与虚拟变量3、胎次、携带B等位基因数量均显著相关(P < 0.05),且均呈正相关(Pearson系数>0)。虚拟变量1和虚拟变量2虽不显著影响产羔数,但二者与虚拟变量3是由产羔季节一个变量转化而来,因此也将其纳入多元线性回归方程进行分析。
|
|
表 4 BMPR-IB基因、胎次及产羔季节与胎产羔数的相关性分析 Table 4 Correlation analysis among BMPR-IB, parity, lambing season and litter size |
以胎产羔数为因变量,虚拟变量1、虚拟变量2、虚拟变量3、携带B等位基因数、胎次为自变量,使用SPSS软件建立多元线性回归模型,模型拟合情况如表 5和表 6所示。线性关系显著(Significance < 0.05),R为0.360,拟合优度中等。综上,模型的拟合效果较好。
|
|
表 5 BMPR-IB、胎次、产羔季节与胎产羔数模型汇总 Table 5 Model of BMPR-IB, parity, lambing season and litter size summary |
|
|
表 6 BMPR-IB、胎次、产羔季节与胎产羔数方差分析模型 Table 6 Model of BMPR-IB, parity, lambing season and litter size variance analysis |
经过拟合度检验,进一步得到多元线性回归系数列表(表 7)。根据对应的系数得到胎产羔数预测的模型方程:胎产羔数=1.006+(-0.03)×虚拟变量1+0.087×虚拟变量2+0.088×虚拟变量3+0.44×携带B等位基因数量+0.147×胎次,表明一个拷贝的FecB突变可使胎产羔数增加0.44只。根据容差和VIF进行共线性判断可知,不存在严重的多重共线性(VIF < 20)。
|
|
表 7 BMPR-IB、胎次、产羔季节与胎产羔数模型的多元线性回归系数 Table 7 Multiple linear regression coefficients of regression model of BMPR-IB, parity, lambing season and litter size |
对建立的模型残差统计量进行分析,其频率分布直方图和标准正态P-P图如图 3所示。由图 3可以看出,模型的标准化残差基本呈正态分布,散点分布也较为靠近直线,具有较好的方差齐性和正态性。

|
A.回归标准化残差的正态P-P图;B.回归标准化残差的直方图 A. Regression normalized residual normal P-P plot; B. Regression normalized residual histogram 图 3 回归标准化残差图(因变量:产羔数) Fig. 3 Regression normalized residual plot(dependent variable: litter size) |
将纯合母羊与杂合父羊测交,其后代的基因型实际比值与理论比值如表 8所示,其中父本基因型为B+,母本基因型为++的后代发现两种基因型,分别为B+和++,比值为1.11:1,与理论比值1:1相符(P>0.05);父本基因型为B+, 母本基因型为BB的后代发现两种基因型,分别为BB和B+,比值为0.82:1,与理论值1:1相符(P>0.05)。
|
|
表 8 不同杂交组合后代基因型实际比例与理论比例 Table 8 The actual and theoretical percentage of different genotypes for each group |
为了使实践生产中寒泊羊种群的平均胎产羔数达到2只,本研究利用上述构建的线性回归模型,对B等位基因频率进行预测。由表 9可知,当达到平均胎产羔数2只,在春季产羔的未经产母羊群体中B等位基因频率需达到96.5%以上,经产母羊群体B等位基因频率需达到80%以上;在夏季产羔,未经产母羊群体中B等位基因频率需达到99.5%以上,经产母羊群体B等位基因频率需达到85%以上;在秋冬季产羔,未经产母羊群体中B等位基因频率需达到86.5%以上,经产母羊群体B等位基因频率需达到70%以上。综上分析,未经产母羊群体B等位基因频率若达到99.5%以上,经产母羊群体B等位基因频率若达到85%以上,预计可实现全年胎产羔数达到2只的育种目标。
|
|
表 9 达到胎产羔数200%所需B等位基因频率预测 Table 9 B allele frequency prediction is needed to reach the litter size of 200% |
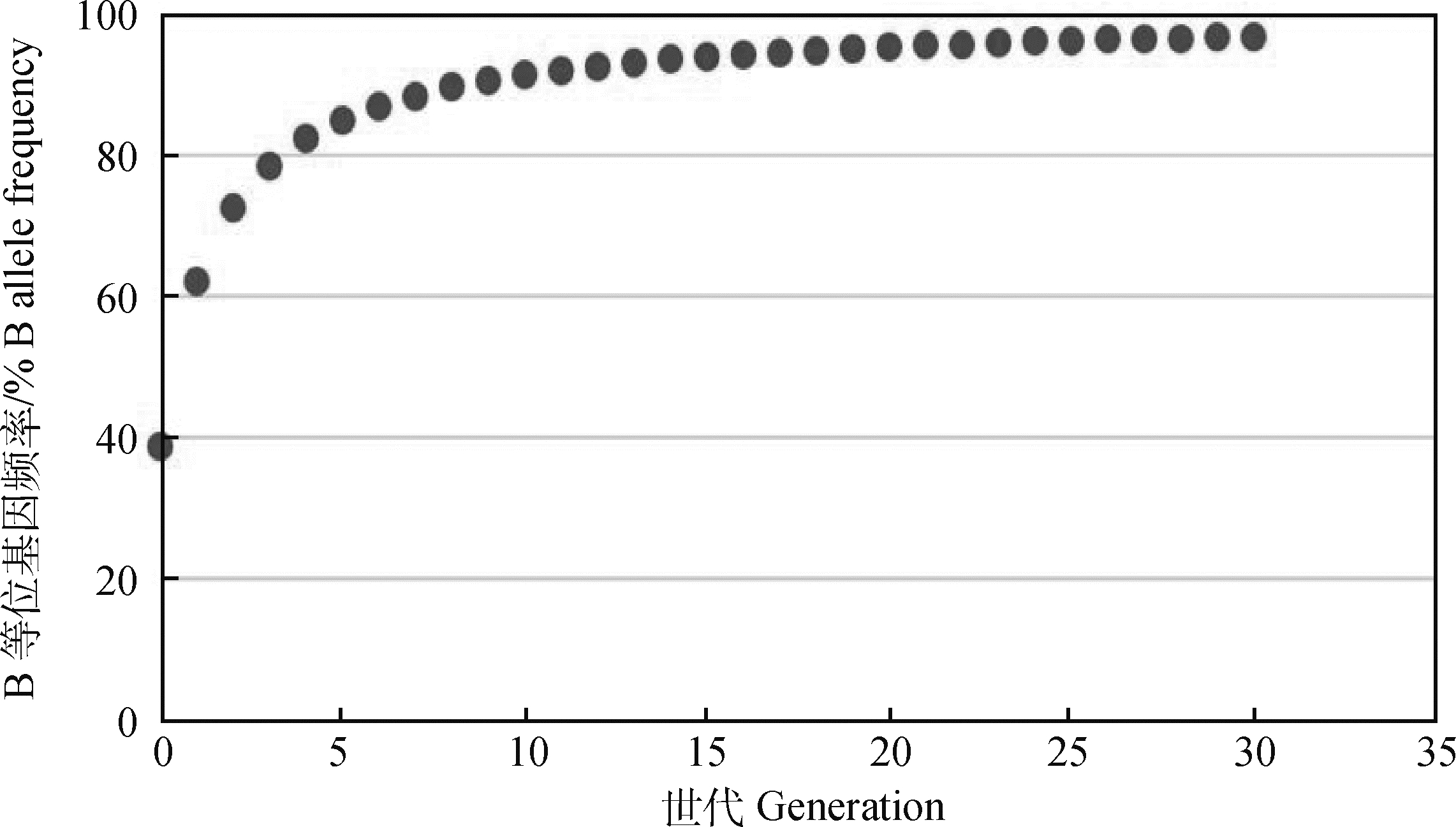
为了测算出胎产羔数达到2只所需的选育世代数,将统计得出的目前核心育种群的+等位基因频率(F0=61.33%)代入公式(5)、(6)计算出B等位基因频率随选育世代数的变化,结果如表 10和图 4所示,随着选育世代数的不断增加,B等位基因频率增加的速度逐渐降低,选育20个世代以后B等位基因趋于平稳。选育6个世代后,B等位基因频率达到86.89%,基本满足繁殖母羊胎产羔数达到2只的育种目标(除未经产母羊在春、夏季产羔外)。
|
|
表 10 随选育世代数增加预测的B等位基因频率 Table 10 Predicted B allele frequency with the increase of breeding generations |
|
图 4 B等位基因频率预测图 Fig. 4 B allele frequency prediction plot |
BMPR-IB基因在寒泊羊群体中存在3种基因型,分别为BB、B+、++,基因型频率为1.97%、73.40%和24.63%,说明小尾寒羊所携带的B等位基因成功导入了寒泊羊种群中。目前,寒泊羊群体中B+基因型占比较大,BB基因型占比较少,这可能与BB基因型的体型外貌和生活力都差于杂合子有关,经过人工对体型外貌的选育,其中有一部分纯合子可能被淘汰。有研究报道,纯合子绵羊体重、体高、胸围、平肩长显著低于野生型[33];纯合子羔羊初生重、断奶后生长速度以及成熟体重均显著低于杂合子与野生型[34]; 携带FecB突变母羊的体重及日增重均低于野生型母羊[35]。根据各基因型比例进行计算,B和+两种等位基因在寒泊羊种群中的频率目前分别为38.67%和61.33%,B基因较+基因的频率仍明显处于偏低水平,需要在维持良好的体型外貌的情况下进一步加强对B基因的选择强度。
BMPR-IB基因在寒泊羊种群中处于Hardy-Weinberg不平衡状态,Ne为1.902,接近等位基因数,说明人工选择具有一定效果。PIC值为0.362,属于中度多态,杂合度为0.474,B等位基因频率仍低于+等位基因频率,说明寒泊羊群体仍具有一定的选择潜能,需进一步加强选配。
3.2 寒泊羊种群胎产羔数性能及影响因素寒泊羊的胎产羔数平均为1.85只,虽然高于杜泊羊绵羊的平均胎产羔数(1.36只),但与小尾寒羊的平均胎产羔数(2.60只)仍有较大差距。目前,寒泊绵羊胎产1、2、3羔及以上的比例分别为46.63%、41.74%、11.63%,显然群体整齐度不够,不利于集约化生产。因此,在今后制定寒泊羊品种选育方案时,既需要提高母羊平均胎产羔数这一经济性状,同时还应兼顾母羊胎产羔数的整齐度。
本研究发现,产羔季节、胎次及FecB突变都对绵羊胎产羔数有显著影响,其中BMPR-IB基因对胎产羔数的影响最为显著,一个拷贝的B等位基因可使胎产羔数增加0.44只,显示以FecB突变作为分子标记进行选种可提高寒泊羊种群的平均胎产羔数,与前人在其他品种绵羊中所得试验结果一致[36],且有研究表明,在人工授精后,此突变也对产羔数具有加性影响[37]。近几年,研究人员通过对不同基因型绵羊各组织中与繁殖相关的基因表达量进行检测,其结果显示,与卵泡发育相关的FGF7[38]和LEPR基因[24]的表达量在具有FecB突变的绵羊中显著上升,进一步说明了此突变的增羔效应。
胎产羔率作为重要的繁殖性状,由于其遗传力低,利用传统方法进行选育的遗传进展十分缓慢。为了缩短选育时间并提高选育的准确性,进行分子标记辅助选种将是一种有效的技术手段[39]。在生产实践中,也可通过以FecB突变作为分子标记进行辅助育种以提高胎产羔数,但应注意与绵羊品种、饲养条件以及当地环境状况结合进行选育,需充分考虑羔羊成活率以及羔羊饲养的经济成本。
3.3 BMPR-IB基因的遗传规律为了进一步提高寒泊羊群体中B等位基因频率并探究解决胎产羔数群体整齐度的问题,本研究以杂合型B+公羊作为父本,以纯合型++和BB母羊分别作为母本,对其后代基因型进行检测,旨在揭示BMPR-IB基因的遗传机制,探究FecB突变作为分子标记在辅助育种中应用的可行性以指导生产实践中的选育工作。结果表明,父本为B+,母本为++时,其后代产生两种基因型B+、++的比例为1.11:1,后代比例符合孟德尔分离定律;父本为B+,母本为BB时,其后代出现两种基因型BB、B+的比例为0.82:1,后代比例符合孟德尔分离定律。本研究中,B+基因型个体较BB和++基因型个体稍多,这可能与B+基因型个体的生活力以及体型外貌具有一定的优势有关[28-29]。综上,BMPR-IB基因遗传符合孟德尔遗传定律,可以B等位基因为分子标记对育种群进行选育以提高群体胎产羔数及整齐度;选用BB或B+公羊交配母羊,可使现阶段寒泊羊种群中的B等位基因频率显著提高。
3.4 育种方案优化及育种周期预测经过上述分析可知,B等位基因已经成功导入寒泊羊种群中,其遗传方式符合孟德尔分离定律,因此利用FecB突变作为分子标记进行辅助育种是行之有效的。而目前在寒泊羊群体中B等位基因频率较低导致胎产羔数仍低于小尾寒羊。为了进一步指导育种实践达到胎产羔数2只的育种目标,我们利用基因频率公式以及上述建立的线性回归模型进行育种方案的优化以及育种周期的预测。
利用线性回归模型对达到育种目标所需B等位基因频率水平进行推算,可知B等位基因频率只有达到99.5%以上才能保证经产和未经产繁殖母羊在所有产羔季节胎产羔数均能够达到2只。B等位基因频率高于86.5%时,除头胎在春夏季节产羔的母羊其胎产羔数可能无法达到2只,其他情况均可达到。以此为目标我们将进一步开展后续的育种工作。目前寒泊羊群体中BB基因型个体较少,为了防止近交系数过高并考虑实践生产情况,无法利用分子标记将+等位基因一次性全部淘汰。因此,我们采用淘汰++基因型个体的方法来快速提高B等位基因频率与BB基因型个体数目。通过公式进行+等位基因频率的推算可发现B基因频率达到99.5%以上所需选育的世代数较多,且后期选择效果逐渐变小,遗传进展逐渐变慢,并可能达到选择极限[40]。而当选育达到6世代时,B等位基因频率已经升至86.89%,可满足大部分繁殖母羊的要求,因此连续淘汰++基因型个体6个世代是较为经济且有效的选择。
综上,在连续淘汰++基因型个体6个世代之后,尽量将未经产母羊的产羔季节安排在秋冬季节产羔,即可达到寒泊羊种群胎产羔数达到2只的育种目标。在选育过程中应注意,在考虑体型外貌的同时,尽量避免对B+基因型个体的过多选择,否则会影响B等位基因频率的上升,延长育种周期。
4 结论BMPR-IB基因在寒泊羊种群中存在BB、B+和+ + 3种基因型,其频率分别为1.97%、73.40%和24.63%,其平均胎产羔数分别为2.69、1.91、1.57只,后代比例符合孟德尔分离定律,个体中增加一个拷贝的B等位基因(FecB突变)可使胎产羔数增加0.44只,以B等位基因为分子标记,经6个世代选育可使寒泊羊种群基本达到胎产羔数2只的育种目标。本研究结果为绵羊育种实践中制定选种和选配方案提供了理论基础。
| [1] | DAVIS G H, MONTGOMERY G W, ALLISON A J, et al. Segregation of a major gene influencing fecundity in progeny of Booroola sheep[J]. N Z J Agric Res, 1982, 25(4): 525–529. DOI: 10.1080/00288233.1982.10425216 |
| [2] | MONTGOMERY G W, CRAWFORD A M, PENTY J M, et al. The ovine Booroola fecundity gene (FecB) is linked to markers from a region of human chromosome 4q[J]. Nat Genet, 1993, 4(4): 410–414. DOI: 10.1038/ng0893-410 |
| [3] | MULSANT P, LECERF F, FABRE S, et al. Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Merino ewes[J]. Proc Natl Acad Sci U S A, 2001, 98(9): 5104–5109. DOI: 10.1073/pnas.091577598 |
| [4] | EL-SEEDY A S, HASHEM N M, EL-AZRAK K M, et al. Genetic screening of FecB, FecXG and FecXI mutations and their linkage with litter size in Barki and Rahmani sheep breeds[J]. Reprod Domest Anim, 2017, 52(6): 1133–1137. DOI: 10.1111/rda.13002 |
| [5] | WANG W M, LIU S J, LI F D, et al. Polymorphisms of the ovine BMPR-IB, BMP-15 and FSHR and their associations with litter size in two Chinese indigenous sheep breeds[J]. Int J Mol Sci, 2015, 16(5): 11385–11397. |
| [6] | DAVIS G H, BALAKRISHNAN L, ROSS I K, et al. Investigation of the Booroola (FecB) and Inverdale (FecXI) mutations in 21 prolific breeds and strains of sheep sampled in 13 countries[J]. Anim Reprod Sci, 2006, 92(1-2): 87–96. DOI: 10.1016/j.anireprosci.2005.06.001 |
| [7] |
杨宇泽, 冯涛, 储明星, 等. 小尾寒羊BMPR-IB基因FecB突变与产羔数和生长发育关系的研究[J]. 华北农学报, 2012, 27(5): 38–43.
YANG Y Z, FENG T, CHU M X, et al. FecB mutation of BMPR-IB gene and its association with litter size and growth traits in small tailed han sheep[J]. Acta Agriculturae Boreali-Sinica, 2012, 27(5): 38–43. DOI: 10.3969/j.issn.1000-7091.2012.05.009 (in Chinese) |
| [8] |
王根林, 毛鑫智, DAVISG H, 等. DNA分析发现我国湖羊和小尾寒羊存在Booroola(FecB)多胎基因[J]. 南京农业大学学报, 2003, 26(1): 104–106.
WANG G L, MAO X Z, DAVIS G H, et al. DNA tests in Hu sheep and Han sheep (small tail) showed the existence of Booroola (FecB) mutation[J]. Journal of Nanjing Agricultural University, 2003, 26(1): 104–106. (in Chinese) |
| [9] | WANG W M, LA Y F, ZHOU X, et al. The genetic polymorphisms of TGFβ superfamily genes are associated with litter size in a Chinese indigenous sheep breed (Hu sheep)[J]. Anim Reprod Sci, 2018, 189: 19–29. DOI: 10.1016/j.anireprosci.2017.12.003 |
| [10] |
于佐卿.杂种绵羊繁殖与生长性状的DNA分子标记研究[D].北京: 中国农业科学院, 2008.
YU Z Q.Study on DNA molecular markers and its related on prolificacy and weight in crossbreed sheep[D].Beijing: Chinese Academy of Agricultural Sciences, 2008.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1422006 |
| [11] | WILSON T, WU X Y, JUENGEL J L, et al. Highly prolific Booroola sheep have a mutation in the intracellular kinase domain of bone morphogenetic protein IB receptor (ALK-6) that is expressed in both oocytes and granulosa cells[J]. Biol Reprod, 2001, 64(4): 1225–1235. DOI: 10.1095/biolreprod64.4.1225 |
| [12] |
史洪才, 冯利君, 白杰, 等. 策勒黑羊FecB突变与卵泡发育相关基因的表达水平[J]. 江苏农业学报, 2013, 29(4): 807–811.
SHI H C, FENG L J, BAI J, et al. mRNA expression level of ovarian follicular developmental related genes and FecB mutation genotype in Qira Black sheep[J]. Jiangsu Journal of Agricultural Sciences, 2013, 29(4): 807–811. DOI: 10.3969/j.issn.1000-4440.2013.04.020 (in Chinese) |
| [13] | GOYAL S, AGGARWAL J, DUBEY P K, et al. Expression analysis of genes associated with prolificacy in FecB carrier and noncarrier Indian sheep[J]. Anim Biotechnol, 2017, 28(3): 220–227. DOI: 10.1080/10495398.2016.1262869 |
| [14] | PIERRE A, PISSELET C, DUPONT J, et al. Molecular basis of bone morphogenetic protein-4 inhibitory action on progesterone secretion by ovine granulosa cells[J]. J Mol Endocrinol, 2004, 33(3): 805–817. DOI: 10.1677/jme.1.01545 |
| [15] | FABRE S, PIERRE A, PISSELET C, et al. The Booroola mutation in sheep is associated with an alteration of the bone morphogenetic protein receptor-IB functionality[J]. J Endocrinol, 2003, 177(3): 435–444. DOI: 10.1677/joe.0.1770435 |
| [16] | KLATTE-SCHULZ F, GIESE G, DIFFER C, et al. An investigation of BMP-7 mediated alterations to BMP signalling components in human tenocyte-like cells[J]. Sci Rep, 2016, 6: 29703. DOI: 10.1038/srep29703 |
| [17] | KLAMMERT U, MUELLER T D, HELLMANN T V, et al. GDF-5 can act as a context-dependent BMP-2 antagonist[J]. BMC Biology, 2015, 13(1): 77. DOI: 10.1186/s12915-015-0183-8 |
| [18] |
陶林, 郭晓飞, 文禹粱, 等. FecB突变对小尾寒羊卵泡发育及AMH和AMHR2基因表达的影响[J]. 农业生物技术学报, 2019, 27(4): 684–691.
TAO L, GUO X F, WEN Y L, et al. Effects of FecB mutation on follicular development and expression of AMH and AMHR2 genes in small tail han sheep (Ovis aries)[J]. Journal of Agricultural Biotechnology, 2019, 27(4): 684–691. (in Chinese) |
| [19] | SOUZA C J H, CAMPBELL B K, WEBB R, et al. Secretion of inhibin A and follicular dynamics throughout the estrous cycle in the sheep with and without the Booroola gene(FecB)[J]. Endocrinology, 1997, 138(12): 5333–5340. DOI: 10.1210/endo.138.12.5627 |
| [20] | MIAO X Y, LUO Q M, ZHAO H J, et al. Ovarian proteomic study reveals the possible molecular mechanism for hyperprolificacy of Small Tail Han sheep[J]. Sci Rep, 2016, 6: 27606. DOI: 10.1038/srep27606 |
| [21] | TANG J S, HU W P, CHEN S, et al. The genetic mechanism of high prolificacy in Small tail han sheep by comparative proteomics of ovaries in the follicular and luteal stages[J]. J Proteomics, 2019, 204: 103394. DOI: 10.1016/j.jprot.2019.103394 |
| [22] | LA Y F, TANG J S, GUO X F, et al. Proteomic analysis of sheep uterus reveals its role in prolificacy[J]. J Proteomics, 2020, 210: 103526. DOI: 10.1016/j.jprot.2019.103526 |
| [23] | GUO X F, WANG X Y, DI R, et al. Metabolic effects of FecB gene on follicular fluid and ovarian vein serum in sheep (Ovis aries)[J]. Int J Mol Sci, 2018, 19(2): 539. DOI: 10.3390/ijms19020539 |
| [24] |
郭晓飞.FecB基因影响小尾寒羊繁殖力的分子机制研究[D].北京: 中国农业大学, 2018.
GUO X F.Study on molecular mechanism of FecB gene for fecundity in Small tail han sheep[D].Beijing: China Agricultural University, 2018.(in Chinese) |
| [25] | ESTIENNE A, PIERRE A, DI CLEMENTE N, et al. Anti-Müllerian hormone regulation by the bone morphogenetic proteins in the sheep ovary:deciphering a direct regulatory pathway[J]. Endocrinology, 2015, 156(1): 301–313. |
| [26] |
于嘉瑞, 王翔宇, 郭晓飞, 等. LEPR及LEP基因表达量对FecB不同基因型小尾寒羊产羔数的影响[J]. 畜牧兽医学报, 2018, 49(5): 954–961.
YU J R, WANG X Y, GUO X F, et al. Effects of expression of LEPR and LEP genes on litter size of Small tail han sheep with different FecB genotypes[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 954–961. (in Chinese) |
| [27] | JUENGEL J L, FRENCH M C, O'CONNELL A R, et al. Mutations in the leptin receptor gene associated with delayed onset of puberty are also associated with decreased ovulation and lambing rates in prolific Davisdale sheep[J]. Reprod Fertil Dev, 2016, 28(9): 1318–1325. DOI: 10.1071/RD14382 |
| [28] | MIAO X Y, LUO Q M, ZHAO H J, et al. Co-expression analysis and identification of fecundity-related long non-coding RNAs in sheep ovaries[J]. Sci Rep, 2016, 6: 39398. DOI: 10.1038/srep39398 |
| [29] | BAHIRE S V, RAJPUT P K, KUMAR V, et al. Quantitative expression of mRNA encoding BMP/SMAD signalling genes in the ovaries of Booroola carrier and non-carrier GMM sheep[J]. Reprod Domest Anim, 2019, 54(10): 1375–1383. DOI: 10.1111/rda.13535 |
| [30] | ZHENG J, WANG Z B, YANG H, et al. Pituitary transcriptomic study reveals the differential regulation of lncRNAs and mRNAs related to prolificacy in different FecB genotyping sheep[J]. Genes (Basel), 2019, 10(2): 157. DOI: 10.3390/genes10020157 |
| [31] |
敦伟涛, 陈晓勇, 田树军, 等. 杜泊绵羊与小尾寒羊杂交自群繁育后代生产性能研究[J]. 华北农学报, 2011, 26(S1): 48–51.
DUN W T, CHEN X Y, TIAN S J, et al. Study on performance of inter-mating breed offspring from small tail han sheep associated with dorper[J]. Acta Agriculturae Boreali-Sinica, 2011, 26(S1): 48–51. (in Chinese) |
| [32] |
张沅.
家畜育种学[M]. 北京: 中国农业出版社, 2001.
ZHANG Y. Animal breeding[M]. Beijing: China Agriculture Press, 2001. (in Chinese) |
| [33] | SEJIAN V, MAURYA V P, PRINCE L L L, et al. Effect of FecB status on the allometric measurements and reproductive performance of Garole×Malpura ewes under hot semi-arid environment[J]. Trop Anim Health Prod, 2015, 47(6): 1089–1093. DOI: 10.1007/s11250-015-0831-6 |
| [34] | GOOTWINE E, ROZOV A, BOR A, et al. Carrying the FecB (Booroola) mutation is associated with lower birth weight and slower post-weaning growth rate for lambs, as well as a lighter mature bodyweight for ewes[J]. Reprod Fertil Dev, 2006, 18(4): 433–437. DOI: 10.1071/RD05134 |
| [35] | KUMAR S, MISHRA A K, KOLTE A P, et al. Effects of the Booroola (FecB) genotypes on growth performance, ewe's productivity efficiency and litter size in Garole×Malpura sheep[J]. Anim Reprod Sci, 2008, 105(3-4): 319–331. DOI: 10.1016/j.anireprosci.2007.03.012 |
| [36] | MISHRA A K, ARORA A L, KUMAR S, et al. Studies on effect of Booroola (FecB) genotype on lifetime ewes' productivity efficiency, litter size and number of weaned lambs in Garole×Malpura sheep[J]. Anim Reprod Sci, 2009, 113(1-4): 293–298. DOI: 10.1016/j.anireprosci.2008.06.002 |
| [37] | QI M Y, XU L Q, ZHANG Z N, et al. Effect of the Booroola fecundity (FecB) gene on the reproductive performance of ewes under assisted reproduction[J]. Theriogenology, 2020, 142: 246–250. DOI: 10.1016/j.theriogenology.2019.10.038 |
| [38] |
周梅, 曹晓涵, 贺小云, 等. 绵羊FGF 7基因组织表达及其多态性与产羔数之间的关系[J]. 畜牧兽医学报, 2018, 49(3): 525–533.
ZHOU M, CAO X H, HE X Y, et al. Tissue expression and polymorphism of sheep FGF 7 gene and their association with litter size[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(3): 525–533. (in Chinese) |
| [39] | HUA G H, YANG L G. A review of research progress of FecB gene in Chinese breeds of sheep[J]. Anim Reprod Sci, 2009, 116(1-2): 1–9. DOI: 10.1016/j.anireprosci.2009.01.001 |
| [40] |
曹钻, 张银霞, 袁志发, 等. 选择效率世代指数研究[J]. 西北农林科技大学学报:自然科学版, 2009, 37(8): 217–220.
CAO Z, ZHANG Y X, YUAN Z F, et al. Research on the generation index of selection efficiency[J]. Journal of Northwest A & F University:Natural Science Edition, 2009, 37(8): 217–220. (in Chinese) |



