在24 h的昼夜周期中,一切生命活动随着温度和光等环境的变化发生周而复始的变化。大多数生物进化出了内源性昼夜节律的生物钟来适应这些环境变化[1]。在哺乳动物中,生殖系统会显示有规律的活化和失活周期,这些周期与外界环境因素(如季节或昼夜)同步,其中,光照强度和持续时间对其影响最大。因此,大多数物种一年四季都在调整它们的繁殖活动,以确保后代的出生和断奶发生在最佳时机[2]。季节性发情本质上属于哺乳动物的年节律循环,FBXL3通过形成SCF复合物行使E3泛素连接酶功能,使CRY蛋白降解进而参与生物钟调控,且该基因的点突变能够显著延长小鼠节律,而FBXL21基因则使CRY蛋白积累,显示出与FBXL3的拮抗作用。因此,阐明FBXL3、FBXL21这两个生物钟基因对于生物节律这一作用机制的完善、季节性繁殖动物繁殖力的提高具有重要意义。因此,本文以生物节律为切入点,从FBXL家族的结构、功能出发,进一步阐释了FBXL3和FBXL21基因在生物节律中的调控作用。
1 生物节律以及生物钟组成生物体内调节生物节律的机器,连同体内控制发育及衰老的时间机器,被称为生物时钟,简称生物钟(biological clocks)。生物钟是一种自我维持的内源性振荡器,在每个细胞中驱动着新陈代谢和生理的日常周期[3]。生物钟存在于人体的几乎所有细胞中,其在细胞功能(包括新陈代谢)中产生节律,使生物过程24 h与环境保持一致[4]。这种受生物体内在机制调控,在时间上以特定周期重复的行为和生理活动称为生物节律(biological rhythm)。地球上的生命表现出各种有规律的振荡过程,每一个都可以称为生物节律。生物节律可能是由环境周期引起的,也可能是由内源性定时装置产生的[5]。生物钟在许多生物过程中起着至关重要的作用,如睡眠-觉醒周期[6]、激素分泌[7]、心血管健康、癌症的治疗[8-9]、葡萄糖稳态以及体温调节等[10]。
生物节律按照周期形式主要可以分为两种循环方式:年节律循环(circannual rhythm)和昼夜节律循环(circadian rhythm)[11],哺乳动物生理学的许多方面表现出的日循环模式,称为昼夜节律[12]。昼夜节律包括睡眠觉醒周期[13]、血压的变化等很多生理活动[14-15];年节律包括植物的发芽、开花、结果等现象。年节律循环虽不如昼夜节律研究深入,但是它们与生理行为(如候鸟的迁徙、羊的季节性繁殖)联系更加紧密。
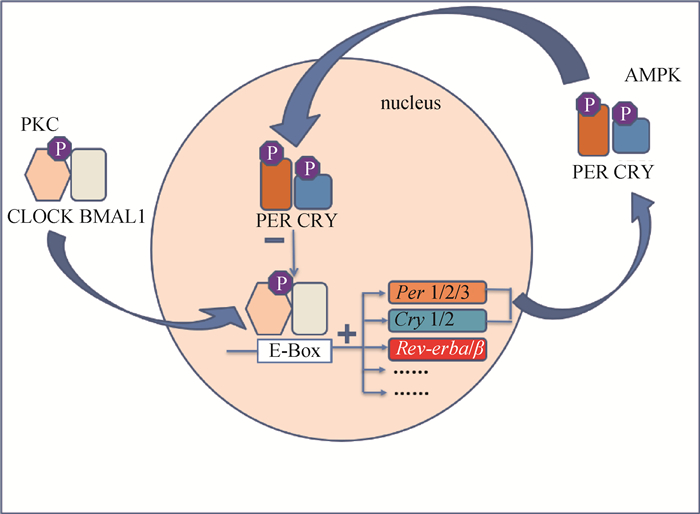
哺乳动物的生物钟有两层含义:一层是几乎每个细胞都存在一套自主的分子振荡器;一层是这些细胞组成的器官组织及细胞自身的生物钟之间以层次化网络的形式来发挥作用。生物钟系统分布于大脑的视交叉上核(suprachiasmatic nucleus, SCN)周围器官以及局部起搏器上,通过转录/翻译后由负反馈调节方式来调控昼夜节律,在该循环中,周期(Per)和隐花色素(Cry)基因被其蛋白产物负向调控[16]。在SCN中,这种细胞自主起搏器的稳定是通过神经元间的耦合来实现的[17-19]。最核心的生物钟定位于动物下丘脑中的视交叉上核,核心生物钟自身与每日昼夜循环产生的外部信号同步,并且将信号传递给其他多个存在特异性自主生物钟的组织。而不同组织内自主生物钟的基本调控方式类似,首先,节律活动需要受到振荡器的牵引,振荡器是由一系列基因构成的转录-翻译反馈环路所维持的,这一环路中至少包含了10种基因,统称为钟基因。钟基因Clock(circadian locomotor output cycles kaput)和Bmal1(brain and muscle arnt-like 1)分别编码含有bHLH-PAS蛋白结构域的相应蛋白。这两个基因组成反馈环路的正调控分支,其蛋白形成CLOCK/BMAL1异源二聚体,该异源二聚体通过结合含E-boxes和E′-boxes等结构域的特殊DNA元件来启动钟基因的转录。同时,在负反馈循环通路中也包括了一系列负调控基因,分别是周期(Period)基因家族(Per1、Per2和Per3)、隐花色素(Cry)基因(Cry1和Cry2)以及Rev-Erbα基因[20]等。CRY蛋白在哺乳动物生物钟的核心执行功能不依赖于光照,而为了驱动时钟振荡,CRYs与PERs蛋白结合,共同抑制自身基因的转录[21-22]。当细胞质中PER1和PER2的浓度增加,PER和CRY(CRY1和CRY2)便组成复合体[23],并逐渐被PER激酶磷酸化,转移至细胞核并在其中累积,随后直接作用于CLOCK/BMAL1异源二聚体,抑制PER和CYR转录[24],而后它们会被降解,又开始转录,形成下一轮循环的开始(图 1)。这样一个循环所需要的时间即为一个生物钟周期,约24 h。这种分子机制是建立在相互连接的转录和翻译反馈回路的基础上[3]。
|
哺乳动物生物钟的核心由转录和翻译负反馈环组成,其中转录因子CLOCK和BMAL1异二聚并促进自身抑制因子CRY1、CRY2及Per1~Per3的表达。当转录因子CLOCK和BMAL1异二聚体进入细胞核,并通过与启动子中的一个E-box结合,驱动Per1、Per2、Per3和隐花色素基因(Cry1、Cry2)的转录时,这个过程就开始了。这些蛋白质翻译后,形成一个复杂蛋白激酶,然后进入细胞核,抑制自己的转录。这一转录反馈循环需要24 h才能完成 The core of mammalian biological clock is composed of transcription and translation negative feedback loops, in which transcription factors clock and BMAL1 heterodimerization promote the expression of autoinhibitory factors CRY1 and CRY2 and Per1-Per3. This process begins when transcription factors CLOCK and BMAL1 heterodimers enter the nucleus and drive the transcription of Per1, Per2, Per3, and cryptochrome genes (Cry1, Cry2) by binding to an E-box in the promoter. These proteins translate into a complex protein kinase, which then enters the nucleus and inhibits its own transcription. This transcriptional feedback loop takes 24 h to complete 图 1 哺乳类生物钟部分反馈环的简单示例[25] Fig. 1 A simple example of a partial feedback loop of the mammalian biological clock[25] |
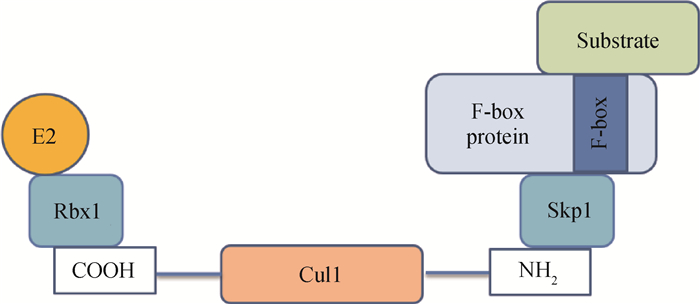
FBXL家族的基因编码含有F-box和LRR结构的蛋白,共包含FBXL1~FBXL22(9除外)共21种蛋白,但成员之间序列同源性很低,各自起着截然不同的生物学作用,因此它们被称为孤儿蛋白。F-box由十几个氨基酸序列组成,介导与SKP1蛋白的结合,进而结合CUL1和RBX1形成SKP1-CUL1-F-box(SCF)复合物[26](图 2)。SCF复合物是泛素途径的一类重要的E3连接酶,E3泛素连接酶(E3)在分子和细胞机制中发挥着重要作用[27]。但对于FBXL家族来说,并非所有成员都具备E3连接酶的功能[28]。
|
每个SCF复合物由4个亚基组成,分别是Skp1、Cul1、Rbx1和F-box protein。Cul1作为支架,通过其COOH末端与Rbx1相互作用连接E2连接酶,还通过其NH2末端与Skp1相互作用。F-box蛋白Skp1和Cul1相互作用,负责底物识别 The complex of SCF consists of 4 subunits: Skp1, Cul1, Rbx1, and F-box protein. As a scaffold, Cul1 interacts with Rbx1 via its COOH terminal to connect E2 ligase and it interacts with Skp1 via its NH2 terminal. The F-box protein Skp1 interacts with Cul1 and is responsible for substrate recognition 图 2 SCF复合物结构图简单示例[29] Fig. 2 Simple example of SCF complex structure diagram[29] |
F-box富含亮氨酸重复蛋白3(F-box and leucinerich repeat protein 3,FBXL3)属于F-box蛋白家族成员,编码构成SKP1-CUL1-F-box泛素连接酶复合物(SCF)中四亚基之一的F-box结构域,其特征在于介导蛋白互作的40个成员,以及用于底物识别的几个串联富含亮氨酸的重复序列。它有8个涉及泛素化的翻译后修饰位点和4个涉及磷酸化的位点。FBXL3基因能够通过形成SCF复合物行使E3泛素连接酶功能参与生物钟调控,并且FBXL3蛋白参与负反馈环,通过促进CRY1和CRY2蛋白降解过程,进而影响哺乳动物的昼夜节律[30]。
FBXL3基因功能在2007年相继被鉴定出来[31-33]。Siepka等[32]使用N-乙基-N-亚硝基脲(ENU)为化学诱变剂,通过正向遗传学方法筛选获得不同昼夜节律活性的小鼠,发现了FBXL3基因的Overtime(Ovtm)突变体。具有Ovtm纯合突变的小鼠具有26 h的周期节律。通过克隆定位和基因互补试验发现,Ovtm突变发生在FBXL3编码区内,该蛋白是SCF-E3泛素连接酶复合物组成部分之一。FBXL3发生Ovtm突变后,结合CRY区域中的异亮氨酸被苏氨酸取代引起蛋白功能丧失,在具有这种突变的小鼠中,PER1和PER2蛋白的水平降低,但CRY蛋白的水平与野生型小鼠的水平没有差异,从而导致PER1和PER2被持续抑制。
Godinho等[33]通过诱变小鼠的跑轮结果发现了FBXL3Afh(After-hours)突变。该突变是FBXL3基因的A>T转化突变,F-box蛋白中第358位的丝氨酸Ser被半胱氨酸Cys代替,Godinho等[33]分别将野生型FBXL3或突变型FBXL3Afh蛋白共转染到用CHX处理的COS7细胞中,观察被标记的Cry2降解率。发现转染FBXL3Afh的细胞中Cry2的降解有明显的延迟,FBXL3Afh突变小鼠其昼夜节律中转录和翻译功能均减弱。2017年,Maggi等[34]对(FBXL3Afh)突变小鼠进行研究,发现它们表现出昼夜节律周期的延长。FBXL3Afh突变小鼠对光照表现出异常反应,这种对光的特殊敏感性则影响了它们的生物钟系统,进而影响小鼠的行为,并且发现在纯合突变体中,其他核心时钟元件基因的表达也发生了改变(如PER2)。FBXL3作为CRY蛋白的基本调控因子,也已经通过对另一种突变小鼠模型(Overtime21)研究得到证实。
经研究发现,FBXL3基因影响人睡眠周期,而不规律的睡眠周期会导致患者发育迟缓,表现智力低下、身材矮小[35]。FBXL3基因的突变除了对哺乳动物的生物钟产生影响,还是一种人类恶性肿瘤中的潜在肿瘤抑制因子,2019年2月,Wang等[8]检测到FBXL3在非小细胞肺癌(NSCLC)中的作用,FBXL3在调节NSCLC细胞增殖和迁移中发挥作用,并且FBXL3在NSCLC组织和细胞系中的表达水平较低。研究者们通过过表达FBXL3,发现NSCLC细胞增殖、迁移等过程被抑制。最终结果表明,FBXL3受miR-4735-3p调控,并在NSCLC中起肿瘤抑制作用。
2.2 FBXL21基因的生物学功能F-box富含亮氨酸重复蛋白21(F-box and leucine rich repeat protein 21,FBXL21)属于F-box蛋白家族成员,是FBXL3的同源基因,位于小鼠第13号染色体上,该基因序列与FBXL3序列有84%的相似性,主要在细胞质中发挥功能。FBXL21基因功能由PAR-bZIP家族成员驱动,在生物钟的核心视交叉上核内高度表达。该基因是一个新的生物钟控制基因,在哺乳动物的生物钟起搏器中起着特殊的作用[36]。
目前,关于FBXL21基因的生物功能的研究相对较少,2013年,Hirano等[36]通过分别监测FBXL21和FBXL3敲除小鼠的跑轮活动发现,FBXL21敲除小鼠出现了更短周期的行为活动,而FBXL3敲除小鼠则表现为更长周期的行为活动。两个基因对于CRY蛋白水平具有拮抗作用,FBXL21减慢生物钟振荡频率,FBXL3则加速生物钟振荡频率,FBXL21与FBXL3共同作用才能使哺乳动物的生物周期保持稳态。
2008年,在弗吉尼亚联邦大学弗吉尼亚精神病和行为遗传学研究所的一项研究中[37],募集了来自爱尔兰273个家庭的1 350名精神分裂症受试者,采集血样,进行基因分型和单倍型分析、表达分析等一系列试验,结果表明,FBXL21及其附近的基因仅在成年人(17岁及以上)的大脑和肾脏中表达,与该试验样本中的精神分裂症显著相关。
2.3 FBXL其他亚型基因的结构及其生物学功能目前,研究的FBXL家族的基因有6个,每个基因的序列都不尽相同。除了FBXL21与FBXL3有着较高的同源性,还有FBXL4、FBXL5、FBXL13、FBXL20基因。几乎每个基因都与不同的癌症或者是葡萄糖的稳态有着千丝万缕的联系。FBXL4基因主要存在于人的第6号染色体上,2017年,Li等[38]通过获得FBXL4缺失突变体小鼠表明,FBXL4的表达依赖于生物钟的调控,进而该基因有节奏地下调GABAA受体,以促进觉醒。FBXL5基因主要存在于细胞核,位于鸡的第4号染色体上,Ruiz和Bruick[39]在2014年首先确定FBXL5属于F-box家族成员,中间含有典型的F-box结构域。在哺乳动物中充当代谢传感器的作用。FBXL5蛋白具有跟血红蛋白相似的铁结合区域,能够对细胞内铁的水平做出相应的反应。因此,FBXL5基因在维持细胞铁稳态方面起着至关重要的作用[40]。2014年,Chen等[41]发现,FBXL5基因在肺癌中表现癌基因作用,该基因的高表达会助长肺癌的发生和发展。FBXL13基因定位于人的第7号染色体上,Fung等[42]研究发现,该基因在细胞中心体处富集,中心体的重叠以及中心体微管的去中心体化已被证明能够引起致癌畸变,FBXL13过表达会降低细胞在完全解聚后再生中心体微管的能力,从而证明FBXL13的表达上调是致癌的。FBXL20位于人的第17号染色体上,属于F-box家族的一个新成员。目前,有研究者证实,FBXL20是一个致癌基因,抑制该基因的表达可以抑制结肠癌细胞的增殖、迁移和侵袭[43]。2018年,张博瀚和吴庆琛[44]发现,FBXL20可能通过调控ERK1/2蛋白的磷酸化影响细胞周期从而发挥作用,对人非小细胞肺癌A549细胞生长产生抑制作用。
3 FBXL家族在生物节律调控中的研究进展如前所述,自主生物钟振荡器的转录-翻译反馈环路的维持,需要PER和CRY作用于CLOCK/BMAL1异源二聚体,抑制它们的转录。抑制后,PER和CRY蛋白发生降解,之后新的转录开始,进行下一轮循环,降解和新循环开始之间的反馈回路有一定延滞,所以整个生物钟周期约为24 h。其中PER和CRY蛋白的翻译后修饰非常重要,因为这些蛋白降解的时长会相应影响生物钟周期。基于这一负反馈系统,生物钟系统再通过控制钟基因调控哺乳动物的动作行为及生理活动。
3.1 FBXL3在节律中的作用继2007年研究者们相继报道获得了小鼠FBXL3突变体后[33, 31, 45],2013年,不同研究者又分别获得了FBXL3敲除小鼠[35, 46-47]。目前,已经证实,FBXL3蛋白可以形成SCF复合物,这个SCF识别的底物为钟基因CRY1和CRY2,它们通过泛素化修饰被降解,FBXL3对其稳定性起重要作用[48]。2007年Busino等[31]研究发现,FBXL3通过调控CRY蛋白的降解来控制生物钟周期的运行。同年,Godinho等[33]揭示了FBXL3Afh突变对哺乳动物生理周期的影响,After-hours突变发生在FBXL3结合CRY的结构域,突变延迟了CRY蛋白降解的速度,进而影响了PER2蛋白的转录[30, 49],FBXL3Afh突变纯合的小鼠具有约27 h的自由活动时间。Siepka等[45]报道,Overtime的FBXL3突变证明该蛋白具有调控CRY和PER基因表达的作用。2013年,研究发现,FBXL3能够调节E-box驱动基因表达的幅度[46]。总而言之,FBXL3敲除或突变后,与底物的结合能力或自身的稳定性下降导致其对底物泛素化能力下降,引起CRY蛋白降解出现滞后,当其出现异常积累时,钟基因的转录就会被抑制[47],完成降解的时间也会相应延长,自然生物钟的周期就会延长。
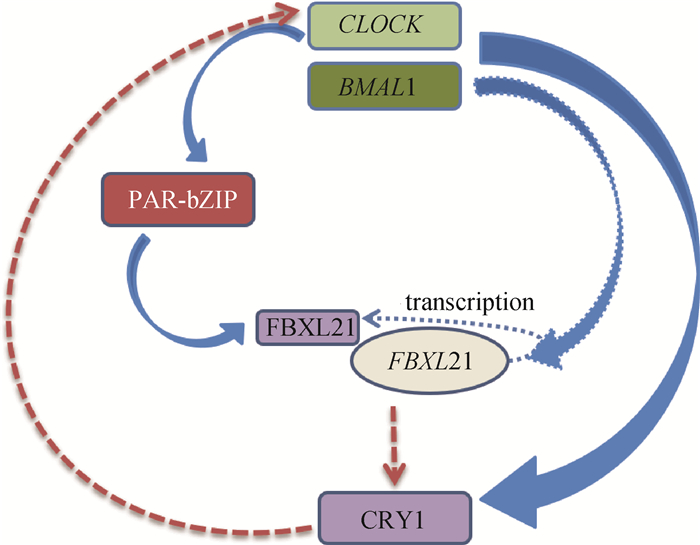
3.2 FBXL21在节律中的作用2008年,Dardente等[50]研究并验证了FBXL3在绵羊中功能的保守性,进一步揭示与FBXL3的同源性最高的FBXL21也与CRY1结合,从而削弱了FBXL3对转录激活因子CLOCK/BMAL1的抑制作用。FBXL21在组织之间的表达水平比FBXL3高,在腺垂体、下丘脑和松果体(所有与生物钟和体内平衡有关的神经内分泌结构)中表达最高。对于FBXL3和FBXL21,他们还发现了新的可变剪接体,并揭示了两个基因的生物功能,而这些变异会减少CRY1蛋白酶的降解。诸多研究结果表明,FBXL21是一个新的生物钟基因,在哺乳动物的生物钟起搏器中起着特殊的作用(图 3)。2013年,Hirano等[36]在《Cell》发表的研究成果中提到,FBXL21与FBXL3的作用拮抗,在哺乳动物的生物钟中,CRY1和CRY2阻遏蛋白通过翻译后修饰来调控钟基因的转录。研究发现,FBXL3通过泛素化使CRY降解。Hirano等[36]发现,FBXL21也泛素化CRY,但作用与FBXL3相反。FBXL21基因的敲除或变异会扰乱哺乳动物生物钟的平衡,FBXL3和FBXL21对CRY蛋白的拮抗作用对于哺乳动物昼夜节律生物钟的稳定至关重要。
|
CLOCK/BMAL1的转录控制(蓝色箭头)CRY1和PAR-bZIP的表达,对FBXL21的影响较小(蓝色虚线箭头)。PAR-bZIP蛋白控制FBXL21的转录,FBXL21蛋白抑制CRY1(红色虚线箭头)的降解,因此,FBXL21在CRY1介导的CLOCK/BMAL1转录抑制(红色虚线箭头)中起着关键作用 Transcription of CLOCK/BMAL1 (blue arrow) regulate the expression of CRY1 and PAR-bZIP and have less effect on FBXL21 (blue dotted arrow). PAR-bZIP protein regulates the transcription of FBXL21, FBXL21 inhibits CRY1 (red dotted arrow) degradation, so FBXL21 plays a key role in CRY1-mediated CLOCK/BMAL1 transcription inhibition (red dotted arrow) 图 3 FBXL21在哺乳动物生物钟中的功能模型图 Fig. 3 Functional model of FBXL21 in mammalian biological clock |
季节性发情是制约动物生产效率的重要因素。深入分析季节性发情的调控机制是提高动物非发情季节配种率的前提。由于发情性状研究困难,多年来,科学家并未鉴定出任何真正的发情性状主效基因。研究者们根据前面所述光照调控的级联通路,对部分候选基因从遗传和分子水平进行了探索,包括褪黑激素受体1A(MTNR1A)[51-52]、褪黑激素受体1B(MTNR1B)、促甲状腺激素β(TSHB)[53]、二型脱碘酶(DIO2)和三型脱碘酶(DIO3)[54]、Kiss1、G蛋白偶联受体54(GPR54)、芳基烷基胺-N-乙酰转移酶(AA-NAT)、RFamide相关肽(RFRP),又如钟基因(Bmal1、Clock、Per1、Per2、Npas2、Cry1和Cry2等)[55]、促性腺激素抑制激素(GnIH)[56]等。目前,钟基因在农业动物上的研究相对较少,2019年10月,陈健楠等[57]研究了钟基因CRY1在雄性牦牛生殖轴中的表达与分布,结果表明,CRY1基因在下丘脑、垂体、睾丸和松果体中均有表达,但在松果体中表达量最高,显著高于其他组织。推测CRY1基因在牦牛的繁殖过程中起着重要作用。2018年,Naval-Sanchez等[58]通过对43个驯养绵羊品种和17个野生亚洲摩弗伦祖先品种进行全基因组重测序,发现位于绵羊10号染色体的FBXL3基因52551820(Oar4.0)位点在驯养绵羊中受到强烈选择、突变为A,所以,此突变很可能与绵羊季节性发情性状相关。大多数绵羊品种为季节性发情品种,一般在秋季白昼变短时繁殖[59]。绵羊全年发情,每年可交配两次,可大大提高经济效益,季节性繁殖性状严重制约了绵羊生产力与繁殖力,为了在遗传水平上改变季节发情,培育新的绵羊品种,了解绵羊季节繁殖性状的分子机制是十分重要的[60]。
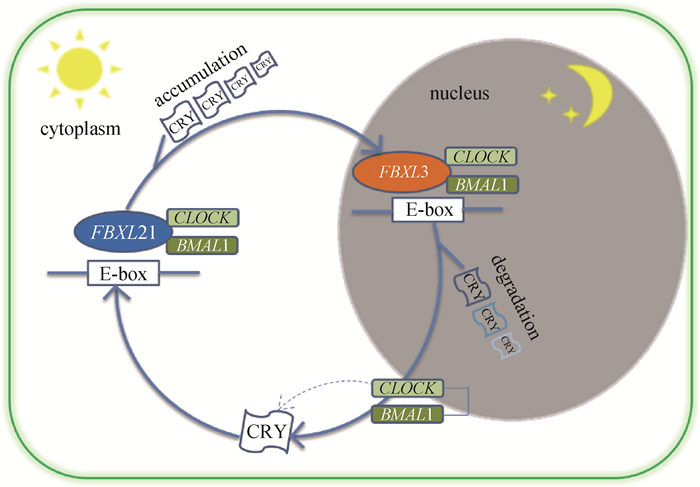
研究者发现,FBXL3能与CRY2共同作用降解c-MYC(细胞增殖的重要调控因子),这一现象把分子钟调控与癌症联系起来[61]。FBXL21是与FBXL3最接近的直系同源基因,其也能结合CRY1和CRY2蛋白,但发挥的作用却与FBXL3基因相反。FBXL21主要在胞质内通过泛素化和CRY蛋白的稳定化来拮抗FBXL3的活动,而非导致其降解。FBXL21主要在视交叉上核表达,而视交叉上核是哺乳动物大脑中的主起搏器。Hirano等[36]在小鼠中的研究发现,FBXL3定位于细胞核,FBXL21定位于细胞质;白天FBXL21蛋白能够帮助CRY蛋白在积累过程中保持稳定,而夜晚FBXL3蛋白泛素化CRY蛋白促进其降解;两者通过相互拮抗共同保持CRY蛋白的稳定,保证生物钟的周期循环(图 4)。
|
图 4 FBXL3与FBXL21参与生物钟调控示意图[35] Fig. 4 Schematic diagram of FBXL3 and FBXL21 participating in biological clock regulation[35] |
目前,关于FBXL3基因及其参与的分子生物钟相关研究,在绵羊中鲜有报道,Dardente等[50]报道了FBXL3和FBXL21基因在绵羊中的基本功能,他们发现绵羊中FBXL3功能保守,与小鼠中报道的类似,FBXL3能够结合CRY1对其进行泛素化降解。FBXL3基因广泛表达于绵羊各组织,但FBXL21特异高表达于脑部垂体前叶、下丘脑以及松果体等生物钟调控相关组织。本实验室在常年发情与季节性发情绵羊多个品种中进行了大群分型验证,发现常年发情绵羊中以突变型A存在,但在季节性发情绵羊中主要以野生型G为主(未发表)。前人研究以及本实验室数据结果暗示,FBXL3基因这一突变应该是外界环境对FBXL3基因进行正向选择的结果,此突变很可能已造成生物钟周期的改变,而且常年发情的绵羊品种中该突变频率非常高。
5 结论与展望综上,在哺乳动物生物钟系统中FBXL21与FBXL3基因对于CRYs蛋白的作用是拮抗的,具有F-box型E3连接酶功能的FBXL3泛素化CRY,并使其降解,FBXL21也泛素化CRY,但与FBXL3的作用相反。故FBXL21、FBXL3联合作用使哺乳动物的昼夜节律稳定。但是,这两个基因在绵羊发情性状中是否扮演重要角色还未见报道。因此,有理由猜想,是否FBXL3、FBXL21基因也已经参与到年节律循环调控中,该基因的点突变造成常年发情绵羊在春夏季节也能发情的表型。发现这些问题后,下一步就是寻找FBXL3或FBXL21基因受到选择发生突变后影响绵羊季节性发情性状的原因,探索其突变后影响绵羊季节性发情性状的分子机理,为利用现代生物技术改变绵羊发情的季节性提供新思路。
| [1] | ZHU B K, DACSO C C, O'MALLEY B W. Unveiling "Musica Universalis" of the cell:a brief history of biological 12-hour rhythms[J]. J Endocr Soc, 2018, 2(7): 727–752. DOI: 10.1210/js.2018-00113 |
| [2] | ANGELOPOULOU E, QUIGNON C, KRIEGSFELD L J, et al. Functional implications of RFRP-3 in the central control of daily and seasonal rhythms in reproduction[J]. Front Endocrinol, 2019, 10: 183. DOI: 10.3389/fendo.2019.00183 |
| [3] | ROBLES M S, HUMPHREY S J, MANN M. Phosphorylation is a central mechanism for circadian control of metabolism and physiology[J]. Cell Metab, 2017, 25(1): 118–127. DOI: 10.1016/j.cmet.2016.10.004 |
| [4] | BAEK M, VIRGILIO S, LAMB T M, et al. Circadian clock regulation of the glycogen synthase (gsn) gene by WCC is critical for rhythmic glycogen metabolism in Neurospora crassa[J]. Proc Natl Acad Sci U S A, 2019, 116(21): 10435–10440. DOI: 10.1073/pnas.1815360116 |
| [5] | REFINETTI R. Integration of biological clocks and rhythms[J]. Compr Physiol, 2012, 2(2): 1213–1239. DOI: 10.1002/cphy.c100088 |
| [6] | LORENZ N, SPADA J, SANDER C, et al. Circadian skin temperature rhythms, circadian activity rhythms and sleep in individuals with self-reported depressive symptoms[J]. J Psychiatr Res, 2019, 117: 38–44. |
| [7] | POGACH M, THOMAS R J. Challenging circadian rhythm disorder cases[J]. Neurol Clin, 2019, 37(3): 579–599. |
| [8] | WANG D Z, HAN X, LI C, et al. FBXL3 is regulated by miRNA-4735-3p and suppresses cell proliferation and migration in non-small cell lung cancer[J]. Pathol Res Pract, 2019, 215(2): 358–365. |
| [9] | NORTH B J, LIU Y Y, INUZUKA H, et al.The role of FBXL subfamily of F-box proteins in tumorigenesis[M]//INUZUKA H, WEI W Y.SCF and APC E3 Ubiquitin Ligases in Tumorigenesis.Cham: Springer, 2014: 47-71. |
| [10] | SERIN Y, ACAR TEK N. Effect of circadian rhythm on metabolic processes and the regulation of energy balance[J]. Ann Nutr Metab, 2019, 74(4): 322–330. DOI: 10.1159/000500071 |
| [11] | OREM J M. Rhythms of life:the biological clocks that control the daily lives of every living thing by Russell G Foster, Leon Kreitzman[J]. Quart Rev Biol, 2005, 80(2): 266–267. DOI: 10.2307/42991836 |
| [12] | HODGES E L, ASHPOLE N M. Aging circadian rhythms and cannabinoids[J]. Neurobiol Aging, 2019, 79: 110–118. DOI: 10.1016/j.neurobiolaging.2019.03.008 |
| [13] |
付聪, 于欢, 陈云飞. 昼夜节律系统与成人昼夜节律睡眠觉醒障碍[J]. 生理科学进展, 2019, 50(1): 35–40.
FU C, YU H, CHEN Y F. Circadian rhythm and adult circadian rhythm sleep-wake disorders[J]. Progress in Physiological Sciences, 2019, 50(1): 35–40. (in Chinese) |
| [14] | PENG H, ZHU Y, GOLDBERG J, et al. DNA methylation of five core circadian genes jointly contributes to glucose metabolism:a gene-set analysis in monozygotic twins[J]. Front Genet, 2019, 10: 329. DOI: 10.3389/fgene.2019.00329 |
| [15] |
马倩雯.生物节律的研究进展[J].重庆医学, 2019, 48(1):129-130. M Q W.
Research progress of biological rhythm[J].Chongqing Medicine, 2019, 48(1): 129-130.(in Chinese) |
| [16] | DALLA BENETTA E, BEUKEBOOM L W, VAN DE ZANDE L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis[J]. Am Nat, 2019, 193(6): 881–896. |
| [17] | MAYWOOD E S, CHESHAM J E, QING-JUN M, et al. Tuning the period of the mammalian circadian clock:additive and independent effects of CK1εTau and Fbxl3Afh mutations on mouse circadian behavior and molecular pacemaking[J]. J Neurosci, 2011, 31(4): 1539–1544. DOI: 10.1523/JNEUROSCI.4107-10.2011 |
| [18] | MAYWOOD E S, REDDY A B, WONG G K Y, et al. Synchronization and maintenance of timekeeping in suprachiasmatic circadian clock cells by neuropeptidergic signaling[J]. Curr Biol, 2006, 16(6): 599–605. DOI: 10.1016/j.cub.2006.02.023 |
| [19] | LIU A C, WELSH D K, KO C H, et al. Intercellular coupling confers robustness against mutations in the SCN circadian clock network[J]. Cell, 2007, 129(3): 605–616. DOI: 10.1016/j.cell.2007.02.047 |
| [20] | BUGGE A, FENG D, EVERETT L J, et al. Rev-erbα and Rev-erbβ coordinately protect the circadian clock and normal metabolic function[J]. Genes Dev, 2012, 26(7): 657–667. DOI: 10.1101/gad.186858.112 |
| [21] | XING W M, BUSINO L, HINDS T R, et al. SCFFBXL3 ubiquitin ligase targets cryptochromes at their cofactor pocket[J]. Nature, 2013, 496(7443): 64–68. |
| [22] |
占思远, 罗万伟, 程波, 等. 山羊clock和cry1基因的克隆及其在大脑和垂体中表达差异的研究[J]. 畜牧兽医学报, 2012, 43(11): 1716–1722.
ZAN S Y, LUO W W, CHENG B, et al. Molecular cloning and differential expression of clock and cry1 genes in goat brain and pituitary[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(11): 1716–1722. (in Chinese) |
| [23] | CORREIA S P, CHAN A B, VAUGHAN M, et al. The circadian E3 ligase complex SCFFBXL3+CRY targets TLK2[J]. Sci Rep, 2019, 9(1): 198. |
| [24] | CHEN R, SCHIRMER A, LEE Y, et al. Rhythmic PER abundance defines a critical nodal point for negative feedback within the circadian clock mechanism[J]. Mol Cell, 2009, 36(3): 417–430. DOI: 10.1016/j.molcel.2009.10.012 |
| [25] | BODEN M J, VARCOE T J, KENNAWAY D J. Circadian regulation of reproduction:from gamete to offspring[J]. Prog Biophys Mol Biol, 2013, 113(3): 387–397. DOI: 10.1016/j.pbiomolbio.2013.01.003 |
| [26] | YUMIMOTO K, MUNEOKA T, TSUBOI T, et al. Substrate binding promotes formation of the Skp1-Cul1-Fbxl3(SCFFbxl3) protein complex[J]. J Biol Chem, 2013, 288(45): 32766–32776. DOI: 10.1074/jbc.m113.511303 |
| [27] | CHEN D, LIU X L, XIA T, et al. A multidimensional characterization of E3 ubiquitin ligase and substrate interaction network[J]. iScience, 2019, 16: 177–191. |
| [28] | SHIROGANE T, JIN J P, ANG X L, et al. SCFβ-TRCP controls clock-dependent transcription via casein kinase 1-dependent degradation of the mammalian period-1(Per1) protein[J]. J Biol Chem, 2005, 280(29): 26863–26872. DOI: 10.1074/jbc.M502862200 |
| [29] |
时广森.FBXL3对近日节律作用机制的研究[D].南京: 南京大学, 2014.
SI G S.The roles of FBXL3 in regulating circadian clock[D].Nanjing: Nanjing University, 2014.(in Chinese) |
| [30] | HUBER A L, PAPP S, CHAN A, et al. CRY2 and FBXL3 cooperatively degrade c-MYC[J]. Mol Cell, 2016, 64(4): 774–789. |
| [31] | BUSINO L, BASSERMANN F, MAIOLICA A, et al. SCFFbxl3 controls the oscillation of the circadian clock by directing the degradation of cryptochrome proteins[J]. Science, 2007, 316(5826): 900–904. DOI: 10.1126/science.1141194 |
| [32] | SIEPKA S M, YOO S H, PARK J, et al. Genetics and neurobiology of circadian clocks in mammals[J]. Cold Spring Harb Symp Quant Biol, 2007, 72: 251–259. |
| [33] | GODINHO S I H, MAYWOOD E S, SHAW L, et al. The after-hours mutant reveals a role for Fbxl3 in determining mammalian circadian period[J]. Science, 2007, 316(5826): 897–900. |
| [34] | MAGGI S, BALZANI E, LASSI G, et al. The after-hours circadian mutant has reduced phenotypic plasticity in behaviors at multiple timescales and in sleep homeostasis[J]. Sci Rep, 2017, 7(1): 17765. DOI: 10.1038/s41598-017-18130-2 |
| [35] | ANSAR M, PARACHA S A, SERRETTI A, et al. Biallelic variants in FBXL3 cause intellectual disability, delayed motor development and short stature[J]. Hum Mol Genet, 2019, 28(6): 972–979. |
| [36] | HIRANO A, YUMIMOTO K, TSUNEMATSU R, et al. FBXL21 regulates oscillation of the circadian clock through ubiquitination and stabilization of cryptochromes[J]. Cell, 2013, 152(5): 1106–1118. |
| [37] | CHEN X N, WANG X, SUN C, et al. FBXL21 association with schizophrenia in Irish family and case-control samples[J]. Am J Med Genet B Neuropsychiatr Genet, 2008, 147B(7): 1231–1237. |
| [38] | LI Q, LI Y, WANG X, et al. Fbxl4 serves as a clock output molecule that regulates sleep through promotion of rhythmic degradation of the GABAA receptor[J]. Curr Biol, 2017, 27(23): 3616–3625. DOI: 10.1016/j.cub.2017.10.052 |
| [39] | RUIZ J C, BRUICK R K. F-box and leucine-rich repeat protein 5(FBXL5):sensing intracellular iron and oxygen[J]. J Inorg Biochem, 2014, 133: 73–77. |
| [40] |
袁曼曼.Fbxl5和Myf6基因的多态性与京海黄鸡生长、繁殖性能的关联分析及表达规律研究[D].扬州: 扬州大学, 2018.
YAN M M.Studies on the genetic effects of Fbxl5 and Myf6 gene on growth and reproductive traits and its expression characterization in Jinghai yellow chicken[D].Yangzhou: Yangzhou University, 2018.(in Chinese) |
| [41] | CHEN Z W, LIU B, TANG N W, et al. FBXL5-mediated degradation of single-stranded DNA-binding protein hSSB1 controls DNA damage response[J]. Nucleic Acids Res, 2014, 42(18): 11560–11569. |
| [42] | FUNG E, RICHTER C, YANG H B, et al. FBXL13 directs the proteolysis of CEP192 to regulate centrosome homeostasis and cell migration[J]. EMBO Rep, 2018, 19(3): e44799. |
| [43] | ZHU J J, DENG S S, DUAN J, et al. FBXL20 acts as an invasion inducer and mediates E-cadherin in colorectal adenocarcinoma[J]. Oncol Lett, 2014, 7(6): 2185–2191. |
| [44] |
张博瀚, 吴庆琛. FBXL20对人非小细胞肺癌A549细胞生长的影响[J]. 第三军医大学学报, 2018, 40(9): 795–800.
ZANG B H, WU Q C. Effects of FBXL20 on proliferation in human non-small cell lung cancer A549 cells[J]. Journal of Third Military Medical University, 2018, 40(9): 795–800. (in Chinese) |
| [45] | SIEPKA S M, YOO S H, PARK J, et al. Circadian mutant overtime reveals F-box protein FBXL3 regulation of cryptochrome and period gene expression[J]. Cell, 2007, 129(5): 1011–1023. |
| [46] | SHI G S, XING L J, LIU Z W, et al. Dual roles of FBXL3 in the mammalian circadian feedback loops are important for period determination and robustness of the clock[J]. Proc Natl Acad Sci U S A, 2013, 110(12): 4750–4755. |
| [47] | YOO S H, MOHAWK J A, SIEPKA S M, et al. Competing E3 ubiquitin ligases govern circadian periodicity by degradation of CRY in nucleus and cytoplasm[J]. Cell, 2013, 152(5): 1091–1105. |
| [48] | ROSENSWEIG C, REYNOLDS K A, GAO P, et al. An evolutionary hotspot defines functional differences between CRYPTOCHROMES[J]. Nat Commun, 2018, 9(1): 1138. DOI: 10.1038/s41467-018-03503-6 |
| [49] | VAUGHAN M, JORDAN S D, DUGLAN D, et al. Phosphorylation of CRY1 serine 71 alters voluntary activity but not circadian rhythms in vivo[J]. J Biol Rhythms, 2019, 34(4): 401–409. DOI: 10.1177/0748730419858525 |
| [50] | DARDENTE H, MENDOZA J, FUSTIN J M. Implication of the F-box protein FBXL21 in circadian pacemaker function in mammals[J]. PLoS One, 2008, 3(10): e3530. |
| [51] | CHU M X, HE Y Q, CHENG D X, et al. Association between expression of reproductive seasonality and alleles of melatonin receptor 1A in goats[J]. Anim Reprod Sci, 2007, 101(3-4): 276–284. DOI: 10.1016/j.anireprosci.2006.09.012 |
| [52] |
孙旭, 张哲, 孙琛, 等. 褪黑素对大鼠纤维化TGF-β1/Smads信号通路干预研究[J]. 黑龙江农业科学, 2019(1): 58–61.
SN X, ZHANG Z, SUN C, et al. Intervention study of melatonin on TGF-β1/Smads signaling pathway in rat fibrosis[J]. Heilongjiang Agricultural Sciences, 2019(1): 58–61. (in Chinese) |
| [53] |
李华振, 刘武军, 刘秋月, 等. 甲状腺激素受体基因调控动物繁殖的研究进展[J]. 畜牧兽医学报, 2019, 50(2): 243–252.
LI H Z, LIU W J, LIU Q Y, et al. Research progress on the regulative role of thyroid hormone receptor gene in animal reproduction[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(2): 243–252. (in Chinese) |
| [54] | HUANG D W, WANG J X, LIU Q Y, et al. Analysis on DNA sequence of TSHB gene and its association with reproductive seasonality in goats[J]. Mol Biol Rep, 2013, 40(2): 1893–1904. DOI: 10.1007/s11033-012-2245-0 |
| [55] | KOVANEN L, SAARIKOSKI S T, AROMAA A, et al. ARNTL (BMAL1) and NPAS2 gene variants contribute to fertility and seasonality[J]. PLoS One, 2010, 5(4): e10007. DOI: 10.1371/journal.pone.0010007 |
| [56] | CLARKE I J, SMITH J T. The role of kisspeptin and gonadotropin inhibitory hormone (GnIH) in the seasonality of reproduction in sheep[J]. Soc Reprod Fertil Suppl, 2010, 67: 159–169. DOI: 10.5661/RDR-VII-159 |
| [57] |
陈健楠, 王琪, 王媛媛, 等. CRY1在雄性牦牛生殖轴中的表达与分布[J]. 农业生物技术学报, 2019, 27(10): 1869–1877.
CEN J N, WANG Q, WANG Y Y, et al. Expression and distribution of CRY1 in the reproductive axis of male yak (Bos grunniens)[J]. Journal of Agricultural Biotechnology, 2019, 27(10): 1869–1877. (in Chinese) |
| [58] | NAVAL-SANCHEZ M, NGUYEN Q, MCWILLIAM S, et al. Sheep genome functional annotation reveals proximal regulatory elements contributed to the evolution of modern breeds[J]. Nat Commun, 2018, 9(1): 859. DOI: 10.1038/s41467-017-02809-1 |
| [59] | POSBERGH C J, THONNEY M L, HUSON H J. Genomic approaches identify novel gene associations with out of season lambing in sheep[J]. J Hered, 2019, 110(5): 577–586. |
| [60] | CAO X H, WANG X Y, LU L L, et al. Expression and functional analysis of the BCL2-associated agonist of cell death (BAD) gene in the sheep ovary during the reproductive cycle[J]. Front Endocrinol, 2018, 9: 512. |
| [61] | WANG X N, SU X X, CHENG S Q, et al. MYC modulators in cancer:a patent review[J]. Expert Opin Ther Pat, 2019, 29(5): 353–367. DOI: 10.1080/13543776.2019.1612878 |



