2. 中国农业大学动物医学院, 农业部动物流行病学重点实验室, 北京 100193;
3. 洛阳普泰生物技术有限公司, 洛阳 471000
2. Key Laboratory of Animal Epidemiology of the Ministry of Agriculture, College of Veterinary Medicine, China Agricultural University, Beijing 100193, China;
3. Luoyang Taipu Biological Engineering, INC., Luoyang 471000, China
弓形虫(Toxoplasma gondii)是一种人畜共患机会性致病原虫,依据感染进程可分为急性感染和慢性感染,急性弓形虫感染的危害更为严重。在畜牧业中,猪的急性弓形虫感染常引起母猪流产、死胎,仔猪发热、呼吸困难、死亡,仔猪可见急性腹泻型弓形虫病,并导致患猪迅速死亡;羊急性弓形虫感染主要表现为发热、神经系统和呼吸系统症状,孕羊发生流产。急性感染的动物在其肌肉、内脏、血液、分泌物甚至奶中存在弓形虫,可感染其他动物和人类。药物对弓形虫急性感染阶段的速殖子有效,而对慢性感染阶段的包囊无效。发现急性感染并早期治疗可以防止虫体在动物体内形成包囊,进入人的食物链,有助于避免经济动物弓形虫病的大规模流行,减少畜牧养殖的经济损失,也能够极大地降低人感染弓形虫的风险。弓形虫急性感染具有发病时间短、发病急、进程快等特点,目前,国际上还没有统一的有效检测方法。发现病原体是急性弓形虫病诊断最直接的证据,与血清抗体相比能够更早地诊断出疾病的发生。但是分离病原的方法费时费力,且具有感染检测人员的风险。PCR(polymerase chain reaction, PCR)方法作为另一种直接检测病原的方法,具有极高的灵敏度,但引物及样品处理方法的差异将直接影响检测结果,此外,PCR检测还需要特殊的仪器和专业的技术。与PCR相比,ELISA操作简便,更适用于大批量样品检测。
弓形虫循环抗原(circulating antigen, CAg)是虫体在宿主体内繁殖过程中产生的代谢和裂解产物,对自然感染状态下急性弓形虫感染的检测具有重要意义。CAg在弓形虫感染早期或急性期的多种动物模型均可检测到[1-2],最早在感染后24 h即可被检测[3]。CAg中含有多种致密颗粒蛋白(dense granule protein,GRA),其中致密颗粒蛋白1(dense granule protein 1, GRA1)是由弓形虫特有的细胞器——致密颗粒分泌的一种可溶性蛋白,又称P24,它发挥调节和修饰纳虫空泡膜(parasitophorous vacuole membrane,PVM)的作用,该基因在弓形虫发育的各个阶段以及不同基因型虫株中都能表达,且表达水平较高,是CAg的重要组成部分[4]。TgGRA1具有良好的免疫原性,常用来与其他抗原配合使用检测血清抗体[5-6]。因此,本试验以血清中TgGRA1抗原为诊断指标,在制备TgGRA1单克隆抗体的基础上,建立双抗体夹心ELISA试验,并对其检测效果进行评价,探究TgGRA1对急性弓形虫感染的诊断意义。
1 材料与方法 1.1 材料弓形虫RH株由本实验室传代和保存;Vero细胞由本实验室传代和保存。GRA1-His和GRA1-GST重组蛋白由本实验室表达及保存。RPMI-1640购自Hyclone公司;Biosun胎牛血清购自上海Biosun生物技术有限公司;FITC标记的羊抗鼠IgG购自美国Proteintech公司;DAPI细胞核染料、弗氏完全佐剂、弗氏不完全佐剂、HAT冻干粉末、小鼠单克隆抗体亚型鉴定试剂盒购自美国Sigma Aldrich公司;PCR相关试剂购自北京全式金生物技术有限公司;PVDF膜购自德国Merck Millipore Novagen公司;蛋白G重力预装柱套装购自北京博奥龙免疫技术有限公司;低背景ECL发光显色试剂盒购自北京康为世纪生物技术科技有限公司。HRP标记兔抗猪IgM,HRP标记山羊抗鼠IgG自北京迈晨生物科技有限公司。6~8周龄雌性BALB/c小鼠购自北京维通利华实验动物技术有限责任公司;试验猪1头,雄性(已去势),断奶后1周,购自北京顺鑫农业股份有限公司。
1.2 方法1.2.1 猪和小鼠急性感染血清的制备 选择弓形虫、住肉孢子虫和新孢子虫抗体阴性猪,腹腔注射弓形虫速殖子2×107个,每天前腔静脉采血10 mL,3 mL用于分离血清,检测血清中IgM抗体,剩下血液样品提取DNA,-80 ℃保存。感染期间观察临床症状,记录体温变化。间接ELISA方法具体操作步骤如下:将弓形虫全虫裂解抗原(Toxoplasma lysis antigen, TLA)用碳酸盐缓冲液稀释至1 μg·mL-1,向96孔板中加入100 μL·孔-1,于4 ℃包被14 h,用0.5% PBST洗涤4次;5%脱脂奶进行封闭,37 ℃孵育1 h;洗涤同上;将血清1:100稀释后加入到板中,100 μL·孔-1,37 ℃孵育1 h,洗涤;HRP标记兔抗猪IgM 1:5 000稀释,加入到酶标板中,100 μL·孔-1,37 ℃孵育1 h;洗涤;在避光条件下将底物显色液A液和B液等比例混合,加入到酶标板中, 100 μL·孔-1,于室温反应5 min;加入2 mol·L-1 H2SO4终止反应,50 μL·孔-1;用酶标仪在波长450和630 nm下读取吸光值。
每只BALB/c小鼠腹腔注射100个弓形虫速殖子,共20只,另设立2只小鼠注射PBS,为空白对照。接种后每天随机取2只试验组小鼠摘眼球采血,一部分分离血清,另一部分提取全血DNA。
1.2.2 单抗的制备及评价 用TgGRA1-His重组蛋白与弗氏佐剂乳化后免疫BALB/c小鼠,取血清抗体效价最高的小鼠在融合前3 d进行冲击免疫。取小鼠的脾与SP2/0细胞融合,用HAT完全培养基在37 ℃ 5% CO2培养箱中培养,第3、7天半换液。收集融合后9~11 d的细胞上清,用间接ELISA方法检测,选择OD450 nm较高、细胞状态良好的细胞进行亚克隆。亚克隆3次后,筛选能够稳定分泌抗体的单株细胞。间接ELISA方法具体操作步骤:TgGRA1-GST 10 μg·孔-1于4 ℃包被14 h,用0.5% PBST洗涤4次;5%脱脂奶37 ℃封闭1 h;洗涤同上;加入100 μL·孔-1细胞上清,37 ℃孵育1 h;洗涤;二抗为HRP标记山羊抗鼠IgG 1:5 000稀释,37 ℃温箱中孵育1 h;洗涤;在避光条件下将底物显色液A液和B液等比例混合,加入到酶标板中100 μL·孔-1,室温反应5 min;加入2 mol·L-1 H2SO4终止反应,50 μL·孔-1;用酶标仪在波长450和630 nm下读取吸光值。
取10周龄以上雌性BALB/c小鼠,腹腔注射无菌石蜡,诱导10~14 d后每只小鼠腹腔注射30万·mL-1杂交瘤细胞0.5 mL;当小鼠腹部鼓起时采集腹水,测定抗体的效价和亚型。Protein G重力预装柱纯化单克隆抗体,SDS-PAGE检测纯化效果,Western blot和间接免疫荧光(indirect immunofluorescent assay, IFA)鉴定抗体特性。纯化后的抗体-80 ℃冻存。
用抗体叠加试验鉴定抗体的识别表位。首先,将单抗倍比稀释与一定量抗原反应,绘制抗体饱和曲线,确定抗体的饱和稀释度,然后将4株抗体在饱和稀释度下两两配对,进行抗体叠加试验。对试验结果进行计算分析,通过相加效应值Ai判断抗体识别抗原表位的差异。计算公式:Ai=2A1+2/(A1+A2)-1。Ai为任意两种抗体配对可能值,A1+2为两种抗体配对使用时450 nm波长下吸光值,A1和A2为两株抗体单独使用时450 nm波长下的吸光值。判定标准:若Ai>0.5,则有相加效应,即两种抗体识别不同的抗原表位;否则两种抗体识别的抗原表位相同或相近。
1.2.3 ESA的制备及GRA1的鉴定 无菌收集弓形虫RH株速殖子,用DMEM调整浓度至1× 108个·mL-1,于37 ℃温箱中培养3 h;2 000 r·min-1离心10 min,收集上清,用煮沸处理过的透析袋在PBS中透析24 h,12 h换1次液;超滤管浓缩后,BCA法测定总蛋白浓度。
利用Western blot对ESA中的GRA1进行鉴定。以ESA为抗原,200倍稀释鼠源TgGRA1单抗为一抗,5 000倍稀释HRP标记羊抗鼠IgG为二抗,设0.5 mg·mL-1重组蛋白GRA1-His抗原为阳性对照进行试验。
1.2.4 夹心ELISA方法的建立 因4株TgGRA1单抗识别相同的抗原表位,所以选择鼠源TgGRA1多抗与1G2单抗建立夹心ELISA方法。将鼠源TgGRA1多抗进行HRP标记,HRP的标记和评价委托洛阳普莱柯生物工程股份有限公司完成。
采用棋盘法确定单抗包被浓度与酶标抗体最佳稀释度。标准阳性样品为加入了TgGRA1-His重组蛋白的FBS血清,浓度为100 ng·mL-1,标准阴性血清为未加蛋白的FBS。最终选择P值在1.0左右,且P/N值最大的条件为最佳抗体使用浓度。在此基础上对包被液的种类和包被条件、封闭液的种类及显色时间进行优化,确定cut off值。优化条件后验证夹心ELISA方法特异性和敏感性。
1.2.5 夹心ELISA与nPCR及商品化试剂盒检测效果的比较 为评价以GRA1为检验目标的双抗体夹心ELISA,本研究引入王权等[7]报道的巢式PCR方法,对实验动物全血中的弓形虫基因进行检测,比较ELISA与核酸检测结果的一致性。鼠弓形虫急性感染血清样品还用两种市售商品化试剂盒(鼠源弓形虫循环抗原检测夹心ELISA试剂盒)进行检测。
1.2.6 夹心ELISA方法检测田间样品 采集北京、通辽、民勤、安阳4个地区部分羊场的山羊血清,按照本研究建立的夹心ELISA方法进行弓形虫循环抗原的检测。
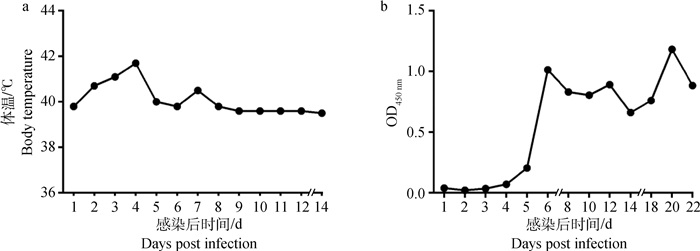
2 结果 2.1 猪和小鼠急性感染血清的制备对试验猪是否感染过弓形虫、新孢子虫和住肉孢子虫这3种猪常见寄生虫病原进行筛查,检测结果均为阴性。猪接种弓形虫速殖子后,2~4 d体温快速升高,第4天达到最高,明显出现精神萎靡,食欲减退等症状;在5 d后体温逐渐恢复正常。IgM抗体从第6天开始由阴性转为阳性,一直持续到采样结束(22 d),如图 1。IgM通常在动物感染7~90 d内存在,猪血清IgM水平说明动物在研究期间处于弓形虫急性感染期。
|
a.弓形虫感染后试验猪体温变化情况;b.弓形虫感染后试验猪血清IgM抗体变化情况 a. Temperature changes of experimental pig after Toxoplasma gondii infection; b. Changes of IgM antibody in serum of experimental pig infected with Toxoplasma gondii 图 1 猪弓形虫急性感染试验结果评价 Fig. 1 Results of Toxoplasma acute infection of swine |
试验组小鼠腹腔接种100个弓形虫RH株速殖子后,24 h后,出现明显的精神沉郁、被毛蓬乱、身体蜷缩,第3天即出现死亡,在7 d内除对照组外小鼠全部死亡。
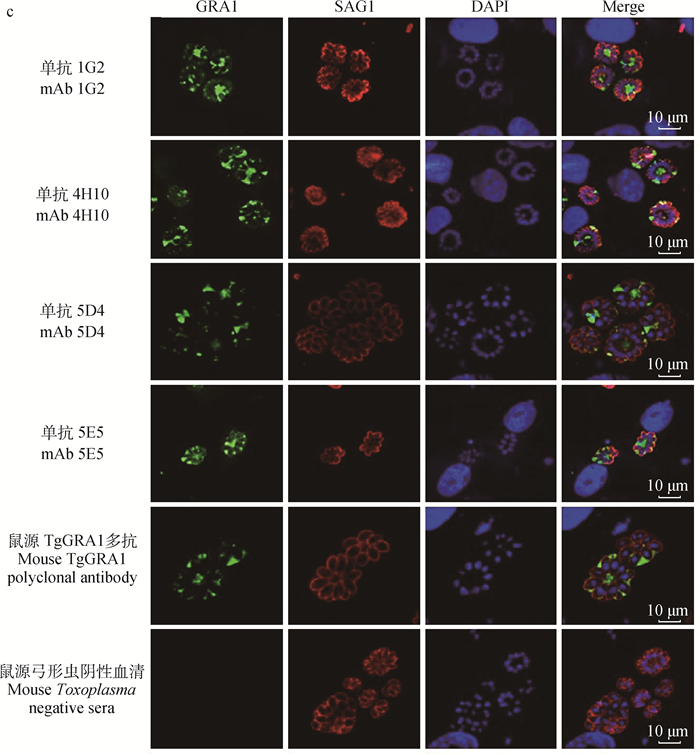
2.2 单抗的制备经过融合和筛选,最终获得4株杂交瘤细胞,分别命名为1G2、4H10、5D4、5E5。4株杂交瘤细胞经过小鼠体内的大量扩增,所制得的腹水效价均在106~107,抗体亚型均为IgG1。用ProteinG重力预装柱分别对4株腹水中的IgG进行纯化,SDS-PAGE显示纯化效果较好,如图 2a。Western blot结果证明,4株单抗能识别弓形虫全虫抗原中的TgGRA1,且与其形态相似、生活史类似、同源性最为接近的新孢子虫无交叉反应,证明单克隆抗体特异性好,如图 2b。顶复亚门下其他种属的寄生虫,例如疟原虫、隐孢子虫、住肉孢子虫的抗原蛋白经NCBI数据库比对,发现与弓形虫GRA1的相似性极低,几乎不存在交叉反应,因此未进一步验证。IFA试验中,可以清楚地在倒置荧光显微镜下观察到弓形虫纳虫空泡内和残体中的GRA1成功地被4株单抗识别,该结果证明4株单克隆抗体与弓形虫具有良好的反应性,如图 2C。

|
a. SDS PAGE鉴定单抗纯化效果(1~4分别是纯化后的1G2、4H10、5D4和5E5 IgG的重链和轻链;M.蛋白质相对分子质量标准);b. Western blot鉴定单抗与新孢子虫无交叉反应(1.鼠源新孢子虫多抗;2~5.分别是单抗1G2、4H10、5D4和5E5); C.4株TgGRA1单抗IFA鉴定(IFA鉴定4株TgGRA1单抗的定位及与弓形虫的反应性。以兔源SAG1抗体标记虫体轮廓,DAPI标记虫体及细胞核,可见4株TgGRA1单抗均定位在弓形虫纳虫空泡内和残体中,与弓形虫具有良好的反应性。标尺=10 μm) a. SDS PAGE was used to identify the purification effect of McAb (1-4 were the heavy chain and light chain of 1G2, 4H10, 5D4 and 5E5 IgG after purification; M. Protein marker); B. No cross reaction between McAbs and Neospora caninum was found by Western blot (1. Mouse Nc polyclonal antibody; lines 2-5 were monoclonal antibody 1G2, 4H10, 5D4 and 5E5);C.IFA identification of TgGRA1 mAb(IFA was used to identify the location of four monoclonal antibodies against TgGRA1 and their reactivity to Toxoplasma gondii. The body outline was marked with a anti-rabbit SAG1 antibody, and the body and nucleus were labeled with DAPI. The results showed that the four TgGRA1 McAbs were located in the vacuoles and residues of Toxoplasma gondii, which showed good reactivity with Toxoplasma gondii. Bar=10 μm) 图 2 4株单抗纯化效果、特异性及IFA鉴定 Fig. 2 Purification, specificity and IFA identification of 4 mAbs |
采用抗体叠加试验进行单抗识别抗原表位的鉴定。首先绘制了抗体饱和曲线,将每株抗体倍比稀释后与一定量抗原反应,确定饱和稀释度,然后将抗体在饱和稀释度下两两配对,进行抗体叠加试验。ELISA结果显示,包被1 μg·mL-1抗原时,4株抗体的OD值在1.02×105~1.64×106稀释度内均呈线性变化。
因此,选择能够与1 μg·mL-1包被抗原反应最为充分的1.02×105稀释度进行抗体相加试验。将4株单抗两两组合,分别进行间接ELISA试验,同时设立单一抗体的对照。结果显示,6种配对方法的相加效应全部小于0.5,说明4株单抗识别的抗原表位相同或相似。
2.3 ESA的制备及GRA1的鉴定胞外培养弓形虫RH株速殖子制备ESA,培养上清经PBS透析和浓缩后,共收集到1 mL ESA,浓度为0.55 mg·mL-1。Western blot检测ESA中的GRA1,同时,以0.5 mg·mL-1的GRA1-His重组蛋白为阳性对照。结果显示,ESA中确实有GRA1的存在,相对分子质量为24 ku,但含量并不高,而2泳道的重组蛋白因带有3个his标签,相对分子质量略大于ESA中TgGRA1,为29 ku。结果如图 3。
|
1. 0.55 mg·mL-1ESA;2. 0.5 mg·mL-1TgGRA1-His;M.蛋白质相对分子质量标准 1. 0.55 mg·mL-1ESA; 2. 0.5 mg·mL-1TgGRA1-His; M. Protein marker 图 3 ESA中GRA1的鉴定 Fig. 3 Identification of GRA1 in ESA |
采用棋盘法确定单抗包被浓度与检测抗体最佳稀释度。结果显示,单抗200倍稀释,检测抗体400倍稀释时,检测效果最佳。包被液为碳酸盐缓冲液,在4 ℃ 14 h +37 ℃1 h包被条件下,用5%脱脂奶封闭时效果最好。在此条件下,cut off值为0.157,且与新孢子虫抗原无交叉反应。
在阴性血清中加入不同浓度的GRA1-His重组抗原和ESA抗原进行夹心ELISA,判定夹心ELISA方法检出抗原的最低浓度。结果显示,优化后的夹心ELISA方法可以检测到FBS中1.563 ng·mL-1以上的GRA1抗原,以及100 ng·mL-1 ESA。
2.5 夹心ELISA与nPCR及商品化试剂盒检测效果的比较以弓形虫ITS为靶基因,使用nPCR技术,检测猪全血DNA中弓形虫基因。试验结果显示,感染后第1天全血DNA检测结果即为阳性,第9天未检测到,从第10天开始至第14天也均为阳性。在鼠感染模型中,感染后第4天有1只小鼠为阳性,第5天及以后2只小鼠均为阳性,第7天时全部死亡。
将猪感染血清1:100稀释使用,用建立的TgGRA1夹心ELISA方法检测。结果显示,第5~7天为阳性,其他时间均为阴性。鼠血清样品1:100稀释后,第5和6天各有1只小鼠为阳性,其他时间均为阴性(表 1、2)。
|
|
表 1 猪弓形虫急性感染检测结果 Table 1 Diagnosing results of swine samples infected acute toxoplasmosis |
|
|
表 2 鼠弓形虫急性感染检测结果 Table 2 Diagnosing results of mice samples infected acute toxoplasmosis |
为比较以GRA1为检验目标的双抗体夹心ELISA方法与市售商品化试剂盒的效果,将采集的鼠血清样品用两种市售商品化试剂盒(鼠源弓形虫循环抗原检测夹心ELISA试剂盒)进行检测。结果显示(表 3),本研究建立的ELISA方法能够有效地检测出弓形虫急性感染的进程,并与检测病原的nPCR方法一致性更高,具有明显的规律性,对临床上急性弓形虫病的治疗有指导意义。
|
|
表 3 夹心ELISA与市售商品化试剂盒检测小鼠血清循环抗原的效果比较 Table 3 Comparison of the efficiency of detecting CAg between sandwich ELISA and two commercial kits |
弓形虫急性感染通常导致病畜的急性病理过程,死亡率较高,因此在流行病学调查中并不及慢性弓形虫病多见。目前,猪多采用集约化饲养,弓形虫急性感染比较少见,但羊还以放牧或半放牧的形式养殖,感染弓形虫的机会较多。孕羊的弓形虫急性感染可造成流产和产死胎、弱胎。考虑到猪急性弓形虫感染大批量田间样品的采集较为困难,而羊感染弓形虫的可能性更高,作者采集了北京、内蒙古通辽、甘肃民勤、河南安阳4个地区部分羊场的山羊血清,利用本研究建立的夹心ELISA方法进行弓形虫循环抗原的检测。结果发现北京、内蒙古通辽、甘肃民勤、河南安阳阳性率分别为5.56%、0.56%、22.22%和3.61%,如表 4。地区间显示出明显的差别,其中,甘肃民勤羊场的循环抗原阳性率较高,可能对畜禽生产和人类健康造成极大威胁。
|
|
表 4 部分地区山羊血清循环抗原统计表 Table 4 Detection of CAg in goat sera from 4 districts of China |
猪弓形虫病曾在20世纪80年代在国内广泛流行,给养猪业造成了巨大的经济损失。如今,猪肉作为人类重要的肉制品来源,弓形虫有通过食物链进入人体的风险;另外,猪的弓形虫感染相比啮齿类动物,更加接近人弓形虫感染的临床情况。但是人工感染猪弓形虫感染模型的建立方法及病原抗体的检测结果在已有的报道中并非完全相同,这与使用的虫株种类、数量、接种途径,以及实验动物的种类、大小、状态都密切相关,特别是体型较大的猪,一般感染剂量要达到107才有可能出现典型的弓形虫感染症状[8],王秀琴等[9]用弓形虫强毒株CN株,确定人工感染猪弓形虫的最佳感染方式为腹腔注射3 000万~ 3 750万个速殖子,弓形虫接种后48 h猪体温开始升高,第5天病情最为严重,并有33%的死亡率,贾永清等[10]通过腹腔注射5 000万个弓形虫GJ株建立猪人工感染模型,在第14天时,血清抗体转阳,Nau等[11]通过口服105个ME49卵囊进行感染,试验猪并没有明显症状,但是抗体水平有明显升高。本研究通过腹腔注射2×107个弓形虫RH株速殖子构建猪弓形虫急性感染模型,感染后2~4 d体温快速升高,有较为明显的临床症状,在5 d后,体温逐渐恢复正常,IgM抗体从第6天开始显示阳性,一直持续到采样结束(22 d)。另外,本研究中还利用小鼠血清样品进行检测,nPCR验证具有较高的准确性,说明本研究所建立的夹心ELISA方法无种属特异性,有望用于猪、鼠等多种动物血清弓形虫循环抗原的检测。
CAg是指弓形虫在宿主体内入侵、运动和增殖过程中产生的代谢和裂解产物。Raizman和Neva[12]于1975年首次在血清中检测到CAg。有报道称,CAg作为诊断抗原检测抗体的敏感性要比全虫抗原高得多[13-14],而且以检测CAg为目标可以极大地降低检测人员的感染风险。目前,国内外学者已建立了一些关于血清CAg的检测方法,例如双抗体ELISA[15],SAG3单抗夹心ELISA[16],宫枫举等[17]制备CAg单抗建立的双抗体夹心ABC-ELISA方法,以及用ESA多抗建立的胶体金免疫层析法[18]。ESA是CAg的主要成分,包括微线体(microneme, MIC)蛋白、棒状体(roptry, ROP)蛋白、致密颗粒蛋白等。这些蛋白在弓形虫识别、黏附、入侵宿主细胞及生长代谢过程中发挥重要作用。而且,不同形态的弓形虫,包括速殖子、子孢子以及包囊内的缓殖子,均可以产生ESA[19],有试验表明,速殖子产生的ESA具有很好的免疫原性,能够成功刺激机体产生抗体或细胞免疫应答[20];而在慢性弓形虫感染者体内,包囊内缓殖子所分泌的ESA正是持续刺激机体免疫系统产生细胞免疫的重要因素[21]。ESA的组分非常丰富,弓形虫速殖子的全部可溶性蛋白进行蛋白组学分析,比对出230种弓形虫蛋白[22],其中能够与弓形虫阳性血清发生反应的蛋白有几十种,相对分子质量主要集中在34~116 ku,这包括了一些GRA蛋白,例如GRA1、GRA2、GRA4、GRA7、GRA9、GRA10[23-24]。TgGRA1在弓形虫入侵宿主细胞时及入侵后均能被分泌到纳虫空泡(parasitophorous vacuole, PV)内,调节PV内钙离子浓度,起到调节、修饰纳虫空泡膜的作用,抵抗宿主溶酶体的攻击,是弓形虫生长发育必不可少的重要功能蛋白。TgGRA1还可以结合特定的B细胞表位,参与调节宿主免疫应答过程[5]。本研究也验证了ESA和CAg中GRA1的存在,而且GRA1能够用于诊断急性弓形虫感染。这与Döşkaya等[25]的试验结果相同,他们利用GRA1抗原检测血清IgG和IgM的水平变化,前期抗体水平到达最高后降低表明可能存在40 d之前的弓形虫感染。但是目前人们对GRA1检测急性弓形虫感染的价值还存在争论。Nau等[11]发现,样品猪弓形虫阳性血清与GRA2、GRA7、GRA9蛋白100%发生反应,而GRA1的反应非常微弱,Jongert等[26]也报道了与RH株感染的猪阳性血清反应最强烈的抗原为GRA7,Ferrandiz等[27]通过对比TLA的检测效果发现,GRA1检测IgG的敏感度不足以区分人弓形虫急慢性感染。这也可以说明,GRA1尽管对T细胞的激活作用是显著的,具有强烈的免疫原性,但它在CAg中的含量可能不占优势,或者GRA1不在PVM外大量存在,因此以GRA1为检测目标鉴定CAg的方法敏感性可能会偏低,这也解释了在检测猪和小鼠血清CAg的过程中,nPCR扩增高拷贝的ITS1基因比夹心ELISA方法的检出时间更早。
4 结论本研究验证了弓形虫ESA中TgGRA1的存在,血清TgGRA1抗原的存在能够指示急性弓形虫感染。利用特异性TgGRA1单克隆抗体与多抗,成功建立了检测弓形虫循环抗原的双抗体夹心ELISA方法,该方法具有良好的特异性、敏感性,可检测猪、小鼠等多种动物血清循环抗原。
| [1] | VAN KNAPEN F, PANGGABEAN S O. Detection of circulating antigen during acute infections with Toxoplasma gondii by enzyme-linked immunosorbent assay[J]. J Clin Microbiol, 1977, 6(6): 545–547. |
| [2] | ASAI T, KIM T J, KOBAYASHI M, et al. Detection of Nucleoside Triphosphate hydrolase as a circulating antigen in sera of mice infected with Toxoplasma gondii[J]. Infect Immun, 1987, 55: 1332–1335. |
| [3] | QUAN J H, HASSAN H A, CHA G H, et al. Antigenemia and specific IgM and IgG antibody responses in rabbits infected with Toxoplasma gondii[J]. Korean J Parasitol, 2009, 47(4): 409–412. |
| [4] | HUGHES H P, VAN KNAPEN F. Characterisation of a secretory antigen from Toxoplasma gondii and its role in circulating antigen production[J]. Int J Parasitol, 1982, 12(5): 433–437. |
| [5] | GONG P T, CAO L L, GUO Y B, et al. Toxoplasma gondii:protective immunity induced by a DNA vaccine expressing GRA1 and MIC3 against toxoplasmosis in BALB/c mice[J]. Exp Parasitol, 2016, 166: 131–136. |
| [6] | FERRA B, HOLEC-G SIOR L, KUR J. A new Toxoplasma gondii chimeric antigen containing fragments of SAG2, GRA1, and ROP1 proteins-impact of immunodominant sequences size on its diagnostic usefulness[J]. Parasitol Res, 2015, 114(9): 3291–3299. |
| [7] |
王权, 王巧全, 潘淑娟, 等. 动物源性食品中弓形虫Nested PCR-RFLP分子检测技术的建立[J]. 中国兽医寄生虫病, 2007, 15(6): 1–7.
WANG Q, WANG Q Q, PAN S J, et al. Establishment of nested PCR-RFLP for detecting Toxoplasma gondii in animal-derived food[J]. Chinese Journal of Veterinary Parasitology, 2007, 15(6): 1–7. (in Chinese) |
| [8] |
孔猛.江苏省部分地区动物弓形虫病血清学调查及猪弓形虫病人工发病模型的建立[D].南京: 南京农业大学, 2009.
KONG M. Serological investigation of toxoplasma gondii in animals in some areas of Jiangsu province and the establishment of porcine toxoplasmosis model by artificial infection[D]. Nanjing: Nanjing Agricultural University, 2009. (in Chinese) |
| [9] |
王秀琴, 张启珩, 徐望平, 等. 人工感染猪弓形虫病症状病理变化及攻毒量测定[J]. 甘肃畜牧兽医, 1999, 29(1): 16–17.
WANG X Q, ZHANG Q H, XU W P, et al. Symptoms and pathological changes of artificially infected swine toxoplasmosis[J]. Gansu Animal and Veterinary Sciences, 1999, 29(1): 16–17. (in Chinese) |
| [10] |
贾永清, 李一经. 人工感染猪弓形虫病血清抗体消长规律的研究[J]. 内蒙古畜牧科学, 1997(2): 1–3.
JIA Y Q, LI J Y. Study on serum antibody levels of artificially infected Toxoplasma gondii[J]. Inner Mongolian Journal of Animal Sciences and Production, 1997(2): 1–3. (in Chinese) |
| [11] | NAU J, ELLER S K, WENNING J, et al. Experimental porcine Toxoplasma gondii infection as a representative model for human toxoplasmosis[J]. Mediators Inflamm, 2017, 2017: 3260289. |
| [12] | RAIZMAN R E, NEVA F A. Detection of circulating antigen in acute experimental infections with Toxoplasma gondii[J]. J Infect Dis, 1975, 132(1): 44–48. |
| [13] | PETRAY P, BONARDELLO N, CLARK R, et al. Evaluation of an ELISA technique for detection of antigens and circulating immune complexes of trypanosoma cruzi by a field study in an endemic zone of argentina[J]. Rev Inst Med Trop São Paulo, 1992, 34(2): 141–147. |
| [14] | HOLEC-GĄSIOR L, FERRA B, HISZCZYŃSKA-SAWICKA E, et al. The optimal mixture of Toxoplasma gondii recombinant antigens (GRA1, P22, ROP1) for diagnosis of ovine toxoplasmosis[J]. Vet Parasitol, 2014, 206(3-4): 146–152. |
| [15] |
傅翠娥, 陈彩华, 杨纪顺, 等. 一种简易、快速检测弓形虫循环抗原的酶联免疫吸附试验[J]. 畜牧兽医学报, 1991, 22(4): 371–374.
FU C E, CHEN C H, YANG J S, et al. A simple and quick ELISA for detertion of circulating antigens of Toxoplasma[J]. Acta Veterinaria et Zootechnica Sinica, 1991, 22(4): 371–374. (in Chinese) |
| [16] |
王海礁.双抗体夹心ELISA法检测弓形虫循环抗原的方法建立[D].长春: 吉林大学, 2011.
WANG H J. Establishment of a double antibody sandwich ELISA method for detection of Toxoplasma gondii circulating antigen[D]. Changchun: Jilin University, 2011. (in Chinese) |
| [17] |
宫枫举, 蒋蔚, 陈永军, 等. 双抗体夹心ABC-ELISA检测弓形虫循环抗原方法的建立[J]. 畜牧与兽医, 2017, 49(1): 65–70.
GONG F J, JIANG W, CHEN Y J, et al. Establishment of a double antibody sandwich ABC-ELISA method for detection of Toxoplasma gondii circulating antigen[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(1): 65–70. (in Chinese) |
| [18] | WANG Y H, LI X R, WANG G X, et al. Development of an immunochromatographic strip for the rapid detection of Toxoplasma gondii circulating antigens[J]. Parasitol Int, 2011, 60(1): 105–107. |
| [19] | TILLEY M, FICHERA M E, JEROME M E, et al. Toxoplasma gondii sporozoites form a transient parasitophorous vacuole that is impermeable and contains only a subset of dense-granule proteins[J]. Infect Immun, 1997, 65(11): 4598–4605. |
| [20] | PRIGIONE I, FACCHETTI P, LECORDIER L, et al. T cell clones raised from chronically infected healthy humans by stimulation with Toxoplasma gondii excretory-secretory antigens cross-react with live tachyzoites:characterization of the fine antigenic specificity of the clones and implications for vaccine development[J]. J Immunol, 2000, 164(7): 3741–3748. |
| [21] | CESBRON-DELAUW M F, CAPRON A. Excreted/secreted antigens of Toxoplasma gondii-their origin and role in the host-parasite interaction[J]. Res Immunol, 1993, 144(1): 41–44. |
| [22] | MA G Y, ZHANG J Z, YIN G R, et al. Toxoplasma gondii:Proteomic analysis of antigenicity of soluble tachyzoite antigen[J]. Exp Parasitol, 2009, 122(1): 41–46. |
| [23] | MERCIER C, ADJOGBLE K D Z, DÄUBENER W, et al. Dense granules:Are they key organelles to help understand the parasitophorous vacuole of all apicomplexa parasites?[J]. Int J Parasitol, 2005, 35(8): 829–849. |
| [24] | XUE J X, JIANG W, CHEN Y J, et al. Twenty-six circulating antigens and two novel diagnostic candidate molecules identified in the serum of canines with experimental acute toxoplasmosis[J]. Parasit Vectors, 2016, 9: 374. |
| [25] | DÖ ÇKAYA M, CANER A, CAN H, et al. Diagnostic value of a Rec-ELISA using Toxoplasma gondii recombinant SporoSAG, BAG1, and GRA1 proteins in murine models infected orally with tissue cysts and oocysts[J]. PLoS One, 2014, 9(9): e108329. |
| [26] | JONGERT E, MELKEBEEK V, DE CRAEYE S, et al. An enhanced GRA1-GRA7 cocktail DNA vaccine primes anti-toxoplasma immune responses in pigs[J]. Vaccine, 2008, 26(8): 1025–1031. |
| [27] | FERRANDIZ J, MERCIER C, WALLON M, et al. Limited value of assays using detection of immunoglobulin G antibodies to the two recombinant dense granule antigens, GRA1 and GRA6 Nt of Toxoplasma gondii, for distinguishing between acute and chronic infections in pregnant women[J]. Clin Diagn Lab Immunol, 2004, 11(6): 1016–1021. |



