2. 广东省水禽健康养殖重点实验室, 广州 510225
2. Guangdong Province Key Laboratory of Waterfowl Healthy Breeding, Guangzhou 510225, China
繁殖力是家养动物的重要经济性状,如何提高动物的繁殖性能一直是畜牧行业的热点研究问题。已有大量的研究表明,类固醇激素在动物生殖功能方面发挥重要作用,其合成与分泌直接调控着动物的繁殖性能[1]。类固醇激素合成急性调节蛋白(steroidogenic acute regukatory protein,StAR)是Clark等[2]1993年在鼠简质肿瘤细胞中分离得到的一个蛋白,并发现该蛋白可以促进胆固醇(类固醇合成的前体)由线粒体外膜向内膜的转运,从而调控类固醇激素的合成。研究发现,阻碍StAR蛋白的转录或翻译后90%的类固醇激素的生物合成受到抑制。这进一步证实了StAR蛋白是类固醇激素合成过程中的重要限速酶[3]。
人们相继在牛[4]、羊[5]、猪[6]和鸡[7]等主要的家养动物中鉴定到StAR蛋白,并发现其与繁殖性能相关。StAR基因在高产和低产香猪卵巢组织的表达存在显著差异,且其多态性与猪卵泡发育和睾丸形态相关[8-10]。同样, 在蛋鸡中也发现,StAR基因在高产和低产蛋鸡卵泡中差异表达,参与鸡产蛋性能调控[11]。然而,在水禽中鲜有StAR基因的相关报道,其基因序列也尚未获取。
本试验以山麻鸭和狮头鹅为研究对象,克隆获取鸭和鹅StAR基因序列,分析该基因的组织表达规律及其在不同时期鹅睾丸组织中的表达情况,为进一步解析StAR基因对水禽繁殖性能的调控机制打下基础。
1 材料与方法 1.1 试验动物本研究选取的试验动物为广东某公司提供的1日龄、52日龄和3岁龄狮头鹅(繁殖期和休产期)公鹅各6只,以及1岁龄的山麻鸭6只。采集大脑、小脑、下丘脑、垂体、心、肝、脾、肺、肾、胸肌、腿肌、腹脂、十二指肠和睾丸组织,置于液氮中速冻,-80 ℃冰箱中保存备用。
1.2 主要试剂和仪器Trizol reagent、荧光定量试剂(SYBR Green PCR Master Mix)和RNA固相清除剂购自Invitrogen公司;DNA纯化回收试剂盒、PCR superMix、PrimeScriptTM RT reagent Kit with gDNA Eraser反转录试剂盒、SMARTer RACE cDNA Amplification Kit、DNA Marker、感受态细胞DH5α和pMD18-T载体购自大连宝生物有限公司(TaKaRa)。Applied Biosystems梯度PCR仪(Veriti)和Applied Biosystems实时荧光定量PCR仪(7500)购自美国ABI公司;NanoDrop 2000C购自美国Thermo Scientific;电泳仪系统(DYY -12)购自北京市六一仪器厂;数码凝胶图像分析系统(Tanon-4100)购自上海天能科技有限公司。
1.3 山麻鸭和狮头鹅组织RNA提取和反转录冻存的组织样按Trizol reagent说明书的步骤提取总RNA,试验过程使用的剪刀、镊子及手术刀片分别用75%乙醇和RNA固相清除剂棉球反复擦拭处理。采用1%琼脂糖凝胶电泳法验证RNA的完整性,用NanoDrop 2000C测定总RNA浓度。按反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser说明书对总RNA进行反转录,合成cDNA,置于-20 ℃保存备用。
1.4 引物设计合成根据NCBI的参考序列,利用Primer 5.0设计鸭和鹅StAR基因的克隆引物以及内参基因β-actin荧光定量引物;根据克隆获得的序列设计鸭和鹅StAR基因的5′、3′RACE引物和荧光定量引物(表 1),送由华大基因有限公司合成。
|
|
表 1 PCR引物信息 Table 1 The information of PCR primers |
分别采用山麻鸭和狮头鹅下丘脑和睾丸混合cDNA样品作为模板进行PCR扩增,克隆StAR基因。PCR反应体系:2×PCR Mix 25 μL,ddH2O 22 μL,cDNA模板l μL,上、下游引物(10 mol·L-1)各1 μL,总共50 μL。PCR反应条件:94 ℃预变性2 min;94 ℃变性30 s,60 ℃(表 1)退火30 s,72 ℃延伸2 min,36个循环;72 ℃后延伸10 min;12 ℃保存。PCR产物采用1%琼脂糖凝胶电泳检测。切胶回收纯化PCR产物,检测回收产物浓度。参照pMD-18T载体说明书,回收产物与T载体16 ℃连接过夜。连接产物转化DH5α感受态细胞后,37 ℃培养12 h,挑取单菌落,接种于1 mL LA液体培养基中,37 ℃ 220 r·min-1振摇培养。菌液PCR鉴定阳性克隆菌,送至华大公司测序,并进行BLAST比对。
分别采用山麻鸭和狮头鹅下丘脑和睾丸混和RNA样品,根据试剂盒SMARTer RACE cDNA Amplification Kit说明书步骤进行RACE PCR,获得鸭和鹅StAR基因的全长。5′和3′RACE对应的基因特异引物(gene-specific primers,GSPs)见表 1,通用引物(universal primer mix)为试剂盒提供。同样,最后获得的PCR产物采用切胶回收纯化,进行克隆测序,送至华大基因有限公司测序,BLAST比对测序结果。
1.6 StAR基因序列分析根据已获得的鸭和鹅的StAR基因序列,与GenBank数据库基因组序列进行比对,分析基因的结构;采用NCBI的ORF Finder工具分析获得该基因相应的编码序列。从NCBI数据库中获取人、小鼠、斑马鱼、非洲爪蟾、猪、牛、鸡、珠鸡、火鸡、日本鹌鹑和斑胸草雀11个物种的氨基酸序列(表 2),与获得的鸭和鹅基因的推导氨基酸序列进行比对分析。利用DNAStar软件分析这13个不同物种StAR基因氨基酸序列之间的同源性;利用MEGA 4.1 (http://www.megasoftware.net/mega41.html)程序计算物种间的遗传距离,并通过邻近归并法Neighbor-joining构建种间系统发生树。
|
|
表 2 StAR氨基酸序列信息 Table 2 Information of StAR amino acid sequence |
采用荧光定量PCR方法检测StAR基因在鸭和鹅不同组织(大脑、小脑、下丘脑、垂体、心、肝、脾、肺、肾、胸肌、腿肌、腹脂、十二指肠和睾丸组织)中的表达,以及在不同时期狮头鹅(1日龄、52日龄和3岁龄繁殖期和休产期)睾丸组织中的表达量。每个样品重复3次,用β-actin作为内参基因进行校正。反应体系:2×PCR Master Mix 10 μL,ddH2O 9.1 μL,cDNA模板0.5 μL,上、下游引物(10 mol·L-1)各0.2 μL,总共20 μL。PCR反应条件:95 ℃ 1 min;95 ℃ 10 s,60 ℃ 30 s,40个循环;读取熔解曲线。采用相对模板量算法(ΔΔCt法)分析数据,基因相对表达量用2-ΔΔCt表示。ΔCt=目的基因Ct-内参基因Ct;ΔΔCt=待测样品中目的基因ΔCt-参照样品中目的基因ΔCt[12]。
1.8 数据分析试验结果用SPSS 20.0进行处理,采用单因素方差分析比较狮头鹅不同时期睾丸组织中基因相对表达量的差异,以P < 0.05表示差异有统计学意义。
2 结果 2.1 鸭StAR基因克隆采用山麻鸭的睾丸和下丘脑组织cDNA池为模板,设计3对引物,PCR分段扩增鸭StAR基因的编码区序列。1.5%的琼脂糖电泳检测结果显示,条带大小与预期相符(图 1A)。回收PCR片段,进行克隆测序,拼接测序结果,得到StAR基因的cDNA序列2 013 bp。根据已获得的序列设计引物,采用RACE PCR方法,获取基因的cDNA全序列,PCR结果获得3个5′RACE和1个3′RACE条带(图 1B),同样回收PCR片段,进行克隆测序,分析测序结果得到3个不同的5′末端和1个3′末端序列。因此,本试验克隆获得了鸭StAR基因3种不同的转录本dSTAR-A、dSTAR-B和dSTAR-C(已提交NCBI数据库,获取登录号:MT501867、MT501868和MT501869)。
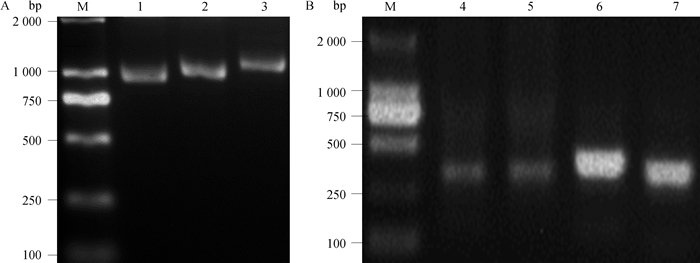
|
M.DNA相对分子质量标准DL2000;1~3.鸭StAR基因引物1-3的扩增产物;4~6.3个不同的鸭StAR基因5′RACE扩增产物;7.鸭StAR基因3′RACE扩增产物 M.DL2000 marker; 1-3.PCR products of primer 1-3 for duck StAR gene; 4-6.Three different products of 5′RACE for duck StAR gene; 7.Product of 3′RACE for duck StAR gene 图 1 鸭StAR基因的PCR扩增结果 Fig. 1 PCR amplification results of duck StAR gene |
序列分析发现,转录本dSTAR-A与NCBI预测的序列XM_027443533.1基本一致(有少数的SNP突变),序列全长为2 374 bp,序列的CDS为273~1 124 bp,共852 bp,编码283个氨基酸;含有5′UTR 272 bp(1~272 bp)和3′UTR 1 250 bp(1 125~2 374 bp)。与鸭的基因组序列(IASCAAS_PekingDuck_PBH1.5)比对分析,发现该序列位于23号染色体,NC_040068.1的1 668 058~1 671 889 bp区域,基因组序列全长3 832 bp,含7个外显子,6个内含子(图 2)。转录本dSTAR-B全长2 170 bp,比dSTAR-A第一外显子缺失了前面的1~204 bp,其他的序列与dSTAR-A完全相同,编码的氨基酸与dSTAR-A相同。转录本dSTAR-C全长2 402 bp,与dSTAR-A相比,缺失了其第一外显子前面的1~237 bp,插入了整个dSTAR-A的内含子2(265 bp),即dSTAR-C的外显子2与dSTAR-A的外显子2、内含子2和外显子3的序列一样(图 2)。dSTAR-C的CDS为436~1 152 bp,共717 bp,编码238个氨基酸。
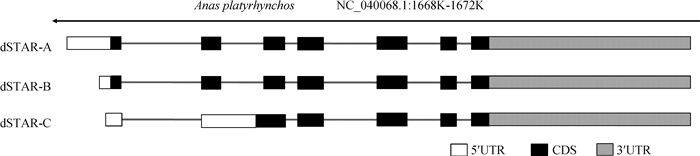
|
UTR.非翻译区域;CDS.编码序列。图 4同 UTR.Untranslated region; CDS.Coding DNA sequences. The same as figure 4 图 2 鸭StAR的基因结构 Fig. 2 The structure of duck StAR gene |
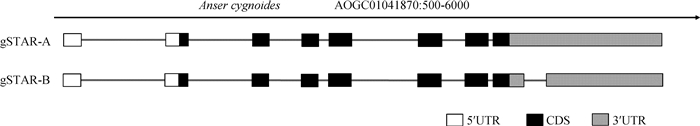
|
图 4 鹅StAR的基因结构 Fig. 4 The structure of goose StAR gene |
根据NCBI预测的鹅StAR基因序列(XM_013194444.1)设计3对引物,采用鹅睾丸和下丘脑组织的cDNA池为模板进行PCR扩增,克隆StAR基因的编码区序列,1.5%的琼脂糖电泳检测结果显示,3对引物均获得不同的条带(图 3A)。回收图 3中箭头指示的PCR片段,进行克隆测序。比对分析测序结果,发现引物6的两条条带为鹅StAR基因的cDNA序列,分别为1 339和1 094 bp;而引物4和5的条带为非特异性条带。根据已获得的序列设计引物,采用RACE PCR方法,获取基因的cDNA全序列,PCR结果分别获得1条5′和2条3′末端片段(图 3B)。回收PCR片段,进行克隆测序,分析测序结果得到1个5′末端和1个3′末端序列(其中条带4测序结果为非特异性条带)。因此,本试验克隆获得鸭StAR基因两种不同的转录本gSTAR-A和gSTAR-B(已提交NCBI数据库,获取登录号:MT501870和MT501871)。
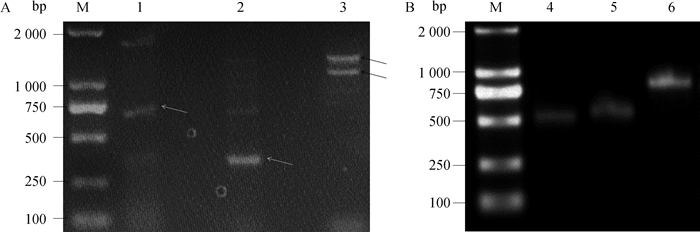
|
M.DNA相对分子质量标准DL2000;1~3.鹅StAR基因引物4~6的扩增产物;4~5.两个不同的鹅StAR基因3′RACE扩增产物;6.鹅StAR基因5′RACE扩增产物 M.DL2000 marker; 1-3.PCR products of primer 4-6 for goose StAR gene; 4-5.Two different products of 3′RACE for goose StAR gene; 6.Product of 5′RACE for goose StAR gene 图 3 鹅StAR基因的PCR扩增结果 Fig. 3 PCR amplification results of goose StAR gene |
序列分析发现,转录本gSTAR-A与NCBI预测的序列XM_013194444.1一致,序列全长为2 309 bp,序列的CDS为212~1 063 bp,共852 bp,编码283个氨基酸;含有5′UTR 211 bp(1~211 bp)和3′UTR 1 246 bp(1 064~2 309 bp)。与浙东白鹅的基因组序列(Anser cygnoides domesticus breed Zhedong scaffold174_128, whole genome shotgun sequence)比对分析发现,该基因位于AOGC01041870(13 989 bp)上的638~5 502 bp区域,基因组序列全长4 865 bp,包含8个外显子和7个内含子(图 4)。转录本gSTAR-B全长2 064 bp,比gSTAR-A缺失了245 bp,缺失区域为3′UTR的1 160~1 404 bp,编码序列不变(图 4)。
2.3 StAR基因编码序列同源进化分析从NCBI数据库下载已知序列的其他11个物种StAR基因的氨基酸序列,与试验获得的鸭和鹅的氨基酸序列进行同源性分析(表 2)。结果发现,鸭和鹅的氨基酸序列之间的同源性高达97.2%,它们与鸡、火鸡、日本鹌鹑和斑胸草雀等禽鸟类同源性较高(84%以上),与人类、小鼠、猪和牛等哺乳动物以及斑马鱼和非洲爪蟾等模式生物同源性也都达到65%以上(图 5A)。基于不同物种的StAR基因氨基酸序列,用NJ法构建分子系统发育树。进化树中鹅与鸭的遗传距离最近,且与鸡、火鸡、日本鹌鹑和斑胸草雀聚成一组,而与斑马鱼的关系最远,该结果与序列同源性分析结果一致(图 5B)。
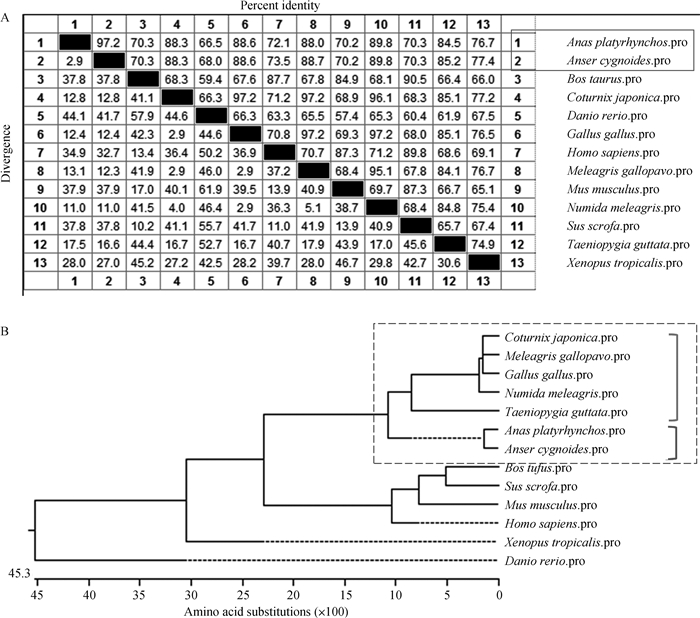
|
A. StAR基因氨基酸序列同源性分析;B. StAR基因氨基酸序列的进化树 A. Homology analysis of StAR amino acid sequence; B. Phylogenetic tree of StAR amino acid sequence 图 5 StAR基因编码序列同源进化分析 Fig. 5 Homologous evolution analysis of coding sequence of StAR gene |
采用荧光定量PCR方法检测StAR基因在山麻鸭和狮头鹅的大脑、小脑、睾丸等14个组织的表达情况。结果表明,该基因在鸭和鹅的14个组织中均有表达,且表达规律较为一致(图 6)。在睾丸、腹脂、胸肌和腿肌表达量相对其他组织较高,其中在睾丸的表达水平明显高于其他各个组织;而在其他组织中表达量较低。

|
Cer.大脑;Ceb.小脑;Hyp.下丘脑;Pit.垂体;Hea.心;Liv.肝;Spl.脾;Lun.肺;Kid.肾;BM.胸肌;LM.腿肌;Dub.十二指肠;Abf.腹脂;Tes.睾丸 Cer.Cerebrum; Ceb.Cerebellum; Hyp. Hypothalamus; Pit.Pituitary; Hea.Heart; Liv.Liver; Spl.Spleen; Lun.Lung; Kid.Kidney; BM.Breast muscle; LM.Leg muscle; Dub.Duodenum; Abf.Abdominal fat; Tes.Testis 图 6 StAR基因在鸭(A)和鹅(B)组织中的表达 Fig. 6 Expressions of StAR gene in various tissues of duck (A) and goose (B) |
采用荧光定量方法检测StAR基因在狮头鹅公鹅不同时期睾丸组织中的表达水平。比较StAR基因在1日龄、52日龄和3岁龄狮头鹅睾丸中的表达,发现其在1日龄时几乎不表达,表达量极显著低于52日龄和3岁龄(P < 0.01);在3岁龄时表达水平极显著高于1和52日龄(P < 0.01,图 7A)。比较StAR基因在成年公鹅繁殖期和休产期睾丸中的表达,发现其在繁殖期的表达水平极显著高于(P < 0.01)休产期(图 7B)。
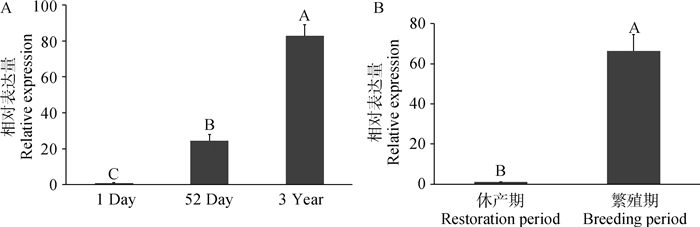
|
不同的大写字母表示差异极显著(P < 0.01) Different capital letters represent the extremely significant differences(P < 0.01) 图 7 不同时期鹅睾丸中StAR基因表达水平 Fig. 7 The expression levels of StAR gene in testis at different stages of googse |
基因的序列获取是基因功能研究的基础,StAR基因的序列在很多物种上已有报道,但是在水禽上尚未见报道[2, 4-7]。本研究根据NCBI数据库预测的序列设计引物进行克隆,获得了鸭StAR基因3个不同转录本,鹅StAR基因2个不同转录本,为后续StAR基因在水禽上的功能研究打下基础。其中,鹅的转录本gSTAR-A与NCBI预测的序列XM_013194444.1一致,而gSTAR-B在3′UTR有245 bp的缺失。鸭的3个转录本与预测序列主要在5′UTR部分不一致,后面的部分与预测序列一致。分析StAR基因的序列发现,该基因不同物种的cDNA序列长度不一,但是其编码序列和氨基酸序列长度比较接近,同源性也较高。其中人类、猪、牛、山羊、火鸡和斑马鱼等氨基酸序列均为285 aa,鸡和日本鹌鹑为281 aa[13-14]。本研究获得的鸭和鹅的StAR基因的最长转录本均编码283个氨基酸,氨基酸序列之间的同源性高达97.2%,与鸡、火鸡、日本鹌鹑和斑胸草雀等禽鸟类同源性也均在84%以上,该结果与Bauer等[7]在脊椎动物中的研究结果相似,均表明StAR基因在进化上是相对保守的。
StAR基因在睾酮的合成中起关键作用,为性别分化、生精和雄性生育所必需[15]。在人和小鼠中有大量的转录组测序或基因表达芯片发现,StAR基因主要在成年个体的肾上腺、睾丸和卵巢中表达(Expression Atlas, https://www.ebi.ac.uk/gxa/home)。在猪、鸡和斑马鱼中也有研究发现,StAR基因主要在睾丸或卵巢中表达[9, 16-17]。为了了解StAR基因在水禽中的表达情况,本研究采用荧光定量PCR方法检测该基因在山麻鸭和狮头鹅的组织表达规律。结果发现,StAR在鸭和鹅中表达规律类似,均在睾丸组织中的表达量最高,在腹脂、胸肌和腿肌中也有较高表达,说明StAR基因可能参与调控水禽的繁殖和肌肉生长。
类固醇激素的合成与分泌在调节动物繁殖过程中发挥着重要作用,而StAR是类固醇激素合成的特异性关键限速酶。已有大量研究证实,StAR能够调节睾酮合成,参与睾丸和卵泡的生长发育,调控排卵以及成熟卵泡的运输等多种繁殖相关的生理过程[18-20]。对家禽的研究表明,StAR基因可影响公鸡的睾丸发育和生精能力[21],能够参与母鸡卵泡的生长发育,还与母鸡的贮精能力有关[22];在鹅上也有研究发现,StAR基因在不同发育阶段的卵泡中差异表达[23]。然而,StAR基因在水禽睾丸发育方面罕有相关的报道,本试验为了进一步研究StAR基因对雄性水禽睾丸发育的影响,检测它在不同时期公鹅睾丸中的表达情况。比较不同年龄阶段发现,StAR基因在1日龄公鹅睾丸中几乎不表达,而到发育阶段(52日龄)时表达量显著上调,3岁龄的表达量又极显著高于52日龄,这表明StAR基因在睾丸发育过程中可能发挥着重要作用。Zhang等[9]在猪上也有类似的研究结果,在长大杂交小猪和成年广东黑猪中StAR基因均在睾丸中表达量最高,而且在7日龄的小猪睾丸中表达量显著低于成年猪。鹅属于季节性繁殖动物,具有很强的就巢性。本研究比较了处于繁殖期和休产期3年龄公鹅的睾丸组织,发现StAR基因在繁殖期的表达水平极显著高于休产期,表明该基因还可能参与调控鹅的繁殖周期节律。
4 结论本研究克隆获得水禽StAR基因的全长cDNA序列,包括鸭StAR基因的3个转录本(dSTAR-A、dSTAR-B和dSTAR-C)和鹅STAR基因的两个转录本(gSTAR-A和gSTAR-B)。StAR基因在成年鸭和鹅中均是在睾丸中表达量最高,在成年公鹅繁殖期睾丸中的表达量显著高于休产期,该结果表明,StAR基因可能参与公鹅生殖发育和繁殖性能的调控。
| [1] | RAO R M, JO Y, BABB-TARBOX M, et al. Regulation of steroid hormone biosynthesis in R2C and MA-10 Leydig tumor cells:role of the cholesterol transfer proteins StAR and PBR[J]. Endocr Res, 2002, 28(4): 387–394. |
| [2] | CLARK B J, SOO S C, CARON K M, et al. Hormonal and developmental regulation of the steroidogenic acute regulatory protein[J]. Mol Endocrinol, 1995, 9(10): 1346–1355. |
| [3] | MANNA P R, EUBANK D W, LALLI E, et al. Transcriptional regulation of the mouse steroidogenic acute regulatory protein gene by the cAMP response-element binding protein and steroidogenic factor 1[J]. J Mol Endocrinol, 2003, 30(3): 381–397. |
| [4] | HARTUNG S, RUST W, BALVERS M, et al. Molecular cloning and in vivo expression of the bovine steroidogenic acute regulatory protein[J]. Biochem Biophys Res Commun, 1995, 215(2): 646–653. |
| [5] | JUENGEL J L, MEBERG B M, TURZILLO A M, et al. Hormonal regulation of messenger ribonucleic acid encoding steroidogenic acute regulatory protein in ovine corpora lutea[J]. Endocrinology, 1995, 136(12): 5423–5429. |
| [6] | PILON N, DANEAU I, BRISSON C, et al. Porcine and bovine steroidogenic acute regulatory protein (StAR) gene expression during gestation[J]. Endocrinology, 1997, 138(3): 1085–1091. |
| [7] | BAUER M P, BRIDGHAM J T, LANGENAU D M, et al. Conservation of steroidogenic acute regulatory (StAR) protein structure and expression in vertebrates[J]. Mol Cell Endocrinol, 2000, 168(1-2): 119–125. |
| [8] | KIM J G, NONNEMAN D, VALLET J L, et al. Sequence variation and evaluation of inhibin α-subunit and steroidogenic acute regulatory protein for reproductive traits in swine[J]. Anim Genet, 2006, 37(4): 424–425. |
| [9] | ZHANG Y H, CUI Y, ZHANG X L, et al. Pig StAR:mRNA expression and alternative splicing in testis and Leydig cells, and association analyses with testicular morphology traits[J]. Theriogenology, 2018, 118: 46–56. |
| [10] |
毛宁, 王嘉福, 张福平, 等. 香猪卵巢StAR和CYP11A1基因的差异表达研究[J]. 中国畜牧兽医, 2018, 45(5): 1137–1144.
MAO N, WANG J F, ZHANG F P, et al. Study on differential expression of StAR and CYP11A1 genes in Xiang Pig ovary[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(5): 1137–1144. (in Chinese) |
| [11] |
李佳宜, 陆应林, 刘小凡, 等. 高产与低产蛋鸡卵巢和卵泡及相关基因的表达差异[J]. 南京农业大学学报, 2017, 40(5): 909–914.
LI J Y, LU Y L, LIU X F, et al. Differentiation of follicle expression between development and related genes high and low-laying hens[J]. Journal of Nanjing Agricultural University, 2017, 40(5): 909–914. (in Chinese) |
| [12] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the method[J]. Methods, 2001, 25(4): 402–408. |
| [13] |
杨沛方, 周志楠, 敖叶, 等. 黔北麻羊StAR基因的克隆、生物信息学分析及在单、多羔黔北麻羊不同性腺组织中的表达[J]. 中国畜牧杂志, 2020.
YANG P F, ZHOU Z N, AO Y, et al. Cloning and bioinformatics analysis of Qianbei Ma sheep StAR gene and its expression in different gonadal tissues of Mutiple and single lamb[J]. Chinese Journal of Animal Science, 2020. DOI: 10.19556/j.0258-7033.20200117-03 (in Chinese) |
| [14] | TUGAEVA K V, SLUCHANKO N N. Steroidogenic acute regulatory protein:structure, functioning, and regulation[J]. Biochemistry (Moscow), 2019, 84(S1): S233–S253. |
| [15] | DAVEY R A, GROSSMANN M. Androgen receptor structure, function and biology:from bench to bedside[J]. Clin Biochem Rev, 2016, 37(1): 3–15. |
| [16] | SECHMAN A, ANTOS P, KATARZYŃSKA D, et al. Effects of 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin on secretion of steroids and STAR, HSD3B and CYP19A1 mRNA expression in chicken ovarian follicles[J]. Toxicol Lett, 2014, 225(2): 264–274. |
| [17] | SHANG G H, PENG X Y, JI C, et al. Steroidogenic acute regulatory protein and luteinizing hormone are required for normal ovarian steroidogenesis and oocyte maturation in zebrafish[J]. Biol Reprod, 2019, 101(4): 760–770. |
| [18] | MA D R, LUO N Q, XUE G Q. Trimethyltin (TMT) reduces testosterone production in adult leydig cells in rats[J]. Int J Toxicol, 2019, 38(6): 493–500. |
| [19] | OZAKI Y, DAMSTEEGT E L, SETIAWAN A N, et al. Expressional regulation of gonadotropin receptor genes and androgen receptor genes in the eel testis[J]. Gen Comp Endocrinol, 2019, 280: 123–133. |
| [20] |
李华振, 刘武军, 刘秋月, 等. 甲状腺激素受体基因调控动物繁殖的研究进展[J]. 畜牧兽医学报, 2019, 50(2): 243–252.
LI H Z, LIU W J, LIU Q Y, et al. Research progress on the regulative role of thyroid hormone receptor gene in animal reproduction[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(2): 243–252. (in Chinese) |
| [21] | ANSARI M, ZHANDI M, KOHRAM H, et al. D-Aspartate amends reproductive performance of aged roosters by changing gene expression and testicular histology[J]. Reprod Fertil Dev, 2018, 30(7): 1038–1048. |
| [22] |
马腾壑, 范静, 王攀林, 等. 贮精能力差异母鸡的贮精腺形态、激素水平及激素受体基因表达量的研究[J]. 畜牧兽医学报, 2020, 51(8): 1845–1852.
MA T H, FAN J, WANG P L, et al. The sperm storage tubules morphology, hormones concentration, and hormone receptor genes expression of laying hens with divergent sperm storage ability[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(8): 1845–1852. (in Chinese) |
| [23] |
荣玉静, 夏露, 胡深强, 等. 固醇类物质对鹅颗粒细胞胆固醇转运相关基因表达的影响[J]. 四川农业大学学报, 2019, 37(1): 103–109.
RONG Y J, XIA L, HU S Q, et al. Effects of sterols on the expression of cholesterol transporter related genes in geese granulosa cells[J]. Journal of Sichuan Agricultural University, 2019, 37(1): 103–109. (in Chinese) |



