姜黄素是从姜科植物姜黄中提取的多酚类物质,也是姜黄发挥药理作用最重要的活性成分[1],其具有抗氧化、抗炎、抗肿瘤、抗糖尿病等药理作用[2-4],姜黄素在多方面的治疗效果,被认为与其抗氧化和抗炎特性有关[5]。多项研究表明,姜黄素具有清除活化的巨噬细胞中超氧自由基、过氧化氢和一氧化氮(NO),还原铁络合物并抑制脂质过氧化的能力,并能够通过降低组胺水平和增加肾上腺的天然可的松的产量来减轻炎症[6-7]。体外研究还发现,姜黄素具有一定的抗菌、抗病毒和抗真菌活性[8-10]。姜黄素即使在4 000~8 000 mg·d-1,甚至高达12 000 mg·d-1的剂量下也显示出良好的耐受性和安全性,已被美国食品与药品监督管理局(FDA)认证为“公认安全”(GRAS)[11-14]。
为减少抗生素滥用造成的危害,我国农业农村部第194号公告[15]规定,自2020年1月1日起,饲料中全面禁止添加抗生素,植物提取物因其广泛的药理作用,逐渐成为研究的热点。有研究表明,断奶仔猪日粮中添加300或400 mg·kg-1姜黄素与添加50 mg·kg-1喹烯酮对改善仔猪生长有相似的作用,均可以降低料重比、隐窝深度和TLR4 mRNA表达,增加绒毛高度:隐窝深度比,且在改善断奶仔猪的肠黏膜屏障完整性、形态和免疫状态方面, 姜黄素比喹烯酮更有效[16]。
但姜黄素属于低溶解度、低渗透性类物质[17],口服后吸收少,代谢消除快[18],导致姜黄素的生物利用度较低,极大地限制了其临床应用。对于姜黄素等难溶性药物,选用合适的载体将其制成固体分散体是提高难溶性药物生物利用度,促进其溶解和在机体内吸收的有效途径[19-20]。固体分散体可以将难溶性药物高度分散在固体载体材料中,提高难溶药物的溶出速率和溶解度,进而提高药物在机体内的吸收和生物利用度[21-22]。本试验对比研究了姜黄素固体分散体与普通的姜黄素预混剂在仔猪体内的药动学过程,探究姜黄素固体分散体在断奶仔猪体内的药动学规律,为姜黄素固体分散体的开发与临床应用提供科学依据。
1 材料与方法 1.1 仪器与设备高效液相色谱仪:岛津SIL-20A,shimadzu corporation;电喷雾-串联四级杆质谱仪:API 4000MS/MS,美国应用生物系统公司,配Analyst4.1.5软件;冷冻离心机:Mach 1.6R冷冻型,美国Thermo Fisher公司;分析天平:AUX 120型,日本SHIMADZU(岛津)公司;色谱柱:C18 Luna R Ornega (50 mm×2.7 mm×1.6 μm),美国Phenomenex公司。
1.2 试验药品与试剂姜黄素对照品:含量98.9%,批号C39R-G43J,由中国食品药品检定研究院提供;姜黄素原料药:含量94.5%,批号20180104,由广州市科虎生物技术研究开发中心提供;姜黄素预混剂,含量10%,批号20180126,由广州市科虎生物技术研究开发中心提供;姜黄素固体分散体,含量10%,批号20180123,华南农业大学兽医学院药理教研室研制,委托佛山市正典生物科技有限公司中试生产;乙腈和甲醇均为色谱纯,Fisher Scientific公司产品;冰乙酸、乙酸乙酯等均为国产分析纯试剂。
1.3 试验动物16头健康二元杂交猪(约克夏×长白),公母各半,7周龄左右,体重(14.43±1.30) kg,饲喂不含抗菌药物的全价日粮,自由采食和饮水。试验前观察1周,临床表现健康后进行试验,试验前16 h起及给药后4 h期间禁食,仅自由饮水。
1.4 试验设计采用平行试验设计方法,将16头断奶仔猪随机编号并分为2组,每组8头,剂量以姜黄素计,按100 mg·kg-1分别单剂量灌胃内服10%姜黄素固体分散剂和灌胃内服10%姜黄素预混剂。
1.5 样品采集将猪仰卧保定好,前腔静脉采血。分别于给药后0、5、15、30、45 min及1、2、2.5、3、3.5、4、5、6、8、10、12、16、24 h采集血浆样品,置于一次性真空采血管中,4 000 r·min-1离心10 min后吸取上层血浆,-80 ℃冰箱保存,待测。
1.6 血浆样品前处理将冷冻保存的姜黄素血浆样品置于室温下,避光,自然解冻,涡旋混匀后,准确吸取0.5 mL血浆置于15 mL离心管中,定量加入0.25 mL乙腈,涡旋30 s后加入4 mL乙酸乙酯,涡旋1 min,于300 r·min-1条件下震荡5 min,8 000 r·min-1离心10 min,取上层液体4 mL,于37 ℃条件下,氮气吹干,0.25 mL甲醇复溶,过0.22 μm针式过滤器,供HPLC-MS/MS检测。
1.7 测定方法1.7.1 色谱条件 色谱柱:C18 Luna R Ornega(50 mm×2.7 mm,1.6 μm),美国Phenomenex公司;流动相:A相为0.1%甲酸水溶液,B相为甲醇;梯度洗脱程序见表 1;流速:0.30 mL·min-1;柱温:37 ℃;进样量:5 μL。
|
|
表 1 梯度洗脱程序 Table 1 Gradient elution procedure |
1.7.2 质谱条件 质谱扫描模式:多反应检测(multiple reaction monitor,MRM);电喷雾离子源负离子扫描(electrospray ionization,ESI-);电喷雾电压(ionspray,IS):4 kV;雾化气压力(nebulizer gas1,GS1):70 psi;辅助气压力(ion source gas2,GS2):50 psi;气帘气压力(curtain gas,CUR):25 psi;离子源温度(the source temperature,TEM):650 ℃;姜黄素的MRM质谱检测参数见表 2。
|
|
表 2 姜黄素的MRM质谱检测参数 Table 2 MRM MS detection parameters of curcumin |
1.7.3 检测限与定量限 取猪空白血浆450 μL,加入50 μL质量浓度为2.0、5.0、10.0 ng·mL-1的姜黄素标准工作液,使得血浆中姜黄素的质量浓度分别为0.2、0.5、1.0 ng·mL-1,按“1.6”方法进行血浆药物提取,按照“1.7.1”色谱条件、“1.7.2”质谱条件进行测定,以信噪比S/N≥3时添加最小浓度为检测限(LOD),S/N≥10时添加最小浓度为定量限(LOQ)。
1.7.4 标准曲线和线性范围 取空白血浆450 μL,加入50 μL姜黄素标准工作液,分别制得0.5、1.0、2.5、5.0、10.0、25.0、50.0 ng·mL-1系列质量浓度的加标样品。按照“1.6”方法进行血浆药物提取,按“1.7.1”色谱条件、“1.7.2”质谱条件进行测定。将姜黄素色谱峰面积(A)分别与其药物浓度(C)作线性回归,绘制标准曲线,求得标准曲线的回归方程和相关系数。
1.7.5 回收率与精密度 将姜黄素标准添加溶液加入到猪空白血浆中,制得低(0.5 ng·mL-1)、中(5.0 ng·mL-1)、高(50.0 ng·mL-1)3个浓度血浆添加样品,按照“1.6”方法进行血浆药物提取,按“1.7.1”色谱条件、“1.7.2”质谱条件进行测定。记录定量离子峰面积,按照标准曲线法计算实测值,每个浓度重复5次用以做批内精密度分析,在不同时间连续制备并测定3个分析批次做批间精密度分析。
1.8 数据处理与统计分析以血浆药物浓度平均值-时间,绘制药时曲线图,数据采用WinNonlin 5.2.1(Pharsight Corp., Raleigh, NC. USA)处理,选择非房室模型计算药动学参数,并使用SPSS19.0独立样本T检验分析数据。
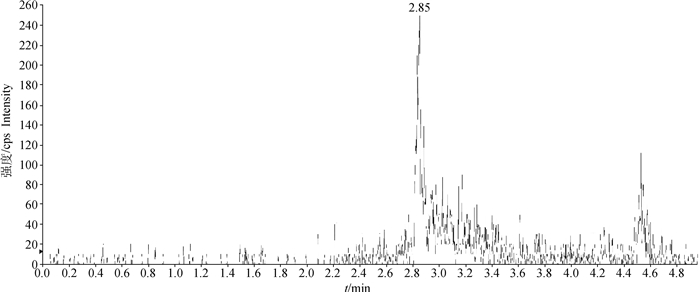
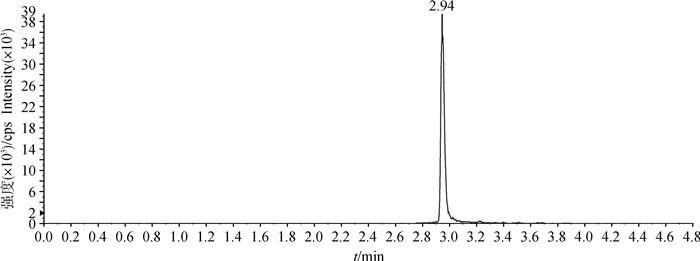
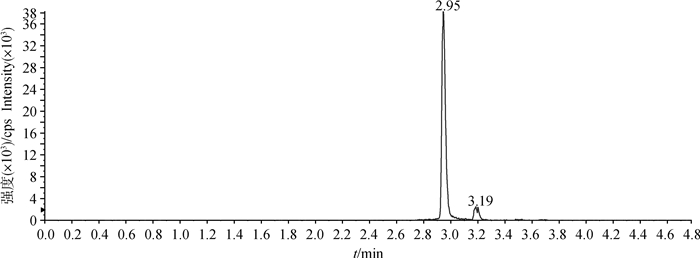
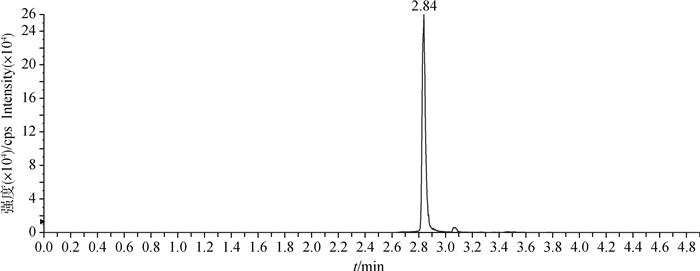
2 结果 2.1 色谱条件适用性在上述处理方法和色谱条件下,空白血浆中的内源性化合物对姜黄素的检测无干扰,药物峰与血浆中杂质分离良好,色谱保留时间为2.85 min左右(图 1~5)。
|
图 1 猪空白血浆定量离子色谱图 Fig. 1 Chromatogram of blank plasma samples of piglet |
|
图 2 姜黄素标准工作液(10.0 ng·mL-1)定量离子色谱图 Fig. 2 Quantitative ion chromatogram of curcumin standard working solution (10.0 ng·mL-1) |
|
图 3 猪空白血浆添加姜黄素标准工作液(10.0 ng·mL-1)定量离子色谱图 Fig. 3 Quantitative ion chromatogram of curcumin standard working solution (10.0 ng·mL-1) added to blank pig plasma |
|
图 4 猪灌服姜黄素固体分散体3 h的血浆定量离子色谱图 Fig. 4 Quantitative ion chromatogram of curcumin in plasma of piglets given solid dispersion for 3 h |
|
图 5 猪灌服姜黄素预混剂3 h的血浆定量离子色谱图 Fig. 5 Quantitative ion chromatogram of curcumin in plasma of piglets given premix for 3 h |
仔猪血浆中姜黄素的检测限为0.2 ng·mL-1,定量限为0.5 ng·mL-1。结果表明,该方法灵敏度高,可以满足血浆中姜黄素检测需要。
2.3 标准曲线和线性范围空白血浆添加姜黄素的质量浓度为0.5~50.0 ng·mL-1线性关系良好,r>0.99。
2.4 回收率与精密度姜黄素在低(0.5 ng·mL-1)、中(5.0 ng·mL-1)、高(50.0 ng·mL-1)3个添加浓度的回收率为95.60%~ 104.01%,批内变异系数为3.14%~ 12.49%,批间变异系数为4.57%~9.99%,符合《兽用化学药物临床药代动力学试验指导原则》要求。
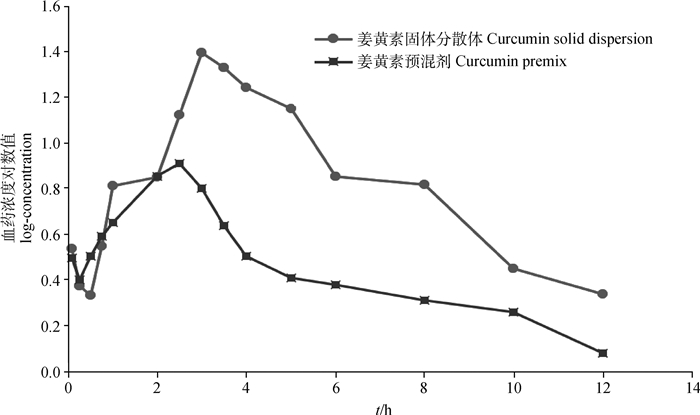
2.5 血药浓度与主要药动学参数健康仔猪灌服10%姜黄素固体分散体和姜黄素预混剂后的药时曲线见图 6。试验中血药浓度-时间数据采用WinNonlin5.2.1非房室模型处理,得到姜黄素固体分散体和姜黄素预混剂的药动学参数,详见表 3。通过SPSS19.0独立样本T检验进行统计分析,比较仔猪灌服姜黄素固体分散体和姜黄素预混剂的药动学参数,结果表明,与预混剂相比,仔猪灌服姜黄素固体分散体后主要药动学参数差异显著(P < 0.01),达峰时间(Tmax)明显延迟,峰浓度(Cmax)显著提高,药时曲线下面积(AUC)明显增大,姜黄素固体分散体的相对生物利用度(F)为280.39%。
|
图 6 口服姜黄素固体分散体和预混剂在猪体内的血药浓度对数值-时间曲线 Fig. 6 log-concentration vs time curve of plasma drug in piglets after oral administration of curcumin solid dispersion and premix |
|
|
表 3 仔猪灌服姜黄素固体分散体和预混剂后的主要药动学参数比较 Table 3 Comparison of the main pharmacokinetic parameters of curcumin solid dispersion and premix in piglets |
本试验建立了姜黄素在猪血浆中的提取、净化方法和HPLC-MS/MS检测方法,并对断奶仔猪灌服姜黄素固体分散体和普通姜黄素预混剂后的药动学进行比较。研究表明,姜黄素可增强巨噬细胞的吞噬活性[23],具有抗菌、抗病毒和抗真菌活性,作为一种天然绿色饲料添加剂,可提高饲料转化率,改善猪肉品质[24]。但姜黄素极难溶于水,口服后姜黄素在体内的低溶解度大大限制了机体对药物的吸收,且姜黄素进入机体后消除快,最终导致生物利用度低,难以发挥其临床疗效。Bangphumi等[25]向大鼠灌服40 mg·mL-1姜黄素,绝对生物利用度仅有0.13%。Gutierres等[26]通过液相色谱法测定大鼠血浆中的姜黄素浓度,大鼠灌服姜黄素500 mg·kg-1后Cmax为(0.06±0.01) μg·mL-1,消除半衰期后t1/2β为(32.70±12.92) min,口服的绝对生物利用度仅有0.47%。
通过选择合适的载体将姜黄素制成固体分散体后,可有效地改善机体对姜黄素的吸收,提高药物的生物利用度。黄秀旺等[27]给小鼠分别灌胃300 mg·kg-1的姜黄素混悬液和姜黄素固体分散体溶液,研究结果表明灌胃给药15 min时的血药峰浓度高达4 120 μg·L-1,灌胃给药后3 h,姜黄素混悬液的吸收率为11.8%,而姜黄素固体分散体溶液的吸收率高达79.7%,吸收率约为姜黄素混悬液的6.75倍。罗见春等[28]将姜黄素制备成姜黄素磷脂复合物,按50 mg·kg-1剂量给大鼠灌服后,AUC由172.41 μg·h·L-1增加至637.38 μg·h·L-1,Cmax由61.64 μg·L-1增大至74.34 μg·L-1。韩刚等[29]将姜黄素PVP固体分散体、姜黄素PEG固体分散体和姜黄素片剂按200 mg·kg-1剂量分别给大鼠灌胃后,结果显示姜黄素PVP固体分散体和PEG固体分散体的AUC分别为19.26和15.47 h·mg·L-1,远大于姜黄素片剂的2.79 h·mg·L-1。
本试验对姜黄素固体分散体在猪体内的药动学研究发现,按100 mg·kg-1姜黄素分别给仔猪灌服姜黄素固体分散体和姜黄素预混剂后,AUC分别为(104.53±38.67)和(37.82±11.48) h·ng·mL-1;Tmax分别为(3.25±0.38)和(2.31±0.37) h;Cmax分别为(26.65±9.65)和(9.55±2.75) ng·mL-1;t1/2β分别为(3.55±2.17)和(6.93±0.86) h;MRT分别为(5.23±0.53)和(4.26±0.47) h。与姜黄素预混剂相比较,姜黄素固体分散体AUC显著增加,Tmax推迟,Cmax显著增大。仔猪灌服姜黄素固体分散体的相对生物利用度为280.39%,为普通预混剂的2.8倍。本研究中的姜黄素固体分散体与文献中报道的鼠[27-28]、兔[19]灌服姜黄素固体分散体后具有相似的药动学特征,相比于预混剂或片剂,均可以显著增加机体对药物的吸收,提高相对生物利用度。
4 结论通过剂型改造,将姜黄素做成固体分散体后,姜黄素在猪体内的达峰时间延迟,峰浓度明显增加,生物利用度显著增大,更有利于姜黄素进入机体发挥其生物活性。
| [1] |
王涵东, 梁维邦. 姜黄素的研究进展[J]. 江苏医药, 2014, 40(10): 1193–1194.
WANG H D, LIANG W B. Research progress of curcumin[J]. Jiangsu Medical Journal, 2014, 40(10): 1193–1194. (in Chinese) |
| [2] |
秦洛宜. 姜黄、莪术、郁金的化学成分与药理作用研究分析[J]. 临床研究, 2019, 27(2): 3–4.
QIN L Y. Analysis of chemical constituents and pharmacological effects of turmeric, medlar and turmeric[J]. Clinical Research, 2019, 27(2): 3–4. (in Chinese) |
| [3] |
胡文卓, 李杜, 冯玛莉. 姜黄素药理作用的研究进展[J]. 世界最新医学信息文摘, 2017, 17(40): 31–33.
HU W Z, LI D, FENG M L. Research progress on pharmacological effects of curcumin[J]. World Latest Medicine Information, 2017, 17(40): 31–33. (in Chinese) |
| [4] |
苗淑涵, 高晋生. 姜黄素药理作用的研究进展[J]. 光明中医, 2017, 32(15): 2284–2287.
MIAO S H, GAO J S. Research progress on pharmacological effect of curcumin[J]. Guangming Journal of Chinese Medicine, 2017, 32(15): 2284–2287. (in Chinese) |
| [5] | MENON V P, SUDHEER A R. Antioxidant and anti-inflammatory properties of curcumin[M]//AGGARWAL B B, SURH Y J, SHISHODIA S. The Molecular Targets and Therapeutic Uses of Curcumin in Health and Disease. Boston, MA: Springer, 2007: 105-125. |
| [6] | NAGPAL M, SOOD S. Role of curcumin in systemic and oral health: an overview[J]. J Nat Sci Biol Med, 2013, 4(1): 3–7. |
| [7] | ALOK A, SINGH I D, SINGH S, et al. Curcumin-pharmacological actions and its role in oral submucous fibrosis: a review[J]. J Clin Diagn Res, 2015, 9(10): ZE01–ZE03. |
| [8] | ZOROFCHIAN MOGHADAMTOUSI S, ABDUL KADIR H, HASSANDARVISH P, et al. A review on antibacterial, antiviral, and antifungal activity of curcumin[J]. BioMed Res Int, 2014, 2014: 186864. |
| [9] | TYAGI P, SINGH M, KUMARI H, et al. Bactericidal activity of curcumin I is associated with damaging of bacterial membrane[J]. PLoS One, 2015, 10(3): e0121313. |
| [10] | LI Y M, WANG J, LIU Y C, et al. Antiviral and virucidal effects of curcumin on transmissible gastroenteritis virus in vitro[J/OL]. J Gen Virol, 2020. (2020-07-17)[2020-08-10]. https://www.microbiologyresearch.org/content/journal/jgv/10.1099/jgv.0.001466#tab2. |
| [11] | SANMUKHANI J, SATODIA V, TRIVEDI J, et al. Efficacy and safety of curcumin in major depressive disorder:a randomized controlled trial[J]. Phytother Res, 2014, 28(4): 579–585. |
| [12] |
李然, 刘晓红, 孔天, 等. 姜黄素的安全性毒理学评价[J]. 卫生研究, 2011, 40(6): 747–749.
LI R, LIU X H, KONG T, et al. Safety toxicology evaluation of curcumin[J]. Journal of Hygiene Research, 2011, 40(6): 747–749. (in Chinese) |
| [13] | Laurus Labs Private Ltd. GRAS Notice (GRN) No. 822 Curcumin[DB/OL]. 2018. (2018-11-15)[2020-07-10]. https://www.fda.gov/media/132575/download. |
| [14] | HEWLINGS S J, KALMAN D S. Curcumin: a review of its' effects on human health[J]. Foods, 2017, 6(10): 92. |
| [15] |
中华人民共和国农业农村部.中华人民共和国农业农村部公告第194号[EB]. (2019-07-10)[2020-05-07]. http://www.moa.gov.cn/govpublic/xmsyj/201907/t20190710_6320678.htm.
Ministry of Agriculture and Rural Affairs, PRC. Gazette of the Ministry of agriculture of the people's republic of China, No. 194[EB]. http://www.moa.gov.cn/govpublic/xmsyj/201907/t20190710_6320678.htm. |
| [16] | XUN W J, SHI L G, ZHOU H L, et al. Effects of curcumin on growth performance, jejunal mucosal membrane integrity, morphology and immune status in weaned piglets challenged with enterotoxigenic Escherichia coli[J]. Int Immunopharmacol, 2015, 27(1): 46–52. |
| [17] | BERGINC K, TRONTELJ J, BASNET N S, et al. Physiological barriers to the oral delivery of curcumin[J]. Pharmazie, 2012, 67(6): 518–524. |
| [18] |
梁宇飞, 张欣欣, 赵丽艳, 等. 从姜黄素的代谢特点探讨姜黄素与胡椒碱的联合应用[J]. 神经药理学报, 2019, 9(6): 47–57.
LIANG Y F, ZHANG X X, ZHAO L Y, et al. Discussed the application of curcumin combined with piperine based on the metabolic characteristics of curcumin[J]. Acta Neuropharmacologica, 2019, 9(6): 47–57. (in Chinese) |
| [19] |
高华宏.复方姜黄素分散片的研制及其在家兔体内的药动学研究[D].广州: 广州中医药大学, 2011.
GAO H H. The development of compound curcumin dispersible tablets and the pharmacokinetics study in rabbits[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2011. (in Chinese) |
| [20] |
董春柳, 刘艳艳, 王天梓, 等. 阿苯达唑固体分散体的制备及分析[J]. 畜牧兽医学报, 2014, 45(6): 1018–1023.
DONG C L, LIU Y Y, WANG T Z, et al. Preparation and analysis of albendazole solid dispersions[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(6): 1018–1023. (in Chinese) |
| [21] |
许东晖, 王胜, 梅雪婷, 等. 聚乙烯吡咯烷酮K30对姜黄素的增溶作用研究[J]. 中药材, 2008, 31(3): 438–442.
XU D H, WANG S, MEI X T, et al. Studies on solubility enhancement of curcumin by polyvinyl-pyrrolidione K30[J]. Journal of Chinese Medicinal Materials, 2008, 31(3): 438–442. (in Chinese) |
| [22] |
崔福德.制剂新技术[M]//崔福德.药剂学. 6版.北京: 人民卫生出版社, 2009: 375-396.
CUI F D. New preparation technology[M]//CUI F D. Pharmacy. 6th ed. Beijing: People's Medical Publishing House, 2009: 375-396. (in Chinese) |
| [23] |
李新建, 刘晓城. 姜黄素调节小鼠免疫功能的实验研究[J]. 中国组织化学与细胞化学杂志, 2005, 14(2): 132–135.
LI X J, LIU X C. Effect of curcumin on immunological function of the mice[J]. Chinese Journal of Histochemistry and Cytochemistry, 2005, 14(2): 132–135. (in Chinese) |
| [24] |
周明, 张靖, 申书婷, 等. 姜黄素在育肥猪中应用效果的研究[J]. 中国粮油学报, 2014, 29(3): 67–73.
ZHOU M, ZHANG J, SHEN S T, et al. The applied effects of curcumin in finishing swine[J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(3): 67–73. (in Chinese) |
| [25] | BANGPHUMI K, KITTIVIRIYAKUL C, TOWIWAT P, et al. Pharmacokinetics of curcumin diethyl disuccinate, a prodrug of curcumin, in wistar rats[J]. Eur J Drug Metab Pharmacokinet, 2016, 41(6): 777–785. |
| [26] | GUTIERRES V O, CAMPOS M L, ARCARO C A, et al. Curcumin pharmacokinetic and pharmaco-dynamic evidences in streptozotocin-diabetic rats support the antidiabetic activity to be via metabolite(s)[J]. Evid Based Complement Altern Med, 2015, 2015: 678218. |
| [27] |
黄秀旺, 许建华, 吴国华, 等. 姜黄素固体分散体在小鼠体内的药代动力学[J]. 中国药理学通报, 2008, 24(11): 1525–1527.
HUANG X W, XU J H, WU G H, et al. Pharmacokinetics of curcumin solid dispersion in mice[J]. Chinese Pharmacological Bulletin, 2008, 24(11): 1525–1527. (in Chinese) |
| [28] |
罗见春, 何丹, 尹华峰, 等. 姜黄素磷脂复合物的药代动力学评价[J]. 第二军医大学学报, 2014, 35(7): 754–757.
LUO J C, HE D, YIN H F, et al. Pharmacokinetics evaluation of curcumin-phospholipid complex[J]. Academic Journal of Second Military Medical University, 2014, 35(7): 754–757. (in Chinese) |
| [29] |
韩刚, 翟丽, 赵琳琳, 等. 姜黄素固体分散体在大鼠体内的药动学研究[J]. 中国药学杂志, 2009, 44(9): 698–700.
HAN G, ZHAI L, ZHAO L L, et al. Pharmaco-kinetics of curcumin solid dispersion in rats in vivo[J]. Chinese Pharmaceutical Journal, 2009, 44(9): 698–700. (in Chinese) |



