2. 中国中医科学院, 北京 100193
2. China Academy of Chinese Medical Sciences, Beijing 100193, China
病理学信息是重大疾病确诊的最终诊断标准,探索疾病的病理改变,对分析和探讨疾病的致病性、致死性意义重大,对研究疾病机制有重要帮助[1]。非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染引起的家猪和野猪的一种急性、热性、高度接触性传染病,世界动物卫生组织将其列为法定报告动物疫病,中国也将其列为一类动物疫病。我国自2018首次报道后,ASF在国内迅速传播[2-3],2019年赵东明团队首次分离并鉴定中国第一个非洲猪瘟病毒毒株(Pig/HLJ/18)[4]。目前,对该病的流行病学、病原学以及疫苗等方面的研究取得巨大进展,随着认知的深入和早期识别、早期措施的介入,非洲猪瘟出现了一些新的临床特征和病理变化,但迄今我国非洲猪瘟的病理学研究报道仍较罕见。
为进一步明确非洲猪瘟的病理学特征,本文采用经典病理学研究方法,复制急性非洲猪瘟病例,通过对病死猪各组织器官尸检病变的观察,建立临床病理学评价标准,通过对剖检病变的出现时间、频率、程度等方面的综合分析,再结合各组织器官的病理组织学变化,探讨病理变化与疾病发生发展的内在关系及其病理机制,为非洲猪瘟的防控和鉴别诊断提供依据。
1 材料与方法 1.1 实验动物60日龄健康长白猪13头,体重约20 kg,检疫证号1100365616。编号,称重。观察筛选期为6 d。试验组猪的纳入标准:实时荧光定量PCR方法检测血清ASFV核酸阴性;无临床症状;未发生过传染病和其他疾病。
1.2 攻毒方法与病原检测试验全程在中国动物疫病预防控制中心动物生物安全三级实验室进行。
肌内注射ASFV毒株Pig/HLJ/18(哈尔滨兽医研究所惠赠),剂量102HAD50·mL-1。攻毒后第6天(days post inoculation,dpi)采集血清,灭活,实时荧光定量PCR方法检测血清ASFV核酸,检测依据SN/T 1559—2010,当样品扩增结果有典型的扩增曲线且Ct值<40,判为ASFV阳性;扩增结果无Ct值或背景信号,判为ASFV阴性。
1.3 临床症状的观察参照我国《非洲猪瘟疫情应急实施方案》(2020年版)进行临床症状观察,记录发病时间、死亡时间、死亡数量等数据。
1.4 病理学数据的采集和统计试验期间的死亡猪,全部进行系统剖检、记录和拍照。采集的组织用中性福尔马林保存,石蜡切片,苏木素伊红染色,光学显微镜观察。病变(分类变量)表示为计数频率和百分比,即发生该病变的猪数/试验猪数×100%。病变程度(连续变量)按各组织器官的不同病变进行分级和评分[5-6]。
2 结果 2.1 临床症状筛选期所有试验猪血清ASFV核酸均为阴性,6 dpi所有试验猪Ct值<40,Ct值=30.74±3.70,非洲猪瘟病例复制成功,发病率100%。发病猪符合非洲猪瘟急性、热性、高传染性等临床特征,3~4 dpi开始出现临床症状,最初表现为食欲减退和体温升高,皮肤潮红先出现在耳部,再发展至颈部、前躯乃至全身皮肤,之后食欲废绝、精神沉郁,警觉性降低,喜卧,皮肤可见出血斑点,呼吸困难,衄血或便血,偶见关节肿胀。部分猪死前可见抽搐、震颤等神经症状。6 dpi出现死亡,至15 dpi全部死亡,病死率100%。中位死亡时间10 dpi,平均死亡时间8.25 dpi。
2.2 临床病理学评价标准的建立根据病死猪各组织器官的病变特点和病变程度,建立急性非洲猪瘟的临床病理学评价标准,对病变进行分级和量化,见表 1。0级为未出现明显眼观病变(0分),1级为轻微病变(1分),2级为中度病变(3分),3级为重度病变(5分),对无法量化的指标,如流鼻血(衄血),则以有(3分)或无(0分)评分。数值变量总和即为该组织器官的病变评分,分值越大表示病变程度越严重。
|
|
表 1 急性非洲猪瘟临床病理学评价标准 Table 1 Clinicopathological evaluation standard for acute African swine fever |
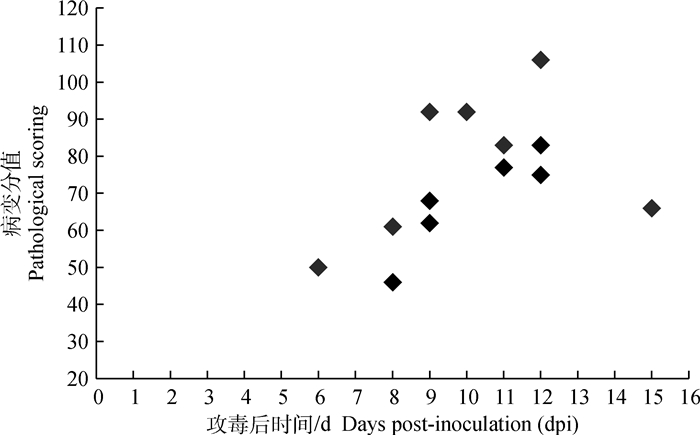
由图 1可见,根据死亡时间和死亡数量,病程发展可分为3个阶段,早期(6~7 dpi),中期(8~12 dpi)和后期(13~15 dpi)。7.7%(1/13)的病例死亡于早期,此时病变尚不明显,提示最急性死亡病例尚未出现明显病变即发生死亡;84.6%(11/13)的病例在中期死亡,这一阶段病情逐渐加重,病变明显,是死亡的集中时期;7.7%(1/13)的病例死亡于后期,病变程度较中期为轻,但较早期为重。
|
图 1 13头试验猪死亡时间、数量与病变程度的关系 Fig. 1 The relationship between the death time, the death number and pathological severity in 13 experimental pigs |
|
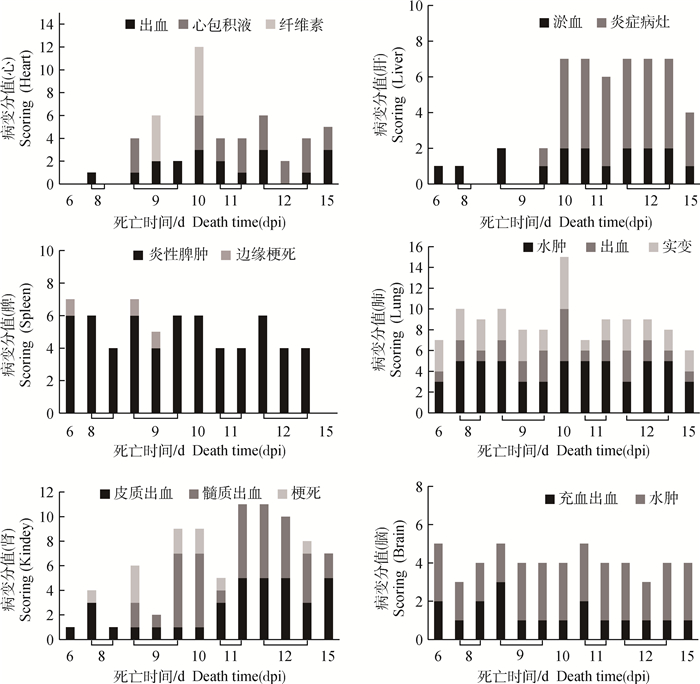
图 2 急性非洲猪瘟主要器官的剖检病变与死亡时间的关系 Fig. 2 The relationship between gross lesions of major organs and death time of acute African swine fever |
|
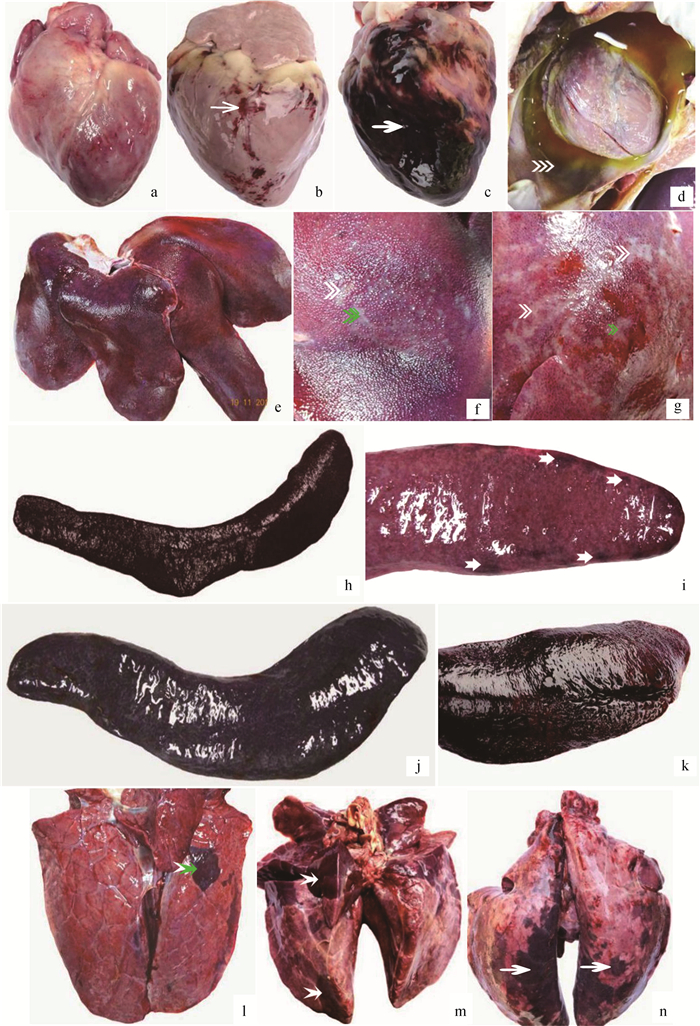
心:轻度(a)、中度(b)、重度(c)心外膜出血,重度心包积液并纤维素渗出(d);肝:轻度(e)、中度(f)和重度(g)病毒性肝炎;脾:轻度(h)、中度(j)和重度(k)急性炎性脾肿,重度脾边缘红色梗死(i);肺:轻度淤血水肿(l)、重度实变(m)和重度水肿出血(n).  .出血; .出血;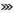 .心包积液; .心包积液; .炎症病灶; .炎症病灶;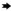 .红色梗死; .红色梗死; .实变
Heart: mild (a), moderate (b) and severe (c) epicardium hemorrhage, severe hydropericardium and fibrinous exudate (d); Liver: mild (e), moderate (f) and severe (g) virus hepatitis; Spleen: mild (h), moderate (j) and severe (k) acute inflammatory splenectasis, severe splenic red infarcts (i); Lung: mild congestion and edema (l), severe consolidation (m), severe oedema and hemorrhage. .实变
Heart: mild (a), moderate (b) and severe (c) epicardium hemorrhage, severe hydropericardium and fibrinous exudate (d); Liver: mild (e), moderate (f) and severe (g) virus hepatitis; Spleen: mild (h), moderate (j) and severe (k) acute inflammatory splenectasis, severe splenic red infarcts (i); Lung: mild congestion and edema (l), severe consolidation (m), severe oedema and hemorrhage. 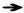 .Hemorrhage; .Hemorrhage; 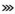 .Hydropericardium; .Hydropericardium; 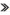 .Virus hepatitis; .Virus hepatitis; 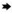 .Red infarcts; .Red infarcts;  .Consolidation
图 3 急性非洲猪瘟剖检病变(Ⅰ)
Fig. 3
Gross lesions of acute African swine fever(Ⅰ) .Consolidation
图 3 急性非洲猪瘟剖检病变(Ⅰ)
Fig. 3
Gross lesions of acute African swine fever(Ⅰ)
|
|
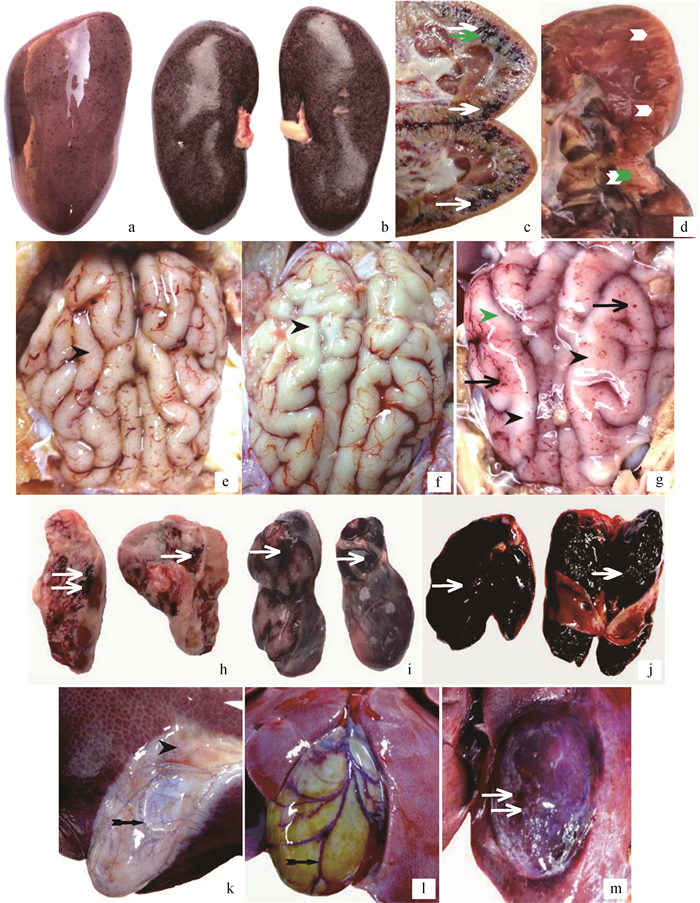
肾:皮质中度(a)和重度点状出血(b)、髓质重度出血(c)、重度肾梗死(d);脑:轻度(e)、中度(f)充血水肿,点状出血及重度水肿(g);淋巴结:轻度(h)、中度(i)和重度(j)肿胀出血;胆囊:轻度(k)、中度(l)淤血水肿,重度出血(m).  .出血; .出血; .梗死; .梗死; .水肿; .水肿;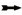 .充血
Kidney: moderate (a) and severe (b) multifocal cortical petechiae, severe medullar (purpurae)haemorrhages (c) and severe renal infarction (d); Brain: mild (e), moderate (f) hyperemia edema, petechiae and severe edema (g); Lymphonodus: mild (h), moderate (i) and severe (j) haemorrhages; Cholecyst: mild (k), moderate (l) congestion edema, severe haemorrhages (m). .充血
Kidney: moderate (a) and severe (b) multifocal cortical petechiae, severe medullar (purpurae)haemorrhages (c) and severe renal infarction (d); Brain: mild (e), moderate (f) hyperemia edema, petechiae and severe edema (g); Lymphonodus: mild (h), moderate (i) and severe (j) haemorrhages; Cholecyst: mild (k), moderate (l) congestion edema, severe haemorrhages (m).  .Haemorrhages; .Haemorrhages; 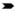 .Infarction; .Infarction;  .Edema; .Edema;  . Hyperemia
图 4 急性非洲猪瘟剖检病变(Ⅱ)
Fig. 4
Gross lesions of acute African swine fever(Ⅱ) . Hyperemia
图 4 急性非洲猪瘟剖检病变(Ⅱ)
Fig. 4
Gross lesions of acute African swine fever(Ⅱ)
|
|
膀胱:轻度(a)、中度(b)和重度(c)黏膜点状出血;胃肠道:肠黏膜重度出血(d),胃浆膜重度出血(e),回盲口重度出血和溃疡(f);颈部:肌间血肿(g、h).  .出血; .出血; .溃疡; .溃疡; .肌间血肿
Bladder: mild (a), moderate (b) and severe (c) mucosal multifocal petechiae; Gastrointestinal tract: severe intestinal mucosa haemorrhages (d), severe gastric serosa haemorrhages (e), severe ostiumileocecale haemorrhages and ulcer (f); Neck: intramscular hematoma (g, h). .肌间血肿
Bladder: mild (a), moderate (b) and severe (c) mucosal multifocal petechiae; Gastrointestinal tract: severe intestinal mucosa haemorrhages (d), severe gastric serosa haemorrhages (e), severe ostiumileocecale haemorrhages and ulcer (f); Neck: intramscular hematoma (g, h). 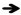 .Haemorrhages; .Haemorrhages;  .Ulcer; .Ulcer;  .Intramscular hematoma
图 5 急性非洲猪瘟的剖检病变(Ⅲ)
Fig. 5
Gross lesions of acute African swine fever(Ⅲ) .Intramscular hematoma
图 5 急性非洲猪瘟的剖检病变(Ⅲ)
Fig. 5
Gross lesions of acute African swine fever(Ⅲ)
|
2.4.1 心 以渗出性和出血性变化为主,见图 3 a~d。在早期死亡猪仅见心外膜轻度出血;病变主要出现在中后期,表现为多量淡黄色或黄红色心包积液(8/13例,61.5%);心外膜弥散性点状或灶状出血(11/13例,84.6%)、心内膜条索状出血(8/13例,61.5%)。少数病死猪在中期出现出血性纤维素性心包炎(2/13例,15.4%)。
2.4.2 肝 以淤血和病毒性肝炎为主要表现,见图 3 e~g。早期以淤血为主,中后期逐渐发展为病毒性肝炎病变。肝体积略肿大,暗红色(10/13例,76.9%);肝间质增宽,实质中散在多量大小不一、边缘不整齐的灰白色炎症灶(8/13例,61.5%)。
2.4.3 脾 病变显著,见图 3 h~k,呈现典型的败血脾(急性炎性脾肿)变化,脾显著肿大呈黑红色(12/13例,92.3%),被膜下可见点状出血(6/13例,46.2%)。脾边缘可见红色梗死灶(3/13例,23.1%)。早期脾的肿大和梗死即非常典型和明显,中后期以炎性脾肿为主要表现。
2.4.4 肺 在早、中和后期均较为一致的表现为水肿、出血与实变(小叶性肺炎),见图 3 l~n。肺水肿(13/13例,100%),体积增大,肺间质显著增宽,肺小叶明显;被膜点状或斑状出血(13/13例,100%);部分病猪肺实变,多以小叶或小叶群为单位,质地坚实,颜色加深,呈暗红或蓝紫色(8/13例,61.5%)。
2.4.5 肾 病变以出血和梗死为主, 见图 4 a~d。肾皮质呈弥散性点状出血(13/13例,100%),呈蚤咬肾或雀卵肾外观。髓质出血病例稍少(10/13例,76.9%),但出血程度更为严重。肾表面及切面可见梗死灶(6/13例,46.2%),梗死灶形状不规则,呈灰白色或灰红色,边缘有红色炎性反应带。早期以皮质瘀点为主,中后期出现梗死,且髓质出血逐渐加重。
2.4.6 脑 主要表现为脑膜充血和脑实质水肿,在早、中和后期均较为一致。脑膜血管树枝状充血(12/13例,92.3%),可见少量点状出血灶(3/13例,23.1%)。脑水肿明显(10/13例,76.9%),脑膜紧张,脑沟变浅,脑回扁平,切面稍突起,湿润苍白。主要病变见图 4 e~g。
2.4.7 淋巴结 在早、中和后期均表现为典型的出血性坏死性淋巴结炎,颌下淋巴结(12/13例,92.3%)、肺门淋巴结(12/13例,92.3%)、肝门淋巴结(13/13例,100%)、肠系膜淋巴结(11/13例,84.6%)及腹股沟淋巴结(10/13例,76.9%)等显著肿胀出血,黑红色,切面可见大理石样变,严重时呈血肿样。主要病变见图 4 h~j。
2.4.8 胆囊 囊壁增厚,树枝状充血或弥漫状出血,胆汁浓稠(12/13例,92.3%),以中后期病变为重。主要病变见图 4 k~m。
2.4.9 膀胱 在早、中和后期均表现为黏膜水肿增厚,弥漫性点状出血(11/13例,84.6%)。主要病变见图 5 a~c。
2.4.10 胃肠道 胃肠黏膜水肿(13/13例,100%)、胃黏膜弥漫状出血(10/13例,76.9%)和回盲口肿胀、充血出血、溃疡灶等病变(11/13例,84.6%)在早期即出现。胃浆膜点状或刷状出血(9/13例,69.2%)主要出现在中后期。主要病变见图 5 d~f。
2.4.11 其他 10 dpi之后死亡病例见颈部皮下和肌间出血(4/13例,30.1%),严重者呈血肿状(图 5 g~h)。中期可见扁桃腺轻微充血(9/13例,69.2%),后期可见出血点(3/13例,23.1%)。衄血(6/13例,46.2%)或便血(3/13例,23.1%)主要出现在中期;后期死亡病例可见关节肿胀(1/13例,7.7%)。
2.5 剖检病变程度的评分与排序病死猪表现败血症典型特征,尸体易腐败,血凝不良或溶血,尸僵不全。图 6示急性非洲猪瘟的特征性剖检变化及病变程度。按照病变程度分别介绍如下。
|
图 6 急性非洲猪瘟特征性剖检变化及病变程度 Fig. 6 The characteristic macroscopy changes and the lesions severity of acute African swine fever |
2.5.1 病变分值≥50 肝门淋巴结的出血性淋巴结炎,急性炎性脾肿(败血脾),脑水肿,肺水肿,肺实变和肺门淋巴结的出血性淋巴结炎。
2.5.2 30≤病变分值< 50 胆囊壁充血、出血、水肿,胃肠道水肿和出血,颌下淋巴结的出血性淋巴结炎,肾皮质与髓质的瘀点,肺出血,回盲口的出血和溃疡,病毒性肝炎,心包积液以及膀胱黏膜点状出血。
2.5.3 10≤病变分值< 30 心外膜和心内膜的出血,肝淤血,脑膜充血、出血,肠系膜和腹股沟淋巴结出血性淋巴结炎,颈部皮下和肌间出血,衄血和肾梗死。
2.5.4 病变分值< 10 扁桃腺充血出血,脾边缘红色梗死,纤维素性心包炎及关节肿胀。
2.6 病理组织学变化2.6.1 心 早期主要病变为间质血管充血、出血,心肌纤维排列紊乱,结构疏松。中后期死亡病例心外膜、心内膜血管显著扩张充血,可见血管破裂所致灶状出血;肌间见多量大小不一的出血灶。血管平滑肌细胞空泡变性和透明样变,血管内皮细胞肿胀、坏死脱落。心肌纤维嗜伊红深染,血管周围及肌间可见淋巴细胞浸润(图 7 A、B)。

|
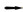 .出血; .出血; .血管内皮细胞脱落; .血管内皮细胞脱落; .间质增宽; .间质增宽; .淋巴细胞浸润; .淋巴细胞浸润; .淋巴小结坏死; .淋巴小结坏死; .水肿; .水肿; .微血栓; .微血栓; .血管管套。A、B.心;C、D.肝;E、F.脾;G~I.肺;J、K.肾;L、M.脑;N、O.淋巴结;P~R.小肠 .血管管套。A、B.心;C、D.肝;E、F.脾;G~I.肺;J、K.肾;L、M.脑;N、O.淋巴结;P~R.小肠
 .Haemorrhages; .Haemorrhages;  . Endothelial cells fall off; . Endothelial cells fall off;  . Interstitial broadening; . Interstitial broadening;  .Lymphocyte infiltration; .Lymphocyte infiltration;  .Lymph node necrosis; .Lymph node necrosis;  .Edema; .Edema;  .Microthrombosis; .Microthrombosis;  .Vascular sleeve. A, B. Heart; C, D. Liver; E, F. Spleen; G-I. Lung; J, K. Kidney; L, M. Brain; N, O. Lymphonodus; P-R. Intestines
图 7 急性非洲猪瘟的病理组织学损伤(苏木素-伊红染色,标尺为100 μm)
Fig. 7
Histopathologic lesions of acute African swine fever (H & E stain, scale bar is 100 μm) .Vascular sleeve. A, B. Heart; C, D. Liver; E, F. Spleen; G-I. Lung; J, K. Kidney; L, M. Brain; N, O. Lymphonodus; P-R. Intestines
图 7 急性非洲猪瘟的病理组织学损伤(苏木素-伊红染色,标尺为100 μm)
Fig. 7
Histopathologic lesions of acute African swine fever (H & E stain, scale bar is 100 μm)
|
2.6.2 肝 早期死亡病例见小叶间静脉与肝窦淤血,肝间质增宽,多量红细胞和淋巴细胞浸润,肝细胞变性坏死。中后期死亡病例见肝间质因多量淋巴细胞、巨噬细胞、红细胞和少量浆细胞浸润而显著增宽,肝小叶被分割成大小不一的小岛状。肝细胞排列紊乱,颗粒变性或细胞核固缩深染,常见凋亡肝细胞。小叶间质和肝窦内多见淋巴细胞坏死和凋亡(图 7 C、D)。
2.6.3 脾 镜检见脾严重出血,大量红细胞浸润,淋巴细胞坏死,脾小体数量减少,白髄面积缩小。严重病例出血性坏死性脾炎病变更为典型,脾实质因淋巴细胞弥漫性凋亡、坏死、崩解而明显减少,脾小体几近消失,仅在中央动脉周围残留少量淋巴细胞;红髓中固有的细胞成分减少,脾髓内充盈大量血液,被膜和小梁中的平滑肌、胶原纤维和弹性纤维肿胀、溶解,排列疏松(图 7 E、F)。
2.6.4 肺 早期以肺水肿和出血为主要病变,肺泡腔内充满大量粉红色浆液,其间混有多量红细胞,间质小静脉和肺泡壁毛细血管扩张、充血、出血,可见少量淋巴细胞。中后期死亡病例呈出血性间质性肺炎或小叶性肺炎,肺间质增宽、水肿,多量红细胞、淋巴细胞和巨噬细胞,且淋巴细胞崩解碎裂;细支气管和肺泡腔内可见大量粉红色浆液、淋巴细胞及脱落的上皮细胞;肺泡壁毛细血管扩张充血,可见透明血栓(图 7 G~I)。
2.6.5 肾 镜检早期死亡病例,肾以出血性变化为主,肾小球略肿胀,肾间质见大量红细胞聚集。中后期死亡病例间质血管淤血出血和血栓形成,间质中可见大量红细胞、少量淋巴细胞和巨噬细胞;肾小球淤血,肿胀,广泛透明血栓形成;梗死灶内肾小管上皮细胞广泛坏死,内有粉红色蛋白管型和脱落的上皮细胞(图 7 J、K)。
2.6.6 脑 早期病变主要为脑水肿,神经元肿胀变圆,血管周围间隙增宽。中后期死亡病例脑结构疏松,多量微血栓形成;病理变化以病毒性脑炎为特征,神经元胞核及胞质肿胀淡染;围管性淋巴细胞浸润,即血管周围淋巴细胞性管套形成;可见卫星现象和噬神经细胞现象(图 7 L、M)。
2.6.7 淋巴结 镜检早期死亡病例,淋巴结肿胀,边缘出血,灶状坏死。中期死亡病例呈典型出血性坏死性淋巴结炎病变特征,大量淋巴细胞凋亡、坏死、崩解碎裂,广泛微血栓形成,严重出血,皮髓结构完全破坏,淋巴小结位置被大量红细胞取代(图 7 N、O)。
2.6.8 小肠 早期死亡病例主要为浆膜水肿、充血出血。中后期死亡病例肠黏膜严重充血出血,黏膜上皮细胞变性、坏死、脱落,固有层和黏膜下层毛细血管显著扩张,充血出血,并有大量淋巴细胞浸润。肠壁淋巴滤泡肿胀,淋巴细胞坏死凋亡(图 7 P~R)。
3 讨论病死猪表现典型的败血症特征,尸体易腐败,血凝不良或溶血,尸僵不全。主要病理变化为肝门淋巴结和肺门淋巴结的出血性坏死性淋巴结炎、急性炎性脾肿(败血脾)、脑水肿、肺水肿和肺实变等,其次为胆囊壁和胃肠道的水肿和出血、颌下淋巴结的出血性淋巴结炎、肾与膀胱的瘀点、肺出血、回盲口的出血与溃疡、病毒性肝炎以及心包积液等。
3.1 免疫系统损伤从病变出现时间、病变发生程度和病变发生率分析,脾和淋巴结是非洲猪瘟病毒首先攻击的器官,在整个病程中病变最为显著,出现时间最早,持续时间最长,发生频率最高。剖检病变主要为败血脾和出血性、坏死性淋巴结炎,组织学病变见大量淋巴细胞凋亡、坏死崩解碎裂,广泛微血栓形成。
在自然感染病例,可在早期出现扁桃腺和颌下淋巴结病变。本试验为肌内注射攻毒感染,扁桃腺和颌下淋巴结的病变在早期并不明显,特别是扁桃腺,仅在后期出现充血、出血。试验结果与文献报道一致[4, 7],也从另一个层面证实,ASFV的临床接触感染途径主要是口和上呼吸道,在鼻咽部或扁桃腺发生感染,病毒最早出现于口腔液中,然后蔓延到颌下淋巴结,再通过淋巴和血液循环迅速向全身扩散。
3.2 血液循环障碍根据本试验结果分析,急性非洲猪瘟的病理变化以血液循环障碍尤为突出,包括水肿、充血、淤血、出血、梗死和弥散性血管内凝血(disseminated intravascular coagulation,DIC)等多种病理表现,出血性病变为其最主要的特征。
根据病变发生时间分析,血液循环障碍早期主要为充血,可见皮肤潮红,之后血液淤滞,血浆成分漏出,导致多器官淤血水肿,肺水肿、心包积液是导致病猪快速死亡的重要原因,此时中枢神经系统和消化系统的水肿可在临床症状上表现为精神沉郁、食欲减退等变化。而肺水肿、心包积液等病变加重了血液循环障碍,镜下见血管内皮细胞肿胀、坏死脱落,血管通透性进一步增高,红细胞和纤维蛋白等血浆成分渗出加剧,出现纤维素性心包炎等变化。病理组织学变化发现,在脾、淋巴结、肾、肺和心等器官可见广泛性的微血栓形成,即DIC,促发小血管内广泛纤维蛋白沉着,导致组织和器官损伤,发生多灶性坏死或梗死。同时,由于凝血因子的消耗引起全身性出血倾向,中后期病死猪表现为严重的血管性出血性素质,皮肤、皮下组织、浆膜、黏膜和内脏器官广泛出血,严重病例可致血管破裂,出现流鼻血(衄血)、颈部皮下血肿等。
结果提示,ASFV感染早期血管反应主要为毛细血管通透性增加,晚期则因DIC引起严重的出血。上述变化与文献报道一致,在感染高毒力和中等毒力ASFV株时,血管改变特别是血管通透性的增加,导致了水肿、淤血、出血与严重的血管周围淋巴细胞浸润[8-9]。
3.3 炎症反应根据本试验结果,非洲猪瘟病毒引发的以淋巴细胞渗出为主的炎症反应贯穿病程始终,在中后期表现更为明显。早期的间质性肺炎可进一步发展为弥散性小叶性肺炎,引起肺的实变,加重呼吸功能障碍;病毒性肝炎也呈进行性发展,肝间质显著增宽,实质中广泛分布灰白色炎性病灶,可致肝呈花斑状外观。结合文献分析,急性炎性脾肿、出血性坏死性淋巴结炎、增生性肾小球肾炎伴急性肾小管损伤、出血性胃肠炎等炎症过程,可一直持续到非洲猪瘟的晚期[10-12]。ASFV感染可导致脑水肿和脑膜血管充血出血,组织学病变显示病毒性脑炎,可在临床表现出轻瘫、共济失调和抽搐等神经症状[13]。
组织学研究证实,ASFV引起的淋巴细胞大量坏死与凋亡过程是ASF发病的关键事件,同时,因血液循环障碍导致的组织坏死,诱发大量炎症因子的释放,进一步加重各组织器官的损伤。单核巨噬细胞是ASFV复制的主要靶细胞,病毒还可在内皮细胞、巨核细胞、血小板以及中性粒细胞中复制。ASFV在淋巴结复制扩散后,首先进入脾,脾的红髓和边缘区富含巨噬细胞,是病毒复制的主要区域。感染的巨噬细胞释放大量炎症介质,进而对血管内皮细胞造成严重损伤,导致血管通透性增加、凝血因子消耗和纤维蛋白溶解系统激活等凝血功能改变,最终引起弥漫性血管内凝血和出血性素质[14-15]。
4 结论急性非洲猪瘟的主要病理过程为典型的免疫/炎症级联反应和严重的全身血液循环障碍,共同导致急性非洲猪瘟的高发病率和高死亡率。
| [1] | XU Z, SHI L, WANG Y J, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020, 8(4): 420–422. DOI: 10.1016/S2213-2600(20)30076-X |
| [2] | LI X D, TIAN K G. African swine fever in China[J]. Vet Record, 2018, 183(9): 300–301. |
| [3] | ZHOU X T, LI N, LUO Y Z, et al. Emergence of African swine fever in China, 2018[J]. Transbound Emerg Dis, 2018, 65(6): 1482–1484. DOI: 10.1111/tbed.12989 |
| [4] | ZHAO D M, LIU R Q, ZHANG X F, et al. Replication and virulence in pigs of the first African swine fever virus isolated in China[J]. Emerg Microbes Infect, 2019, 8(1): 438–447. DOI: 10.1080/22221751.2019.1590128 |
| [5] | CHEN N S, ZHOU M, DONG X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China:a descriptive study[J]. Lancet, 2020, 395(10223): 507–513. DOI: 10.1016/S0140-6736(20)30211-7 |
| [6] | GALINDO-CARDIEL I, BALLESTER M, SOLANES D, et al. Standardization of pathological investigations in the framework of experimental ASFV infections[J]. Virus Res, 2013, 173(1): 180–190. |
| [7] | HOWEY E B, O'DONNELL V, DE CARVALHO FERREIRA H C, et al. Pathogenesis of highly virulent African swine fever virus in domestic pigs exposed via intraoropharyngeal, intranasopharyngeal, and intramuscular inoculation, and by direct contact with infected pigs[J]. Virus Res, 2013, 178(2): 328–339. |
| [8] | KARALYAN Z R, TER-POGOSSYAN Z R, KARALYAN N Y, et al. Hemophagocytic lymphohistiocytosis in acute African swine fever clinic[J]. Vet Immunol Immunopathol, 2017, 187: 64–68. DOI: 10.1016/j.vetimm.2017.03.008 |
| [9] | ZAKARYAN H, KARALOVA E, VOSKANYAN H, et al. Evaluation of hemostaseological status of pigs experimentally infected with African swine fever virus[J]. Vet Microbiol, 2014, 174(1-2): 223–228. DOI: 10.1016/j.vetmic.2014.08.029 |
| [10] | RUIZ-GONZALVO F, RODRÍGUEZ F, ESCRIBANO J M, et al. Functional and immunological properties of the baculovirus-expressed hemagglutinin of African swine fever virus[J]. Virology, 2018, 218(1): 285–289. |
| [11] | KARALYAN N Y, TATOYAN M R, SEMERJYAN A B, et al. Association of hemophagocytic lymphohistiocy-tosis with kidney lesions in acute African swine fever virus infection[J]. Ann Parasitol, 2018, 64(4): 343–350. |
| [12] | SEMERJYAN A B, TATOYAN M R, KARALYAN N Y, et al. Cardiopathology in acute African swine fever[J]. Ann Parasitol, 2018, 64(3): 253–258. |
| [13] | KARALYAN Z A, SARGSYAN M A, ARZUMAN-YAN H H, et al. Pathomorphology of the brain in the acute form of African swine fever[J]. Ann Parasitol, 2017, 63(4): 347–352. |
| [14] | HERRERA-URIBE J, JIMÉNEZ-MARÍN A, LACASTA A, et al. Comparative proteomic analysis reveals different responses in porcine lymph nodes to virulent and attenuated homologous African swine fever virus strains[J]. Vet Res, 2018, 49: 90. DOI: 10.1186/s13567-018-0585-z |
| [15] | TAKAMATSU H H, DENYER M S, LACASTA A, et al. Cellular immunity in ASFV responses[J]. Virus Res, 2013, 173(1): 110–121. |



