2. 马鞍山史记动物健康管理有限公司, 马鞍山 238251;
3. 安徽省动物疫病预防与控制中心, 合肥 230091
2. Maanshan Shiji Animal Health Management Limited Company, Maanshan 238251, China;
3. Anhui Province Animal Disease Prevention and Control Center, Hefei 230091, China
副猪嗜血杆菌(Haemophilus parasuis,HPS)为巴斯德菌科成员,临床上可引起以多发性纤维素性浆膜炎和关节炎为特征的猪格氏病(Glässer’s disease),该病呈世界性分布,目前,流行呈上升趋势,危害日渐严重,已成为全球范围内影响养猪业的典型细菌性疾病之一[1]。抗生素和疫苗接种可用于猪格氏病的预防和控制,但由于细菌耐药性的不断产生,以及绿色养殖理念的日益发展,使得疫苗接种成为一个有价值的选择。然而,HPS血清型众多且地方性特征明显,不同的血清型菌株之间缺乏有效的交叉保护力,毒力与血清型的严格关系尚未得到证实[2]。相较于血清型分型,基因分型可以将所有HPS分型,尤其是多位点序列分型(multilocus sequence typing,MLST)系根据细菌基因组中7个看家基因在菌株之间的多态性而建立的基因分型方法,可在全球数据库中进行比对,加强对DNA信息的获取,不仅对于HPS的菌群结构定义和跟踪演化研究,而且对于区分致病的毒力菌株与寄居的无毒菌株以及促进疫苗的发展均具有重要意义[3]。
本试验针对临床分离鉴定的89株HPS,首先利用PCR技术鉴定血清型,并统计各血清型HPS在不同分离部位的菌株分布数量;其次应用MLST方法进行序列类型(sequence typing,ST)鉴定分析、位点多态性分析、BURST分群统计和UPGMA系统发育树聚类分析。从而了解和掌握HPS临床分离株血清型和基因型的流行分布特点及其相关性,为猪格氏病的有效防控提供科学依据。
1 材料与方法 1.1 菌株受试菌株源于2008—2019年临床发病猪,每头病猪均采集肺、肝、脾、肾、脑、关节积液、心包积液、腹腔积液和胸腔积液等组织样本,由安徽农业大学动物传染病实验室分离、鉴定与保存,共计89株HPS。
1.2 主要试剂和仪器0.6%酵母浸膏胰酪胨大豆琼脂(TSA-YE)、0.6%酵母浸膏胰酪胨大豆肉汤(TSB-YE)均购自绍兴天恒生物科技有限公司;新生小牛血清均购自北京索莱宝科技有限公司;琼脂糖、烟酰胺腺嘌呤二核苷酸(NAD)均购自生工生物工程(上海)股份有限公司;2×Taq PCR Master Mix、DL2000 DNA Marker均购自天根生化科技有限公司。PCR扩增仪均购自杭州晶格科学仪器有限公司;电泳仪购自北京六一仪器厂。
1.3 引物合成参照Jia等[4]和Mullins等[5]的方法合成HPS血清型鉴定用15种基因引物和HPS MLST鉴定用7种看家基因引物。引物均由南京金斯瑞生物科技有限公司合成。
1.4 血清型鉴定利用煮沸法提取HPS基因组DNA作为模板,用于PCR鉴定HPS的血清型。PCR反应体系(25 μL):2×Taq PCR Master Mix 12.5 μL,上、下游引物(20 μmol·L-1)各0.25 μL,模板DNA 2 μL,ddH2O 10 μL。PCR反应条件:95 ℃5 min;95 ℃30 s,56 ℃ 30 s,68 ℃1 min,36个循环;68 ℃5 min。将PCR产物经琼脂糖凝胶电泳后在凝胶成像仪上进行观察,并记录结果。
1.5 MLST鉴定参照Mullins等[5]建立的HPS MLST分型方法。PCR反应体系(50 μL):2×Taq PCR Master Mix 25 μL,上、下游引物(20 μmol·L-1)各2.5 μL,模板DNA 5 μL,ddH2O 15 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 1 min,45 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。扩增产物由通用生物系统(安徽)有限公司进行双向测序。将所有测序菌株的7种基因位点序列在HPS MLST数据库(http://pubmlst.org/hparasuis)进行上传,得到对应等位基因的编号,最终确定ST型,并在MLST数据库中完成新发现等位基因序列的提交。
1.6 MLST分析1.6.1 ST型与血清型的菌株分布统计 统计89株HPS ST型与血清型的菌株分布数量。
1.6.2 位点多态性分析 利用START2软件计算89株HPS的等位基因数、多态性位点、GC含量和非同义替换与同义替换比(dN/dS)。
1.6.3 BURST分群统计 利用BURST程序展开89株HPS的ST型克隆群(clonal complexes,CC)归类(菌株之间存在至少5个看家基因的等位基因编号相同时,则这些菌株可以归于同一个CC)。
1.6.4 UPGMA系统发育树聚类分析 采用无权重配对算术平均数法(UPGMA)构建89株HPS的系统进化树进行聚类分析。
2 结果 2.1 血清型鉴定2.1.1 血清型分型 89株HPS临床分离株共鉴定出9种血清型,包括血清1、2、4、5、7、11、12、13和14型,此外还存在无扩增基因的未定型(NT)HPS(图 1)。血清4型25株,占28.09%;血清13型20株,占22.47%;血清7型12株,占13.48%;未定型10株,占11.24%;血清5型9株,占10.11%;血清11型4株,占4.49%;血清2型和14型各3株,占3.37%;血清1型2株,占2.25%;血清12型1株,占1.12%。其中,血清4、13、7和5型为优势血清型。
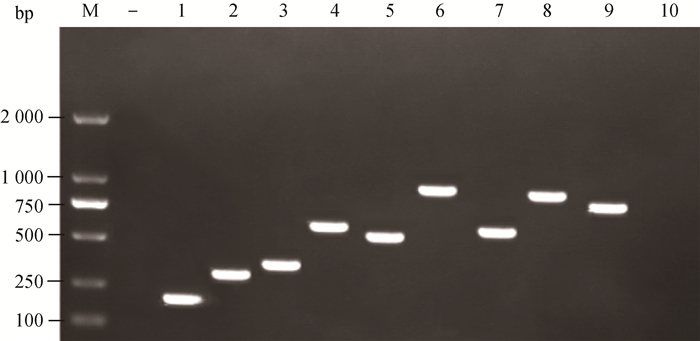
|
M.DL2000 DNA相对分子质量标准;—.阴性对照;1.血清1型funB;2.血清2型wzx;3.血清4型wciP;4.血清5型funK;5.血清7型funQ;6.血清11型amtA;7.血清12型Hypothetical gene;8.血清13型gltP;9.血清14型funAB;10.未定型 M. DL2000 DNA marker; —. Negative control; 1. Serotype 1 funB; 2. Serotype 2 wzx; 3. Serotype 4 wciP; 4. Serotype 5 funK; 5. Serotype 7 funQ; 6. Serotype 11 amtA; 7. Serotype 12 Hypothetical gene; 8. Serotype 13 gltP; 9. Serotype 14 funAB; 10. nontypeable 图 1 HPS不同血清型的PCR鉴定 Fig. 1 PCR Identification of different serotypes of HPS |
2.1.2 血清型分布 在89株HPS临床分离株的来源组织中,肺64株,其中,血清4型19株,占29.69%;血清13型16株,占25%;未定型8株,占12.5%;血清5和7型各6株,占9.38%;血清2和11型各3株,占4.69%;血清1、12和14型各1株,占1.56%。肝2株,血清5和7型各1株,占50.00%。脾9株,其中血清4型4株,占44.44%;血清1、5、7、13和14型各1株,占11.11%。脑4株,其中,未定型2株,占50.00%;血清4和13型各1株,占25.00%。关节积液4株,其中血清13型2株,占50.00%;血清4和14型各1株,占25.00%。胸腔积液2株,血清5和7型各1株,占50.00%。心包积液2株,血清7和11型各1株,占50.00%。腹腔积液和鼻腔各1株,血清型均为7型。表明肺是HPS的主要分离部位。
2.2 MLST鉴定利用特异性引物对89株HPS临床分离株的基因组DNA进行PCR扩增,共得到rpoB(470 bp)、atpD(582 bp)、mdh(537 bp)、g3pd(564 bp)、infB(501 bp)、6pgd(599 bp)和frdB(553 bp)7个看家基因,扩增片段大小与预期结果一致(图 2)。登录HPS MLST数据库(http://pubmlst.Org/hparasuis),将整理好的89株HPS临床分离株的7个看家基因测序结果上传至平台,共得到60个等位基因,不同的等位基因组合后,共获得24种ST型,ST267、ST268、ST387和ST365为优势基因型(表 1)。
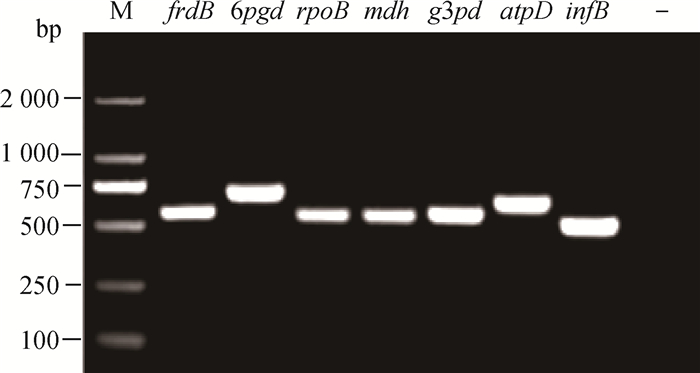
|
M. DL2000 DNA相对分子质量标准;其他条带为7种看家基因;—.阴性对照 M. DL2000 DNA marker; The other strips are 7 housekeeping genes; —. Negative control 图 2 HPS 7种看家基因的PCR鉴定 Fig. 2 PCR Identification of 7 housekeeping genes of HPS |
|
|
表 1 89株HPS的MLST鉴定结果 Table 1 MLST identification results of 89 HPS |
2.3.1 ST型与血清型的菌株分布统计 89株HPS临床分离株共鉴定出24种ST型和9种血清型,表明MLST方法相较于血清型分型方法分辨率更高。ST267有24株,血清4型占83.33%(20/24),血清11型占12.5%(3/24),血清13型占4.17%(1/24);ST268有19株,血清型均为13型;ST387有8株,血清4型占63.5%(5/8),未定型占37.5%(3/8);ST365有5株,血清型均为5型;ST333、ST391、ST397各3株,血清型均为7型;ST389和ST398各3株,血清型分别为未定型和2型;ST299和ST388各2株,血清型均为未定型;ST269有2株,血清型均为1型;ST393和ST395各1株,血清型分别为12型和11型;ST241、ST396、ST399各1株,血清型均为14型;ST270、ST271、ST392各1株,血清型均为7型;ST272、ST274、ST390、ST394各有1株,血清型均为5型。显示HPS临床分离株流行血清型和基因型呈现多元化,HPS的ST型与血清型之间存在一定的交叉性,多数ST型菌株只能对应一种血清型,但同一血清型菌株存在多个ST型。
2.3.2 位点多态性分析 利用START2软件对89株HPS临床分离株的7个看家基因序列进行分析,7个看家基因的每个基因位点存在3~13个数目不等的等位基因,多态性位点从3(g3pd)到71(6pgd)不等,具有明显的遗传异质性;GC含量从39.95%(mdh)到46.28%(rpoB)不等,与特定看家基因的GC含量几乎一致,表明测序结果准确可靠;非同义替换(dN)/同义替换(dS)从0.015 7(atpD)到0.1062(g3pd)不等,但比值均远小于1,表明7个看家基因位点存在明显的抗氨基酸变化效应(表 2)。
|
|
表 2 7个看家基因位点的主要参数 Table 2 Main parameters of 7 housekeeping gene loci |
2.3.3 BURST分群统计 利用BURST程序将89株HPS临床分离株划分为11个CC和2个单个ST型,其中,ST269和ST399属于单个ST型;ST241、ST271、ST299、ST388、ST389和ST398分别属于CC241、CC247、CC245、CC291、CC184和CC398,ST267和ST395属于CC267,ST272和ST274属于CC272,ST268、ST393和ST396属于CC176,ST270、ST333、ST387、ST391、ST392和ST397属于CC324,ST365、ST390和ST394组成CC390(表 3)。结果表明同一CC中的不同ST型菌株存在亲缘关系,且ST269和ST399与其他ST型菌株无亲缘关系。
|
|
表 3 89株HPS的BURST分群统计 Table 3 BURST cluster statistics of 89 HPS |
2.3.4 UPGMA系统发育树聚类分析 构建的89株HPS临床分离株系统发育树聚类分析,24种ST型分为4个分支,分支1包括ST299和ST398,分支2包括ST268、ST272、ST274、ST365、ST389、ST390、ST393、ST394、ST396和ST399,分支3包括ST269、ST270、ST271、ST333、ST387、ST388、ST391、ST392和ST397,分支4包括ST241、ST267和ST395。分支1中HPS血清型包括2型和NT型,以中等毒力血清型菌株为主,分离部位包括肺和脑,临床表现均为肺炎;分支2中HPS血清型包括5型、12型、13型、14型和NT型,以强毒力血清型菌株为主,分离部位包括肺、肝、脾、关节积液、脑和胸腔积液,临床表现为肺炎、关节炎和多发性浆膜炎;分支3中HPS血清型包括1、4、7和NT型,以中等毒力菌株和无毒力血清型菌株为主,分离部位包括鼻腔、肺、脾、肝、关节积液、心包积液、胸腔积液和腹腔积液,临床表现为肺炎和多发性浆膜炎;分支4中HPS血清型包括4、11、13和14型,以中等毒力血清型菌株为主,分离部位包括肺、脾、脑、关节积液和心包积液,临床表现为肺炎和多发性浆膜炎(图 3)。表明ST型与血清型存在一定的交叉性,且与HPS临床致病力相关。

|
分支干上的数字为分支编号;标尺表示序列差异的分支长度;分支点上的数字为菌株编号和ST型号;括号内的数字为7个看家基因所对应的等位基因编号;括号后的数字表示血清型,之后依次是分离部位和临床表现 Numbers on the branch trunk are the branch number; Bar: Nucleoride divergence; Numbers at the branch point are strain number and ST type; Numbers in parenthesis represented the allele number corresponding to the 7 housekeeping gene; Numbers after parentheses indicated serotype, followed by origin and clinical manifestation in turn 图 3 基于89株HPS分离株ST型构建的UPGMA系统发育树 Fig. 3 UPGMA phylogenetic tree based on 89 HPS ST type |
近年来,猪格氏病作为现代化的日龄隔离式生产系统下的一种重要疾病,其流行呈明显上升趋势,且影响猪生产的各个阶段,给养猪业带来了严重的损失。长期不合理的使用抗生素使得HPS耐药性的产生和耐药谱的拓宽[6],目前疫苗免疫仍是防控该病的主要手段。但HPS已知血清型多达15种,不同血清型之间缺乏交互免疫关系[7],因而监测和调查HPS动态流行情况对筛选相关型别疫苗和制定防制措施都是基础性依据。同时,鉴于传统的血清分型方法尚不能甄别现存的NT型菌株,MLST作为一种基于菌群基因结构的高分辨率分子流行病学研究手段,可实现跨区域性细菌流行病学监测,弥补传统分型方法的局限性。
猪格氏病已在国内外多地区呈散发流行态势,欧洲、北美洲、南美洲及澳洲部分地区以HPS血清5、4和13型为主要流行血清型,国内则以血清4、5型为主,其次为血清13、14和12型[8],可见HPS在世界范围内呈多元差异化分布。而国内不同地区HPS流行情况也不尽相同。广东、湖南、安徽、四川及河南等地均有一定数量的HPS被分离,多种血清型被发现报道且优势血清型多集中于血清4、5型[9-12]。这不仅表明HPS在国内不同地区的分布具有明显地方性特征,而且血清4、5型呈常态化流行。相同地区HPS流行情况也并非一致,2005年,国内HPS以血清4、5、13、14和12型占据主导地位,而2010—2011年则以血清4、5、12、13、15和2型为主要流行血清型[13]。在本试验的89株HPS临床分离株中,血清4、5、7和13型为优势血清型,不全同于国内的相关报道,血清2、12型仅占很小比例且血清7型分离率明显增多,与近年多地报道的血清7型菌株分离比重明显增加相一致[14-15],且与Jia等[4]报道的HPS血清5、4、NT、7和13型在中国7个省份占主导地位基本符合。这表明HPS的流行特点存在时空差异,其优势菌株分布处于动态变化中。同时也提示,这可能是造成猪格氏病疫苗免疫失败的首要原因[16]。此外,目前,国内外HPS流行血清型不断变化,这与现代集约化养殖中,生猪流动频繁,特别是将不同来源的猪混合饲养不无关系。
与定殖于健康猪群上呼吸道的HPS不同,本试验中的89株HPS分离株均源于临床发病猪,有64株HPS分离于肺,包括9种血清型以及NT型菌株,其中,优势血清4、5、7和13型HPS占比73.44%(47/64株),病猪均呈现不同程度的猪格氏病典型症状,这表明HPS肺分离株具有毒力,对猪肺泡巨噬细胞(porcine alveolar macrophages,PAM)存在较强的吞噬抗性,为细菌在肺泡内增殖提供重要的窗口期[17]。此外,PAM与HPS的对抗所引发的炎症反应打开了细菌进入血液的通道,而血清/补体抗性则是细菌利用血液循环形成全身性感染的重要保证[18],这提示肺是HPS进入下呼吸道后引起全身性感染的原发性侵入位点。
MLST作为分子流行病学重要研究手段,序列数据明确可靠,能够实现对所有HPS菌株分型。贾爱卿等[19]对21株HPS广东分离株进行MLST分型,共获得16个ST型,ST121出现频率最高。Olvera等[20]利用MLST方法对120株HPS西班牙分离株和11株标准HPS进行分型,结果显示,有109个ST型,ST46出现频率最高。Wang等[21]利用MLST分析源自中国5个省的48株HPS和2株澳大利亚分离株,共获得44个ST型,ST24和ST27出现频率最高。不同地区、不同时段HPS的基因型流行情况均存在差异。本试验中的89株HPS临床分离株以ST267、ST268、ST387和ST365为主要流行ST型,分别占比26.97%、21.35%、8.99%和5.62%。进一步分析显示7个看家基因的每个基因位点存在3~13个数目不等的等位基因,多态性位点从3(g3pd)到71(6pgd)不等,具有明显的遗传异质性,且以同义突变为主,不改变编码的蛋白质。BURST分群统计发现,89株HPS临床分离株被划分为11个CC和2个单个ST型,ST393(广西株GXheng19-3)与ST396(安徽株AHquan18-1)划分在CC176;ST390(安徽株SX-3F)和ST394(安徽株SX-1XQJY)与ST365(山东株SDlin18-4)组成CC390,同一CC中的不同ST型菌株分离于不同地区的不同猪场,但存在亲缘关系,推测这可能与跨区引种、频繁跨省调运生猪等原因有关。
目前已知血清1、5、10、12、13、14型为高致病力菌株,血清2、4、8、15型为中等毒力菌株,血清3、6、7、9、11型菌株毒力较低,不能引起临床症状[22]。HPS的血清型已被普遍作为其毒力的标志。然而,血清型与毒力并不呈明显对等关系,相同血清型菌株的毒力大小也能存在极大差异[23]。本试验通过构建UPGMA系统发育树进行聚类分析,89株HPS临床分离株被划分为4个分支,分支2以强毒力血清型菌株为主,多分离于肺,分支1、3和4以多数中等毒力和部分无毒力血清型菌株为主,常见于肺、肝、脾、脑和关节等部位,这表明不同ST型菌株的侵染特征与特定分支之间存在关联,这一发现为从基因水平上区分致病性和非致病性HPS提供了依据。分支2和4中ST267和ST268不仅在肺炎病猪中分离到,在多发性浆膜炎以及关节炎病猪中也有相同基因型的分离株,表明相同ST型的HPS分离株致病力并不完全相同。而优势血清型7型HPS作为无毒力血清型菌株,除了分离于肺和鼻腔以外,在肝、脾及各处积液也存在相同血清型的分离株,表明相同血清型的HPS分离株致病力也不完全一致。HPS的ST型与血清型存在一定的交叉性,这种交叉性与HPS临床致病力相关。
4 结论HPS流行血清型呈动态变化,肺是HPS引起全身性感染的原发性侵入位点;HPS流行ST型呈现多元化,具有明显的遗传异质性;不同ST型菌株的侵染特征与特定分支之间存在关联,ST型与血清型存在一定的交叉性,且与HPS临床致病力相关。
| [1] | LI M, CAI R J, SONG S, et al. Evaluation of immunogenicity and protective efficacy of recombinant outer membrane proteins of Haemophilus parasuis serovar 5 in a murine model[J]. PLoS One, 2017, 12(4): e0176537. DOI: 10.1371/journal.pone.0176537 |
| [2] |
王乐, 赵战勤, 薛云, 等. 副猪嗜血杆菌国内流行血清型菌株的致病性比较研究[J]. 中国兽医学报, 2014, 34(11): 1748–1752.
WANG L, ZHAO Z Q, XUE Y, et al. Comparative study on pathogenicity of the most prevalent serovars of Haemophilus parasuis isolates in China[J]. Chinese Journal of Veterinary Science, 2014, 34(11): 1748–1752. (in Chinese) |
| [3] | VANDERHAEGHEN W, CERPENTIER T, ADRIAENSEN C, et al. Methicillin-resistant Staphylococcus aureus (MRSA) ST398 associated with clinical and subclinical mastitis in Belgian cows[J]. Vet Microbiol, 2010, 144(1-2): 166–171. DOI: 10.1016/j.vetmic.2009.12.044 |
| [4] | JIA A Q, ZHOU R Y, FAN H Y, et al. Development of serotype-specific PCR assays for typing of Haemophilus parasuis isolates circulating in southern China[J]. J Clin Microbiol, 2017, 55(11): 3249–3257. DOI: 10.1128/JCM.00688-17 |
| [5] | MULLINS M A, REGISTER K B, BRUNELLE B W, et al. A curated public database for multilocus sequence typing (MLST) and analysis of Haemophilus parasuis based on an optimized typing scheme[J]. Vet Microbiol, 2013, 162(2-4): 899–906. DOI: 10.1016/j.vetmic.2012.11.019 |
| [6] |
付丹, 谭晓婷, 曹玉琴, 等. 副猪嗜血杆菌耐药性研究进展[J]. 中国预防兽医学报, 2016, 38(7): 591–594.
FU D, TAN X T, CAO Y Q, et al. Advances in drug resistance of Haemophilus parasuis[J]. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(7): 591–594. (in Chinese) |
| [7] | ZHANG Y H, LI G, XIE F, et al. Evaluation of glutathione-binding protein A of Haemophilus parasuis as a vaccine candidate in a mouse model[J]. J Vet Med Sci, 2017, 79(1): 184–187. DOI: 10.1292/jvms.16-0327 |
| [8] | ZHAO Z Q, LIU H S, XUE Y, et al. Analysis of efficacy obtained with a trivalent inactivated Haemophilus parasuis serovars 4, 5, and 12 vaccine and commercial vaccines against Glässer's disease in piglets[J]. Can J Vet Res, 2017, 81(1): 22–27. |
| [9] |
郭龙, 宋文博, 贾双, 等. 2017年我国规模化猪场副猪嗜血杆菌流行病学调查[J]. 中国兽医学报, 2019, 39(11): 2152–2156.
GUO L, SONG W B, JIA S, et al. Epidemiological survey of Haemophilus parasuis in large-scale pig farms of China in 2017[J]. Chinese Journal of Veterinary Science, 2019, 39(11): 2152–2156. (in Chinese) |
| [10] |
陈章, 汪清峰, 刘晓露, 等. 副猪嗜血杆菌安徽株血清型、基因型及耐药性[J]. 微生物学通报, 2020, 47(2): 571–582.
CHEN Z, WANG Q F, LIU X L, et al. Serotype, genotype and drug resistance of Haemophilus parasuis in Anhui province[J]. Microbiology China, 2020, 47(2): 571–582. (in Chinese) |
| [11] |
丁文文, 王乐, 李飞跃, 等. 副猪嗜血杆菌的分离鉴定及其流行病学研究[J]. 中国预防兽医学报, 2019, 41(8): 789–794.
DING W W, WANG L, LI F Y, et al. The isolation, identification and epidemiology of Haemophilus parasuis[J]. Chinese Journal of Preventive Veterinary Medicine, 2019, 41(8): 789–794. (in Chinese) |
| [12] |
邱静静, 丁柯, 余祖华, 等. 2014-2017年河南省副猪嗜血杆菌分离菌株的PCR鉴定及分型[J]. 畜牧兽医学报, 2019, 50(8): 1649–1657.
QIU J J, DING K, YU Z H, et al. PCR identification and serotyping of Haemophilus parasuis isolated from Henan province in 2014-2017[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(8): 1649–1657. (in Chinese) |
| [13] | ZHAO Y D, WANG Q, LI J, et al. Epidemiology of Haemophilus parasuis isolates from pigs in China using serotyping, antimicrobial susceptibility, biofilm formation and ERIC-PCR genotyping[J]. PeerJ, 2018, 6(5): e5040. |
| [14] |
王治方, 徐引弟, 朱文豪, 等. 副猪嗜血杆菌流行优势菌株调查和耐药性分析[J]. 中国兽医学报, 2019, 39(10): 1942–1946.
WANG Z F, XU Y D, ZHU W H, et al. Investigation of prevailing strains and drug resistance analysis of Haemophilus parasuis[J]. Chinese Journal of Veterinary Science, 2019, 39(10): 1942–1946. (in Chinese) |
| [15] | WANG Z H, ZHAO Q, WEI H L, et al. Prevalence and seroepidemiology of Haemophilus parasuis in Sichuan province, China[J]. Peer, 2017, 5: e3379. DOI: 10.7717/peerj.3379 |
| [16] | FU S L, GUO J, LI R Z, et al. Transcriptional profiling of host cell responses to virulent Haemophilus parasuis:new insights into pathogenesis[J]. Int J Mol Sci, 2018, 19(5): 1320. DOI: 10.3390/ijms19051320 |
| [17] | MATHIEU-DENONCOURT A, LETENDRE C, AUGER J P, et al. Limited interactions between Streptococcus suis and Haemophilus parasuis in in vitro co-infection studies[J]. Pathogens, 2018, 7(1): 7. DOI: 10.3390/pathogens7010007 |
| [18] |
程蕾, 陈洪波. 巨噬细胞-γδΤ细胞免疫轴在猪格拉瑟氏病发病机制中的作用[J]. 畜牧兽医学报, 2018, 49(5): 879–886.
CHENG L, CHEN H B. The role of macrophage-γδΤ cell immune axis in the pathogenesis of Glässer's disease[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 879–886. (in Chinese) |
| [19] |
贾爱卿, 袁子彦, 何永龙, 等. 副猪嗜血杆菌广东分离株MLST分型研究[J]. 中国预防兽医学报, 2014, 36(1): 23–26.
JIA A Q, YUAN Z Y, HE Y L, et al. MLST study of the Hamoephilus parasuis isolated from Guangdong province[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(1): 23–26. (in Chinese) |
| [20] | OLVERA A, CERDÀ-CUÉLLAR M, ARAGON V. Study of the population structure of Haemophilus parasuis by multilocus sequence typing[J]. Microbiology, 2006, 152(12): 3683–3690. DOI: 10.1099/mic.0.29254-0 |
| [21] | WANG L Y, MA L N, LIU Y A, et al. Multilocus sequence typing and virulence analysis of Haemophilus parasuis strains isolated in five provinces of China[J]. Infect Genet Evol, 2016, 44: 228–233. DOI: 10.1016/j.meegid.2016.07.015 |
| [22] |
李飞跃, 陈坤鹏, 丁文文, 等. 副猪嗜血杆菌小鼠毒力和仔猪毒力的相关性分析[J]. 畜牧兽医学报, 2020, 51(6): 1408–1418.
LI F Y, CHEN K P, DING W W, et al. Correlation between virulence of Haemophilus parasuis in mice and piglet[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(6): 1408–1418. (in Chinese) |
| [23] | YU J, WU J Q, ZHANG Y Y, et al. Identification of putative virulence-associated genes among Haemophilus parasuis strains and the virulence difference of different serovars[J]. Microb Pathog, 2014, 77: 17–23. DOI: 10.1016/j.micpath.2014.10.001 |



