奇异变形杆菌(Proteus mirabilis)是变形杆菌属中最重要的病原菌之一。其分布广泛,可在多种环境中存活,是导致人和动物感染的重要条件致病菌[1],也是泌尿系统感染中危害程度仅次于大肠杆菌的病原菌[2]。近年来,奇异变形杆菌引起人与动物的感染频繁发生[3-4],并且耐药性不断增强,给临床治疗带来了极大困难。前期研究表明,犬源奇异变形杆菌产生脲酶,具有强耐药性、强生物被膜形成能力,严重威胁人类健康[5]。因此,需要寻找一种新方法治疗奇异变形杆菌引起的相关感染。
噬菌体广泛存在于自然界,是一类可以感染并裂解细菌的病毒,其特异性极强,除对宿主菌具有裂解作用,不会感染其他的人和动物[6]。近年来,噬菌体作为一种抗生素替代物或补充治疗方法,在食源性感染防治[7-8]、控制病原菌的传播[9]以及治疗耐药性细菌感染等[10-11]方面取得了巨大的进展。在耐药菌株不断出现、新抗菌药研发停滞不前的状况下,噬菌体作为治疗感染性疾病的手段再次引起人们的关注。
前期孙萌萌等[12]从居民区生活污水中分离出4株奇异变形杆菌的噬菌体,具有较好的特异性和裂解活性。周祥莹等[4]以貉源奇异变形杆菌为宿主菌分离出裂解性噬菌体,为貉奇异变形杆菌病的治疗提供了参考。本研究从泌尿系统结石反复发作犬的尿液中分离到的奇异变形杆菌作为宿主菌,分离到3株奇异变形杆菌噬菌体,命名为vB_PmM_S、vB_PmM_W和vB_PmM_X,对其生物学特性进行研究,同时评价裂解性噬菌体对奇异变形杆菌生物被膜的作用效果,以期为奇异变形杆菌引起的泌尿系统感染的治疗和研制新型抗菌制剂奠定基础。
1 材料与方法 1.1 材料1.1.1 菌株及水样来源 宿主菌奇异变形杆菌分离株(HLJP-1、HLJP-6)来源于临床泌尿系统结石反复发作犬的尿液,奇异变形杆菌CMCC(B)49005购自中国食品药品检定研究院。水样采自城市污水。
1.1.2 主要试剂和仪器 LB液体培养基、营养琼脂培养基、Baird-Parker琼脂基础、亚碲酸盐卵黄增菌液、尿素酶琼脂基础购自青岛海博生物技术有限公司;聚乙二醇8000、氯仿等购自生工生物工程(上海)股份有限公司;OMEGA病毒DNA提取试剂盒购自杭州昕诚生物科技有限公司;RNA酶、DNA酶和Hoechst 33342购自北京索莱宝科技有限公司;绿豆核酸酶购自NEB(北京)有限公司;BamHⅠ购自宝生物工程(大连)有限公司。电热恒温培养箱(上海森信实验仪器有限公司);低温冷离心机(德国艾本德股份公司);JEM-2100 Plus透射电子显微镜(日本电子株式会社)。
1.2 方法1.2.1 噬菌体的分离纯化及电镜观察 取未处理城市污水3 000 mL,纱布初滤大颗粒杂质后加入CaCl2终浓度为1 mmol·L-1,6 000 g离心15 min除去其他杂质。透析袋浓缩离心后的污水上清4 ℃过夜,浓缩后的污水,经0.22 μm滤膜过滤除菌、备用。以奇异变形杆菌(HLJP-1、HLJP-6和49005)为宿主菌分离噬菌体。将100 mL滤液上清加入2×LB培养基100 mL,滴入对数生长期的宿主菌100 μL,37 ℃ 160 r·min-1振荡培养24 h,8 000 g离心30 min,取上清,0.22 μm滤器过滤除菌。将滤液和宿主菌充分混合,孵育10 min,接种到55 ℃半固体培养基(琼脂含量0.75%)充分混匀,倒入营养琼脂平板中,凝固后,置于37 ℃恒温培养6~8 h,观察噬菌斑的形成情况。挑取形状规则且透明的噬菌斑,采用双层平板法[13]分离纯化10次,可以得到纯化的噬菌体。
取噬菌体悬液10 μL(106 PFU·mL-1)置于铜网,静置20 min左右,用滤纸吸干多余液体,用负染液(2%磷钨酸溶液)染色5 min,滤纸吸干染液后,用蒸馏水清洗2遍,干燥后置于透射电镜(JEM-2100 Plus,JEOL,日本)观察。
1.2.2 最佳感染复数测定及一步生长曲线 根据Cai等[14]的方法稍作改动,将细菌培养至对数生长期(约1×108 CFU·mL-1),噬菌体与CMCC(B)49005各100 μL,按照比例为100、10、1、0.1、0.01、0.001进行混合,室温静置15 min。37 ℃恒温160 r·min-1振荡培养4 h。双层平板法测定噬菌斑数量,以噬菌体滴度增加最高比例的为最佳感染复数,重复3次取均值。
一步生长曲线绘制参考Morozova等[15]的方法,进行适当修改。取500 μL对数生长期的CMCC(B)49005(OD600 nm=0.3,约为1×108 CFU·mL-1),加入相同体积的噬菌体溶液以达到最佳感染(MOI=0.001)。混合物37 ℃静置孵育15 min,8 000 g离心5 min,弃上清,将沉淀重悬于10 mL LB液体培养基中,37 ℃恒温摇床160 r·min-1振荡培养。每间隔5 min取样,测定不同时间点噬菌体滴度,绘制一步生长曲线。
1.2.3 噬菌体温度和pH稳定性试验 将噬菌体等体积分装,分别置于不同温度水浴中孵育1 h后,检测噬菌体滴度变化,评价噬菌体热稳定性。同样,将等体积的噬菌体分别加到不同pH(pH=2.0~ 12.0)的缓冲溶液中37 ℃水浴中孵育1 h,检测噬菌体滴度,评价噬菌体酸碱稳定性。
1.2.4 噬菌体核酸类型及酶切分析 取浓缩后的噬菌体悬液,参照OMEGA病毒DNA提取试剂盒说明书提取噬菌体基因组。取10 μL噬菌体基因组DNA,分别进行RNA酶、DNA酶、绿豆核酸酶和BamHⅠ消化。酶切体系:7 μL纯水,2 μL Buffer K,1 μL限制性内切酶,振荡混匀,37 ℃水浴2 h,酶切产物经0.8%琼脂糖凝胶电泳分析。
1.2.5 最适保存条件 以vB_PmM_S为例,检测噬菌体用不同方法保存3、6和12个月后的滴度,比较不同保存条件下噬菌体的滴度变化。1)噬菌体与宿主菌等量混合,加入DMSO(5%)混合后分装于无菌管中密封保存于4和-80 ℃冰箱。2)噬菌体与宿主菌等量混合,加入甘油(30%)混合后分装于无菌管中密封保存于4和-80 ℃冰箱。3)噬菌体溶解于SM液,置于4 ℃保存。
1.2.6 生物被膜制备 参照Schuch等[16]的方法,用LB液体培养基复苏奇异变形杆菌HLJP-1,37 ℃过夜培养,按1:100比例将复苏的HLJP-1转接入LB液体培养基,37 ℃振荡培养到对数生长期。在96孔细胞培养板中每孔加入200 μL对数生长期菌液,放入37 ℃恒温静置培养48 h,每组3孔重复。以只含培养基的孔作为对照。结晶紫染色法半定量检测生物被膜形成情况。
1.2.7 生物被膜清除 将纯化的vB_PmM_S、vB_PmM_W和vB_PmM_X按等比例混合制备噬菌体鸡尾酒。用无菌PBS洗生物膜3次,每孔分别加入200 μL vB_PmM_S、vB_PmM_W、vB_PmM_X和噬菌体鸡尾酒,至终浓度为108 PFU·mL-1,SM液为对照组,37 ℃恒温静置培养。于4、8、12和24 h取样。处理后样品,PBS清洗3次,500 μL甲醇固定30 min,烘干后再加入500 μL结晶紫(1%)染色30 min。无菌水冲洗烘干后加500 μL冰乙酸(33%)溶解结晶紫,用酶标仪测定600 nm处吸光度。参照Schuch等[16]的方法进行结果判定。同时采用双层平板法检测噬菌体鸡尾酒作用生物被膜效价变化。
1.2.8 荧光显微镜观察噬菌体鸡尾酒对生物被膜的清除效果 按“1.2.6”方法,在24孔细胞爬片上培养成熟的细菌生物被膜,加入2 mL效价约为108 PFU·mL-1的噬菌体鸡尾酒处理24 h,PBS洗涤3次去除游离细菌,之后使用Hoechst 33342染色3~5 min,封片后,置于荧光显微镜下观察膜内细菌密度。
1.2.9 生物被膜形成抑制 将噬菌体鸡尾酒与对数生长期的宿主菌(1×108 CFU·mL-1)等比例接种到96孔细胞培养板中,37 ℃恒温静置培养48 h。宿主菌不加噬菌体组作为空白对照组。后期处理及结果判定参照方法“1.2.7”。
2 结果 2.1 噬菌斑及噬菌体电镜观察通过双层琼脂平板法从城市污水中分离出3株噬菌体,分别命名为vB_PmM_S、vB_PmM_W和vB_PmM_X,在双层琼脂平板上可见形状规则、边界清晰、透明和大小相近的噬菌斑(图 1)。3株噬菌体负染后经电镜观察(图 1),噬菌体头部呈二十面体对称,直径为(30±3) nm;噬菌体均具有短尾。根据国际病毒分类委员会分类规则[17],分离的3株噬菌体属于有尾病毒目(Caudovirales),肌尾噬菌体科(Myoviridae),电镜下形态存在差异。

|
图 1 vB_PmM_S、vB_PmM_W和vB_PmM_X噬菌斑和电镜图片 Fig. 1 Phage plaque and electron micrograph of vB_PmM_S, vB_PmM_W and vB_PmM_X |
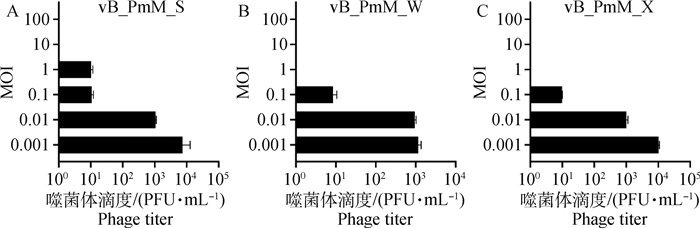
如图 2A、C所示,当MOI=0.001时,噬菌体vB_PmM_S和vB_PmM_X感染宿主后噬菌体滴度增加了将近104;如图 2B所示,当MOI=0.001时,噬菌体vB_PmM_W感染宿主菌后产生的噬菌体滴度增加了103。因此,噬菌体vB_PmM_S、vB_PmM_W和vB_PmM_X的最佳感染复数为0.001。
|
图 2 vB_PmM_S、vB_PmM_W、vB_PmM_X最佳感染复数测定 Fig. 2 Determination of MOI for vB_PmM_S, vB_PmM_W and vB_PmM_X |
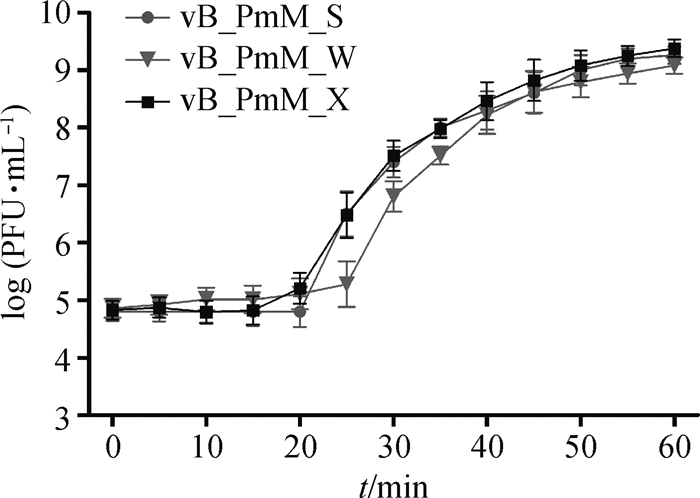
当MOI=0.001时噬菌体产出量最高,因此绘制一步生长曲线时按0.001的比例测定。vB_PmM_S、vB_PmM_W和vB_PmM_X一步生长曲线如图 3所示。vB_PmM_S感染宿主菌后20 min内(潜伏期)滴度无明显的变化,在感染宿主菌后20~55 min,噬菌体数量急剧增加,可知vB_PmM_S爆发时间约为35 min,平均裂解量为70 PFU·cell-1(裂解量=爆发末期噬菌体效价/感染初期宿主菌浓度)。vB_PmM_X一步生长曲线与vB_PmM_S相似。vB_PmM_W潜伏期约为25 min,爆发时间约为30 min。
|
图 3 vB_PmM_S、vB_PmM_W、vB_PmM_X一步生长曲线测定 Fig. 3 One-step growth curve of vB_PmM_S, vB_PmM_W and vB_PmM_X |
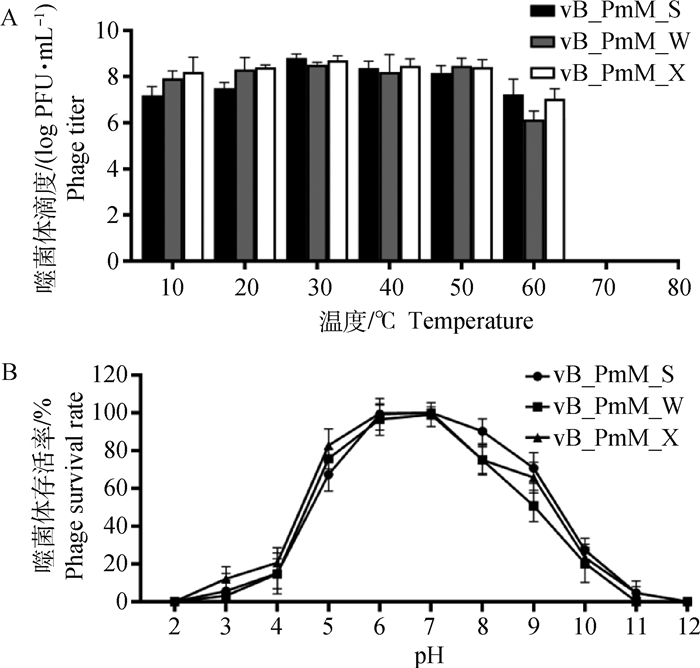
噬菌体分离自城市污水中,对环境的适应和耐受能力相对较强。热稳定性试验结果(图 4 A)表明,噬菌体vB_PmM_S在10~60 ℃,活性基本稳定。当温度升高到60 ℃时,噬菌体vB_PmM_W和vB_PmM_X滴度下降10~100倍;达到70 ℃时,噬菌体全部失活。
|
图 4 噬菌体vB_PmM_S、vB_PmM_W、vB_PmM_X的热稳定性和酸碱稳定性测定 Fig. 4 Determination of thermal and pH stability of vB_PmM_S, vB_PmM_W and vB_PmM_X |
从结果(图 4 B)可以看出,噬菌体vB_PmM_S、vB_PmM_W、vB_PmM_X经不同的pH处理1 h后,pH为2.0和12.0(vB_PmM_W pH为11)时噬菌体失活;而pH在5.0~8.0时酸碱度对噬菌体的活性影响不大,且当pH为6.0~7.0时噬菌体活性最高。结果表明,vB_PmM_S、vB_PmM_W、vB_PmM_X具有较好的热稳定性和耐酸碱性,能够满足动物体内治疗的需要。
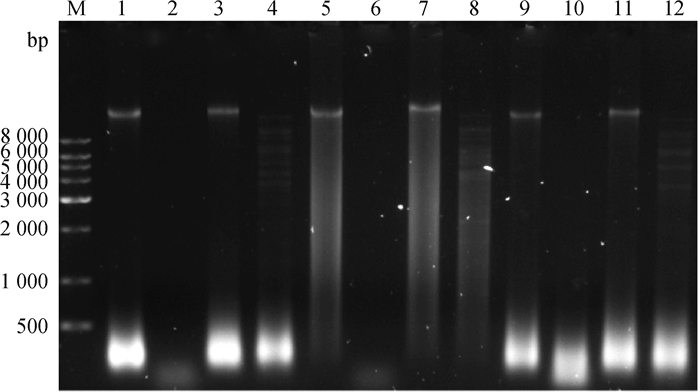
2.5 噬菌体核酸类型及酶切分析提取vB_PmM_S、vB_PmM_W、vB_PmM_X基因组DNA经0.8 %琼脂糖凝胶电泳分析表明,3株噬菌体都属于双链DNA噬菌体,并且3株噬菌体大小不相同(图 5);3株噬菌体基因组经BamHⅠ限制性内切酶酶切后,呈现不相同的酶切条带。以上结果从噬菌体形态、生物学特性、基因组大小、酶切分析等方面证明3株噬菌体为不同噬菌体。
|
M. 1 kb DNA Ladder I相对分子质量标准;1、5、9. RNA酶消化结果;2、6、10. DNA酶消化结果;3、7、11.绿豆核酸酶消化结果;4、8、12. BamHⅠ酶切产物 M. 1 kb DNA Ladder I maker; 1, 5, 9. RNase digestion results; 2, 6, 10. DNA enzyme digestion results; 3, 7, 11. Mung bean nuclease digestion results; 4, 8, 12. BamH Ⅰ digestion products 图 5 vB_PmM_S、vB_PmM_W、vB_PmM_X基因组及酶切电泳图 Fig. 5 Genome and restriction map of vB_ vB_PmM_S, vB_PmM_W and vB_PmM_X |
以vB_PmM_S为例,检测噬菌体在不同条件下的保存效果。vB_PmM_S分别加入终浓度为30%的甘油和5%的DMSO置于4 ℃,分别保存3、6和12个月后,随保存时间延长,噬菌体滴度明显下降,滴度由最初的109 PFU·mL-1分别下降至1.3×102和1.5×101 PFU·mL-1。分别加入终浓度为30%的甘油和5%的DMSO的vB_PmM_S置于-80 ℃保存,12个月噬菌体滴度下降约为3个数量级。vB_PmM_S直接保存在SM液置于4 ℃保存中3个月,噬菌体滴度变化不明显,6个月滴度下降4个数量级,12个月滴度降至102 PFU·mL-1。短期保存(6个月)vB_PmM_S,条件为SM液4 ℃保存;长期保存可采用甘油(30%)或者DMSO(5%)置于-80 ℃(表 1)。
|
|
表 1 不同保存条件下噬菌体的稳定性 Table 1 Stability of phage on different storage conditions |
奇异变形杆菌能够在泌尿导管上形成生物被膜导致多种疾病和并发症[5]。由图 6 A可知,3株噬菌体分别处理生物被膜24 h后,可不同程度地清除生物被膜;由图 6 B可知,随着噬菌体鸡尾酒处理时间的延长,被膜内细菌密度减小,当噬菌体鸡尾酒作用时间延长至24 h,被膜内细菌基本被清除,结晶紫染色后测定吸光度OD600 nm由0.83降至0.19。同时,噬菌体鸡尾酒噬菌体总效价由108升至109 PFU·mL-1,对生物被膜保持持续的清除作用。结果表明噬菌体鸡尾酒对奇异变形杆菌生物被膜有良好的清除效果。
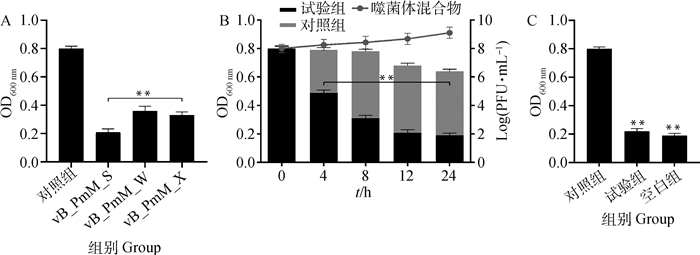
|
A. 3株噬菌体对生物被膜的清除能力;B.噬菌体鸡尾酒对生物被膜的清除作用;C.噬菌体鸡尾酒对生物被膜形成的抑制作用。**.P<0.01 A. Removal effect of three phages on biofilm; B. Ability of phage cocktail to eliminate biofilm; C. The inhibition effect of phage cocktail on biofilm. **.P < 0.01 图 6 噬菌体鸡尾酒对奇异变形杆菌生物被膜作用 Fig. 6 Phage cocktail effects on the biofilm of Proteus mirabilis |
在生物被膜形成抑制试验中(图 6C),将噬菌体鸡尾酒与奇异变形杆菌共同作用48 h后,与对照组相比,噬菌体鸡尾酒能极显著(P<0.01)抑制奇异变形杆菌生物被膜的形成,与空白组相似。结果表明,噬菌体鸡尾酒具有破坏奇异变形杆菌生物被膜的能力。
由图 7可以看出,HLJP-1可在细胞爬片上形成致密的生物被膜结构。与对照组相比,噬菌体鸡尾酒处理24 h后镜下观察发现细菌多散在分布,很少有聚集的现象,同时可以直观地看出被膜内细菌密度明显减小,表明噬菌体鸡尾酒可以破坏生物被膜结构,并且对膜内细菌有较强的清除能力。
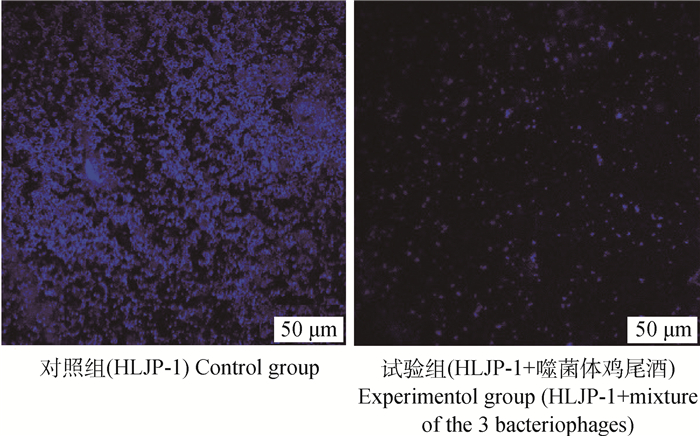
|
图 7 荧光显微镜观察生物被膜 Fig. 7 Observation of biofilm by fluorescence microscope |
奇异变形杆菌分布广泛[18],能够引起人和动物食物中毒、泌尿系统和呼吸系统感染[19]。近年来,奇异变形杆菌耐药性不断增强[20],耐药菌株的不断出现,不仅对畜牧业造成很大影响,还严重威胁人类健康。寻找新型的靶向特异性、对人兽安全、环保的抗菌生物制剂十分必要。
噬菌体在生态系统的分布广泛,比抗生素更容易获得,而且噬菌体对细菌具有特异性靶向作用,裂解宿主菌时几乎不会影响其他菌群,是细菌种群强大的自然调节剂,噬菌体的多样性不可估量。
本研究从城市污水中分离出3株奇异变形杆菌噬菌体,经电镜观察,根据最新国际病毒分类委员会第十次报告提出的分类原则[17],本文所分离的3株噬菌体属于有尾病毒目,肌尾噬菌体科,其核酸均为双链DNA。分离的噬菌体的最佳感染复数为0.001;一步生长曲线的结果表明,vB_PmM_S潜伏期约为20 min,爆发期约为35 min,平均裂解量为70 PFU·cell-1。表明噬菌体对奇异变形杆菌具有良好的特异性和高效的裂解性。进一步测定噬菌体温度敏感性和最适pH,3株噬菌体发挥最佳的裂解活性温度和pH略有不同,但都在相对较宽的范围内(温度10~60 ℃;pH 5.0~8.0),满足噬菌体体内治疗的要求,能够应用于人和动物感染性疾病的治疗。
奇异变形杆菌是引起泌尿系统感染、感染性结石最主要的病原菌之一。先前研究表明,奇异变形杆菌能够在不同类型的泌尿导管上形成晶体生物被膜[5]。生物被膜结晶堵塞导管,受感染的尿液回流到肾,导致肾盂肾炎、败血症和休克等多种并发症[21]。奇异变形杆菌分泌的胞外多糖等在感染性结石形成和持续性感染中起主要作用[22]。本研究用于分离裂解性噬菌体的宿主菌来源于泌尿系统结石反复发作、伴有血尿的宠物犬,能够形成较强的生物被膜。而生物被膜的形成对细菌提供了保护,使其免受药物和机体免疫系统清除,对细菌耐药性的产生和延长治疗时间起到一定作用[23]。前期研究表明,噬菌体鸡尾酒在治疗革兰阴性菌感染的效果优于单一噬菌体治疗,可以减少和避免细菌突变及细菌对噬菌体产生抗性[24-25]。本文将分离到的3株噬菌体混合制备噬菌体鸡尾酒处理生物被膜,能够发挥协同作用增强噬菌体裂解效果,减少噬菌体抗性菌株的产生。噬菌体组合的鸡尾酒不但能够有效清除形成的生物被膜,还能够抑制细菌定植、形成生物被膜,具有治疗和控制由奇异变形杆菌引起的人和动物泌尿系统感染性疾病的潜力。
4 结论分离获得的3株奇异变形杆菌噬菌体能够发挥协同作用增强裂解效果,混合后制备的噬菌体鸡尾酒能够有效清除奇异变形杆菌生物被膜,并且抑制细菌定植和生物被膜的形成。研究结果为奇异变形杆菌引起的泌尿系统感染的治疗和研制新型抗菌制剂奠定基础。
| [1] | CHEN C Y, CHEN Y H, LU P L, et al. Proteus mirabilis urinary tract infection and bacteremia: risk factors, clinical presentation, and outcomes[J]. J Microbiol Immunol Infect, 2012, 45(3): 228–236. DOI: 10.1016/j.jmii.2011.11.007 |
| [2] | MOBLEY H L T, BELAS R. Swarming and pathogenicity of Proteus mirabilis in the urinary tract[J]. Trends Microbiol, 1995, 3(7): 280–284. DOI: 10.1016/S0966-842X(00)88945-3 |
| [3] | CERNOHORSKA L, CHVILOVÁ E. Proteus mirabilis isolated from urine, resistance to antibiotics and biofilm formation[J]. Klin Mikrobiol Infekc Lek, 2011, 17(3): 81–85. |
| [4] |
周祥莹, 刘慧, 孙虎芝, 等. 貉源奇异变形杆菌的分离鉴定及噬菌体的分离[J]. 黑龙江畜牧兽医, 2018(20): 199–202.
ZHOU X Y, LIU H, SUN H Z, et al. Isolation and identification of Proteus mirabilis from raccoon dog and isolation of bacteriophage[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(20): 199–202. (in Chinese) |
| [5] | MORRIS N S, STICKLER D J, WINTERS C. Which indwelling urethral catheters resist encrustation by Proteus mirabilis biofilms?[J]. Br J Urol, 1997, 80(1): 58–63. |
| [6] | HATFULL G F, HENDRIX R W. Bacteriophages and their genomes[J]. Curr Opin Virol, 2011, 1(4): 298–303. DOI: 10.1016/j.coviro.2011.06.009 |
| [7] |
郑小双, 高璐, 张辉, 等. 副溶血性弧菌广谱裂解性噬菌体的筛选及其在海产品安全控制中的应用[J]. 食品科学, 2019, 40(10): 141–148.
ZHENG X S, GAO L, ZHANG H, et al. Screening for broad-spectrum lytic phage against vibrio parahaemolyticus and its application to marine products[J]. Food Science, 2019, 40(10): 141–148. (in Chinese) |
| [8] |
聂若男, 李晚宁, 杨其乐, 等. 1株裂解性短尾沙门氏菌噬菌体T139的生物学特性及其对牛奶和牛肉的抑菌作用[J]. 食品科学, 2019, 40(18): 130–136.
NIE R N, LI W N, YANG Q L, et al. Biological characteristics of a lytic short-tailed Salmonella phage T139 and its antibacterial effect in milk and ground beef[J]. Food Science, 2019, 40(18): 130–136. (in Chinese) |
| [9] | WROE J A, JOHNSON C T, GARCÍA A J. Bacteriophage delivering hydrogels reduce biofilm formation in vitro and infection in vivo[J]. J Biomed Mater Res Part A, 2020, 108(1): 39–49. DOI: 10.1002/jbm.a.36790 |
| [10] | DEDRICK R M, GUERRERO-BUSTAMANTE C A, GARLENA R A, et al. Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus[J]. Nat Med, 2019, 25(5): 730–733. DOI: 10.1038/s41591-019-0437-z |
| [11] | FOX A. Engineered phages stymie drug-resistant infection[J]. Science, 2019, 364(6440): 518–519. DOI: 10.1126/science.364.6440.518 |
| [12] |
孙盟盟, 宋天一, 胡士华, 等. 奇异变形杆菌噬菌体的分离鉴定及其生物学特性分析[J]. 中国生物制品学杂志, 2012, 25(3): 336–339.
SUN M M, SONG T Y, HU S H, et al. Isolation, identification and biological characters of bacteriophages of Proteus mirabilis[J]. Chinese Journal of Biologicals, 2012, 25(3): 336–339. (in Chinese) |
| [13] | ABATÁNGELO V, BACCI N P, BONCOMPAIN C A, et al. Broad-range lytic bacteriophages that kill Staphylococcus aureus local field strains[J]. PLoS One, 2017, 12(7): e0181671. DOI: 10.1371/journal.pone.0181671 |
| [14] | CAI R P, WANG Z J, WANG G, et al. Biological properties and genomics analysis of vB_KpnS_GH-K3, a Klebsiella phage with a putative depolymerase-like protein[J]. Virus Genes, 2019, 55(5): 696–706. DOI: 10.1007/s11262-019-01681-z |
| [15] | MOROZOVA V, KOZLOVA Y, SHEDKO E, et al. Isolation and characterization of a group of new Proteus bacteriophages[J]. Arch Virol, 2018, 163(8): 2189–2197. DOI: 10.1007/s00705-018-3853-3 |
| [16] | SCHUCH R, KHAN B K, RAZ A, et al. Bacteriophage Lysin CF-301, a potent antistaphylococcal biofilm agent[J]. Antimicrob Agents Chemother, 2017, 61(7): e02666–16. |
| [17] | LEFKOWITZ E J, DEMPSEY D M, HENDRICKSON R C, et al. Virus taxonomy: the database of the International Committee on Taxonomy of Viruses (ICTV)[J]. Nucleic Acids Res, 2018, 46(D1): D708–D717. DOI: 10.1093/nar/gkx932 |
| [18] | ARMBRUSTER C E, FORSYTH-DEORNELLAS V, JOHNSON A O, et al. Genome-wide transposon mutagenesis of Proteus mirabilis: essential genes, fitness factors for catheter-associated urinary tract infection, and the impact of polymicrobial infection on fitness requirements[J]. PLoS Pathog, 2017, 13(6): e1006434. DOI: 10.1371/journal.ppat.1006434 |
| [19] | COHEN-NAHUM K, SAIDEL-ODES L, RIESENBERG K, et al. Urinary tract infections caused by multi-drug resistant Proteus mirabilis: risk factors and clinical outcomes[J]. Infection, 2010, 38(1): 41–46. DOI: 10.1007/s15010-009-8460-5 |
| [20] |
张利锋, 李娟, 卢金星. 奇异变形杆菌耐药性研究进展[J]. 疾病监测, 2016, 31(5): 427–432.
ZHANG L F, LI J, LU J X. Progress in research of antibiotic resistance of Proteus mirabilis[J]. Disease Surveillance, 2016, 31(5): 427–432. (in Chinese) |
| [21] | HOLLING N, LEDNOR D, TSANG S, et al. Elucidating the genetic basis of crystalline biofilm formation in Proteus mirabilis[J]. Infect Immun, 2014, 82(4): 1616–1626. |
| [22] |
高逢彬. 泌尿系感染性结石的成因及诊治现状[J]. 泌尿外科杂志(电子版), 2015, 7(4): 51–54.
GAO F B. The causes and diagnosis of infectious urinary calculi[J]. Journal of Urology for Clinicians (Electronic Version), 2015, 7(4): 51–54. (in Chinese) |
| [23] | ARMBRUSTER C E, MOBLEY H L T, PEARSON M M. Pathogenesis of Proteus mirabilis infection[J]. EcoSal Plus, 2018, 8(1). DOI: 10.1128/ecosalplus.ESP-0009-2017 |
| [24] | GU J M, LIU X H, LI Y, et al. A method for generation phage cocktail with great therapeutic potential[J]. PLoS One, 2012, 7(3): e31698. DOI: 10.1371/journal.pone.0031698 |
| [25] | YU L, WANG S, GUO Z M, et al. A guard-killer phage cocktail effectively lyses the host and inhibits the development of phage-resistant strains of Escherichia coli[J]. Appl Microbiol Biotechnol, 2018, 102(2): 971–983. |



