2. 东北寒区肉牛科技创新教育部工程研究中心, 延吉 133002
2. Engineering Research Center of North-East Cold Region Beef Cattle Science & Technology Innovation, Yanji 133002, China
由于人们对高品质牛肉的追求日渐增长,促使优等肉牛产业链条向高附加值畜牧业发展延伸,使一直处在低潮状态的肉牛养殖业成为畜牧行业的热门。延边黄牛作为中国5大良种黄牛之一,体格高大、抗寒、耐粗饲、肉质口感独特、遗传特性稳定且性情温顺易于管理,迄今为止,已有150多年的历史,是我国东北地区首屈一指的肉牛品种[1]。牛肉的品质与脂肪含量有关,增加肌内脂肪沉积可以有效改善肉质性状[2]。脂肪细胞来源于间充质干细胞(MSC),其首先分化为成脂细胞,然后分化为前脂肪细胞,最后分化为成熟的脂肪细胞[3-4]。前体脂肪细胞的分化大体上可以分成4个阶段,即增殖阶段、有丝分裂克隆阶段、早期分化阶段及终末分化阶段[5]。前体脂肪细胞生长至接触抑制后,逐渐停止增殖,开始分化[6]。分化过程受到许多转录因子的调控,例如CCAAT增强子结合蛋白β(CCAAT enhancer binding proteins β, C/EBPβ)诱导过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma, PPARγ)表达,PPARγ再激活CCAAT增强子结合蛋白α(CCAAT enhancer binding proteins α, C/EBPα)的表达,进而促进脂肪分化。最终,前体脂肪细胞分化为含有大颗粒脂滴的成熟脂肪细胞[7]。
microRNA (miRNA)最早是在1993年被Lee等[8]在秀丽新线虫中发现的,广泛存在于真核细胞中。miRNA可以从基因组上转录而来,但是不会翻译成蛋白质,而是与靶mRNA结合,通过抑制mRNA的翻译或降解靶mRNA来调控靶基因的表达[9]。从而在RNA的基础上行使自身的生物学功能,参与包括脂肪代谢和细胞分化等一系列的重要进程[10]。例如,miR-16-5p[11]、miR-26b[12]、miR-181a[13]等可以促进脂肪分化,而miR-124-3p[14]、miR-375[15]和miR-127[16]等可以抑制脂肪分化。本课题组前期利用miRNA-seq和RNA-seq联合对延边黄牛背最长肌的高、低脂肪组进行转录组分析,发现bta-miR-17-3p和含钾离子通道四聚化结构域15 (potassium channel tetramerisation domain containing 15,KCTD15)都在高、低脂肪组中存在差异表达;其中,KCTD15基因在高脂肪组的表达量高于低脂肪组,而低脂肪组bta-miR-17-3p的表达量则高于高脂肪组,二者呈现相反的分布规律[17-18]。因此,推测,bta-miR-17-3p和KCTD15都可能作用于延边黄牛的肌内脂肪沉积。并且通过TargetScan检索到KCTD15也是bta-miR-17-3p的预测靶基因。所以推测,KCTD15可能是bta-miR-17-3p的候选靶基因。然而,尚未有报道将bta-miR-17-3p及其任何靶基因与脂肪形成联系起来。
虽然小鼠3T3-L1细胞系常被用来研究脂肪细胞分化,但小鼠与牛存在物种间差异,3T3-L1的成脂过程无法准确地反映出延边黄牛脂代谢的实际调控过程[19]。本研究以初生延边黄牛原代前体脂肪细胞为试验材料,分别使用miRNA模拟物和抑制剂来过表达或敲低细胞中的bta-miR-17-3p。采用qRT-PCR和Western blot检测牛前脂肪细胞中PPARγ、C/EBPα和KCTD15的表达。并通过双荧光素酶报告基因测定法验证bta-miR-17-3p与KCTD15是否存在靶标关系。研究结果旨在阐明bta-miR-17-3p在脂肪细胞分化中的作用,为进一步研究miRNA介导的牛脂肪组织的生理调节提供理论基础。
1 材料与方法 1.1 试验样品延边黄牛前体脂肪细胞由实验室前期分离得到,HepG2细胞由延边大学药学院赠与。细胞都储存在液氮罐中。
1.2 主要试剂琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒、DH5α大肠杆菌感受态细胞和DNA聚合酶均购自北京天根生化科技有限公司;Xba Ⅰ、Hpa Ⅰ内切酶和T4连接酶均购自北京NEB公司;总RNA提取试剂盒、pGL3-Control萤火虫荧光素酶载体、PRL-TK海肾荧光素酶载体和Dual-GloTM Luciferase Assay System双荧光素酶检测试剂盒均购自北京Promega公司;转染试剂lipo2000和lipo3000购自Invitrogen公司;反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)和荧光定量试剂盒TB GreenTM Premix Ex TaqTM Ⅱ购自大连宝生物公司;胰岛素、地塞米松和IBMX购自Sigma公司;Rabbit Anti-CEBP-alpha antibody和Rabbit Anti-PPAR gamma antibody均购自北京博奥森公司;Anti-KCTD15 antibody购自艾博抗公司;β-actin (4D3) monoclonal antibody、Goat anti-Rabbit IgG (H+L)-HRP和Goat anti-Mouse IgG (H+L) -HRP购自Bioworld公司。
1.3 延边黄牛前体脂肪细胞培养及成脂分化将细胞置于含有10%胎牛血清的DMEM完全培养基中培养,培养皿放置在37 ℃,50 mL·L-1 CO2条件下的培养箱中。当前体脂肪细胞生长到70%~80%汇合度时,用胰酶消化后把悬浮细胞传代到6孔板中。等到细胞长满后开始进行诱导分化,向完全培养液中添加终浓度为10 μg·mL-1的胰岛素、0.5 mmol·L-1的IBMX和1.0 μmol·L-1的DEX。2 d后,撤去旧培养液,更换成终浓度为10 μg·mL-1胰岛素的完全培养液。再过2 d后,重新更换为不含诱导剂的完全培养液培养细胞,直至第9天完成诱导分化。
1.4 生物信息学分析通过miRBase(http://www.mirbase.org/)获得miR-17-3p的成熟序列,并进行哺乳动物之间的同源性分析。通过TargetScan(http://www.targetscan.org/vert_71/)网站预测bta-miR-17-3p的靶基因。
1.5 牛前体脂肪细胞的转染将牛前体脂肪细胞以1×106个·孔-1的密度接种到6孔板中,每孔放2 mL DMEM完全培养基。一旦细胞生长到70%汇合,就更换新的无双抗完全培养基。将5 μL的lipo2000和10 μL的20 μmol·L-1的bta-miR-17-3p mimic(或等体积的抑制物或阴性对照NC)分别添加到100 μL的Opti-MEM培养基中。然后将lipo2000-Opti-MEM和bta-miR-17-3p-Opti-MEM混匀,并在室温下孵育5 min。6 h后给细胞换成新鲜完全培养液。
1.6 油红O染色牛前体脂肪细胞诱导分化9 d后,弃培养液,用PBS洗涤细胞两次,并在室温下用4%多聚甲醛溶液固定30 min。用PBS冲洗两次。将油红O染液添加到6孔板中室温条件下染色30 min。弃油红O溶液,并将细胞用水洗涤3次。最后,在显微镜下观察细胞的形态和脂滴。
1.7 双荧光素酶报告基因检测系统验证根据美国国家生物技术信息中心(NCBI)提供的牛KCTD15基因的3′UTR序列,设计引物以扩增与bta-miR-17-3p种子序列(5′端第2~8个碱基)完全匹配的基因片段。将Xba Ⅰ和Hpa Ⅰ限制性酶切位点分别添加到上游和下游引物的5′端。将PCR产物连接至pGL3-Control载体。另外,设计了突变引物以定点突变种子序列的3个碱基,并将突变的PCR产物也克隆到pGL3-Control载体中。引物序列在表 1中列出,划线部分为酶切位点。扩增反应体系包括:cDNA 3 μL, 2×Taq PCR Mastermix 10 μL, 上、下游引物各0.5 μL,用双蒸水补足20 μL。PCR反应程序:95 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃退火30 s,30个循环;72 ℃延伸10 min。
|
|
表 1 候选靶基因KCTD15的种子序列引物 Table 1 Primers targeting the seed region of the candidate target gene KCTD15 |
将HepG2细胞接种到96孔板中,同时,用lipo-3000将0.1 μg pGL3-Control载体、5 ng内参质粒pRL-TK和0.5 μL 20 μmol·L-1的bta-miR-17-3p mimic或mimic NC共转染到细胞里。48 h后,使用双荧光素酶检测试剂盒检测荧光素酶活性。
1.8 前体脂肪细胞RNA提取及qRT-PCR检测使用总RNA提取试剂盒从细胞中提取RNA。用PrimeScript RT试剂盒将RNA反转录为cDNA。使用SYBR Premix Ex Taq Ⅱ试剂盒进行qRT-PCR。冰上配制qRT-PCR反应液:TB Green Premix Ex Taq Ⅱ 5 μL,上、下游引物各0.4 μL,cDNA样品1 μL,双蒸水3.2 μL。在PCRmax Eco 48实时PCR仪上进行qRT-PCR反应。反应程序:95 ℃预变性30 s,95 ℃变性5 s和60 ℃退火30 s共40个循环。2-ΔΔCt方法用于计算相对mRNA表达水平,β-actin基因被用作内参基因来标准化其他蛋白质编码基因的表达。用于qPCR的引物序列见表 2。
|
|
表 2 用于qRT-PCR的引物 Table 2 Primers used for qRT-PCR analysis |
使用RIPA裂解缓冲液提取细胞总蛋白。使用BCA蛋白质检测试剂盒测量总蛋白质浓度。将每个样品中分别取20 μg蛋白在12%SDS-PAGE凝胶中电泳。等到蓝色染料迁移到胶板下部边缘,将凝胶转移到聚偏二氟乙烯(PVDF)膜上,用半干转的方式进行转膜。转膜后在室温条件下将PVDF膜浸泡在浓度为50 g·L-1卵清蛋白的TBST溶液封闭2 h。封闭结束后使用封闭液将一抗稀释1 000倍,然后与PVDF膜一起4 ℃孵育过夜。在TBST中洗涤5次后,将膜放入稀释了5 000倍的二抗溶液中4 ℃孵育2 h。然后将膜在TBST中冲洗5次,并使用化学发光溶液对膜进行曝光和观察,同时,使用Image J软件对目标条带强度进行数字分析。
1.10 数据分析所有结果均以“平均值±标准差”表示。荧光定量PCR和Western blot测定的数据采用独立样本t检验分析,双荧光素酶报告基因试验所得的数据通过单因素ANOVA方差分析进行评估,P < 0.05代表组间差异具有统计学意义。所有统计分析均使用SPSS 20.0软件进行。
2 结果 2.1 牛前体脂肪细胞的成脂能力正常的延边黄牛前体脂肪细胞贴壁后呈梭形(图 1A)。前体脂肪细胞经诱导分化后可产生大量呈戒环状的脂滴(图 1B),说明细胞能够成功分化并可用于后续试验。
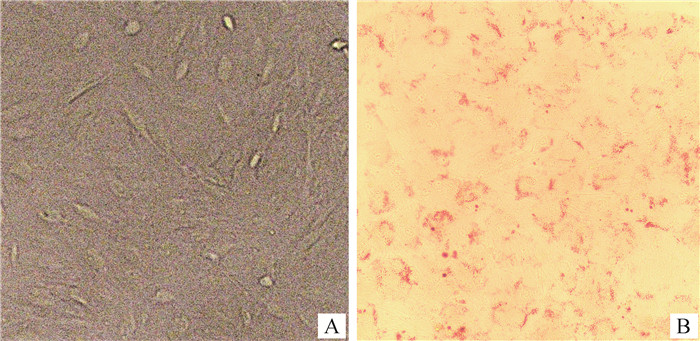
|
A.培养4 d后的延边黄牛前体脂肪细胞;B.前体脂肪细胞诱导分化9 d后的油红O染色结果 A. Yanbian Yellow cattle preadipocytes cultured for 4 days; B. Oil Red O stained result of preadipocytes after induced differentiation for 9 days 图 1 体外培养的延边黄牛前体脂肪细胞(200×) Fig. 1 In vitro cultured Yanbian Yellow cattle preadipocytes (200×) |
牛(bta)miR-17-3p位于牛的第12号染色体上。而人(hsa)miR-17-3p位于第13号染色体上,鼠的(mmu)miR-17-3p位于第14号染色体上。同时,hsa-miR-17-3p、mmu-miR-17-3p和bta-miR-17-3p是同源的,种子序列完全一致。不仅是人和鼠,成熟的miR-17-3p序列在很多哺乳动物之间也高度保守,包括在大猩猩、猴、猪和山羊等物种中。尽管miRNA序列之间存在一些细微差异,但种子序列却是相同的(图 2A)。使用TargetScan预测的bta-miR-17-3p的候选靶基因KCTD15的结合位点如图 2B所示。

|
A.哺乳动物中的miR-17-3p序列,其种子区域以阴影表示;B.KCTD15基因3′UTR中bta-miR-17-3p的结合位点 A.The miR-17-3p sequence in mammals with the seed regions indicated in shadow; B.The target site of bta-miR-17-3p within the 3′UTR of the KCTD15 mRNA transcript 图 2 miR-17-3p的生物学分析 Fig. 2 Biological analysis of miR-17-3p |
将等量miR-17-3p mimic和mimic NC转染到牛的前体脂肪细胞中,待细胞长满后开始诱导分化。miRNA含有FAM绿色荧光标记,6 h后荧光显微镜下观察转染效率,如图 3所示,转染效率较高,可进行后续试验。分别提取已转染miR-17-3p mimic和mimic NC的细胞的总RNA和蛋白质,通过荧光定量PCR和Western blot检测脂代谢标志基因PPARγ和C/EBPα在mRNA和蛋白水平上的相对表达量。结果显示,转染miR-17-3p mimic后,PPARγ和C/EBPα的mRNA表达量以及C/EBPα的蛋白表达水平都有极显著提高(P < 0.01);PPARγ的蛋白表达量也有显著增加(P < 0.05,图 4A、B)。
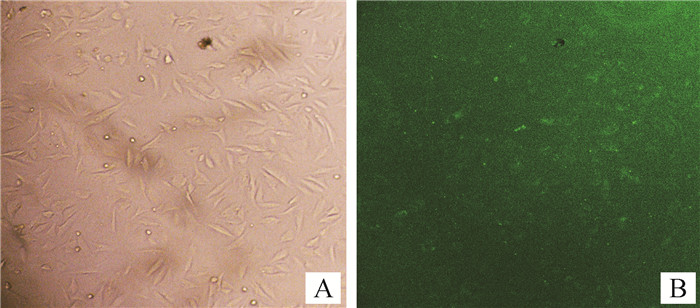
|
A.自然光下成像;B.荧光显微镜下成像 A. Imaged under natural light; B. Imaged under fluorescence microscopy 图 3 miRNA转染效率估测(100×) Fig. 3 Estimation of miRNA transfection efficiency (100×) |
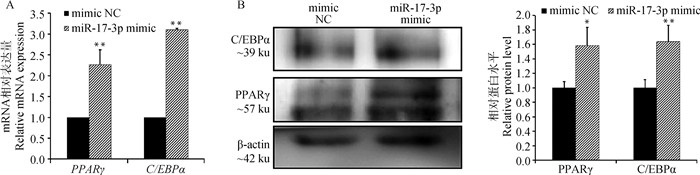
|
A. miR-17-3p过表达后成脂标记基因mRNA表达;B. miR-17-3p过表达后成脂标记基因编码蛋白的表达。*. P < 0.05, **. P < 0.01;下同 A. The mRNA expression of adipogenic marker genes after overexpressing miR-17-3p; B. The protein expression of adipogenic marker genes after overexpressing miR-17-3p. *. P < 0.05, **. P < 0.01; the same as below 图 4 miR-17-3p过表达后对成脂标志基因的影响 Fig. 4 Effect of miR-17-3p overexpression on adipogenic marker genes |
为了更全面探究miR-17-3p对牛成脂分化的影响,将等量人工合成的miR-17-3p inhibitor和inhibitor NC转染到牛的前体脂肪细胞中。检测脂代谢标志基因PPARγ和C/EBPα在mRNA和蛋白水平上表达量的变化。结果显示,转染了miR-17-3p inhibitor后脂肪细胞中脂代谢标志基因PPARγ和C/EBPα在mRNA和蛋白水平的表达量相较阴性对照组都有显著或极显著地降低(P < 0.05或P < 0.01,图 5A、B)。
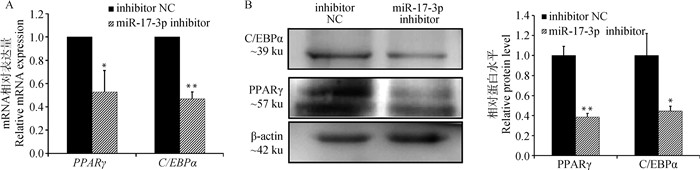
|
A.抑制miR-17-3p表达后成脂标记基因mRNA表达;B.抑制miR-17-3p表达后成脂标记基因编码蛋白的表达 A.The mRNA expression of adipogenic marker genes after inhibiting miR-17-3p expression; B.The protein expression of adipogenic marker genes after inhibiting miR-17-3p expression 图 5 抑制miR-17-3p表达后对成脂标志基因的影响 Fig. 5 Effect of miR-17-3p knockdown on adipogenic marker genes |
为了确定miR-17-3p能否特异性识别KCTD15的3′UTR,本试验扩增了KCTD15的3′UTR中包含miR-17-3p种子序列结合位点的片段(图 6A)。创建了野生型重组质粒“pGL3-Control-WT”和突变型重组质粒“pGL3-Control-MUT”(图 6B)。分为pGL3-Control、pRL-TK、miR-17-3p mimic;pGL3-Control、pRL-TK、miR-NC;pGL3-KCTD15-WT、pRL-TK、miR-17-3p mimic;pGL3-KCTD15-WT、pRL-TK、miR-NC;pGL3-KCTD15-MUT、pRL-TK、miR-17-3p mimic;pGL3-KCTD15-MUT、pRL-TK、miR-NC共6组,每组设3个重复孔,共转染进HepG2细胞,荧光活性检测结果见图 6C。结果表明,过表达miR-17-3p极显著降低了野生型质粒的荧光活性(P < 0.05),但对突变型质粒和空载质粒没有显著作用(P>0.05);而阴性对照对各组质粒的荧光活性都没有明显影响(P>0.05)。这一结果说明KCTD15可能是miR-17-3p的潜在靶基因。
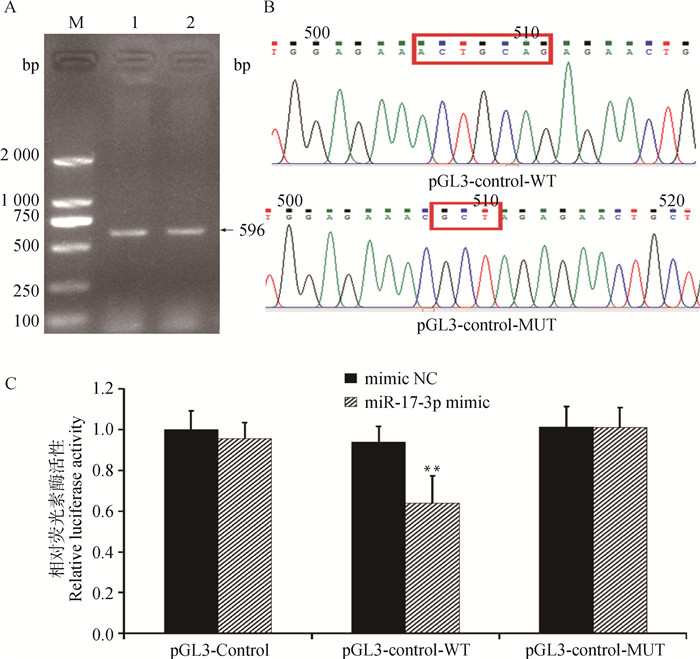
|
A.KCTD15 3′UTR的PCR产物电泳图;B.野生型质粒(方框为预测靶点)和突变型质粒(方框为突变位点);C.miR-17-3p与KCTD15靶向关系的双荧光素检测。M. DNA相对分子质量标准 A.KCTD15 3′UTR PCR product electrophoresis map; B.Wild type plasmid (the box is the predicted target site) and mutant plasmid (the box is the mutation site); C.Dual-luciferase reporter assay of targeting relationship between miR-17-3p and KCTD15. M. D2000 DNA marker 图 6 miR-17-3p的靶基因验证 Fig. 6 Validation of miR-17-3p target gene |
为了确定牛miR-17-3p是否通过靶向KCTD15促进脂肪生成。本试验用miR-17-3p mimic和mimic NC转染了牛的前体脂肪细胞。诱导分化后提取细胞总RNA和蛋白进行检测。结果显示,过表达miR-17-3p显著抑制了KCTD15基因的mRNA表达量(P < 0.05),并极显著降低了该基因编码蛋白的表达量(P < 0.01,图 7A、B)。本试验又将miR-17-3p inhibitor和inhibitor NC转染进前体脂肪细胞中进行检测。结果显示,抑制miR-17-3p的表达后,KCTD15的mRNA和蛋白表达水平会随之得到显著提高(P < 0.05,图 7C、D)。这也再次证明,在延边黄牛中miR-17-3p与KCTD15存在靶向关系,说明miR-17-3p参与调控KCTD15的表达。
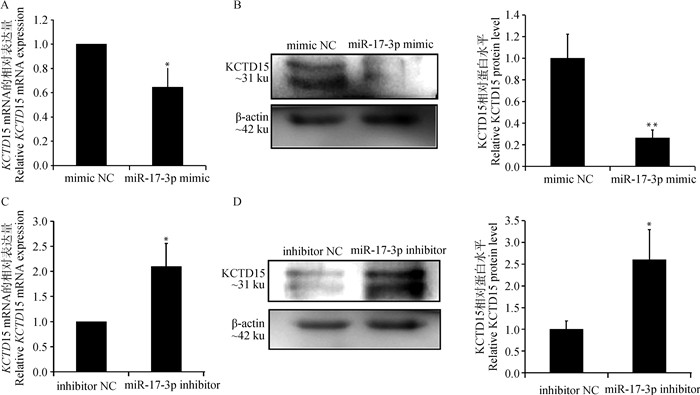
|
A. miR-17-3p过表达后KCTD15的mRNA表达;B.miR-17-3p过表达后KCTD15的蛋白表达;C.抑制miR-17-3p表达后KCTD15的mRNA表达;D.抑制miR-17-3p表达后KCTD15的蛋白表达 A.The mRNA expression of KCTD15 after miR-17-3p overexpression; B.The protein expression of KCTD15 after miR-17-3p overexpression; C.The mRNA expression of KCTD15 after inhibiting miR-17-3p expression; D.The protein expression of KCTD15 after inhibiting miR-17-3p expression 图 7 miR-17-3p对KCTD15表达的影响 Fig. 7 The effect of miR-17-3p on expression of KCTD15 |
体外分离培养前体脂肪细胞可以具象地观察脂肪组织的形成过程,能直接认识到多种调控因子对整个分化进程的调节方式,所以近几年有越来越多的研究者利用前体脂肪细胞来探究脂代谢的调控机制[20]。脂肪细胞的增殖分裂导致数量增多,发育分化则会导致体积的增大,这两个方面都会立竿见影地影响到脂肪沉积,而肉牛脂肪组织的种类和3种不同类型组织的占比又会不同程度地调节肉质的嫩度和口感风味[21]。miRNAs是脂肪形成和脂质代谢的重要调节因子。一些miRNAs,例如miR-214-3p、miR-20a-5p和miR-144-3p有促脂肪形成的作用[22-24]。但是,还有其他miRNAs,包括miR-429、miR-18b-3p和miR-27,会作用于脂肪形成的负调控机制[25-27]。
尽管许多研究表明,miR-17-3p调节几种关键的生物学功能,包括细胞增殖[28-29]、肿瘤发生[30-31]、炎症[32]和细胞凋亡[33],但目前很少有关于miR-17-3p参与脂肪形成的报道。本课题组前期对高脂和低脂延边黄牛背最长肌进行了转录组测序,发现两组的miR-17-3p和KCTD15都存在差异表达,所以它们可能会影响延边黄牛的肌内脂肪沉积[17-18]。使用生物信息学网站预测到KCTD15也恰好是miR-17-3p靶基因。因此推测,miR-17-3p可能通过靶向KCTD15来调节脂代谢。本研究使用qRT-PCR和Western blot技术分析miR-17-3p对延边黄牛前体脂肪细胞分化的作用,发现,miR-17-3p的过表达增加了脂肪形成标志基因PPARγ和C/EBPα的表达量;而抑制细胞中miR-17-3p的表达量可以降低脂肪细胞中PPARγ和C/EBPα的mRNA和蛋白的表达。这些结果表明,miR-17-3p可能促进延边黄牛前体脂肪细胞分化。
KCTD15属于含钾离子通道四聚化结构域蛋白家族。牛的KCTD15基因位于18号染色体上,DNA序列全长16 008 bp,总共包含7个外显子,CDS区序列总长852 bp,共编码283个氨基酸。KCTD15基因在下丘脑中高表达,主要功能是调节机体能量平衡与能量动态平衡;是中枢肥胖基因的一种,可能会通过影响中枢神经系统调控肥胖状态,是导致肥胖和脂肪累积的潜在靶标[34]。Willer等[35]在2009年进行的大规模全基因组关联研究中证实了KCTD15与人的肥胖症有关。在此基础上,越来越多的研究者在大量人群中组织了若干次横跨各个年龄段和性别的肥胖症状调查,都认为KCTD15可以调控肥胖症的发生[36-37]。张鹏等[38]将3T3-L1细胞中的KCTD15基因敲低后,使用Illumina基因表达谱芯片筛选差异表达基因,结果发现,KCTD15基因可能通过影响脂质的合成与运输以及DNA甲基化等活动来抑制前体脂肪细胞的分化。有报道证明,FGF信号通路可以抑制非洲爪蟾细胞中KCTD15的表达[39];而FGF通路可以促进前体脂肪细胞的早期分化[40]。由此可以证明,KCTD15可能对前体脂肪细胞分化起到负调节作用,这与本研究结果是一致的。但也有研究表明,KCTD15可以抑制斑马鱼胚胎中的Wnt/beta-catenin信号通路[41],但是Wnt/beta-catenin信号通路在多数哺乳动物中起到抑制脂肪分化的作用。所以, 有关KCTD15调节脂代谢和成脂分化的作用机制还需要更深入的研究和探索。
本研究通过双荧光素酶报告基因检测发现,miR-17-3p通过与KCTD15的3′UTR结合来抑制其表达。同时,过表达miR-17-3p也会抑制KCTD15 mRNA和蛋白的表达水平,而抑制miR-17-3p表达后KCTD15的表达水平则会上升。这表明,miR-17-3p可能会通过靶向KCTD15促进成脂分化。这些结果可以增进对牛脂肪形成分子途径的了解,并为分子育种提供理论依据,也可以为研究肥胖相关疾病的生物治疗方法提供新的研究方向。但是,目前,关于miR-17-3p及其靶基因在脂代谢方面的研究鲜有报道,本试验也只是从分子角度简单验证了脂代谢标志基因和靶基因的表达量变化,尚未明确其详细的作用机制。因此,miR-17-3p与KCTD15以及其他靶基因的调控网络还需要通过更缜密和更广泛的方法进行深入探索。
4 结论bta-miR-17-3p可以与KCTD15的3′UTR处结合,抑制KCTD15的表达。用bta-miR-17-3p模拟物转染牛前体脂肪细胞会增加脂代谢标志基因的表达,降低靶基因KCTD15的表达;而抑制miR-17-3p的表达则会有相反的结果。说明miR-17-3p可能通过靶向KCTD15促进延边黄牛前体脂肪细胞分化。
| [1] |
严昌国, 王勇, 朴圣哲, 等. 延边黄牛牛肉品质特性的研究[J]. 黄牛杂志, 2004, 30(3): 5–7.
YAN C G, WANG Y, PIAO S Z, et al. Study on the beef quality traits of Yanbian cattle[J]. Journal Yellow Cattle Science, 2004, 30(3): 5–7. (in Chinese) |
| [2] | HOEHNE A, NUERNBERG G, KUEHN C, et al. Relationships between intramuscular fat content, selected carcass traits, and fatty acid profile in bulls using a F2-population[J]. Meat Sci, 2012, 90(3): 629–635. DOI: 10.1016/j.meatsci.2011.10.005 |
| [3] | DANI C, SMITH A G, DESSOLIN S, et al. Differentiation of embryonic stem cells into adipocytes in vitro[J]. J Cell Sci, 1997, 110: 1279–1285. |
| [4] | PITTENGER M F, MACKAY A M, BECK S C, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999, 284(5411): 143–147. DOI: 10.1126/science.284.5411.143 |
| [5] | GREGOIRE F M, SMAS C M, SUL H S. Under-standing adipocyte differentiation[J]. Physiol Rev, 1998, 78(3): 783–809. |
| [6] | OTTO T C, LANE M D. Adipose development:from stem cell to adipocyte[J]. Crit Rev Biochem Mol Biol, 2005, 40(4): 229–242. DOI: 10.1080/10409230591008189 |
| [7] | GREGOIRE F M. Adipocyte differentiation:from fibroblast to endocrine cell[J]. Exp Biol Med, 2001, 226(11): 997–1002. DOI: 10.1177/153537020122601106 |
| [8] | LEE R C, FEINBAUM R L, AMBROS V. The C. elegans Heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-4[J]. Cell, 1993, 75(5): 843–854. DOI: 10.1016/0092-8674(93)90529-Y |
| [9] | BARTEL D P. MicroRNAs:target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215–233. DOI: 10.1016/j.cell.2009.01.002 |
| [10] | MUDHASANI R, PURI V, HOOVER K, et al. Dicer is required for the formation of white but not brown adipose tissue[J]. J Cell Physiol, 2011, 226(5): 1399–1406. DOI: 10.1002/jcp.22475 |
| [11] | XU J J, ZHANG L P, SHU G B, et al. microRNA-16-5p promotes 3T3-L1 adipocyte differentiation through regulating EPT1[J]. Biochem Biophys Res Commun, 2019, 514(4): 1251–1256. DOI: 10.1016/j.bbrc.2019.04.179 |
| [12] | LI G L, NING C Y, MA Y, et al. miR-26b promotes 3T3-L1 adipocyte differentiation through targeting PTEN[J]. DNA Cell Biol, 2017, 36(8): 672–681. DOI: 10.1089/dna.2017.3712 |
| [13] | ZHANG Z, GAO Y, XU M Q, et al. miR-181a regulate porcine preadipocyte differentiation by tar-geting TGFBR1[J]. Gene, 2019, 681: 45–51. DOI: 10.1016/j.gene.2018.09.046 |
| [14] | PAN Y, JING J, QIAO L, et al. MiRNA-seq reveals that miR-124-3p inhibits adipogenic differentiation of the stromal vascular fraction in sheep via targeting C/EBPα[J]. Domest Anim Endocrinol, 2018, 65: 17–23. DOI: 10.1016/j.domaniend.2018.05.002 |
| [15] | LIU S Y, SUN G J, YUAN B, et al. miR-375 negatively regulates porcine preadipocyte differen-tiation by targeting BMPR2[J]. FEBS Lett, 2016, 590(10): 1417–1427. DOI: 10.1002/1873-3468.12169 |
| [16] | GAO Y, WANG Y Q, CHEN X C, et al. MiR-127 attenuates adipogenesis by targeting MAPK4 and HOXC6 in porcine adipocytes[J]. J Cell Physiol, 2019, 234(12): 21838–21850. DOI: 10.1002/jcp.28660 |
| [17] |
王冰冰.肉牛脂肪沉积MiRNA的筛选及MiR-26a在不同部位中的表达分析[D].延吉: 延边大学, 2018.
WANG B B.Screening of fatty MiRNAs in beef cattle and the expression of MiR-26a in different parts[D].Yanji: Yanbian University, 2018.(in Chinese) |
| [18] |
庞喆.基于RNA-seq延边黄牛肌内脂肪候选基因的筛选与表达分析[D].延吉: 延边大学, 2018.
PANG Z.Screening and expression analysis of intramuscular fat candidate genes in Yanbian Yellow cattle based on RNA-seq[D].Yanji: Yanbian University, 2018.(in Chinese) |
| [19] | TRAN K V, GEALEKMAN O, FRONTINI A, et al. The vascular endothelium of the adipose tissue gives rise to both white and brown fat cells[J]. Cell Metab, 2012, 15(2): 222–229. |
| [20] | FERNYHOUGH M E, VIERCK J L, HAUSMAN G J, et al. Primary adipocyte culture:adipocyte purification methods may lead to a new understanding of adipose tissue growth and development[J]. Cytotechnology, 2004, 46(2): 163–172. |
| [21] | CARNEVALLI L S, MASUDA K, FRIGERIO F, et al. S6K1 plays a critical role in early adipocyte differentiation[J]. Dev Cell, 2010, 18(5): 763–774. |
| [22] | XI F X, WEI C S, XU Y T, et al. MicroRNA-214-3p targeting Ctnnb1 promotes 3T3-L1 preadipocyte differentiation by interfering with the Wnt/β-Catenin signaling pathway[J]. Int J Mol Sci, 2019, 20(8): 1816. DOI: 10.3390/ijms20081816 |
| [23] | ZHU E D, ZHANG J J, ZHOU J, et al. miR-20a-5p promotes adipogenic differentiation of murine bone marrow stromal cells via targeting Kruppel-like factor 3[J]. J Mol Endocrinol, 2018, 60(3): 225–237. DOI: 10.1530/JME-17-0183 |
| [24] | SHEN L Y, LI Q, WANG J Y, et al. miR-144-3p promotes adipogenesis through releasing C/EBPα from Klf3 and CtBP2[J]. Front Genet, 2018, 9: 677. DOI: 10.3389/fgene.2018.00677 |
| [25] |
王书芳, 潘洋洋, 任端阳, 等. miR-200c和miR-429靶向调节绵羊皮下脂肪细胞中SCD1表达的研究[J]. 畜牧兽医学报, 2019, 50(7): 1347–1357.
WANG S F, PAN Y Y, REN D Y, et al. Regulation of SCD1 gene expression by miR-200c and miR-429 in ovine subcutaneous adipocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(7): 1347–1357. (in Chinese) |
| [26] | SUN G R, LI F, MA X F, et al. gga-miRNA-18b-3p inhibits intramuscular adipocytes differentiation in chicken by targeting the ACOT13 gene[J]. Cells, 2019, 8(6): 556. DOI: 10.3390/cells8060556 |
| [27] | JANG S Y, CHAE M K, LEE J H, et al. MicroRNA-27 inhibits adipogenic differentiation in orbital fibroblasts from patients with Graves' orbitopathy[J]. PLoS One, 2019, 14(8): e0221077. DOI: 10.1371/journal.pone.0221077 |
| [28] | SHI J, BEI Y H, KONG X Q, et al. miR-17-3p contributes to exercise-induced cardiac growth and protects against myocardial ischemia-reperfusion injury[J]. Theranostics, 2017, 7(3): 664–676. DOI: 10.7150/thno.15162 |
| [29] | LIU Z Y, ZHANG Z R, YAO J H, et al. Serum extracellular vesicles promote proliferation of H9C2 cardiomyocytes by increasing miR-17-3p[J]. Biochem Biophys Res Commun, 2018, 499(3): 441–446. DOI: 10.1016/j.bbrc.2018.03.157 |
| [30] | SAND M, HESSAM S, AMUR S, et al. Expression of oncogenic miR-17-92 and tumor suppressive miR-143-145 clusters in basal cell carcinoma and cutaneous squamous cell carcinoma[J]. J Dermatol Sci, 2017, 86(2): 142–148. DOI: 10.1016/j.jdermsci.2017.01.012 |
| [31] | XU Z, ZHANG Y Y, DING J J, et al. miR-17-3p downregulates mitochondrial antioxidant enzymes and enhances the radiosensitivity of prostate cancer cells[J]. Mol Ther Nucleic Acids, 2018, 13: 64–77. DOI: 10.1016/j.omtn.2018.08.009 |
| [32] | CURTI V, DI LORENZO A, ROSSI D, et al. Enantioselective modulatory effects of naringenin enantiomers on the expression levels of miR-17-3p involved in endogenous antioxidant defenses[J]. Nutrients, 2017, 9(3): 215. DOI: 10.3390/nu9030215 |
| [33] | WU D J, ZHANG H, JI F, et al. MicroRNA-17 promotes osteosarcoma cells proliferation and migration and inhibits apoptosis by regulating SASH1 expression[J]. Pathol Res Pract, 2019, 215(1): 115–120. DOI: 10.1016/j.prp.2018.10.012 |
| [34] | SKOBLOV M, MARAKHONOV A, MARAKASOVA E, et al. Protein partners of KCTD proteins provide insights about their functional roles in cell differentiation and vertebrate development[J]. BioEssays, 2013, 35(7): 586–596. DOI: 10.1002/bies.201300002 |
| [35] | WILLER C J, SPELIOTES E K, LOOS R J F, et al. Six new loci associated with body mass index highlight a neuronal influence on body weight regulation[J]. Nat Genet, 2009, 41(1): 25–34. DOI: 10.1038/ng.287 |
| [36] | LI S X, ZHAO J H, LUAN J A, et al. Cumulative effects and predictive value of common obesity-susceptibility variants identified by genome-wide association studies[J]. Am J Clin Nutr, 2010, 91(1): 184–190. DOI: 10.3945/ajcn.2009.28403 |
| [37] | ELKS C E, LOOS R J F, HARDY R, et al. Adult obesity susceptibility variants are associated with greater childhood weight gain and a faster tempo of growth:the 1946 British Birth Cohort Study[J]. Am J Clin Nutr, 2012, 95(5): 1150–1156. DOI: 10.3945/ajcn.111.027870 |
| [38] |
张鹏, 金康宣, 陈宇晟, 等. 表达谱芯片分析KCTD15对3T3-L1前体脂肪细胞的影响[J]. 第三军医大学学报, 2014, 36(9): 937–940.
ZHANG P, JIN K X, CHEN Y S, et al. Effect of KCTD15 gene on 3T3-L1 preadipocyte by global expression profile microarray[J]. Journal of Third Military Medical University, 2014, 36(9): 937–940. (in Chinese) |
| [39] | TAKAHASHI C, SUZUKI T, NISHIDA E, et al. Identification and characterization of Xenopus kctd15, an ectodermal gene repressed by the FGF pathway[J]. Int J Dev Biol, 2012, 56(5): 393–402. DOI: 10.1387/ijdb.113333ct |
| [40] | PATEL N G, KUMAR S, EGGO M C. Essential role of fibroblast growth factor signaling in preadipoctye differentiation[J]. J Clin Endocrinol Metab, 2005, 90(2): 1226–1232. DOI: 10.1210/jc.2004-1309 |
| [41] | DUTTA S, DAWID I B. KCTD15 inhibits neural crest formation by attenuating Wnt/β-catenin signaling output[J]. Development, 2010, 137(18): 3013–3018. DOI: 10.1242/dev.047548 |



