2. 青岛易邦生物工程有限公司/动物基因工程疫苗国家重点实验室, 青岛 266114;
3. 中国动物卫生与流行病学中心, 青岛 266032
2. State Key Laboratory of Animal Genetic Engineering Vaccine/YEBIO Bioengineering Co., Ltd of Qingdao, Qingdao 266114, China;
3. China Animal Health and Epidemiology Center, Qingdao 266032, China
禽腺病毒(fowl adenovirus, FAdV)为禽类机体常在性、条件性致病病原,临床上常表现为隐性感染,无明显的临床症状,当鸡群严重应激、混合感染或是发生免疫抑制性疾病时呈急性暴发。近几年来,由1亚群禽腺病毒感染引起的鸡包涵体肝炎或心包积水综合征等临床病例明显增多,死亡率高达80%,给我国养禽业造成巨大的经济损失[1-3]。
现已报道的禽腺病毒有5个种(A~E),12个血清型,其中,C4是目前临床上分离率较高的血清型之一[4]。禽腺病毒是二十面体无囊膜的双链DNA病毒,该病毒的衣壳蛋白有Hexon、Penton和Fiber三种主要结构蛋白,其中,Fiber蛋白的羧基端头部区域是特异性受体的结合位点,也是病毒早期吸附宿主细胞的必须位点,具有抗原性,已经成为基于表位疫苗的候选者[5-8]。Fadv-4的两条Fiber蛋白(Fiber-1和Fiber-2), 分别由两条不同Fiber基因编码,且两条Fiber蛋白的长度差异显著,重组Fiber-2蛋白比Fiber-1蛋白活性更好,对Fadv-4的保护作用更强[9]。鉴于此,Fiber-2蛋白被认为是Fadv-4的一种重要的保护性抗原的蛋白,在疫病检测诊断技术、新型重组蛋白亚单位疫苗、病毒致病机理研究等方面具有潜在的开发应用价值[10]。
本研究从心包积水严重,疑似禽腺病毒感染的30日龄左右发病死亡蛋鸡中分离病毒,取肝组织样品接种鸡胚盲传增殖,分离到1株1群C4型禽腺病毒HN-ZK株,并以分离毒的DNA为模板,用大肠杆菌原核表达系统对其Fiber-2蛋白进行表达,并对其免疫活性进行评价分析,为开发FAdV-4亚单位疫苗提供了实验数据和理论基础。
1 材料与方法 1.1 试验材料1.1.1 病料 疑似禽腺病毒感染的病(死)鸡,采自河南省周口市某蛋鸡场,一个发病鸡舍6 000羽50日龄鸡群,死亡514羽,随机抽取20羽发病死亡鸡,取其肝。
1.1.2 血清、菌株和载体 禽腺病毒的阳性血清、大肠杆菌E.coli BL21菌株及表达载体pET28a由动物基因工程疫苗国家重点实验室提供。
1.1.3 主要试剂 琼脂糖、DNA提取试剂盒、DNA凝胶回收试剂盒,购自上海生工生物工程有限公司;Ex Taq酶、限制性内切酶(BamHⅠ、NotⅠ)和T4 DNA连接酶等购自NEB公司。
1.2 方法1.2.1 病毒的分离鉴定 将病死鸡的肝组织研磨、冻融、过滤除菌后,卵黄囊接种7日龄SPF鸡胚,收获48~120 h死亡及120 h仍存活的鸡胚尿囊液及胚体,混合研磨,盲传3代,置-80 ℃冰箱保存备用[11]。取保存的病毒液提取DNA,进行FAdV的PCR鉴定(根据Hexon基因序列设计引物,上游引物:5′-CAARTTCAGGCAGACGGT-3′,下游引物:5′-TAGTGATGMCGSGACATCAT -3′,反应参数:95 ℃ 5 min;94 ℃变性30 s;53 ℃退火30 s;72 ℃延伸35 s;35个循环,扩增片段约为900 bp,编码约300个氨基酸[7]),对扩增出的Hexon基因片段进行回收,回收产物克隆至pMD-18T载体中,转化DH5α宿主菌,挑取阳性克隆送上海生工生物工程有限公司进行测序,根据测序结果,与GenBank中发表的已知血清型的Ⅰ群禽腺病毒相应基因序列进行比对分析,同时对PCR鉴定为禽腺病毒核酸阳性的病毒样本,利用1群禽腺病毒阳性血清,按照常规的血清中和试验方法[5]进行血清型鉴定。
1.2.2 病毒含量测定 参照唐雪、马海田[12]的鸡胚原代肝细胞分离培养方法,用11日龄SPF鸡胚制备鸡胚原代肝细胞,将分离毒接种肝细胞,按常规方法测定TCID50[13]。
1.2.3 动物回归试验 将40只35日龄的SPF鸡(经动物基因工程疫苗国家重点实验室/青岛易邦生物工程有限公司动物伦理审批委员会批准)随机分成4组,每组10只,在负压隔离器内分开饲养,自由采食和饮水。前3组分别肌内注射0.1 mL FADV-4病毒液(病毒含量分别为107、106、105TCID50·只-1),最后一组注射等体积的生理盐水作为对照。连续观察14 d,记录4组试验鸡的临床症状(0为正常,1为轻微精神沉郁,2为严重精神沉郁,3为麻痹/虚脱,4为死亡)、死亡数量、死亡鸡剖检病变,待观察截止日结束,对存活鸡进行剖检,记录结果,并对4组试验结果进行生物统计分析,并以P<0.05判为差异显著。
1.2.4 Fiber-2蛋白的表达 根据GenBank中报道的FAdV-4 KR5株基因序列(HE608152.1),设计fiber-2基因的特异性引物(上游引物:5′-GGATCCCTCAACCAACAAGGACCCA-3′;下游引物:5′-GCGGCCGCTTAGGTTCCGCTGTTGT-TTGG-3′),以分离株基因组DNA为模板,进行PCR扩增(反应参数为:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,35个循环;最后72 ℃延伸10 min)。目的条带经琼脂糖凝胶回收试剂盒回收后,用T4 DNA连接酶连接到pMD19-T载体上构建成pMD19-T-Fiber-2质粒。用限制性内切酶BamHⅠ、NotⅠ分别酶切pMD19-T-Fiber-2质粒和表达载体pET28a,琼脂糖凝胶电泳,分别回收873 bp的fiber-2 DNA片段和约5 300 bp的表达载体片段,并用T4 DNA连接酶连接。转化大肠杆菌E.coli DH5α感受态细胞,提取质粒后,用限制性内切酶BamHⅠ、NotⅠ酶切鉴定阳性质粒,命名为pET28a-Fiber-2。将pET28a-Fiber-2质粒转化大肠杆菌E.coli BL21感受态细胞,挑取单菌落PCR鉴定阳性转化子,命名为E.coli BL21/pET28a-Fiber-2。接种于10 mL的LB+卡那霉素的培养液中,37 ℃振荡培养至OD600 nm为0.6~0.8。加入0.5 mol·L-1的α-乳糖至终浓度为0.03 mol·L-1,37 ℃再培养6 h。取出后8 000 r·min-1离心10 min,收集菌体。加10倍于湿菌重的PBS,超声波破碎。4 ℃ 12 000 r·min-1离心15 min,上清和沉淀分别用SDS-PAGE上样缓冲液处理,并进行SDS-PAGE分析。
1.2.5 重组蛋白的纯化 用10倍湿菌体积的PBS溶液重悬沉淀,用超声破碎仪充分裂解菌体(冰上进行),20 000 r·min-1离心30 min,弃上清,沉淀用PBST充分洗涤3次后,加入适量的Binding buffer(6 mol·L-1尿素,0.5 mol·L-1 NaCl,20 mmol·L-1Tris-HCl,10 mmol·L-1,pH 7.9),于振荡器上溶解包涵体(4 ℃,30 min),20 000 r·min-1离心30 min(4 ℃),将上清液移入新管,经0.22 μm的滤器过滤后加入经Binding buffer处理过的Ni-NTA层析柱,室温低速振荡30 min,静置,待树脂完全沉降后,让液体自然流出,随后依次用10倍柱体积的Binding buffer,6倍柱体积的Washing buffer (8 mol·L-1尿素,0.5 mol·L-1 NaCl,60 mmol·L-1咪唑,20 mmol·L-1 Tris-HCl,pH 7.9)充分洗涤层析柱,最后用6倍柱体积Elution buffer (6 mol·L-1尿素,500 mmol·L-1咪唑,0.5 mol·L-1 NaCl,20 mmol·L-1Tris-HCl,pH 7.9)洗脱目的蛋白,收集洗脱液,取适量洗脱液进行SDS-PAGE电泳检测。纯化蛋白经BCA蛋白检测试剂盒检测蛋白含量。
1.2.6 重组蛋白免疫原性试验 将纯化的Fiber-2蛋白液用无菌复性缓冲液稀释至目的蛋白含量为300 μg·mL-1制备水相,与油相按体积比1:2比例混合乳化制备油乳剂疫苗。选取14日龄SPF鸡60只,平均分为6组。各组免疫疫苗剂量分别为0.05、0.1、0.2、0.3 mL·只-1,同时,设10只不免疫的SPF鸡作为攻毒对照组,剩余10只作为空白对照组。免疫后21 d,除空白对照组外的所有试验鸡肌内注射FAdV-4分离毒(HN-ZK株),每只0.1 mL(含100 LD50),观察14 d,记录临床表现和死亡情况,以攻毒对照组试验鸡10/10发病,空白对照鸡无任何临床表现为对照成立,计算攻毒保护率。
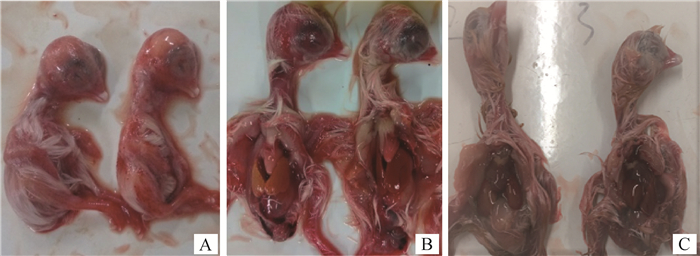
2 结果 2.1 病毒分离及特性鉴定情况2.1.1 病毒分离 病料混悬液经卵黄囊途径接种7日龄SPF鸡胚,72 h后开始出现死亡,收获死亡胚体及胚液,处理后盲传至第3代,鸡胚表现为死胚,胚体卷曲、充血,比对照鸡胚矮小、剖检可见接毒鸡胚的肝肿大、质脆,对照胚发育正常,无明显眼观病变。结果详见图 1A~C。
|
A.接毒胚:胚体小、充血; B.接毒胚:肝肿大、质脆; C.对照胚:个体大,肝正常 A. Infected chicken embryos: the embryo body is small and hyperemic; B. Infected embryos: swelling and brittle liver; C. Control embryos 图 1 接毒鸡胚的病理学特征分析 Fig. 1 Pathological characteristics of chicken embryos infected with the virus |
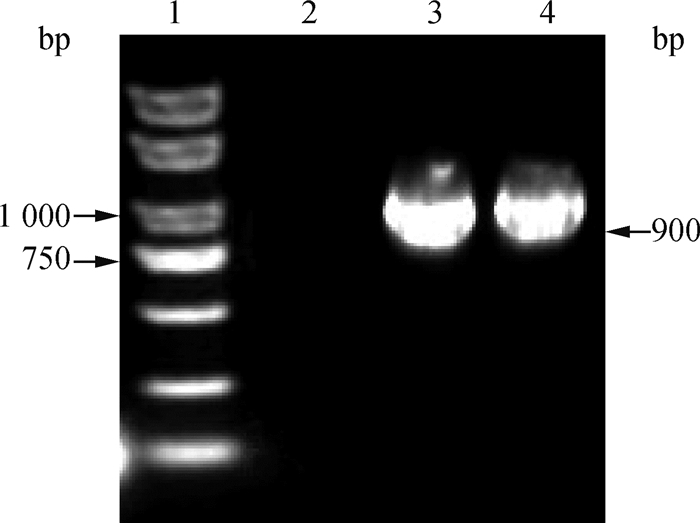
2.1.2 Hexon基因的PCR鉴定及血清型鉴定 分离毒株PCR扩增出约900 bp的片段,与预期的目的片段大小相符,扩增片段电泳结果详见图 2。利用1群禽腺病毒阳性血清对PCR鉴定为阳性的分离毒样本进行血清型鉴定,结果表明分离毒为1群血清4型禽腺病毒, 命名为HN-ZK株。
|
1.DL2000 DNA相对分子质量标准;2.阴性对照;3.阳性对照;4.分离毒(HN-ZK株) 1.DL2000 DNA marker; 2. Negative control; 3. Positive control; 4. Isolate (HN-ZK strain) 图 2 分离毒株的PCR鉴定结果 Fig. 2 PCR results of the isolated virus |
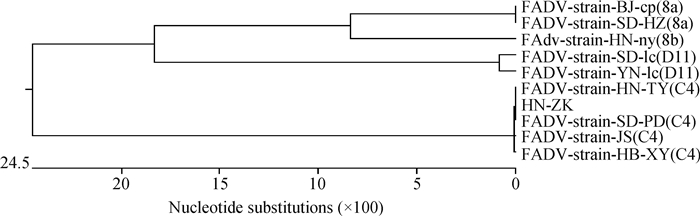
2.1.3 Hexon基因测序及遗传进化分析 根据Hexon基因测序、比对和遗传进化分析结果可知,分离毒(HN-ZK株)与血清C4型毒株的相似性为100%,与血清D-11型两毒株及8a、8b型的相似性分别为62.1%、63.8%、66.7%、64.2%。遗传进化分析可知分离毒株(HN-ZK株)与1群C4型禽腺病毒属于同一分支,详见图 3。
|
A.临床表现评分; B.存活率; C.病死鸡心包积液明显; D.病死鸡肝肿胀、色泽变黄; E. SPF对照鸡心、肝组织正常。*.P<0.05,n=10 A. Clinical score; B. Survival rate; C. Pericardial effusion in infected chickens; D. The swollen and yellow liver of infected chickens; E. Negative control of SPF chicken's heart and liver. *.P < 0.05, n=10 图 3 分离毒株Hexon基因遗传进化树分析 Fig. 3 Phylogenetic analysis of the isolated virus (HN-ZK strain) hexon gene |
2.1.4 病毒含量测定 分离毒感染鸡胚原代肝细胞后24 h,细胞呈现出明显的病变,主要特征为细胞逐渐聚集、圆缩、溶解,高倍镜下观察可见活细胞数量减少,细胞内有类似包涵体的颗粒物,而对照细胞无类似的病变。用Reed-Muench法计算,病毒含量为107.5TCID50·0.1 mL-1。
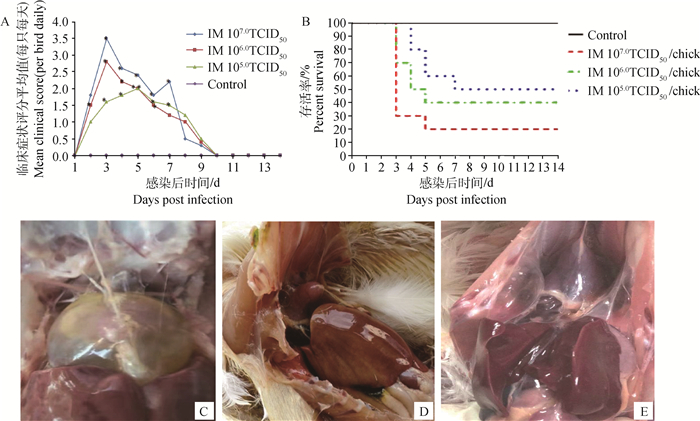
2.1.5 动物回归试验 分离毒株感染SPF鸡后,从试验鸡的临床表现、评分和死亡情况可知,3组试验鸡均于感染后第2天开始发病,死亡期主要集中在感染后第3~7天,感染后第10天未死亡鸡均恢复正常。感染鸡的临床症状统计分值与对照鸡差异显著(P<0.05,n=10),平均分值变化情况详见图 4A。其中107TCID50组试验鸡于感染后第3天有7只死亡,第5天1只死亡;106TCID50组试验鸡于感染后第3天有3只死亡,第4天有2只死亡,第5天有1只死亡;105TCID50剂量组于感染后第4天有2只死亡,第5天有2只死亡,第7天1只死亡,至观察期结束,107TCID50、106TCID50、105TCID50剂量组的存活率分别为2/10、4/10、5/10,详见图 4B;病死鸡剖检发现心包积有淡黄色透明的渗出液;肝肿胀、边缘钝圆、质地变脆,色泽变黄,对照鸡剖检后,各脏器未见明显异常,详见图 4C~E。
|
图 4 FAdV-4分离毒株(HN-ZK株)感染SPF鸡发病情况的临床指标 Fig. 4 Clinical incidence of SPF chickens infected with the isolated FAdV-4 (HN-ZK strain) |
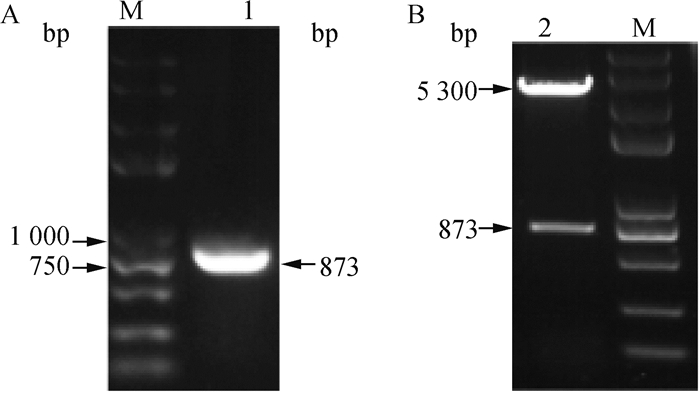
2.2.1 fiber-2基因的扩增及表达质粒的鉴定 提取分离株(HN-ZK株)DNA, 以此为模板进行PCR,扩增出873 bp的特异性目的条带(见图 5A);用BamHⅠ、NotⅠ酶切鉴定pET28a-Fiber-2质粒,切出873和5 300 bp两条目的条带(见图 5B)。
|
M. Trans2K Plus II DNA相对分子质量标准;1. fiber-2基因扩增产物;2. pET28a-Fiber-2阳性质粒酶切产物(BamHⅠ+NotⅠ) m. Trans2K Plus II DNA marker; 1. fiber-2 gene amplification product; 2. pET28a-Fiber-2 digested with BamHⅠ+NotⅠ) 图 5 Fiber-2基因的PCR扩增(A)及pET28a-Fiber-2质粒的酶切鉴定(B) Fig. 5 PCR amplification of fiber-2 gene (A) and analysis of the digested pET28a-Fiber-2 plasmid with enzymes (B) |
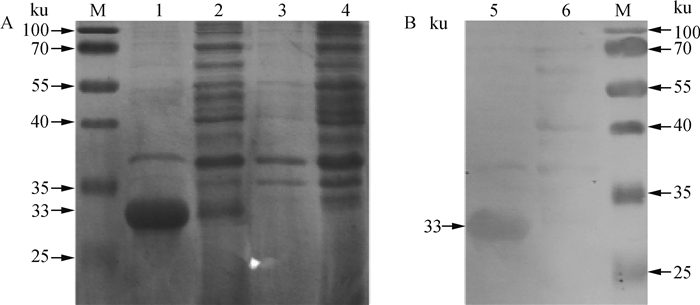
2.2.2 重组蛋白的诱导表达 SDS-PAGE结果显示,与诱导前对照相比,重组菌E. coli BL21/pET28a-Fiber-2经乳糖诱导,诱导样品在33 ku左右可见1条特异性的蛋白条带,与预期大小一致(结果见图 6A)。重组Fiber-2蛋白,主要以包涵体形式存在于菌体破碎后的沉淀中,将重组Fiber-2蛋白进行SDS-PAGE电泳,并用转膜仪转印到PVDF膜上,可与抗1群4型禽腺病毒特异性血清结合,再结合山羊抗鸡IgG酶标二抗后经DAB显色,可观察到相对分子质量约为33 ku的特异性反应条带,结果见图 6B,纯化后的蛋白经测定含量为300 mg·mL-1。
|
M.蛋白相对分子质量标准;1.E.coli BL21/pET28a-Fiber-2诱导后破碎沉淀;2. E. coli BL21/pET28a-Fiber-2诱导后破碎上清;3. E. coli BL21/pET28a-Fiber-2未诱导破碎沉淀;4. E. coli BL21/pET28a-Fiber-2未诱导破碎上清;5. E.coli BL21/pET28a-Fiber-2诱导后破碎沉淀;6. E. coli BL21/pET28a-Fiber-2未诱导破碎沉淀 M. Standard protein molecular mass; 1. E. coli BL21/pet28a-fiber-2 induced crushing and precipitation; 2.E. coli BL21/pet28a-fiber-2 induced crushing supernatant; 3. E. coli BL21/pet28a-fiber-2 not induced crushing precipitation; 4. E. coli BL21/pet28a-fiber-2 not induced crushing supernatant; 5. E. coli BL21/pet28a-fiber-2 induced crushing and precipitation; 6. E. coli BL21/pet28a-fiber-2 not induced crushing precipitation 图 6 Fiber-2蛋白SDS-PAGE电泳检测(A)和Western blot检测(B) Fig. 6 Identification of Fiber-2 protein by SDS-PAGE (A) and Western blot (B) |
2.2.3 免疫效果分析 以纯化的Fiber-2蛋白液制备的疫苗免疫SPF鸡,免疫后21 d攻毒,攻毒对照鸡在攻毒后14 d观察期内全部(10/10)出现发病的症状,临床评分均大于1.5,与空白对照鸡差异显著(P < 0.05, n=10),试验对照成立。攻毒对照鸡至观察期结束共死亡9只,剖检可见典型的心包积水症状;免疫鸡0.05 mL·只-1(5 μg)剂量组攻毒后7/10获得保护;0.1 mL·只-1(10 μg)剂量组攻毒后8/10获得保护;0.2 mL·只-1(20 μg)和0.3 mL·只-1(30 μg)剂量组攻毒后均10/10获得保护,结果详见表 1。
|
|
表 1 分离株免疫保护试验结果 Table 1 Summary of immunoprotection outcome |
禽腺病毒病是一种全世界范围流行的家禽和野禽常见的主要传染病。1群禽腺病毒分为A、B、C、D、E 5个种,12个血清型,其中心包积水-肝炎综合征主要由4型禽腺病毒引起。该病最早于1987年,在巴基斯坦卡拉奇附近的安加拉首次暴发[14],随后,在南亚的印度、中东的伊朗、南美的墨西哥和东亚的日本等国相继报道,呈现较快速度的传播[1, 3, 9, 15-19]。我国2014年心包积水-肝炎综合征在鸡群中零星发生,2015年已在全国全面暴发,造成比较严重的经济损失。本试验从发病死亡严重的病死鸡场采集病料,应用常规技术分离到一株1群血清4型禽腺病毒,该病毒具较强的致病性,能致死鸡胚,在肝细胞上生长、产生细胞病变,35日龄SPF鸡肌内注射105~107TCID50该分离病毒,可引起鸡不同程度发病及死亡,其临床症状及剖检病变与自然感染一致。
3.2目前,对于1群禽腺病毒病的防治主要以全病毒灭活疫苗研究较多。但全病毒灭活苗需借助鸡胚或细胞繁殖病毒,生产成本高,且活毒操作存在生物安全隐患,重组亚单位疫苗因具有安全、高效等特点,被赋予了良好的开发和应用前景[20-24]。Shah等[25]将大肠杆菌表达的心包积液综合征(HPS)病毒的五邻体核衣壳蛋白制成亚单位疫苗免疫肉鸡,通过强毒攻毒保护试验,发现该疫苗保护率可达90%以上,证明重组五邻体核衣壳蛋白亚单位疫苗可以作为预防HPS的备选疫苗。Schachner等[26]通过杆状病毒表达FAdV-4的Fiber-1、Fiber-2和Hexon loop-1蛋白,分别用3种纯化的蛋白制备亚单位疫苗免疫1日龄SPF鸡,免疫后21 d进行攻毒保护试验。结果发现,Fiber-2蛋白表现出很好的保护力,攻毒后鸡死亡率仅为3.5%,Fiber-1表现出中等保护率,鸡死亡率为38%,而hexon loop-1未对鸡群起到保护作用,鸡死亡率为78%,与阴性对照组无明显差异;重组Fiber-2蛋白制备的亚单位疫苗在该研究中被认定为候选疫苗来预防鸡的心包积液综合征。另据文献报道,利用昆虫杆状病毒表达系统获得的重组Fiber-2蛋白,最低剂量2.5 μg·只-1,即可提供100%的保护,以对应强毒力HB1501株的感染,免疫鸡既没有临床症状,也没有在鸡体上观察到明显的损伤[26]。此外,对SPF鸡免疫Fiber-2重组蛋白(≥2.5 μg·只-1)疫苗可以诱导比全病毒灭活疫苗更快更强的免疫反应,可见Fiber-2重组蛋白是一种重要的免疫保护性蛋白,并被认为是预防心包积水-肝炎综合征亚单位疫苗的一个重要候选蛋白[27-28]。虽然利用杆状病毒表达的Fiber-2重组蛋白2.5 μg·只-1即可提供100%的保护,本试验利用大肠杆菌表达系统诱导表达的FAdV Fiber-2蛋白,经纯化后与矿物油佐剂乳化制备的疫苗免疫SPF鸡,需要20 μg·只-1可保护免疫鸡10/10抵抗强毒株攻击,但杆状病毒表达系统的蛋白表达量低,难以形成种子批,且成本较高,目前在畜牧养殖行业仅限于猪用产品的开发,大肠杆菌表达系统操作简单,周期短,表达产物稳定,且表达的包涵体易于纯化,适合规模化生产,可进一步研制成抗体检测试剂盒、蛋白亚单位疫苗等产品,对于养殖利润相对较低的禽类比较适合。
4 结论成功分离鉴定到了1群4型禽腺病毒,并选用大肠杆菌表达系统,成功构建了能表达FAdV Fiber-2蛋白的工程菌,经诱导表达的重组Fiber-2蛋白,相对分子质量约为33 ku,Western blot结果证实,重组Fiber-2蛋白能与抗1群4型禽腺病毒特异性血清发生特异性免疫反应,用该重组蛋白制备的亚单位疫苗安全性好,效力高。目前,该表达系统已成功放大应用于规模化生产,应用前景良好。
| [1] |
王婉, 王彦红, 刘伊, 等. 鸡包涵体肝炎病原检测及病理学观察[J]. 畜牧兽医学报, 2015, 46(2): 273–278.
WANG W, WANG Y H, LIU Y, et al. Pathogenic detection and pathological observation of inclusion body hepatitis in chicken[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(2): 273–278. (in Chinese) |
| [2] | JADHAO S J, DEEPAK J N, KATARIA J M, et al. Characterisation of fowl adenoviruses from chickens affected with infectious hydropericardium during 1994-1998 in India[J]. Comparative Study Indian J Exp Biol, 2003, 41(4): 321–327. |
| [3] | HESS M, RAUE R, PRUSAS C. Epidemiological studies on fowl adenoviruses isolated from cases of infectious hydropericardium[J]. Avian Pathol, 1999, 28(5): 433–439. DOI: 10.1080/03079459994443 |
| [4] | MAZAHERI A, PRUSAS C, VOß M, et al. Some strains of serotype 4 fowl adenoviruses cause inclusion body hepatitis and hydropericardium syndrome in chickens[J]. Avian Pathol, 1998, 27(3): 269–276. DOI: 10.1080/03079459808419335 |
| [5] | ZHAO J, ZHONG Q, ZHAO Y, et al. Pathogenicity and complete genome characterization of fowl adenoviruses isolated from chickens associated with inclusion body hepatitis and hydropericardium syndrome in China[J]. PLoS One, 2015, 11(8): e0161744. |
| [6] | LOUIS N, FENDER P, BARGE A, et al. Cell-binding domain of adenovirus serotype 2 fiber[J]. J Virol, 1994, 68(6): 4104–4106. DOI: 10.1128/JVI.68.6.4104-4106.1994 |
| [7] | HENRY L J, XIA D, WILKE M E, et al. Characterization of the knob domain of the adenovirus type 5 fiber protein expressed in Escherichia coli[J]. J Virol, 1994, 68(8): 5239–5246. DOI: 10.1128/JVI.68.8.5239-5246.1994 |
| [8] | GELDERBLOM H, MAICHLE-LAUPPE I. The fibers of fowl adenoviruses[J]. Arch Virol, 1982, 72(4): 289–298. DOI: 10.1007/BF01315225 |
| [9] | AFZAL M, MUNEER R, STEIN G. Studies on the aetiology of hydropericardium syndrome (Angara disease) in broilers[J]. Vet Rec, 1991, 128(25): 591–593. DOI: 10.1136/vr.128.25.591 |
| [10] | HESS M, CUZANGE A, RUIGROK R W, et al. The avian adenovirus penton: two fibres and one base[J]. J Mol Biol, 1995, 252(4): 379–385. DOI: 10.1006/jmbi.1995.0504 |
| [11] | MAREK A, NOLTE V, SCHACHNER A, et al. Two fiber genes of nearly equal lengths are a common and distinctive feature of Fowl adenovirus C members[J]. Vet Microbiol, 2012, 156(3-4): 411–417. DOI: 10.1016/j.vetmic.2011.11.003 |
| [12] |
唐雪, 马海田. 一种改良的鸡胚原代肝细胞的分离培养方法[J]. 南京农业大学学报, 2008, 31(4): 154–156.
TANG X, MA H T. Cultivation and identification of chicken embryo hepatocytes in primary culture[J]. Journal of Nanjing Agricultural University, 2008, 31(4): 154–156. (in Chinese) |
| [13] | REED L J, MUENCH H. A simple method of estimating fifty percent endo-points[J]. Am J Hyg, 1938, 27: 493–797. |
| [14] | ANJUM A D, SABIR M A, IQBAL Z. Hydropericarditis syndrome in broiler chickens in Pakistan[J]. Vet Rec, 1989, 124(10): 247–248. DOI: 10.1136/vr.124.10.247 |
| [15] | ABDUL-AZIZ T A, AL-ATTAR M A. New syndrome in Iraqi chickes[J]. Vet Rec, 1991, 129(12): 272. |
| [16] | ABDUL-AZIZ T A, HASAN S Y. Hydropericar-dium syndrome in broiler chickens: its contagious nature and pathology[J]. Res Vet Sci, 1995, 59(3): 219–221. DOI: 10.1016/0034-5288(95)90005-5 |
| [17] | ABE T, NAKAMURA K, TOJO H, et al. Histology, immunohistochemistry, and ultrastructure of hydropericardium syndrome in adult broiler breeders and broiler chicks[J]. Avian Dis, 1998, 42(3): 606–612. DOI: 10.2307/1592690 |
| [18] | DAHIYA S, SRIVASTAVA R N, HESS M, et al. Fowl adenovirus serotype 4 associated with outbreaks of infectious hydropericardium in Haryana, India[J]. Avian Dis, 2002, 46(1): 230–233. DOI: 10.1637/0005-2086(2002)046[0230:FASAWO]2.0.CO;2 |
| [19] | KIM J N, BYUN S H, KIM M J, et al. Outbreaks of hydropericardium syndrome and molecular characterization of Korean fowl adenoviral isolates[J]. Avian Dis, 2008, 52(3): 526–530. DOI: 10.1637/8178-112207-Case |
| [20] | GAHÉRY-SÉGARD H, FARACE F, GODFRIN D, et al. Immune response to recombinant capsid proteins of adenovirus in humans: antifiber and anti-penton base antibodies have a synergistic effect on neutralizing activity[J]. J Virol, 1998, 72(3): 2388–2397. DOI: 10.1128/JVI.72.3.2388-2397.1998 |
| [21] | BRADLEY R R, LYNCH D M, IAMPIETRO M J, et al. Adenovirus serotype 5 neutralizing antibodies target both hexon and fiber following vaccination and natural infection[J]. J Virol, 2012, 86(1): 625–629. DOI: 10.1128/JVI.06254-11 |
| [22] | YU B, DONG J, WANG C, et al. Characteristics of neutralizing antibodies to adenovirus capsid proteins in human and animal sera[J]. Virology, 2013, 437(2): 118–123. DOI: 10.1016/j.virol.2012.12.014 |
| [23] | FINGERUT E, GUTTER B, GALLILI G, et al. A subunit vaccine against the adenovirus egg-drop syndrome using part of its fiber protein[J]. Vaccine, 2003, 21(21-22): 2761–2766. DOI: 10.1016/S0264-410X(03)00117-8 |
| [24] | MAUTNER V, WILLCOX H N. Adenovirus antigens: a model system in mice for subunit vaccination[J]. J Gen Virol, 1974, 25(3): 325–336. DOI: 10.1099/0022-1317-25-3-325 |
| [25] | SHAH M S, ASHRAF A, RAHMAN M, et al. A subunit vaccine against hydropericardium syndrome using adenovirus penton capsid protein[J]. Vaccine, 2012, 30(50): 7153–7156. DOI: 10.1016/j.vaccine.2012.10.013 |
| [26] | SCHACHNER A, MAREK A, JASKULSKA B, et al. Recombinant FAdV-4 fiber-2 protein protects chickens against hepatitis-hydropericardium syndrome (HHS)[J]. Vaccine, 2014, 32(9): 1086–1092. DOI: 10.1016/j.vaccine.2013.12.056 |
| [27] | PITCOVSKI J, FINGERUT E, GALLILI G, et al. A subunit vaccine against hemorrhagic enteritis adenovirus[J]. Vaccine, 2005, 23(38): 4697–4702. DOI: 10.1016/j.vaccine.2005.03.049 |
| [28] | SCHONEWILLE E, JASPERS R, PAUL G, et al. Specific-pathogen-free chickens vaccinated with a live FAdV-4 vaccine are fully protected against a severe challenge even in the absence of neutralizing antibodies[J]. Avian Dis, 2010, 54(2): 905–910. DOI: 10.1637/8999-072309-Reg.1 |



