2. 东北农业大学动物医学学院, 哈尔滨 150030
2. College of Veterinary Medicine, Northeast Agricultural University, Harbin 150030, China
犬乳腺肿瘤是发病率和死亡率都很高的肿瘤,仅次于皮肤肿瘤,病理组织学诊断约50%为恶性肿瘤,手术切除是目前的主要治疗方式,浸润和远端转移是造成患犬死亡的主要原因,早期诊断是降低死亡率和发病率的关键[1-2]。越来越多的研究表明:微小RNAs(miRNAs)与肿瘤的发展、转移、浸润及对放化疗药物的抗性有密切关系,其异常表达可以用于肿瘤的早期诊断、预后及指导靶向治疗[3]。miRNAs是存在于真核生物体内一类非编码单链小分子RNA,具有高度的保守性、时序性和特异性,由18~25个左右核苷酸组成,主要通过与靶基因mRNA的3′UTR碱基结合,从而引起mRNA降解或蛋白质的翻译抑制,调控肿瘤细胞增殖和凋亡、侵袭转移和靶向药物治疗等[4-5]。因此,基于miRNA表达水平可能是乳腺癌早期诊断的有力依据。有报告称miR-502在乳腺癌中具有促进肿瘤生长的作用,可引起乳腺癌的侵袭和转移,扮演癌基因的角色[6],但miR-502与犬乳腺癌的发生、发展及转移是否相关,目前尚无报道。本研究拟采用实时荧光定量PCR(qRT-PCR)方法检测miR-502在犬乳腺癌及癌旁正常组织中的转录情况,进一步分析其与临床病理因素之间的关系,旨在探讨miR-502与犬乳腺癌的发生、发展的相关性,为其可能成为犬乳腺癌诊断和治疗的新分子标志物提供实验依据。
1 材料与方法 1.1 一般资料选自2017年1月—2018年12月东北农业大学附属动物医院和河南省郑州市部分宠物医院经HE染色病理组织学确诊的30例犬乳腺癌病例的癌组织及癌旁正常乳腺组织样本,其中犬乳腺浸润性导管癌20例、导管原位癌4例,囊内乳头状癌2例,导管内乳头状癌2例、微乳头状癌2例。获取患犬组织样本前均经主人的知情同意,且选择的患犬在手术前均未接受过放疗或肿瘤方面的任何治疗,通过B超和X光检测是否发生转移。评估每个肿瘤的大小、皮肤溃疡、坏死和生长方式(扩张性和浸润性)及评估是否有局部淋巴结转移。2位病理学家根据世界卫生组织(WHO,2010版)的犬乳腺肿瘤分类标准进行病理学分型[7]。根据Nottingham方法进行恶性上皮肿瘤的组织学分级[8]。年龄范围6~15岁,中位年龄9.5岁,肿瘤直径 < 3 cm 6例,3≤T≤5 cm 16例,>5 cm 8例;组织学分级Ⅰ级6例,组织学分级Ⅱ级15例,组织学分级Ⅲ级9例。组织标本一部分10%福尔马林液固定用于病理组织学检验,另一部分迅速置于液氮速冻,-80 ℃保存,待提取RNA。术后癌组织及癌旁组织标本经病理组织学证实为犬乳腺癌及正常乳腺组织,
1.2 主要试剂和仪器Trizol试剂购自美国Invitrogen公司;增强型MiRcute microRNA cDNA第一链合成试剂盒、增强型MiRcute microRNA荧光定量检测试剂盒、snRNA U6购自北京天根生物公司;罗氏480实时荧光定量PCR仪购自美国罗氏公司,其它试剂来自国产公司。
1.3 RNA提取和qRT-PCR反应采用Trizol法提取组织中的总RNA,按照增强型MiRcute microRNA cDNA第一链合成试剂盒说明书操作合成miRNA的cDNA的第一链,所有操作均在冰上进行。miR-502引物由北京天根生物公司设计,cfa-miR502,miRNA序列:5′-AAUGCACCUGGGCAAGGAUUCA-3′,上游引物:5′-GCACCTGGGCAAGGATTCA-3′,由库美生物公司合成,内参U6为北京天根生物公司的商品化引物(RNU6B),下游引物为通用引物序列。反应条件和步骤:Total RNA 2 μg,2×miRNA RT Reaction Buffer 10 μL,miRNA RT Enzyme Mix 2 μL,RNase-Free ddH2O补至总体积20 μL体系,反转录反应条件:42 ℃60 min(miRNA加尾反应和逆转录反应);95 ℃,3 min(酶失活反应)。合成的cDNA反应液可放置于-80 ℃保存。按MiRcute microRNA荧光定量检测试剂盒说明书操作,反应体系为2×miRcute Plus miRNA Premix (with SYBR & ROX)10 μL,Forward Primer (10 μmol·L-1) 0.4 μL,Reverse Primer (10 μmol·L-1) 0.4 μL,miRNA第一链cDNA 2 μL,ddH2O补至20 μL。反应条件: 95 ℃预变性15 min,94 ℃ 20 s、60 ℃ 34 s,共40个循环。以snRNA U6作为内参,采用2-△△CT法计算miR-502在犬恶性乳腺肿瘤组织和癌旁组织中的相对表达量。
1.4 统计学分析应用SPSS 20.0版软件对试验结果进行统计学分析,试验数据以x±s表示,组间比较选择采用t(Wilcoxon)检验;计数资料选择χ2检验及Fisher确切概率法分析miR-502与临床病理特征的关系。采用Graphpad prism 7.0进行图像绘制。以*P < 0.05为差异显著,**P < 0.01为差异极显著。
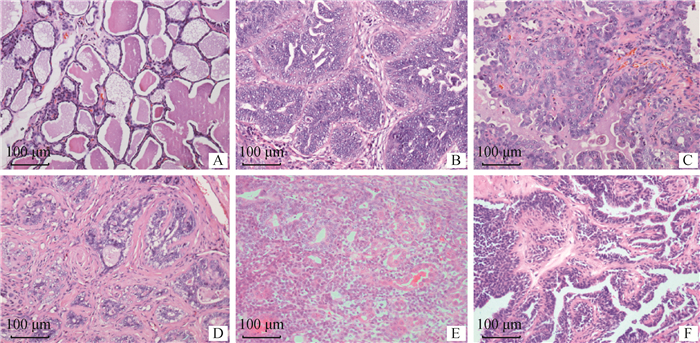
2 结果 2.1 犬乳腺癌组织及癌旁组织的组织病理学检查对临床收集的犬乳腺肿瘤组织进行病理组织切片及HE染色,病理组织学鉴定结果如图 1所示,癌旁正常乳腺组织(A):显示腺细胞有序排列,具有正常的细胞有丝分裂指数,无细胞或细胞核的多形性,组织周围无炎性细胞浸润。浸润性导管癌(B):细胞和细胞核大小、形状不一,形成不规则的管状、条索状、小梁状结构,内充满大量的癌细胞;有丝分裂指数高;癌细胞突破导管壁的基底膜向间质及周围组织呈侵袭性生长,伴有结缔组织增生及纤维化产物,导管内衬与灶双层上皮鳞状分化。浸润性微乳头状癌(C):导管内的肿瘤细胞不规则聚集成团,且这些乳头状肿瘤团没有纤维组织形成的蒂支撑,四周为腔洞,细胞多形性缺乏,细胞质与细胞核比例低,细胞质嗜酸性,有丝分裂指数高。导管原位癌(D):基底膜完整,肿瘤细胞排列在导管周围;轻度核多形性,偶见核分裂。囊内乳头状癌(E):小管管腔扩张形成囊状结构。乳头状突起的支撑物为细的纤维结缔组织,管腔内含有嗜酸性、絮状物质。导管内乳头状癌(F):导管肿瘤细胞呈无柄或有蒂的乳头状结构;乳头是由细纤维血管基质中度核和细胞多形性支持。
|
A.癌旁正常乳腺;B.浸润性导管癌;C.浸润性微乳头状癌;D.导管原位癌;E.囊内乳头状癌;F.导管内乳头状癌 A. Adjacent normal breast; B. Invasive ductal carcinoma; C. Invasive micropapillary carcinoma; D. Ductal carcinoma in situ; E. Intracapsular papillary carcinoma; F. Intraductal papillary carcinoma 图 1 犬乳腺癌组织和癌旁组织的组织病理学结果(200×) Fig. 1 Histopathological results of canine breast cancer and adjacent tissues (200×) |
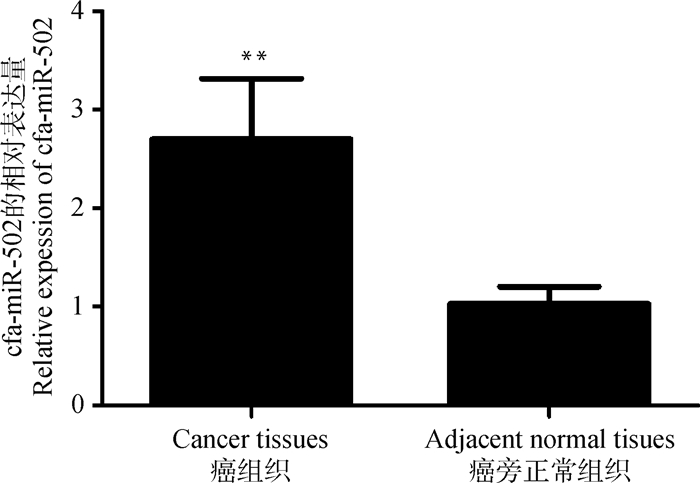
采用qRT-PCR方法检测cfa-miR-502在30例犬乳腺癌及正常癌旁组织中的相对表达情况。经统计学分析结果显示,与癌旁正常乳腺组织相比(1.030±0.175),犬乳腺癌组织中cfa-miR-502的相对表达量显著升高(2.702±0.614),差异有统计学意义(P < 0.01),图中的cfa代表犬种属的编码,见图 2。
|
**.P < 0.01 图 2 cfa-miR-502在犬乳腺癌及癌旁正常组织中的表达 Fig. 2 Expression of cfa-miR-502 in canine breast cancer and adjacent normal tissues |
以犬乳腺癌组织中miR-502的表达量的中位数作为分界点将其分为低表达组和高表达组,分析两组与犬乳腺癌临床病理参数的关系,统计学分析结果显示:miR-502的表达与犬恶性乳腺肿瘤的病理组织学分级、淋巴转移有关,miR-502的高表达主要发生在组织学Ⅲ级,miR-502的低表达主要发生在组织学Ⅱ级,组织学分级越高,miR-502的表达越多,肿瘤恶性程度越高(P < 0.05),miR-502的表达与犬乳腺癌的转移有关(P < 0.01),肿瘤转移的患犬,miR-502的高转录比例占85.71%(12/16),但与年龄和肿瘤大小无关(P>0.05),见表 1。
|
|
表 1 miR-502的表达与犬乳腺癌临床病理特征的关系 Table 1 Relation between expression of miR-502 and clinicopathological features of canine with breast cancer |
乳腺癌是女性最常见的恶性肿瘤之一,也是兽医临床上母犬常发的肿瘤,发病率和死亡率都很高,犬乳腺癌的发病概率约为人类的3倍,已经严重威胁其生命健康,犬乳腺癌相对致病因素、组织学特征、分子表型、生物学行为、转移模式等方面与人类乳腺癌具有相似之处,适合作为研究人类乳腺肿瘤的模型[9]。miRNA是一种广泛存在于生物体内的非编码RNA,有着复杂的生物学功能,其异常表达已被表征为人类疾病的共同特征,特别是恶性肿瘤,miRNA既可以作为癌基因,又可以作为抑癌基因,miRNAs的失调发生在各种类型的癌症中,与肿瘤发生、疾病进展、耐药性和转移有关[10]。
miR-502是miRNAs中的一员,目前关于miR-502在犬乳腺癌中表达及临床病理特征的关系的研究较少。同一miRNA分子在不同的肿瘤组织中表达不同,在多种癌症中发挥重要作用。已有研究发现,miR-502在人乳腺癌中的表达水平显著低于癌旁组织, 通过下调肿瘤坏死因子受体相关因子2 (TRAF2)发挥促进乳腺癌细胞凋亡和抑制乳腺癌细胞增殖的作用[11];Chen等[12]发现, miRNA-502表达下调与肝癌的发生、发展相关,miRNA-502通过靶向下游磷脂酰肌醇3-激酶γ (PIK3CG)抑制肝癌细胞增殖、G1/S期细胞周期阻滞和促进肝癌细胞凋亡。Jin等[13]发现miR-502-3p在肝癌细胞株和人肝癌组织中均表达下调,早期(TNM Ⅰ和Ⅱ期)肝癌组织样本中miR-502-3P的表达水平明显高于晚期(TNM Ⅲ期)肝癌组织样本,miR-502-3p的表达与肝癌TNM分期呈显著负相关,且miR-502-3p的过度表达显著抑制肝癌的增殖、转移、侵袭和细胞黏附。然而,Xu等[14]发现miR-502在食管癌组织中显著上调,过表达miR-502促进TE1癌细胞的增殖,通过激活PI3K/AKT通路抑制dox诱导的细胞凋亡。Osaki等[15]对SNP(犬乳腺癌细胞系)和犬的正常乳腺组织miRNA assay结果显示:miR-502在SNP细胞中高表达,表达差异5.994 5倍。而Liu等[6]通过qRT-PCR方法对60例配对乳腺癌和癌旁组织样本分析结果显示,乳腺癌组织中的miR-502表达显著低于癌旁组织,提示miRNA分子在不同的肿瘤组织中表达不同。与文献研究一致,本研究通过qRT-PCR方法检测miR-502在犬乳腺癌组织和癌旁组织中的表达水平,发现miR-502在犬乳腺癌组织中的表达水平较癌旁组织明显上调,差异具有统计学意义,进一步分析miR-502的表达与临床病理特征的关系发现,组织学分级Ⅲ(分化程度低)和转移的miR-502表达水平显著高于组织学分级低和未转移的表达,miR-502表达与组织学分级与转移有关(P < 0.05),与年龄和肿瘤大小无关(P>0.05),提示miR-502可能参与犬乳腺癌的发生、发展,发挥癌基因的功能。尽管临床上关于miR-502与犬乳腺癌关系的研究较少,但本研究结果提示miR-502可作为犬乳腺癌的诊断预测的新靶点。但关于miR-502在犬乳腺癌的发生、发展中的具体表达变化,及其相关的调控机制,仍有待于进一步研究确定。
4 结论利用实时荧光定量PCR方法检测miR-502在犬乳腺癌及癌旁正常组织中的表达,并进一步分析miR-502表达与临床病理特征的关系。结果表明miR-502在犬乳腺癌组织中表达上调,且miR-502表达与犬乳腺癌的组织学分级与转移有关,提示miR-502与犬乳腺肿瘤的发生、发展有一定关系,可能作为犬乳腺癌诊断的肿瘤标记物。
| [1] | PINHO S S, CARVALHO S, CABRAL J, et al. Canine tumors: a spontaneous animal model of human carcinogenesis[J]. Transl Res, 2012, 159(3): 165–172. DOI: 10.1016/j.trsl.2011.11.005 |
| [2] | NGUYEN F, PEÑA L, IBISCH C, et al. Canine invasive mammary carcinomas as models of human breast cancer. Part 1: natural history and prognostic factors[J]. Breast Cancer Res Treat, 2018, 167(3): 635–648. DOI: 10.1007/s10549-017-4548-2 |
| [3] | ABBA M L, PATIL N, LEUPOLD J H, et al. MicroRNA regulation of epithelial to mesenchymal transition[J]. J Clin Med, 2016, 5(1): 8. DOI: 10.3390/jcm5010008 |
| [4] | IORIO M V, CROCE C M. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review[J]. EMBO Mol Med, 2012, 4(3): 143–159. DOI: 10.1002/emmm.201100209 |
| [5] | CZECH B, HANNON G J. Small RNA sorting: matchmaking for Argonautes[J]. Nat Rev Genet, 2011, 12(1): 19–31. DOI: 10.1038/nrg2916 |
| [6] | LIU B, ZHANG X N, SONG F J, et al. MiR-502/SET8 regulatory circuit in pathobiology of breast cancer[J]. Cancer Lett, 2016, 376(2): 259–267. DOI: 10.1016/j.canlet.2016.04.008 |
| [7] | MISDORP W, ELSE R W, HELLMEN E, et al. Histological classification of mammary tumors of the dog and the cat[M]//SHULMAN F I. World Health Organization International Histological Classification Tumors of Domestic Animals. 2nd ed. Washington: Armed Forces Institute of Pathology, 1999. |
| [8] | ELSTON C W, ELLIS I O. Assessment of histological grade[M]//ELSTON C W, ELLIS I O. The Breast. New York: Churchill Livingstone, 1998. |
| [9] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7–34. DOI: 10.3322/caac.21551 |
| [10] | BERTOLI G, CAVA C, CASTIGLIONI I. The potential of miRNAs for diagnosis, treatment and monitoring of breast cancer[J]. Scand J Clin Lab Invest, 2016, 76(S245): S34–S39. |
| [11] | SUN L L, WANG J, ZHAO Z J, et al. Suppressive role of miR-502-5p in breast cancer via downregulation of TRAF2[J]. Oncol Rep, 2014, 31(5): 2085–2092. DOI: 10.3892/or.2014.3105 |
| [12] | CHEN S L, LI F, CHAI H Y, et al. miR-502 inhibits cell proliferation and tumor growth in hepatocellular carcinoma through suppressing phosphoinositide 3-kinase catalytic subunit gamma[J]. Biochem Biophys Res Commun, 2015, 464(2): 500–505. DOI: 10.1016/j.bbrc.2015.06.168 |
| [13] | JIN H S, YU M, LIN Y, et al. MiR-502-3P suppresses cell proliferation, migration, and invasion in hepatocellular carcinoma by targeting SET[J]. Onco Targets Ther, 2016, 9: 3281–3289. |
| [14] | XU J, PAN X X, HU Z D. MiR-502 mediates esophageal cancer cell TE1 proliferation by promoting AKT phosphorylation[J]. Biochem Biophys Res Commun, 2018, 501(1): 119–123. DOI: 10.1016/j.bbrc.2018.04.188 |
| [15] | OSAKI T, SUNDEN Y, SUGIYAMA A, et al. Establishment of a canine mammary gland tumor cell line and characterization of its miRNA expression[J]. J Vet Sci, 2016, 17(3): 385–390. DOI: 10.4142/jvs.2016.17.3.385 |



