2. 艾贝尔宠物医院, 南京 210036
2. Ai-Bi Pet Hospital, Nanjing 210036, China
动物模型对于理解大脑和神经的发育至关重要。从灵长类动物到小动物,如大鼠、兔和绵羊,许多物种已被用于神经科学研究。绵羊早期主要用于兽医科学和动物生产领域的研究。与其他小型实验动物相比,绵羊是研究神经系统疾病的重要模型,同时也是研究早期大脑发育和性别分化对成年动物影响的一个有价值的模型[1]。绵羊还被用于高等灵长类动物大脑功能和行为的研究,例如出生后母羊和犊羊之间的依恋行为[2-3]。绵羊模型一直在神经科学研究领域扩展应用,例如癫痫[4]、脑损伤[5]、脑缺血[6]、脑发育异常[7]、睡眠呼吸暂停[8]等方面的研究。磁共振成像(magnetic resonance imaging,MRI)诊断技术在神经系统疾病的研究中已被广泛应用。国外十几年前就有关于绵羊颅脑的磁共振研究,首次报道的临床研究是2002年由Opdam等[9]通过功能性磁共振成像(fMRI)和脑电图来定位癫痫病灶。2007年MRI就已被用于检查反刍动物的脑部疾病,但缺乏详细的影像资料[10]。2010年Schmidt等[11]又研究了反刍动物的脑部FES-T2WI图像,比较了反刍动物与犬类脑部结构的异同。2015年Lee等[12]利用常规的fMRI和扩散张量成像(DTI)对绵羊大脑进行了研究。2016年Ella等[13]制作了一个与参考立体定位空间相连高质量的高分辨率3D绵羊大脑图谱。尽管这些研究表明绵羊模型适用于颅脑结构和功能的评估,但仍没有一个较为完整的绵羊MRI图谱。本研究的主要目的是建立一个完整的正常湖羊颅脑MRI影像解剖结构图谱和相关结构的MRI测量参考值,为经济动物颅脑疾病的影像学诊断提供依据,同时也为医学实验动物模型的研究提供了有价值的参考。
1 材料与方法 1.1 实验动物11~13月龄湖羊10只,体重45~50 kg,购自同一养殖场,雌雄各半。所有湖羊都进行了临床指标和神经系统检查,均未表现出神经症状,健康状况符合实验动物标准。
1.2 主要仪器设备联影uMR560 1.5 T全身磁共振扫描仪、4号大柔性线圈(中国,联影);VSA-2100动物专用吸入麻醉机(美国,VETLAND);磁共振专用心电监护仪(美国,Invivo)。
1.3 实验动物准备每只羊在进行检查前禁食24 h,禁水2 h。肌内注射速眠新(0.1 mg·kg-1)诱导麻醉,采用面罩,异氟烷维持麻醉。通过心电监护仪监测心率、体温、麻醉深度、呼吸速率及呼出CO2分压。检查结束后按照所用速眠新剂量等比例肌内注射苏醒灵(0.1 mg·kg-1)。
1.4 MRI检查采用1.5 T全身磁共振扫描仪、4号大柔性线圈进行颅脑扫描。
羊麻醉后俯卧保定,使鼻中隔与水平面保持垂直,头部用泡沫垫固定,防止旋转。羊颈部以下、躯干可用配套泡沫垫支撑,避免扫描过程中被检动物移动。选择清晰的横断面和冠状面定位图像为参考,在横断面定位相上选择平行于大脑镰的矢状面为标准扫描基线进行扫描,在冠状面定位相上使矢状面平行于大脑纵裂进行扫描得到标准的矢状面扫描图像;再选择清晰显示中脑导水管结构的正中矢状面图像,以平行于第四脑室底平面为冠状面扫描基线进行扫描,为标准的冠状面扫描图像;最后,选择清晰显示第四脑室结构的正中矢状面定位图像,以垂直于第四脑室底平面为横断面扫描基线进行扫描,获得标准的横断面扫描图像。
扫描参数:自旋回波(SE)序列T1加权像TR=500.0 ms,TE=11.8 ms,ETL=1,层厚5 mm,层间距0.55 mm,矩阵417×480,视野=1 328 mm×1 486 mm。快速自旋回波(FSE)序列T2加权像TR=4 157.0 ms,TE=87.2 ms,ETL=15,层厚5 mm,层间距0.6 mm,矩阵417×480,视野=1 328 mm×1 454 mm。快速液体衰减反转恢复(FLAIR)序列TR=8 000.0 ms,TE=90.4 ms,TI=2 300 ms,ETL=15,层厚5 mm,层间距0.6 mm,矩阵209×240,视野=1 328 mm×1 486 mm。
1.5 图像分析和统计学分析所有原始图像传到计算机后进行处理。形态解剖结构参照文献资料[11-13]进行识别并标注,应用HOROS软件和AUTO CAD 2018软件,选择好已设置的标尺,采用手动方法选择目标区域,在T2正中矢状面测量前颅窝中线区面积、后颅窝中线区面积。前颅窝中线区包括嗅球,沿脑背侧至小脑幕,沿中脑顶盖至蝶鞍背侧,包括脑垂体和视交叉,后颅窝中线区包括小脑和乳头体背侧至枕骨大孔的区域,两者之和,即为总中线区脑面积[14]。在海马面积最大的横断面上测量海马厚度。选取第三脑室在连续两幅以上的横断面图像中出现在间脑背侧的图像,测量端脑高度、间脑高度及第三脑室高度的最大值。在T2正中矢状面通过第四脑室中心垂直于脑干测量第四脑室高度。在垂体面积最大的T1横断面上测量垂体高度、宽度、长度[14-15]。同时计算垂体高度与脑面积P:B的比率。所有计量资料数据均由三位影像研究者手动测量,采用x±s表示,所有数据用SPSS Statistics进行统计分析。
2 结果通过磁共振成像仪扫描获得10只湖羊颅脑正常磁共振影像图,结果显示10只湖羊颅脑的影像并无明显差异,各序列结构均相同。采用SE、FSE扫描出的T1、T2加权成像对软组织具有良好三维分辨率的能力。脑脊液在T2加权像上呈高信号,可轻易识别侧脑室、第三脑室、中脑导水管、第四脑室和视神经根等影像结构。可完整地观察到湖羊脑部嗅球、大脑、小脑、垂体等基本结构。另外,大脑内可见到端脑和间脑,左右侧脑室对称地位于左右大脑半球内侧,而且大脑半球被大脑纵裂隔开,还可见端脑与间脑间的第三脑室,以及左右两侧海马对称并清晰可见。此外,小脑呈椭圆形,内有小脑蚓部,两侧膨大的小脑半球,以及小脑、延脑和脑桥之间的第四脑室均可见。具体解剖结构及定位像如图 1~5所示。
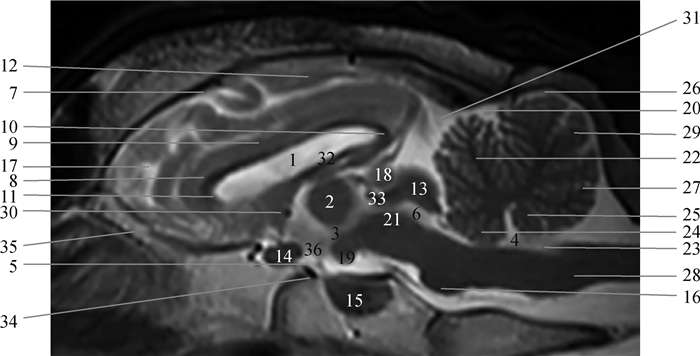
|
1.侧脑室;2.丘脑间黏合;3.第三脑室;4.第四脑室;5.漏斗隐窝;6.中脑导水管;7.柄状沟;8.胼胝体膝;9.胼胝体;10.胼胝体压部;11.胼胝体嘴;12.束状沟;13.四叠体;14.视交叉;15.垂体;16.脑桥;17.膝回;18.松果体;19.乳头体(中脑);20.原裂;21.被盖(菱脑);22.小脑小山;23.闩;24.前髓帆;25.后髓帆;26.小脑山坡;27.小舌;28.延髓(末脑);29.蚓结节;30.前联合(间脑);31.小脑幕;32.第三脑室脉络丛;33.丘脑;34.土耳其鞍(蝶鞍);35.嗅球;36.下丘脑 1. Lateral ventricle; 2. Interthalamic adhesion; 3. Third ventricle; 4. Fouth ventricle; 5. Infundibular recess; 6. Mesencephalic aqueduct; 7. Ansate sulcus; 8. Genu of the corpus callosum; 9. Cotrpus callosum; 10. Splenium of the corpus callosum; 11. Rostrum of the corpus callosum; 12. Splenial sulcus; 13.Lamina quadrigemina; 14.Optic chiasm; 15. Pituitary gland; 16. Pons; 17. Genual gyrus; 18. Pineal body; 19. Mamillary body (midbrain); 20. Primary fissure; 21. Tegmentum (hindbrain); 22. Culmen; 23. Obex; 24. Velum medullare anterius; 25. Velum medullare posterius; 26. Declive; 27. Lingual; 28. Medulla oblongata(myelencephalon); 29. Tuber vermis; 30. Rostral commissure(diencephalon); 31. Tentorium cerebelli; 32. Choroid plexus of third ventricle; 33. Thalamus; 34. Sella turcica; 35.Bulbus olfactorius; 36. Hypothalamus 图 1 湖羊颅脑正中矢状面影像解剖结构 Fig. 1 The midsagittal images morphological structures of the Hu-sheep brain |
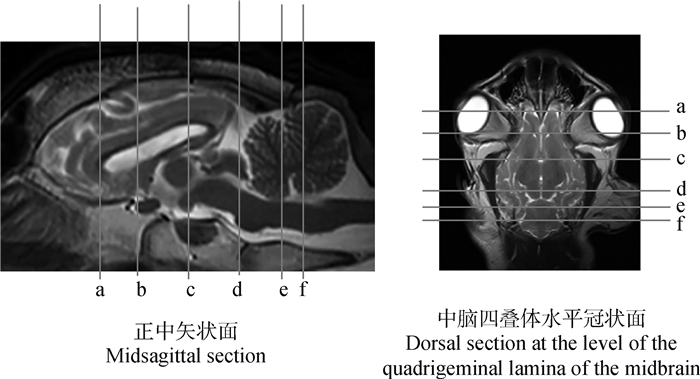
|
a.胼胝体嘴切面定位线;b.终板切面定位线;c.下丘脑切面定位线;d.中脑上丘切面定位线;e.小脑脚头侧切面定位线;f.小脑小舌切面定位线 a. The position line of the Hu-sheep brain at the level of the rostrum of corpus callosum; b. The position line of the Hu-sheep brain at the level of the lamina terminalis; c. The position line of the Hu-sheep brain at the level of the hypothalamus; d. The position line of the Hu-sheep brain at the level of the rostral colliculus of the midbrain; e. The position line of the Hu-sheep brain at the level of the rostral cerebellar peduncles; f. The position line of the Hu-sheep brain at the level of the lingula 图 2 湖羊脑部横断面切面定位线 Fig. 2 Transversal magnetic resonance images reference of brain of Hu-sheep |

|
1.侧脑室;2.扣带回;3.第三脑室;4.第四脑室;5.漏斗;6.中脑导水管;7.胼胝体;8.终板;9.视交叉;10.苍白球;11.外侧嗅束;12.束状沟;13.豆状核;14.内囊;15.下垂体;16.脑岛;17.内缘回;18.缘沟;19.大脑侧裂;20.薛氏回;21.前联合;22.尾状核;23.丘脑;24.穹隆体;25.嗅裂;26.上薛氏回;27.上薛氏沟;28.缘回;29.丘脑间黏合;30.杏仁核;31.下丘脑;32.穹隆柱;33.松果体;34.胼胝体嘴;35.后联合;36.中心灰质;37.大脑脚;38.丘臂;39.海马;40.外薛氏回;41.外压部沟;42.外缘沟;43.前小脑脚;44.中央小叶;45.小脑小山;46.小脑中脚;47.小脑蚓部;48.大脑镰;49.绒球;50.脑桥;51.小舌;52.小脑幕;53.前庭神经核;54.锥体;55.小脑山坡;56.副绒球;57.后丘;58.蜗神经核;59.上丘;60.膝沟;61.嗅球;62.中央沟 1. Lateral ventricle; 2. Cingulated gyrus; 3. Third ventricle; 4. Fouth ventricle; 5. Infundibulum; 6. Mesencephalic aqueduct; 7. Cotrpus callosum; 8. Lamina terminalis; 9. Optic chiasm; 10. Globus pallidus; 11. Lateral olfactory tract; 12. Splenial sulcus; 13. Putamen; 14. Internal capsule; 15. Pituitary gland; 16. Insula; 17. Endomarginal gyrus; 18. Marginal gyrus; 19. Sylvian fissure; 20. Sylvian gyrus; 21. Rostral commissur; 22. Caudate nucleus; 23. Thalamus; 24. Corpus of fornix; 25. Rhinal fissure; 26. Suprasylvian gyrus; 27. Suprasylvian sulcus; 28. Marginal sulcus; 29. Interthalamic adhesion; 30. Amygdaloid body; 31. Hypothalamus; 32.Columella fornicis; 33. Pineal body; 34. Rostrum of the corpus callosum; 35. Commissura fornicis seu hipocampi; 36. Central grey substance; 37.Pedunculi cerebri; 38. Brachium quadrigeminum; 39. Hippocampus; 40. Ectosylvian gyrus; 41. Ectosplenial sulcus; 42. Ectomarginal sulcus; 43. Rostral cerebellar peduncle; 44. Central lobule; 45. Culmen; 46. Medipeduncle; 47. Vermis; 48. Falx cerebri; 49. Flocculus; 50. Pons; 51. Lingual; 52.Tentorium cerebelli; 53. Vestibular nuclei; 54. Pyramidal tracts; 55. Declive; 56. Paraflocculus; 57. Caudal colliculus; 58. Cochlear nuclei; 59. Colliculus superior; 60. Genual sulcus; 61. Bulbus olfactorius; 62. Central sulcus 图 3 湖羊颅脑横断面图像解剖结构(A~F对应图 2中a~f) Fig. 3 Transverse images morphological structures of the Hu-sheep brain (A-F correspond to a-f in Fig. 2) |
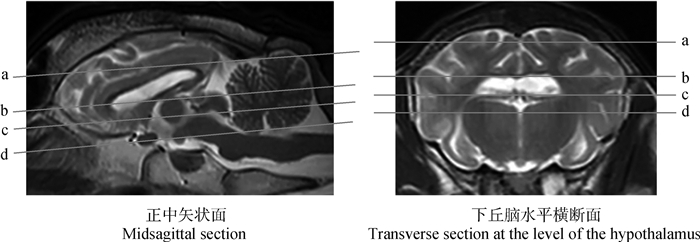
|
a.束状沟切面定位线;b.侧脑室切面定位线;c.中脑四叠体切面定位线;d.第三脑室腹侧切面定位线 a. The position line of the Hu-sheep brain at the level of the splenial sulcus; b. The position line of the Hu-sheep brain at the level of the lateral ventricle; c. The position line of the Hu-sheep brain at the level of the quadrigeminal lamina of the midbrain; d. The position line of the Hu-sheep brain at the level of the third ventricle 图 4 湖羊脑部冠状面切面 Fig. 4 Dorsal magnetic resonance images reference of brain of Hu-sheep |

|
1.冠状沟;2.膝回;3.十字沟;4.柄状沟;5.冠状回;6.上薛氏沟;7.薛氏回;8.外薛氏回;9.外缘沟;10.外缘回;11.缘沟;12.缘回;13.束状沟;14.嗅球;15.侧脑室;16.隔核;17.穹隆体;18.脑岛;19.丘脑;20.上丘;21.尾丘;22.小脑小山;23.锥体;24.斜角回;25.对角沟;26.尾状核;27.丘脑后结节;28.外侧膝状体;29.海马;30.海马回;31.原裂;32.小脑半球;33.第三脑室;34.中脑导水管;35.外薛氏沟;36.内囊;37.侧裂池;38.额回;39.中央小叶;40.扣带回;41.胼胝体;42.丘脑间联合;43.内侧膝状体; 44.杏仁体 1. Coronal sulcus; 2. Genual gyrus; 3. Cruciate sulcus; 4. Ansate sulcus; 5. Coronal gyrus; 6. Suprasylvian sulcus; 7. Sylvian gyrus; 8. Ectosylvian gyrus; 9. Ectomarginal sulcus; 10. Ectomarginal gyrus; 11. Marginal gyrus; 12. Marginal sulcus; 13. Splenial sulcus; 14. Olfactory bulb; 15. Lateral ventricle; 16. Septal nuclei; 17. Corpus of fornix; 18.Insula; 19. Thalamus; 20. Colliculus superior; 21. Caudal colliculus; 22. Culmen; 23. Pyramidal tracts; 24.Diagongal sulcus; 25. Diagonal sulcus; 26. Caudate nucleus; 27. Pulvinar; 28. Lateral geniculate body; 29. Hippocampus; 30. Parahippocampal gyrus; 31. Primary fissure; 32. cerebellar hemispheres; 33. Third ventricle; 34. Mesencephalic aqueduct; 35. Ectosylvian sulcus; 36. Internal capsule; 37. Sylvian fissure; 38. Gyrus frontalis; 39. Central lobule; 40. Cingulated gyrus; 41. Cotrpus callosum; 42. Interthalamic adhesion; 43. Medial geniculate body; 44. Corpus amygdaloidem 图 5 湖羊颅脑冠状面影像解剖结构(A~D对应图 4中a~d) Fig. 5 The dorsal images morphological structures of the Hu-sheep brain (A-D correspond to a-d in Fig. 4) |
矢状面包括两侧颧骨之间的16个切面,选取了T2WI的正中矢状面并标注出大部分已有命名的36个解剖结构。
2.2 横断面横断面包括从筛板到寰椎头侧的19个切面,选取了胼胝体嘴、终板、下丘脑、中脑上丘、小脑脚头侧及小脑小舌的6个部位具有代表性的T2加权像、快速液体衰减反转恢复FLAIR序列及T1加权像(对应正中矢状面和海马水平冠状面的参考线如图 2所示),标注出大部分已有命名的62个解剖结构(图 3)。
2.3 冠状面冠状面包括从硬脑膜到蝶骨的12个切面,选取了束状沟、侧脑室、中脑四叠体及第三脑室腹侧水平的4张具有代表性的T2WI切面(对应正中矢状面和下丘脑水平横断面参考线见图 4),标注出大部分已有命名的44个解剖结构(图 5)。
2.4 湖羊颅脑解剖结构测量对湖羊颅脑各参数测量方法如图 6所示,选取湖羊颅脑T2正中矢状面测量前(图 6A-a)、后颅窝中线区面积(图 6A-b)、计算总中线区脑面积,平行于脑干测量垂体长度(图 6A-c),垂直于脑干测量第四脑室高度(图 6A-d)。在海马最大的T2横断面测量海马最大厚度(图 6B)。测量大脑镰到后联合的距离为端脑高度(图 6C-a),端脑腹侧至丘脑背侧之间的距离为第三脑室高度(图 6C-b),第三脑室腹侧和垂体之间的距离为间脑高度(图 6C-c)。在垂体最大的T1横断面测量垂体宽度及高度(图 6D-a、b),并计算垂体高度与垂体面积最大的横断面脑面积比率。相关影像学解剖结构数据见表 1。
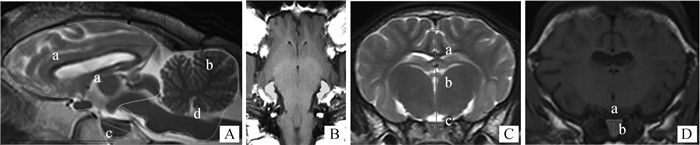
|
A.前后颅窝中线区的划分(a.前颅窝中线区;b.后颅窝中线区;c.垂体长度;d.第四脑室高度);B.海马最大面积的T2横断面;C.端脑、第三脑室及间脑高度的测量标记(a.端脑高度;b.第三脑室高度;c.间脑高度);D.垂体最大面积的T1横断面(a.垂体最大宽度;b.垂体最大高度) A. the midline area of the cranial and caudal cranial fossa (a. The midline area of the cranial cranial fossa; b. The midline area of the caudal cranial fossa; c.Length of pituitary; d.Fourth ventricular height); B. T2 cross-section of the largest hippocampus; C. The measurement marks of the height of telencephalon, third ventricle and diencephalon (a. Telencephalic height; b. Third ventricular height; c. Diencephalic height); D. T1 cross-section of the largest pituitary (a. Maximum width of pituitary; b. Maximum height of pituitary) 图 6 湖羊脑部MRI数据的测量标记 Fig. 6 Measurement markers of MRI data in the brain of Hu-sheep |
|
|
表 1 健康湖羊大脑影像学解剖结构基本数据的测定结果 Table 1 MRI measurement results of the brain image anatomical basic data in Hu-sheep |
湖羊是我国特有的,也是世界罕见的白色羔皮绵羊品种,具有繁殖力强、早期生长快、适应舍饲和高湿高热的环境等特点,作为我国珍贵的绵羊品种资源,在我国的羊业发展中具有相当大的潜力和广阔的开发利用前景[16]。绵羊也是研究神经内分泌控制生殖功能领域良好的动物模型,尤其是在研究激素和环境因素对季节性繁殖的影响。2013年,Chalivoix等[17]发现光周期变化与下丘脑和视前区神经细胞黏附分子表达的变化有关。2014年Batailler等[18-19]证实,光周期与母羊大脑结构(如下丘脑)的成体神经发育有关,尽管关于绵羊季节性繁殖的神经控制领域已经有了很多研究,但仍缺乏一个清晰和连贯的评估,对于季节性繁殖过程中发生的分子和细胞神经解剖学变化是否会在大脑系统层面引发其他变化还不清楚,通过MRI技术的介入可以更加有效地评估整个大脑的时间和空间维度。本研究首次对湖羊的颅脑磁共振影像解剖结构进行研究,MRI是当前兽医临床中对于中枢神经系统疾病应用最为广泛的影像学检查技术之一[20],由于该技术具有无创、无放射性损伤、可重复性动态观测的特点,能清晰地观察到细微的脑部解剖结构。本研究采用了常用的3种MRI扫描序列,分别为SE序列、FSE序列以及FLAIR序列。为进一步了解湖羊脑影像学解剖结构的基本生物学数据,并查阅了相关文献资料发现关于绵羊脑部MRI解剖结构数据相对缺乏,故本文以新西兰白兔相关脑部解剖MRI解剖结构数据的测量方法作为参考[14-15],测量并对比分析了湖羊的影像结构和数据,发现湖羊颅脑影像与绵羊、山羊及犬猫相比在形状、大小和信号强度方面均无明显差异,但湖羊丘脑结构发育较犬猫良好,影像上发现其视交叉、延髓较大,小脑半球相对于大脑半球大,视觉嗅觉系统和间脑的与犬相比较大,这些具有一定的研究优势[11]。本研究绘制了一套详细的湖羊颅脑MRI图谱,并测量了湖羊脑部各结构大致的数据范围,可作为兽医临床影像解剖资料,也为今后以湖羊作为神经、内分泌及其他方面疾病的动物模型建立基础,该图谱的应用将为建立脑结构间的神经导航程序提供一个精确的框架。
4 结论采用1.5 T高场磁共振系统对湖羊颅脑进行了全方面的影像解剖结构研究,获得了全面的湖羊颅脑核磁影像解剖结构图谱,包括颅脑横断面、矢状面及冠状面的T1WI、T2W1、抑水序列图像,同时也建立了在核磁影像上测量湖羊颅脑解剖结构的数据库。本研究为湖羊及其他绵羊颅脑疾病的影像学诊断提供依据,同时也为医学实验动物模型的研究提供了有价值的参考。
| [1] | POORE K R, BOULLIN J P, CLEAL J K, et al. Sex- and age-specific effects of nutrition in early gestation and early postnatal life on hypothalamo-pituitary-adrenal axis and sympathoadrenal function in adult sheep[J]. J Physiol, 2010, 588(12): 2219–2237. DOI: 10.1113/jphysiol.2010.187682 |
| [2] | LÉVY F, KELLER M. Neurobiology of maternal behavior in sheep[J]. Adv Study Behav, 2008, 38: 399–437. DOI: 10.1016/S0065-3454(08)00008-9 |
| [3] | LÉVY F, KELLER M. Olfactory mediation of maternal behavior in selected mammalian species[J]. Behav Brain Res, 2009, 200(2): 336–345. DOI: 10.1016/j.bbr.2008.12.017 |
| [4] | STYPULKOWSKI P H, GIFTAKIS J E, BILLSTROM T M, et al. Development of a large animal model for investigation of deep brain stimulation for epilepsy[J]. Stereotact Funct Neurosurg, 2011, 89(2): 111–122. DOI: 10.1159/000323343 |
| [5] | GRIMMELT A C, EITZEN S, BALAKHADZE I, et al. Closed traumatic brain injury model in sheep mimicking high-velocity, closed head trauma in humans[J]. Cent Eur Neurosurg, 2011, 72(3): 120–126. DOI: 10.1055/s-0031-1271732 |
| [6] | BOLTZE J, FÖRSCHLER A, NITZSCHE B, et al. Permanent middle cerebral artery occlusion in sheep:a novel large animal model of focal cerebral ischemia[J]. J Cereb Blood Flow Metab, 2008, 28(12): 1951–1964. DOI: 10.1038/jcbfm.2008.89 |
| [7] | PERENTOS N, MARTINS A Q, WATSON T C, et al. Translational neurophysiology in sheep:measuring sleep and neurological dysfunction in CLN5 Batten disease affected sheep[J]. Brain, 2015, 138(4): 862–874. DOI: 10.1093/brain/awv026 |
| [8] | LÉTOURNEAU P, PRAUD J P. A radiotelemetry system for polysomnographic recordings in lambs[J]. Methods, 2003, 30(2): 115–121. DOI: 10.1016/S1046-2023(03)00072-0 |
| [9] | OPDAM H I, FEDERICO P, JACKSON G D, et al. A sheep model for the study of focal epilepsy with concurrent intracranial EEG and functional MRI[J]. Epilepsia, 2002, 43(8): 779–787. DOI: 10.1046/j.1528-1157.2002.04202.x |
| [10] | SCHENK H C, GANTER M, SEEHUSEN F, et al. Magnetic resonance imaging findings in metabolic and toxic disorders of 3 small ruminants[J]. J Vet Intern Med, 2007, 21(4): 864–871. |
| [11] | SCHMIDT M J, LANGEN N, KLUMPP S, et al. A study of the comparative anatomy of the brain of domestic ruminants using magnetic resonance imaging[J]. Vet J, 2012, 191(1): 85–93. DOI: 10.1016/j.tvjl.2010.12.026 |
| [12] | LEE W, LEE S D, PARK M Y, et al. Functional and diffusion tensor magnetic resonance imaging of the sheep brain[J]. BMC Vet Res, 2015, 11: 262. DOI: 10.1186/s12917-015-0581-8 |
| [13] | ELLA A, DELGADILLO J A, CHEMINEAU P, et al. Computation of a high-resolution MRI 3D stereotaxic atlas of the sheep brain[J]. J Comp Neurol, 2017, 525(3): 676–692. DOI: 10.1002/cne.24079 |
| [14] | MVLLHAUPT D, AUGSBURGER H, SCHWARZ A, et al. Magnetic resonance imaging anatomy of the rabbit brain at 3 T[J]. Acta Vet Scand, 2015, 57(1): 47. DOI: 10.1186/s13028-015-0139-6 |
| [15] |
潘永明, 金平, 徐剑钦, 等. 基于3.0T磁共振成像系统初步观察WHBE兔脑部形态解剖结构[J]. 中国实验动物学报, 2017, 25(4): 356–361.
PAN Y M, JIN P, XU J Q, et al. Preliminary observation of the anatomical structures of the brain in WHBE Rabbits by 3.0 T magnetic resonance imaging system[J]. Acta Laboratorium Animalis Scientia Sinica, 2017, 25(4): 356–361. (in Chinese) |
| [16] |
林嘉. 湖羊特异的行为习性及其利用[J]. 中国草食动物科学, 2012(S1): 419–422.
LIN J. Hu-sheep specific behavioral habits and their utilization[J]. China Herbivore Science, 2012(S1): 419–422. (in Chinese) |
| [17] | CHALIVOIX S, GUILLAUME D, COGNIÉ J, et al. Photoperiodic variations of the polysialylated form of neural cell adhesion molecule within the hypothalamus and related reproductive output in the ewe[J]. Cell Tissue Res, 2013, 352(2): 387–399. DOI: 10.1007/s00441-012-1544-z |
| [18] | BATAILLER M, DROGUERRE M, BARONCINI M, et al. DCX-expressing cells in the vicinity of the hypothalamic neurogenic niche: a comparative study between mouse, sheep, and human tissues[J]. J Comp Neurol, 2014, 522(8): 1966–1985. DOI: 10.1002/cne.23514 |
| [19] | BATAILLER M, DEROUET L, BUTRUILLE L, et al. Sensitivity to the photoperiod and potential migratory features of neuroblasts in the adult sheep hypothalamus[J]. Brain Struct Funct, 2016, 221(6): 3301–3314. DOI: 10.1007/s00429-015-1101-0 |
| [20] | THOMAS W B. Evaluation of veterinary patients with brain disease[J]. Vet Clin North Am: Small Anim Pract, 2010, 40(1): 1–19. DOI: 10.1016/j.cvsm.2009.09.002 |



