2. 江苏高校动物重要疫病与人兽共患病防控协同创新中心, 扬州 225009
2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China
破骨细胞(osteoclast,OC)是由造血干细胞分化而来的具有独特形态学特点的多核细胞,是体内唯一具有骨吸收活性的细胞[1-3]。OC的活性增加与几种常见的骨疾病有关,包括绝经后骨质疏松症、骨转移、Paget’s病等[4-5]。OC前体细胞存在于脾、骨髓和外周血液等,成熟OC是由单核前体细胞经过复杂的融合过程形成的[6-7]。近年来,寻找抑制OC分化的靶位点已经成为该领域的研究热点。
细胞骨架是细胞内以蛋白纤维为主要成分的网状结构,主要由3类蛋白质纤维构成,包括微丝、微管和中间纤维[8]。Rho GTPases能够调节肌动蛋白细胞骨架的聚合和解聚。Rho激活可以导致细胞产生应力纤维和局部黏着斑,并调控细胞膜受体与细胞骨架之间的信号转导[9-11]。RhoU作为非经典Rho GTPases家族重要成员,在OC形成过程中显著上调,参与OC前体的融合[12-13]。本实验室前期研究表明在诱导RAW 264.7细胞生成OC的过程中,RhoU基因表达量逐渐升高[14],但是RhoU在OC细胞分化过程中的作用机制尚未明确。
本文利用慢病毒介导的siRNA技术沉默破骨细胞诱导过程中RhoU mRNA的表达,研究了RhoU对OC分化、OC及其前体细胞形态的影响,为治疗骨质疏松等疾病提供了新思路。
1 材料与方法 1.1 细胞株RAW 264.7细胞株购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库(ATCC Number:TIB-71)。
1.2 主要试剂与仪器TRAP染色试剂盒(Sigma-Aldrich,USA);胎牛血清、DMEM、α-MEM、L-谷氨酰胺(Gibco,USA);BSA(Sigma-Aldrich,USA);PrimeScript® RT reagent Kit with gDNA Eraser、SYBR® Premix Ex TaqTMⅡKit(TaKaRa,Japan);Trizol、罗丹明-鬼笔环肽(Invitrogen,USA);RANKL、M-CSF(R & D,USA);Vimentin (D21H3) XP® Rabbit mAb(Cell Signaling,USA);Rat mAb to Tubulin,Goat pAb to Rat IgG H & L(Alexa Fluor® 488)(Abcam,English);青链霉素(北京索莱宝公司);RhoU siRNA、Control siRNA由赛业(广州)生物科技有限公司构建。
二氧化碳培养箱,NanoDrop 2000(Thermo,USA);5810R型冷冻离心机(Eppendorf,Germany);AXIO倒置显微镜(ZEISS,USA);ABI 7500 qRT-PCR仪(ABI,USA);Leica-sp8激光共聚焦显微镜(Leica,Germany);SW-CJ-1F型单人双面净化工作台(苏州净化设备有限公司)。
1.3 细胞培养与转染RAW 264.7细胞复苏后,用DMEM培养液(含有10% FBS, 100 U·mL-1青霉素, 100 μg ·mL-1链霉素和2 mmol·L-1 L-谷氨酰胺)悬浮细胞,37 ℃,5%CO2恒温培养。细胞传代至第5代细胞稳定时,收集对数生长细胞接种到24孔板(5×104·孔-1)内,放入细胞培养箱,待细胞长到对数期转染。将细胞随机分成两组,即阴性对照组和RhoU沉默组。每孔吸出200 μL原培养液,分别加入siRhoU慢病毒20 μL及阴性病毒4 μL;随即每孔加入0.3 μL 5 mg·L-1的Polybrene;放入培养箱培养6 h后,再加入200 μL DMEM培养液。转染48 h后加入4 μg·mL-1嘌呤,筛选2 d。细胞长满后进行稳定传代,并用于后续试验。RAW 264.7细胞在M-CSF和RANKL作用下诱导至第4天产生大量OC。
1.4 qRT-PCR检测RhoU和破骨细胞标志性基因表达变化 1.4.1 引物的设计和合成根据GenBank中小鼠的抗酒石酸酸性磷酸酶(TRAP)、组织蛋白酶K(cathepsin K, CTSK)、Ⅱ型碳酸酐酶(CAⅡ)、基质金属蛋白酶-9 (MMP-9)、核因子κB受体活化因子配体(RANKL)和GAPDH基因序列,采用Primer Premier 5.0软件设计特异性引物,由南京华大基因科技有限公司合成,引物序列见表 1。
|
|
表 1 本研究所用引物序列 Table 1 Primer sequences used in this study |
将阴性对照组和RhoU沉默组细胞系分别接种在6孔板中,用α-MEM培养液(含有10%FBS、25 ng·mL-1 M-CSF和20 ng·mL-1RANKL)诱导至第4天。4 ℃预冷PBS洗2遍,每组加入1 mL Trizol试剂提取各孔总RNA,根据紫外可见分光光度计测定RNA纯度及浓度,A260 nm/A280 nm=2.0为RNA最佳纯度。根据PrimeScript® RT reagent Kit with gDNA Eraser试剂盒说明书进行反转录。合成的cDNA保存在-20 ℃备用。
1.4.3 实时荧光定量cDNA稀释10倍后根据SYBR®Premix Ex TaqTM ⅡKit试剂盒说明书进行TRAP、CTSK、CAⅡ、MMP-9、DC-STAMP、RANK和GAPDH基因的PCR扩增。PCR反应体系为20 μL:SYBR® Premix Ex TaqTMⅡ 10 μL,上游引物(10 μmol·L-1)0.8 μL,下游引物(10 μmol·L-1)0.8 μL,ROX Reference DyeⅡ 0.4 μL,cDNA模板2 μL,无RNAse水6 μL。qRT-PCR扩增采用两步法,扩增程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。每个样品重复3次。反应结束后以熔解曲线来判定PCR产物的特异性。以GAPDH作为内参基因,使用2-△△Ct法测算目的基因的表达量。
1.5 抗酒石酸酸性磷酸酶染色观察破骨细胞的生成将阴性对照组和RhoU沉默组细胞系分别接种到96孔板中,用α-MEM培养液(含有10%FBS、25 ng·mL-1 M-CSF和20 ng·mL-1RANKL)诱导培养至第4天,弃去培养基,4 ℃预冷PBS冲洗2遍,4%多聚甲醛室温固定20 min,PBS洗3遍,根据TRAP染色试剂盒说明书进行染色。在光学显微镜下观察,选择每孔不同视野进行拍摄,细胞核数量3个或以上的细胞判定为破骨细胞,并利用Image J和Image pro plus软件分别统计破骨细胞的数量和面积。
1.6 免疫荧光观察破骨细胞形态变化将阴性对照组和RhoU沉默组细胞系分别接种到24孔板中,用α-MEM培养液(含有10%FBS、25 ng·mL-1M-CSF和20 ng·mL-1RANKL)诱导至第3或4天,弃去培养基,PBS洗涤3遍,用4%多聚甲醛固定细胞30 min;0.4% TritonX-100室温透膜15 min;5%BSA室温封闭1.5 h;添加罗丹明-鬼笔环肽、FITC-α-tubulin和Vementin抗体,4 ℃过夜孵育;用PBS洗涤3遍,添加抗大鼠488荧光二抗,室温孵育2 h;PBS洗涤3遍,封片;Leica-sp 8激光共聚焦显微镜观察、拍照。
1.7 Western blot检测RhoU和破骨细胞标志性蛋白表达变化细胞诱导致第4天,加入裂解液,收集细胞获取总蛋白。BCA方法测定蛋白质浓度,调整蛋白浓度使其一致。按照30 μg的上样量对蛋白样品进行定量,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)2 h,250 mA转膜1.5 h,5%脱脂乳室温摇床封闭1.5 h,加入相应抗体和GAPDH,4 ℃孵育过夜后,TBST缓冲液洗涤3次,加入HRP标记的二抗(1:10 000),室温孵育2 h,TBST缓冲液洗涤3次,加入ECL显影液进行显影。
1.8 数据分析所有试验重复3次,数据显示为x±s。用SPSS v.20.0软件进行单因素方差分析,以P < 0.01(差异极显著)、P < 0.05(差异显著)作为差异显著性判断标准。
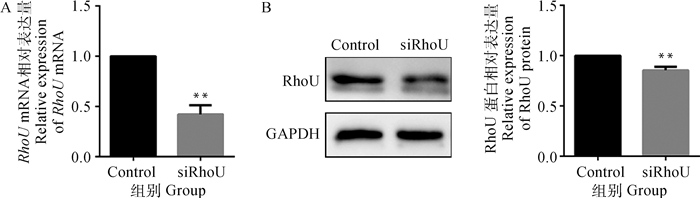
2 结果 2.1 qRT-PCR和Western blot检测RhoU沉默效果阴性对照组和RhoU沉默组细胞分别添加M-CSF和RANKL,诱导4 d后用qRT-PCR检测RhoU基因的沉默效果,Western blot检测RhoU蛋白。结果显示(图 1),与Control组相比,RhoU沉默组RhoU mRNA和蛋白表达量均极显著降低(P < 0.01)。
|
A.qRT-PCR检测RhoU mRNA;B.Western blot检测RhoU蛋白。与阴性对照组相比,*.P < 0.05;**.P < 0.01。下同 A. Detection of RhoU mRNA by qRT-PCR; B. Detection of RhoU protein by Western blot. Compared with negative control group, *.P < 0.05; **.P < 0.01. The same as follows 图 1 RhoU基因和蛋白的沉默效果 Fig. 1 Silencing effect of RhoU gene and protein |
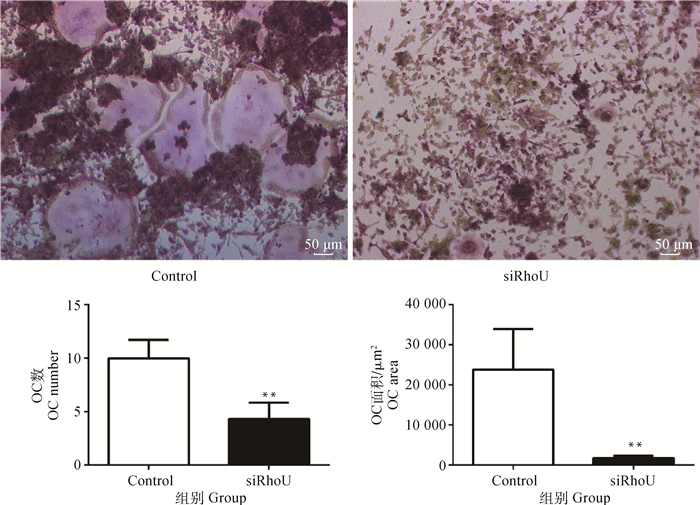
阴性对照组和RhoU沉默组细胞分别添加M-CSF和RANKL,诱导4 d后TRAP染色结果显示(图 2),阴性对照(Control)组在诱导至第4天产生大量TRAP,与RAW 264.7细胞诱导效果无明显差异;RhoU沉默组产生的TRAP极少,OC产生的数目和面积均极显著低于Control组(P < 0.01)。
|
图 2 RhoU沉默后对破骨细胞生成数目和面积的影响(TRAP染色) Fig. 2 Effect of RhoU silencing on the number and area of osteoclastogenesis (TRAP staining) |
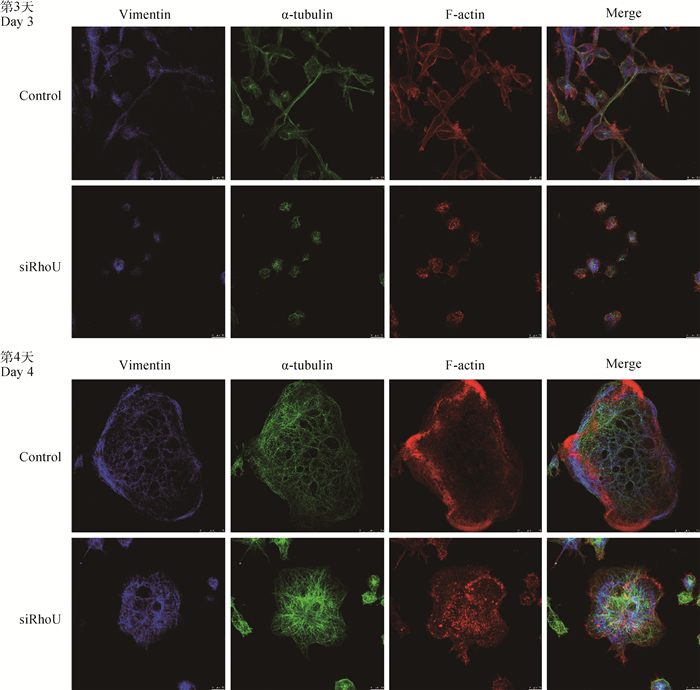
阴性对照组和RhoU沉默组细胞在M-CSF和RANKL诱导至第3或4天,对波形蛋白(vimentin)、微丝(F-actin)及微管(α-tubulin)染色(图 3)。结果显示,在OC分化过程中,细胞骨架发生了显著的变化。第3天多数前体细胞形成细长的丝状伪足,第4天OC伪足小体集中在边缘,并紧密排列成环状,形成封闭带。与Control组相比,RhoU沉默组前体细胞大部分细胞不能形成细长的丝状伪足,形成的OC较小而且不能形成完整的封闭带。
|
图 3 RhoU沉默后对破骨细胞及其前体细胞细胞骨架的影响 Fig. 3 Effect of RhoU silencing on cytoskeleton of osteoclasts and their precursor cells |
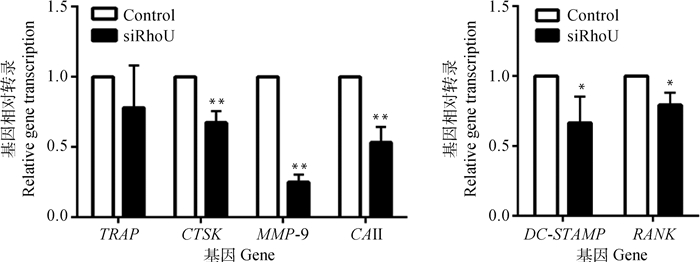
阴性对照组和RhoU沉默组细胞分别添加M-CSF和RANKL,诱导4 d后提取总RNA。qRT-PCR结果显示(图 4),与Control组相比,RhoU沉默组OC分化特异性基因CTSK、MMP-9和CAⅡ mRNA水平极显著下降(P < 0.01),而TRAP下降不显著(P>0.05)。DC-STAMP是细胞融合的关键基因,RANK是核因子κB受体活化因子配体(RANKL)的特异性受体,RANK与RANKL结合后促进OC的分化。沉默RhoU后,DC-STAMP和RANK转录水平显著下降(P < 0.05)。
|
图 4 RhoU沉默后对破骨细胞特异性基因mRNA水平的影响 Fig. 4 Effect of RhoU silencing on mRNA levels of osteoclast-specific genes |
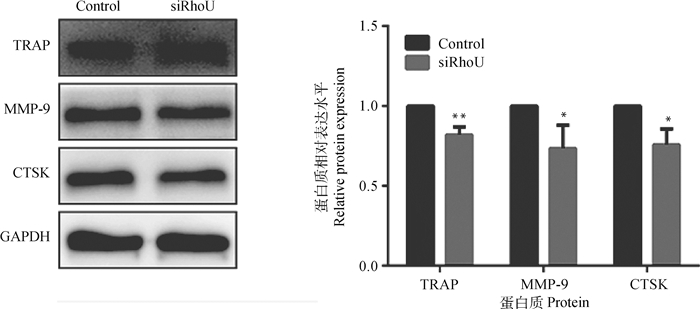
为了研究RhoU在破骨细胞分化的作用,构建稳定siRhoU细胞后,采用Western blot检测相关蛋白的表达(图 5)。结果表明,与Control组相比,RhoU沉默组破骨细胞分化特异性蛋白TRAP、MMP-9和CTSK表达水平均显著或极显著下降(P < 0.05或P < 0.01)。
|
图 5 RhoU沉默后对破骨细胞TRAP、MMP-9和CTSK蛋白表达的影响 Fig. 5 Effects of RhoU silencing on the expression of TRAP, MMP-9 and CTSK proteins in osteoclasts |
破骨细胞是多核高度分化的终末细胞,与成骨细胞和骨细胞共同维持骨骼代谢平衡。细胞骨架在OC分化、融合和成熟过程中扮演了重要的角色,封闭带的形成对OC发挥骨吸收作用起到至关重要的作用[15-16]。Rho GTPases能够调节肌动蛋白细胞骨架的重组,促进OC前体细胞移动到邻近的细胞,有利于OC的融合和封闭带的形成[9]。Rho是OC研究的第一个GTP酶。研究表明使用肉毒梭菌C3外酶抑制RhoA、RhoB和RhoC会破坏封闭带的形成,导致OC失活[17]。本实验室前期研究表明Rho GTPases调控的丝状伪足和板状伪足,对OC封闭带形成起着重要作用[14]。Rho GTPasse家族中与OC骨架调节有关的最新成员是RhoU,也被称为WRCH1(Wnt1反应性Cdc42同系物1)。RhoU与Cdc42具有显著的序列和功能相似性,但与Cdc42不同,RhoU具有极其快速的内在鸟嘌呤核苷酸交换活性。此外,RhoU与黏着斑蛋白在OC肌动蛋白核周围共定位[18]。但是,RhoU在OC分化过程中的功能仍需进一步研究。
本研究通过慢病毒沉默RhoU,观察OC细胞骨架及封闭带的形成。首先,RhoU基因沉默后mRNA和蛋白表达量均显著下降,能满足后续试验要求。TRAP是OC分化与成熟的标志性酶,是破骨细胞分泌到骨吸收陷窝中发挥骨吸收活性的重要酶[19]。TRAP染色发现,RhoU沉默后OC形成数目和面积减少。OC分化和活性与特异性蛋白的表达有关,组织蛋白酶是一大类主要存在于溶酶体的胞内蛋白酶,属于半胱氨酸蛋白酶家族。Ⅰ型胶原是骨基质中最主要的胞外蛋白,CTSK作为主要的Ⅰ型胶原降解酶,它在OC选择性高表达, 是OC发挥作用最主要的酶[20-21];MMP-9是基质金属蛋白水解酶超家族中锌结合肽链内切酶家族的一员,主要功能是降解或重建细胞外基质[22-23]。CAⅡ是一种含锌金属酶,其在骨吸收过程具有重要的调节作用,不仅能分泌H+到骨吸收陷窝内,参与骨质和矿物质的降解,还能影响OC的分化及迁移,并通过改变细胞内Ca2+浓度与骨吸收陷窝中的pH发挥作用[24-25]。本研究结果表明,干扰RhoU后,TRAP、MMP-9和CTSK蛋白表达量较对照组显著下降,相关基因表达也显著下降,而TRAP基因水平变化不显著,其具体机制需要进一步探究。OC最初的黏附结构是点状的富含微丝的伪足小体,在分化早期先形成簇,再形成小的伪足小体环,最终形成伪足小体带[26-27]。在骨吸收过程中,封闭带使OC牢牢黏附在骨表面[28-30]。免疫荧光结果显示,沉默RhoU后OC变小,细胞骨架不完整,缺乏完整的封闭带。
TRAP染色发现,RhoU沉默后OC生成减少,但是前体细胞数量未减少;同时参与破骨细胞分化与融合的重要基因DC-STAMP表达量显著降低。以上结果表明,RhoU沉默后不影响前体细胞的产生,但是抑制前体细胞融合成OC。免疫荧光观察发现,RhoU沉默后前体细胞丝状伪足变短或消失,提示RhoU可能调控前体细胞丝状伪足的功能进而影响细胞融合。RhoU沉默后RANK基因表达量降低,说明RhoU还可能通过调控RANK与RANKL的结合进而影响OC的分化。但是,RhoU调控OC分化的机制需进一步研究。
4 结论RhoU沉默后可以抑制OC的分化,抑制前体细胞丝状伪足的形成, 进而影响其融合可能是重要原因。
| [1] | VAANANEN H K, LAITALA-LEINONEN T. Osteoclast lineage and function[J]. Arch Biochem Biophys, 2008, 473(2): 132–138. DOI: 10.1016/j.abb.2008.03.037 |
| [2] | INDO Y, TAKESHITA S, ISHⅡ K A, et al. Metabolic regulation of osteoclast differentiation and function[J]. J Bone Miner Res, 2013, 28(11): 2392–2399. DOI: 10.1002/jbmr.1976 |
| [3] | ONO T, NAKASHIMA T. Recent advances in osteoclast biology[J]. Histochem Cell Biol, 2018, 149(4): 325–341. DOI: 10.1007/s00418-018-1636-2 |
| [4] | BOYLE W J, SIMONET W S, LACEY D L. Osteoclast differentiation and activation[J]. Nature, 2003, 423(6937): 337–342. DOI: 10.1038/nature01658 |
| [5] | ZACH F, POLZER F, MUELLER A, et al. p62/sequestosome 1 deficiency accelerates osteoclastogenesis in vitro and leads to Paget's disease-like bone phenotypes in mice[J]. J Biol Chem, 2018, 293(24): 9530–9541. DOI: 10.1074/jbc.RA118.002449 |
| [6] | JANSEN I D C, VERMEER J A F, BLOEMEN V, et al. Osteoclast fusion and fission[J]. Calcified Tissue Int, 2012, 90(6): 515–522. DOI: 10.1007/s00223-012-9600-y |
| [7] | CHEN X, WANG Z Q, DUAN N, et al. Osteoblast-osteoclast interactions[J]. Connect Tissue Res, 2018, 59(2): 99–107. DOI: 10.1080/03008207.2017.1290085 |
| [8] |
左志慧, 胡江天. 细胞骨架生物力学的研究进展[J]. 医学综述, 2013, 19(19): 3457–3459.
ZUO Z H, HU J T. Research advances in cytoskeletal biomechanics[J]. Medical Recapitulate, 2013, 19(19): 3457–3459. DOI: 10.3969/j.issn.1006-2084.2013.19.001 (in Chinese) |
| [9] | BRAZIER H, PAWLAK G, VIVES V, et al. The Rho GTPase Wrch1 regulates osteoclast precursor adhesion and migration[J]. Int J Biochem Cell Biol, 2009, 41(6): 1391–1401. DOI: 10.1016/j.biocel.2008.12.007 |
| [10] |
赵龙, 陈彻, 李明, 等. 艰难梭菌毒素A对K562细胞Rho GTPases及细胞骨架的影响[J]. 中国实验血液学杂志, 2018, 26(5): 1330–1335.
ZHAO L, CHEN C, LI M, et al. Effects of Tcd A on Rho GTPases and the cytoskeleton of leukemia cell line K562[J]. Journal of Experimental Hematology, 2018, 26(5): 1330–1335. (in Chinese) |
| [11] | DRUBIN D G, MAZZORANA M, TERRADO J, et al. Comparative transcriptomics reveals RhoE as a novel regulator of actin dynamics in bone-resorbing osteoclasts[J]. Mol Biol Cell, 2014, 25(3): 380–396. DOI: 10.1091/mbc.e13-07-0363 |
| [12] | TAO W K, PENNICA D, XU L F, et al. Wrch-1, a novel member of the Rho gene family that is regulated by Wnt-1[J]. Gene Dev, 2001, 15(14): 1796–1807. DOI: 10.1101/gad.894301 |
| [13] | SONG R L, LIU X Z, ZHU J Q, et al. New roles of filopodia and podosomes in the differentiation and fusion process of osteoclasts[J]. Genet Mol Res, 2014, 13(3): 4776–4787. DOI: 10.4238/2014.July.2.7 |
| [14] |
宋瑞龙. OPG对破骨细胞分化过程中细胞骨架的影响及其分子机理[D].扬州: 扬州大学, 2014.
SONG R L. Influences of osteoprotegerin on the cytoskeleton of osteoclast and the involve signalling pathways in the process of osteoclast differentiation[D]. Yangzhou: Yangzhou University, 2014. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-11117-1015664698.htm |
| [15] | VÄÄNÄNEN H K, ZHAO H B, MULARI M, et al. The cell biology of osteoclast function[J]. J Cell Sci, 2000, 113: 377–381. |
| [16] | MATSUBARA T, KINBARA M, MAEDA T, et al. Regulation of osteoclast differentiation and actin ring formation by the cytolinker protein plectin[J]. Biochem Biophys Res Commun, 2017, 489(4): 472–476. DOI: 10.1016/j.bbrc.2017.05.174 |
| [17] | ZHANG D, UDAGAWA N, NAKAMURA I, et al. The small GTP-binding protein, rho p21, is involved in bone resorption by regulating cytoskeletal organization in osteoclasts[J]. J Cell Sci, 1995, 108: 2285–2292. |
| [18] | ORY S, BRAZIER H, BLANGY A. Identification of a bipartite focal adhesion localization signal in RhoU/Wrch-1, a Rho family GTPase that regulates cell adhesion and migration[J]. Biol Cell, 2007, 99(12): 701–716. DOI: 10.1042/BC20070058 |
| [19] | DIEPENHORST N A, NOWELL C J, RUEDA P, et al. High throughput, quantitative analysis of human osteoclast differentiation and activity[J]. Anal Biochem, 2017, 519: 51–56. DOI: 10.1016/j.ab.2016.12.010 |
| [20] | LU J, WANG M L, WANG Z Y, et al. Advances in the discovery of cathepsin K inhibitors on bone resorption[J]. J Enzyme Inhib Med Chem, 2018, 33(1): 890–904. DOI: 10.1080/14756366.2018.1465417 |
| [21] | DODDS R A, JAMES I E, RIEMAN D, et al. Human osteoclast cathepsin K is processed intracellularly prior to attachment and bone resorption[J]. J Bone Mineral Res, 2001, 16(3): 478–486. DOI: 10.1359/jbmr.2001.16.3.478 |
| [22] | FUNAYAMA H, ISHIKAWA S E, KUBO N, et al. Increases in interleukin-6 and matrix metalloproteinase-9 in the infarct-related coronary artery of acute myocardial infarction[J]. Circ J, 2004, 68(5): 451–454. DOI: 10.1253/circj.68.451 |
| [23] | WANG X D, YU Y Y, LIEU S, et al. MMP9 regulates the cellular response to inflammation after skeletal injury[J]. Bone, 2013, 52(1): 111–119. DOI: 10.1016/j.bone.2012.09.018 |
| [24] | BERNHARDT A, KOPERSKI K, SCHUMACHER M, et al. Relevance of osteoclast-specific enzyme activities in cell-based in vitro resorption assays[J]. Eur Cells Mater, 2017, 33: 28–42. DOI: 10.22203/eCM.v033a03 |
| [25] | KIN J H, KIM E Y, LEE B, et al. The effects of Lycii Radicis Cortex on RANKL-induced osteoclast differentiation and activation in RAW 264. 7 cells[J]. Int J Mol Med, 2016, 37(3): 649–658. DOI: 10.3892/ijmm.2016.2477 |
| [26] | DESTAING O, SALTEL F, GÉMINARD J C, et al. Podosomes display actin turnover and dynamic self-organization in osteoclasts expressing actin-green fluorescent protein[J]. Mol Biol Cell, 2003, 14(2): 407–416. DOI: 10.1091/mbc.e02-07-0389 |
| [27] | BATSIR S, GEIGER B, KAM Z. Dynamics of the sealing zone in cultured osteoclasts[J]. Cytoskeleton, 2017, 74(2): 72–81. DOI: 10.1002/cm.21350 |
| [28] | JURDIC P, SALTEL F, CHABADEL A, et al. Podosome and sealing zone:specificity of the osteoclast model[J]. Eur J Cell Biol, 2006, 85(3-4): 195–202. DOI: 10.1016/j.ejcb.2005.09.008 |
| [29] | TAKITO J, INOUE S, NAKAMURA M. The sealing zone in osteoclasts:a self-organized structure on the bone[J]. Int J Mol Sci, 2018, 19(4): 984. DOI: 10.3390/ijms19040984 |
| [30] | XU S, ZHANG Y, WANG J, et al. TSC1 regulates osteoclast podosome organization and bone resorption through mTORC1 and Rac1/Cdc42[J]. Cell Death Differ, 2018, 25(9): 1549–1566. DOI: 10.1038/s41418-017-0049-4 |



