流行性出血病(epizootic haemorrhagic disease,EHD)是由流行性出血病病毒(epizootic haemorrhagic disease virus,EHDV)感染反刍动物并能引起严重危害的一种虫媒病毒病。EHD主要流行于热带、亚热带及温带地区,病毒通过雌性库蠓的吸血性叮咬进行传播[1]。不同种类反刍动物对EHDV的易感性与感染后的临床症状存在差异,北美白尾鹿对EHDV高度易感,可引起感染动物的急性死亡[2];牛对EHDV也高度易感,主要表现为发热、口腔溃烂出血、呼吸道疾病和组织器官坏死,妊娠期母牛早产、流产和奶牛产奶量急剧减少[3-4];羊对EHDV的易感性较低,表现为皮下水肿,眼结膜、心外膜、胃及肠的浆膜面出血,鼻子排带绿色黏液[5-6]。EHD在流行期间危害较大,严重影响着各国畜牧业和国际贸易的发展,世界动物卫生组织(OIE)已将EHD列为法定报告传染病[7]。
EHDV为呼肠孤病毒科(Reoviridae)环状病毒属(Orbivirus)成员,为无囊膜病毒,病毒粒子呈圆形或六角形,二十面体对称,直径约62 nm。病毒具双层衣壳结构,其中外层衣壳表面由42个环状壳粒组成,为该病毒的典型特征[4]。病毒基因组大小约20 kb,由10个节段(Seg-1~Seg-10)双链RNA组成,可编码7种结构蛋白(VP1~VP7)和4种非结构蛋白(NS1、NS2、NS3、NS3a)。Seg-3编码的VP3是构成病毒内层衣壳的主要蛋白,VP3为EHDV的高度保守蛋白,但Seg-3核酸序列在不同地域分离的毒株间却存在差异,可据此确定病毒地域型(topotype),将世界范围分离的EHDV分离株分为东方型(Eastern)和西方型(Western)[8]。Seg-2编码的VP2蛋白是构成病毒外层衣壳的主要蛋白,具有高度变异的特性,为诱导机体产生特异性中和抗体的主要蛋白,决定着病毒的血清型[9]。美洲、欧洲、非洲、澳洲和亚洲等地区均有分离到不同EHDV血清型毒株的报道,目前世界范围已发现至少9种不同血清型EHDV(EHDV-1、-2、-4、-5、-6、-7、-8、-9、-10)[10]。
2012年在国家(农业)公益性行业专项的资助下,云南省畜牧兽医科学院在我国内蒙古、新疆、湖北、江苏、山西、广东、广西、云南等省(自治区)开展EHDV血清学调查,在云南、广西和广东等地采集的牛血清样本中检测到EHDV-2、-6和-7型病毒的特异性中和抗体[11-13],表明上述血清型EHDV很可能在我国南方地区的牛群中广泛流行。随后,曹颖颖等[14]在广西分离到EHDV-5型毒株,吕敏娜等[15]在广东分离到EHDV-1型毒株,但目前尚无EHDV-7型毒株的分离报道。本文首次报道了EHDV-7型毒株(YNSZ/V269/2013)在我国的分离,研究结果为我国深入开展EHDV-7型病毒遗传特性、致病性等研究提供了基础,同时为云南乃至全国开展EHDV的防控提供了有价值的参考资料。
1 材料与方法 1.1 主要试剂磁珠法病毒RNA抽提试剂盒MagMAX-96 Viral RNA Isolation Kit、MEM培养基、新生牛血清购自Thermo公司;AgPath-ID One-step RT-PCR Kit购自Ambion公司;总RNA提取试剂RNAiso-Plus、DNA胶回收试剂盒、pMD19-T载体、E.coli DH5α感受态细胞、PrimeScritp逆转录酶、Ex Taq DNA聚合酶购自大连宝生物公司。
1.2 细胞、毒株和阳性血清仓鼠肾细胞(Baby hamster kidney cell, BHK-21)为本实验室保存;EHDV-1、-2、-5、-6、-7、-8型参考毒株由澳大利亚麦克阿瑟·伊丽莎白农业研究所(Elizabeth Macarthur Agricultural Institute, EMAI)提供;EHDV-1、-2、-5、-6、-7、-8型参考毒株阳性血清,由本实验室用纯化处理后的各血清型参考毒株免疫家兔制备,抗体效价分别如下:1:453、1:320、1:226、1:453、1:320和1:640。
1.3 引物设计与合成根据GenBank中公布的澳大利亚和日本EHDV毒株的序列,使用Oligo 7.0软件设计2对引物分别用于扩增EHDV-7型毒株Seg-2与Seg-3的ORF(open reading frame)区,引物由上海英骏生物技术有限公司合成(表 1)。
|
|
表 1 EHDV-7型分离毒株的Seg-2与Seg-3 ORF区扩增引物信息 Table 1 Primer information of Seg-2, Seg-3 ORF of EHDV-7 isolates |
在云南省师宗县(经度:E104°17′,N24°36′,海拔940 m)设立牛羊虫媒病毒监控点,采用放养的方式设置EHDV血清学和核酸阴性的10头牛与5只羊作为哨兵动物。每年5—12月定期从哨兵动物上采集肝素钠抗凝血、EDTA抗凝血和常规血等三种血液样品于4 ℃冰盒保存,并立即送至实验室进行牛羊虫媒病毒的检测与病毒分离工作。
1.5 EHDV抗体和核酸检测使用本实验室制备的EHDV C-ELISA试剂盒[16],对监控点采集的哨兵动物血清进行EHDV血清抗体检测。取50 μL EDTA抗凝血,以MagMax Express核酸自动提取仪提取核酸,采用本实验室建立的EHDV高通量qRT-PCR技术对血液样本中EHDV核酸进行检测。
1.6 病毒的分离与鉴定对核酸检测为EHDV阳性的血液样本(Ct值<34)进行病毒分离,简述如下:取1 mL肝素钠抗凝血离心并收集红细胞(RBCs),以PBS洗涤1次,加入500 μL灭菌水振荡裂解RBCs。取裂解后的RBCs 200 μL接种于生长为单层的BHK-21细胞,连续盲传4代以上,每代培养7 d,直至细胞在接种后4~6 d出现明显的细胞病变(CPE)。提取病变细胞核酸,进行EHDV的群特异性qRT-PCR检测。
1.7 血清学中和试验采用Karber法测定待鉴定病毒的TCID50,由于EHDV和蓝舌病病毒(BTV)在BHK-21细胞引起的病变过程相似,所以使用EHDV标准阳性血清,参照2014年OIE手册[7]和GB/T 18089-2008方法[17]对病毒进行中和试验,鉴定血清型。简要操作如下:将标准阳性血清梯度稀释后每孔50 μL加入细胞培养板;按50 μL·孔-1的量加入100个TICD50的病毒悬液,充分混匀后37 ℃ 5% CO2条件下孵育1 h;加入100 μL·孔-1的BHK-21细胞悬液于37 ℃ 5% CO2条件下培养7 d;观察细胞病变,进行病毒血清型的初步判定(抗体效价 < 1:16判定为阴性,1:16≤抗体效价 < 1:45判定为可疑,抗体效价≥1:45判定为阳性)。若待检病毒只被某一标准阳性血清中和,使用该血清型的标准参考毒株作为对照,对分离到病毒的动物阳性血清再次进行中和试验,计算血清中和抗体效价。
1.8 RT-PCR扩增与克隆测序将病毒接种BHK-21细胞,待出现完全CPE后,用RNA提取试剂RNAiso-Plus提取细胞总RNA。以变性后的RNA为模板,使用Radom 6 mers随机引物和PrimeScritp逆转录酶进行cDNA合成。以合成的cDNA为模板,使用表 1中的引物进行EHDV Seg-2与Seg-3 ORF区的扩增。将符合扩增大小的PCR产物进行胶回收,并与pMD19-T载体连接。将连接产物转化E. coli DH5α感受态细胞,涂布含Amp的LB平板,挑取白色菌落进行菌落PCR鉴定,对鉴定结果为阳性的菌落进行测序。
1.9 序列分析与系统发生树构建使用DNASTAR软件(Ver 6.0)对测序结果进行序列拼接。使用MEGA 6.0[18]软件进行序列比对分析,并构建系统发生树。建树方法为邻近法(Neighbor-joining, NJ),选择遗传距离模型(P-distance),自举检验(bootstrap)取值1 000。系统发生树中其他国家分离的EHDV毒株序列以“GenBank序列号EHDV血清型分离国家病毒分离时间”表示。
2 结果 2.1 病毒分离鉴定2013年,师宗监控点19号哨兵牛8月13日采集的血液样本经EHDV群特异性qRT-PCR检测为阳性(Ct值29.6),表明动物感染了EHDV。EHDV阳性血液在BHK-21细胞盲传的第3代,细胞出现明显的CPE,100倍显微镜下观察,接种3 d后部分细胞开始变圆并皱缩,6 d后细胞基本全部脱落崩解(图 1)。提取病变细胞核酸进行EHDV群特异性qRT-PCR检测,Ct值为14.9,表明成功从19号哨兵牛血液中分离出EHDV,将分离的病毒命名为YNSZ/V269/2013。

|
A.对照BHK-21细胞;B..接种后3 d的BHK-21细胞;C.接种后6 d的BHK-21细胞 A. BHK-21 cell control; B. Infected BHK-21 cell after 3 days; C. Infected BHK-21 cell after 6 days 图 1 BHK-21细胞感染EHDV后的病变(100×) Fig. 1 Cytopathic effect of BHK-21 infected with EHDV (100×) |
Karber法测定出分离病毒TCID50为105.97·mL-1。将19号哨兵牛分离到病毒前1周(8月6日)与分离到病毒后3周(8月20日、9月3日和9月14日)采集的血清倍比稀释(1:10~1:1 280)后与100个TCID50的YNSZ/V269/2013进行中和试验,结果显示感染动物产生了针对YNSZ/V269/2013的特异性中和抗体,且中和抗体效价随时间逐步升高(表 2),确认19号哨兵牛被病毒YNSZ/V269/2013感染。
|
|
表 2 血清中和试验 Table 2 Serum neutralization test |
取EHDV标准阳性血清与100个TCID50的YNSZ/V269/2013进行中和试验,结果显示EHDV-1、-2、-5、-6与-8型阳性血清对病毒均无中和作用,而EHDV-7型阳性血清对病毒的中和指数为1:320(表 2),表明分离的YNSZ/V269/2013为血清型7型。取8月6日、8月20日和9月3日19号哨兵牛上采集的血清,以100个TCID50的EHDV-7澳大利亚参考毒(EHDV-7/AUS)进行血清中和试验,结果显示被感染动物的血清对EHDV-7/AUS的中和指数分别为≤1:7、1:113和1:226,进一步表明19号哨兵牛产生了针对EHDV-7型病毒的特异性中和抗体。
2.3 EHDV-7型毒株Seg-2与Seg-3的RT-PCR扩增与克隆测序为掌握EHDV-7型YNSZ/V269/2013毒株的遗传特征,笔者设计了2对引物对分离的EHDV-7型毒株的Seg-2与Seg-3 ORF区进行RT-PCR扩增,结果显示设计引物可特异性的扩增出大小分别为2.9与2.7 kb的目的DNA片段(图 2)。将纯化后的PCR扩增产物克隆入T载体,测序结果显示成功克隆了YNSZ/V269/2013毒株Seg-2、Seg-3的ORF区。
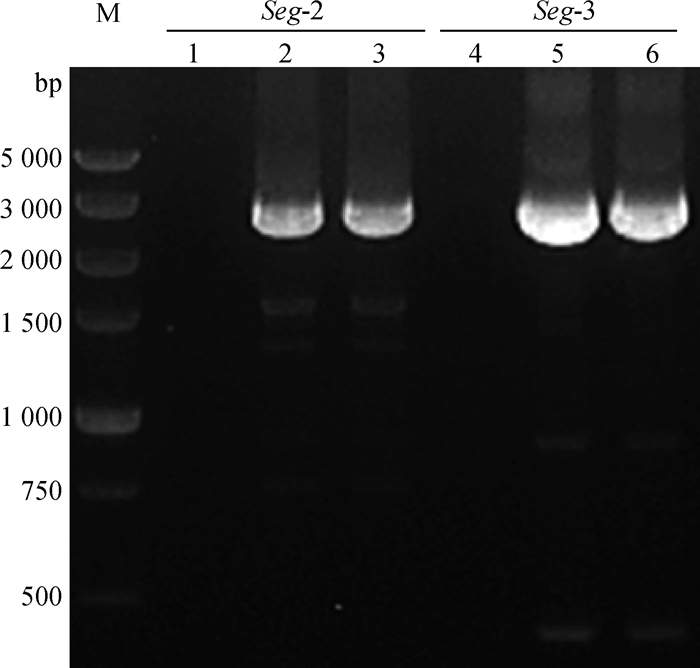
|
M.DNA DL5000相对分子质量标准;1.阴性对照;2. EHDV-7/AUS(2 949 bp);3. YNSZ/V269/2013(2 949 bp);4.阴性对照;5. EHDV-7/AUS(2 700 bp);6. YNSZ/V269/2013(2 700 bp) M. DL5000 DNA marker; 1. Negative control; 2. EHDV-7/AUS (2 949 bp); 3. YNSZ/V269/2013 (2 949 bp); 4. Negative control; 5. EHDV-7/AUS (2 700 bp); 6. YNSZ/V269/2013 (2 700 bp) 图 2 YNSZ/V269/2013毒株Seg-2与Seg-3 ORF区RT-PCR扩增产物 Fig. 2 RT-PCR products of Seg-2 and Seg-3 ORF regions of YNSZ/V269/2013 isolate |
克隆的EHDV-7型YNSZ/V269/2013毒株Seg-2 ORF区长度为2 949 bp,可编码982个氨基酸的VP2蛋白(序列暂未提交GenBank)。与世界范围分离的EHDV-7型毒株Seg-2/VP2序列比对显示,YNSZ/V269/2013与日本毒株的序列相似度最高(≥97.3%/98.6%),与澳大利亚EHDV-7型毒株的相似度稍低(90.4%/93.8%),与以色列毒株的相似度最低(74.6%/79.4%)。构建的系统发生树显示,世界范围EHDV-7型毒株的Seg-2可分为两个相对独立的进化分支:以色列2006年分离的毒株聚为一簇,形成Western型,中国、日本、澳大利亚分离毒株聚为一簇,形成Eastern型(图 3)。
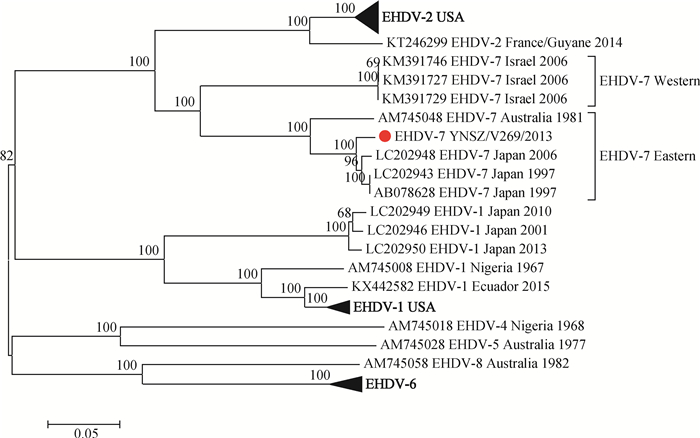
|
其他国家分离的EHDV毒株序列以“GenBank序列号EHDV血清型分离国家病毒分离时间”表示, 表示本研究获得的EHDV序列。下图同
equences of EHDV strains isolated from other countries are expressed as "GenBank sequence number EHDV serotype Country Virus isolation time", 表示本研究获得的EHDV序列。下图同
equences of EHDV strains isolated from other countries are expressed as "GenBank sequence number EHDV serotype Country Virus isolation time",  indicates the EHDV sequence obtained in this study. The same as below
图 3 基于NJ法的EHDV Seg-2序列的系统发育分析
Fig. 3
Phylogenetic analyses of available EHDV Seg-2 sequences with the Neighbor Joining method indicates the EHDV sequence obtained in this study. The same as below
图 3 基于NJ法的EHDV Seg-2序列的系统发育分析
Fig. 3
Phylogenetic analyses of available EHDV Seg-2 sequences with the Neighbor Joining method
|
克隆的YNSZ/V269/2013毒株Seg-3 ORF区长度为2 700 bp,可编码899个氨基酸的VP3蛋白(序列暂未提交GenBank)。Seg-3系统发生树显示,世界范围的EHDV Seg-3可形成Eastern与Western两个大进化分支,分离自中国、日本与澳大利亚的毒株共同构成了Eastern型,分离自美国、以色列、尼日利亚、南非等国家的EHDV聚为Western型(图 4)。YNSZ/V269/2013的Seg-3/VP3与日本、澳大利亚毒株均高度相似(>91.0%/98.4%),与Western型EHDV毒株的Seg-3核酸序列相似度较低,在79.5%~80.5%之间;而VP3氨基酸序列相似度较高,在94.6%~96.7%之间。
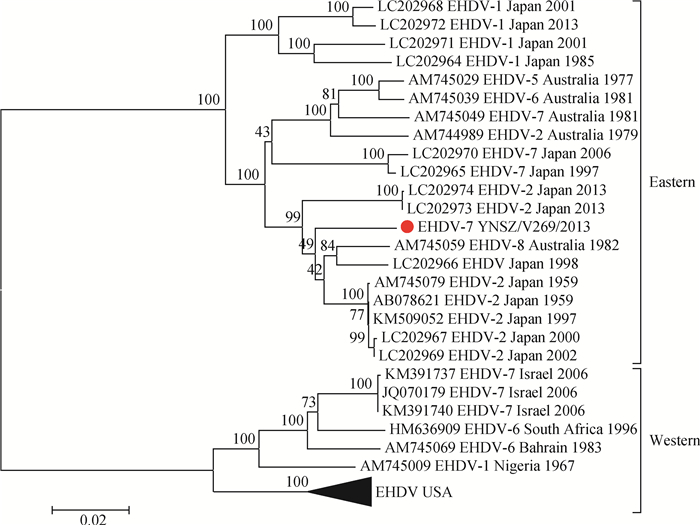
|
图 4 基于NJ法的EHDV-7 Seg-3序列的系统发育分析 Fig. 4 Phylogenetic analyses of available EHDV-7 Seg-3 with the Neighbor Joining method |
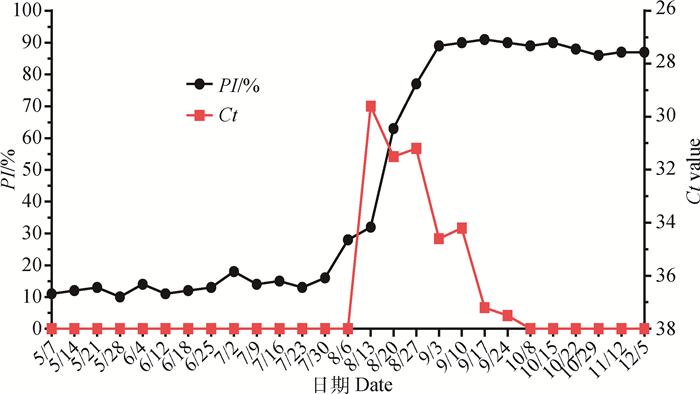
为明确EHDV-7型毒株在牛上的感染特性,笔者分别采用C-ELISA和qRT-PCR方法对19号哨兵牛2013年5—12月采集血液中的血清抗体与病毒载量进行监测。C-ELISA结果显示8月20日哨兵动物EHDV抗体转阳,抑制率(present inhabitation,PI)从8月13日(分离到病毒时间点)的32%升高到了63%,随后血清抗体抑制率继续升高,9月3日达到89%,以后均维持在80%以上。qRT-PCR检测结果显示,在动物血清抗体转阳前1周的8月13日,血液样品中检测到EHDV核酸,并且核酸含量最高(Ct值最低为29.6),随后6周血液中的病毒含量持续减少(Ct值逐渐升高),7周后血液样品核酸检测Ct值均大于38,并判定为EHDV核酸阴性(图 5)。
|
左边Y轴:C-ELISA结果抑制率(PI)%;右边Y轴:qRT-PCR结果Ct值;X轴:样品采集日期 Left Y axis: C-ELISA results (PI) %; Right Y axis: qRT-PCR results Ct value; X axis: sample collection date 图 5 师宗牛-19血清EHDV C-ELISA和血液qRT-PCR检测结果 Fig. 5 Results of EHDV C-ELISA and qRT-PCR of numbered cattle-19 serum and blood in Shizong |
EHDV-7型主要分布于北非、亚洲、澳洲和地中海地区。澳大利亚在1979—1982年,连续4年对北方领地以及昆士兰州的哨兵牛采血监测,分离出多株EHDV-7毒株[19];日本分别在1997年和2006年从牛上分离到多株EHDV-7型毒株[20]。21世纪以来,多次出现了EHDV-7型在牛上引起疫病的报道:2006—2007年间,EHDV-7型在阿尔及利亚、突尼斯、摩洛哥引起牛群EHD疫情的暴发[19],以色列在国内多次流行EHD的疫区分离到多株EHDV-7型毒株,特别是在2008年首次分离到能使牛产生明显临床症状的EHDV-7型毒株[21]。
由于EHDV不同血清型毒株之间缺乏有效的交叉免疫保护,所以掌握某一地区流行的EHDV的血清型与遗传背景对EHD防控措施具有重要的指导意义。云南省属低纬度高原地区,地理位置特殊,地况地貌复杂,境内湖泊河流纵横,气候类型丰富多样,全省大部分地区年降水量在1 100 mm左右,具有适合各类吸血节肢动物生存繁殖的温度、湿度及降水等生态条件,有利于虫媒病毒在媒介昆虫和动物宿主之间的传播循环,因此虫媒病毒种类众多[22-23]。本实验室在云南分离到了EHDV-1、-5、-6、-10等血清型毒株(另文报道),但EHDV-7型尚属首次分离获得,表明了我国云南省流行EHDV的多样性,也提醒云南可能存在发生该病的风险。因此为更好地保护我国畜牧业的健康发展,今后还需加强EHDV的监测,进一步掌握该病毒在云南的分布和遗传特征,为本病防治提供科学依据。
通过对分离EHDV YNSZ/V269/2013毒株Seg-2、Seg-3 ORF区的比对和进化分析,发现该毒株和世界范围分离的EHDV-7型毒株序列相似度较高并且同在一个分支,确定为血清型7型毒株,血清中和试验也得出同样的判定结果。在进化树上该分离毒株与日本和澳大利亚的毒株共同构成了Eastern型,而美国、以色列、尼日尼亚、南非等国家的毒株聚为Western型,表明流行于中国、日本与澳大利亚的EHDV-7型毒株有着相同的起源;且中国和日本EHDV-7型毒株亲缘关系更近,它们之间可能有着共同的祖先,但随着时间推移病毒在各自的生态环境中形成了相对独立的进化分支。目前,我国与澳大利亚和日本均暂未发现分离到7型EHDV毒株的牛有明显临床症状,这也反映了EHDV-7的Eastern型和Western型毒株的差异,印证了Anthony等[19]学者的研究,EHDV-7型病毒在南非和以色列能使牛产生明显的临床症状,但同样血清型的病毒在澳大利亚和日本却不能使牛产生临床症状,这可能是因为7型的Western毒株致病性强于Eastern毒株。
本研究用EHDV C-ELISA和qRT-PCR检测了哨兵动物牛-19,5—12月采集血液中的血清抗体和核酸,并将所有病毒核酸阳性的抗凝血都接种了BHK-21细胞,但只有8月13日的样品分离到病毒。这和8月13日血液样品中病毒含量高(核酸Ct值29.6),而血清抗体水平还较低(抑制率为32%)有关。随着被感染时间的推移,血清抗体水平迅速升高,1周后(8月20日)为63%,2周后(8月27日)为77%,3周后(9月3日)上升到89%,并一直维持在80%以上至12月更换动物,而病毒核酸含量却持续减少,7周后已经检测不到核酸阳性,血液中抗体水平的升高和病毒含量的减少影响了后续血液样品病毒的分离。这提示我们,动物被EHDV感染后,在血清抗体未明显升高前更容易分离到病毒。
4 结论从云南省师宗县哨兵牛分离到的一株EHDV血清7型毒株(YNSZ/V269/2013),为我国的首次分离。毒株Seg-2、Seg-3的序列分析显示病毒属Eastern型,与日本7型毒株亲缘关系最近。自然感染YNSZ/V269/2013的牛未出现明显临床症状,感染1周后血液中病毒含量就达到最高点,3周后血清抗体水平达最高点;但血液中病毒含量减少较快,7周后已检测不到病毒核酸。研究结果为进一步开展中国EHDV-7型病毒的全基因组测序、诊断方法的建立、流行病学调查与致病性研究奠定了基础。
| [1] | MACLACHLAN N J, ZIENTARA S, SAVINI G, et al. Epizootic haemorrhagic disease[J]. Rev Sci Tech, 2015, 34(2): 341–351. DOI: 10.20506/rst.issue.34.1.58 |
| [2] | ANBALAGAN S, HAUSE B M. Characterization of epizootic hemorrhagic disease virus from a bovine with clinical disease with high nucleotide sequence identity to white-tailed deer isolates[J]. Arch Virol, 2014, 159(10): 2737–2740. DOI: 10.1007/s00705-014-2120-5 |
| [3] | SPEDICATO M, CARMINE I, TEODORI L, et al. Innocuity of a commercial live attenuated vaccine for epizootic hemorrhagic disease virus serotype 2 in late-term pregnant cows[J]. Vaccine, 2016, 34(12): 1430–1435. DOI: 10.1016/j.vaccine.2016.02.003 |
| [4] | SAVINI G, AFONSO A, MELLOR P, et al. Epizootic haemorrhagic disease[J]. Res Vet Sci, 2011, 91(1): 1–17. DOI: 10.1016/j.rvsc.2011.05.004 |
| [5] | ALBAYRAK H, OZAN E, GUR S. A serologic investigation of epizootic hemorrhagic disease virus (EHDV) in cattle and Gazella subgutturosa subgutturosa in Turkey[J]. Trop Anim Health Prod, 2010, 42(8): 1589–1591. DOI: 10.1007/s11250-010-9610-6 |
| [6] | NOON T H, WESCHE S L, CAGLE D, et al. Hemorrhagic disease in bighorn sheep in Arizona[J]. J Wildl Dis, 2002, 38(1): 172–176. DOI: 10.7589/0090-3558-38.1.172 |
| [7] | OIE. Manual of diagnostic tests and vaccines for terres. OIE terrestrial manual[S]. 2014, Chapter 2: 1-11. |
| [8] | IWATA H, CHUMA T, ROY P. Characterization of the genes encoding two of the major capsid proteins of epizootic haemorrhagic disease virus indicates a close genetic relationship to bluetongue virus[J]. J Gen Virol, 1992, 73(4): 915–924. DOI: 10.1099/0022-1317-73-4-915 |
| [9] | ANBALAGAN S, COOPER E, KLUMPER P, et al. Whole genome analysis of epizootic hemorrhagic disease virus identified limited genome constellations and preferential reassortment[J]. J Gen Virol, 2014, 95(2): 434–441. |
| [10] | MAAN N S, MAAN S, POTGIETER A C, et al. Development of real-time RT-PCR assays for detection and typing of epizootic haemorrhagic disease virus[J]. Transbound Emerg Dis, 2017, 64(4): 1120–1132. DOI: 10.1111/tbed.2017.64.issue-4 |
| [11] |
曹颖颖, 钟华, 吴健敏. 鹿流行性出血热病毒研究进展[J]. 中国兽医学报, 2017, 37(3): 571–576.
CAO Y Y, ZHONG H, WU J M. Research progress of deer epidemic hemorrhagic fever virus[J]. Chinese Journal of Veterinary Science, 2017, 37(3): 571–576. (in Chinese) |
| [12] |
张怡轩, 林俊, 曹颖颖, 等. 广西鹿流行性出血热病毒血清型调查及分布影响分析[J]. 上海畜牧兽医通讯, 2016(4): 19–21.
ZHANG Y X, LIN J, CAO Y Y, et al. Serological investigation and distribution impact analysis of epizootic hemorrhagic disease virus in Guangxi[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2016(4): 19–21. DOI: 10.3969/j.issn.1000-7725.2016.04.006 (in Chinese) |
| [13] |
和东华, 杨振兴, 高林, 等. 云南省边境地区牛流行性出血病病毒血清学调查[J]. 云南畜牧兽医, 2016(5): 7–10.
HE D H, YANG Z X, GAO L, et al. Serological investigation of epizootic hemorrhagic disease virus in border areas of Yunnan Province[J]. Yunnan Journal of Animal Science and Veterinary Medicine, 2016(5): 7–10. DOI: 10.3969/j.issn.1005-1341.2016.05.003 (in Chinese) |
| [14] |
曹颖颖, 吴健敏, 林俊, 等. 广西首例牛源鹿流行性出血热病毒的分离鉴定[J]. 中国预防兽医学报, 2015, 37(10): 746–750.
CAO Y Y, WU J M, LIN J, et al. Isolation and identification of the first case of epizootic hemorrhagic disease virus from cattle in Guangxi[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(10): 746–750. DOI: 10.3969/j.issn.1008-0589.2015.10.04 (in Chinese) |
| [15] |
吕敏娜, 朱建波, 李娟, 等. 广东一株牛源流行性出血病病毒的分离鉴定[J]. 中国预防兽医学报, 2017, 39(1): 67–70.
LV M N, ZHU J B, LI J, et al. Isolation and identification of the epizootic hemorrhagic disease virus from cattle in Guangdong[J]. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(1): 67–70. (in Chinese) |
| [16] |
朱建波, 杨振兴, 肖雷, 等. 流行性出血病多克隆抗体C-ELISA检测方法的建立[J]. 畜牧兽医学报, 2018, 49(7): 1440–1450.
ZHU J B, YANG Z X, XIAO L, et al. Establishment of a rapid competitive ELISA for detecting antibodies against epizootic haemorrhagic disease virus[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(7): 1440–1450. (in Chinese) |
| [17] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 18089-2008蓝舌病病毒分离、鉴定及血清中和抗体检测技术[S].北京: 中国标准出版社, 2008.
People's Republic of China State Administration of Quality Supervision, Inspection and Quarantine, China National Standardization Management Committee. GB/T 18089-2008 Isolation, identification and serum neutralization antibody test in Bluetongue virus[S]. Beijing: China Standard Press, 2008.(in Chinese) |
| [18] | TAMURA K, STECHER G, PETERSON D, et al. MEGA6:Molecular evolutionary genetics analysis version 6. 0[J]. Mol Biol Evol, 2013, 30(12): 2725–2729. DOI: 10.1093/molbev/mst197 |
| [19] | ANTHONY S J, MAAN N, MAAN S, et al. Genetic and phylogenetic analysis of the non-structural proteins NS1, NS2 and NS3 of epizootic haemorrhagic disease virus (EHDV)[J]. Virus Res, 2009, 145(2): 211–219. DOI: 10.1016/j.virusres.2009.07.019 |
| [20] | SHIRAFUJI H, KATO T, YAMAKAWA M, et al. Characterization of genome segments 2, 3 and 6 of epizootic hemorrhagic disease virus strains isolated in Japan in 1985-2013:Identification of their serotypes and geographical genetic types[J]. Infect Genet Evol, 2017, 53: 38–46. DOI: 10.1016/j.meegid.2017.05.010 |
| [21] | FORZAN M, PIZZURRO F, ZACCARIA G, et al. Competitive enzyme-linked immunosorbent assay using baculovirus-expressed VP7 for detection of epizootic haemorrhagic disease virus (EHDV) antibodies[J]. J Virol Methods, 2017, 284: 212–216. |
| [22] | LEI W W, GUO X F, FU S H, et al. Isolation of Tibet orbivirus, TIBOV, from Culicoides collected in Yunnan, China[J]. PLoS One, 2015, 10(8): e0136257. DOI: 10.1371/journal.pone.0136257 |
| [23] | WANG J L, LI H C, HE Y W, et al. Isolation and genetic characterization of Mangshi Virus:a newly discovered seadornavirus of the reoviridae family found in Yunnan Province, China[J]. PLoS One, 2015, 10(12): e0143601. DOI: 10.1371/journal.pone.0143601 |



