2. 农业部动物疾病临床诊疗技术重点实验室, 呼和浩特 010018
2. Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease of Ministry of Agriculture, Hohhot 010018, China
酵母菌是一种益生菌,酵母菌细胞内的多种生物活性物质在被作为营养物质吸收的同时还可以促进机体的免疫反应。有研究表明,给绵羊饲喂含有益生性酿酒酵母菌的饲料后,同时提高了机体的体液免疫和细胞免疫功能[1]。反刍动物摄入益生性酵母菌后可有效改善瘤胃菌群结构和瘤胃内环境、防止奶牛酸中毒等[2-3]作用。目前酵母菌作为蛋白质补充剂,其应用己广泛涉及到诸多畜牧业领域,益生性酵母菌已然成为牲畜饲料添加剂中不可或缺的一员。
抗微生物肽是参与宿主机体抵御病原体入侵的一种小分子多肽,防御素作为广泛分布于动物和植物界的一类富含半胱氨酸的阳离子内源性抗微生物肽, 是内源性抗微生物肽中的一个大家族。依据防御素分子内半胱氨酸的位置和连接方式可将哺乳动物防御素分为α-防御素、β-防御素、θ-防御素[4]。其中β-防御素广泛分布于禽类、人、鼠、牛、羊、猪、狗的多种器官上皮组织内[5-6]。目前,在绵羊体内鉴定出两种β-防御素,即SBD-1、SBD-2[7],通过qPCR检测SBD-2 mRNA只表达于舌及远端回肠,而气管和整个消化道(舌到结肠)都有SBD-1 mRNA表达,并且在绵羊瘤胃中SBD-1 mRNA的表达量较多[8]。由此猜想,β-防御素是绵羊瘤胃天然免疫的重要部分。β-防御素具有独特的抗菌机制和广谱抗菌、抗病毒活性,同时还可以作为免疫调节剂来激活与调节机体的免疫系统,是生物体天然免疫的重要成员[9-10]。对于致病因子诱导机体产生β-防御素的研究有很多[11-13],但益生菌诱导生物产生防御素的研究较少,2013年李砚[14]研究发现,植物乳杆菌能够诱导绵羊瘤胃上皮细胞内β-防御素-1(SBD-1)基因的表达。2015年王佩等[15]用枯草芽孢杆菌影响了绵羊瘤胃上皮细胞SBD-1的表达。2018年,Jin等[16]用益生性酿酒酵母菌诱导SBD-1的表达,发现酿酒酵母菌能够显著上调绵羊瘤胃上皮细胞SBD-1的表达。
到目前为止,关于通过用益生性酿酒酵母菌及其灭活菌诱导绵羊瘤胃外植体产生β-防御素的研究尚未见相关报道,而使用绵羊瘤胃外植体为研究对象相较体外培养的细胞更能模拟体内环境。因此,本研究采用qPCR技术和ELISA试验检测酿酒酵母菌及其灭活菌在不同浓度、不同时间段刺激诱导体外培养的绵羊瘤胃外植体中SBD-1 mRNA和蛋白的表达变化,为从益生菌与动物外植体抗菌肽表达关系的新角度解析防御素发挥免疫作用的新途径和机制提供一定的基础及依据。
1 材料与方法 1.1 试验动物由呼和浩特市北亚清真屠宰场挑选健康状况良好的绵羊,屠宰后立即剪取瘤胃内面乳头密集处组织块,用生理盐水冲洗干净后放入磷酸盐缓冲液(PBS)中,低温保存备用。
1.2 供试菌株酿酒酵母菌(Saccharomyces cerevisiae)由内蒙古农业大学兽医学院微生物实验室购于中国微生物菌种网(编号:CGMCC2.161)。
1.3 主要试剂及仪器设备主要试剂:DMEM/F12培养基(Hyclone)、RNA Fast200总RNA极速抽提试剂盒(上海飞捷)、Prime Script RT Reagent Kit with gDNA Eraser(DRR047A)(TaKaRa)、SYBR Premix Ex TaqTMⅡ(DRR820A)(TaKaRa)、绵羊防御素β1(DEFβ1)ELISA检测试剂盒(武汉新启迪)等。
仪器设备:二氧化碳培养箱(Thermo,美国)、倒置相差显微镜(Olympus,日本)、实时荧光定量PCR仪(ViiA7,ABI,美国)、Synergy H4 Hybrid酶标仪(BioTek Inc.,Winooski,VT,美国)。
1.4 试验方法 1.4.1 酿酒酵母菌的培养酿酒酵母菌冻干粉于-80 ℃保存,使用时接种于麦芽汁培养基,30 ℃、180 r·min-1有氧培养48 h,活化并纯化,纯化完成的酿酒酵母菌一部分4 ℃保存,少量菌液连续倍比稀释,并涂布于无菌的麦芽汁琼脂平板中,30 ℃培养48 h后进行菌落计数,以确定菌液浓度,用于后续试验。
1.4.2 酿酒酵母菌的灭活确定菌液浓度后将保存于4 ℃的酿酒酵母菌分装于锥形瓶中,121 ℃高压30 min使其失活。再用一定量的灭活菌液涂布于无菌的麦芽汁琼脂平板上,30 ℃培养48 h无酿酒酵母菌菌落生成,即菌液灭活成功。
1.4.3 绵羊瘤胃外植体的培养参考了其他外植体培养方案[17]建立了绵羊瘤胃外植体的培养方法。将取来的绵羊瘤胃外植体用生理盐水洗去瘤胃内容物,钝性分离肌层和浆膜层。用含抗生素的磷酸盐缓冲液(PBS内含1 mg·mL-1青霉素、500 μg·mL-1链霉素、100 μg·mL-1庆大霉素、50 μg·mL-1两性霉素)洗涤外植体3~4次,洗至外植体表面无杂物,再用剪刀镊子将外植体分割成1 cm×0.5 cm的小块若干。将小块放入12孔细胞培养板中,每孔放4块外植体小块,孔内加入2.5 mL液体培养基(内含:200 μg·mL-1青霉素、100 μg·mL-1链霉素、50 μg·mL-1庆大霉素、25 μg·mL-1两性霉素、2 μg·mL-1胰岛素-转铁蛋白-硒添加剂的DMEM/F12液体培养基),并且以0 h作为空白对照组,取培养24、48 h外植体做H.E染色,评估外植体结构完整度。
1.4.4 酿酒酵母菌及其灭活菌对绵羊瘤胃外植体的刺激试验将在细胞培养箱中稳定1 h的外植体用PBS洗涤3次,在每孔中加入900 μL DMEM/F12培养基,再分别加入酿酒酵母菌及其灭活菌(菌液浓度为104、105、106、107、108、109 CFU·mL-1)100 μL刺激2 h,同时设置未刺激组为空白对照组。弃去培养板孔内液体,再用PBS洗涤绵羊瘤胃外植体5次以上,每孔重新加入1.5 mL DMEM/F12培养基,继续诱导培养2、4、8、12、16、20、24 h后, 分别将外植体及培养上清液冻存,用于后续试验。同时设置平行试验组用于酿酒酵母菌及其灭活菌对外植体的毒性检测。
1.4.5 MTT法检测酿酒酵母菌及其灭活菌对绵羊瘤胃外植体毒性将用不同浓度的酿酒酵母菌及其灭活菌(104、105、106、107、108、109 CFU·mL-1)刺激2 h后继续诱导培养2、4、8、12、16、20、24 h的试验组与空白对照组绵羊瘤胃外植体用PBS洗涤5次以上,再加入含有MTT(250 mg·mL-1)的DMEM/F12培养基,于37 ℃培养箱中培养4 h,使得甲瓒在外植体内沉积。将外植体取出再放入甲醇中浸没使甲瓒析出。通过Synergy H4 Hybrid酶标仪(BioTek Inc.,Winooski,VT,USA)将570 nm的甲瓒光密度除以外植体干重来确定其活力。不同菌液浓度与不同培养时间的外植体活力是其与空白对照比较所确定的。
1.4.6 绵羊瘤胃外植体总RNA的提取、反转录以及qPCR技术检测SBD-1 mRNA相对表达量采用FAST200试剂盒,按其说明书进行操作得到总RNA,-80 ℃保存备用。使用反转录试剂盒(RR047A),按其说明书将提取的总RNA进行反转录反应。37 ℃ 15 min,85 ℃ 5 s,将得到的cDNA于-20 ℃保存备用。根据GenBank公布的SBD-1基因和管家基因β-actin序列,用DNAStar软件设计引物,引物序列见表 1,并由上海生物工程公司合成。
|
|
表 1 qPCR引物序列 Table 1 The primer sequences for real-time PCR |
以反转录得到的cDNA为模板,进行qPCR反应检测外植体内SBD-1 mRNA的相对表达量。每个样品的目的基因和β-actin基因分别做5个重复。反应结束后,将qPCR得到的SBD-1和β-actin基因的Ct值,根据公式2-ΔCt[18]求出添加不同浓度酿酒酵母菌对绵羊瘤胃外植体内SBD-1的相对表达量。
1.4.7 ELISA试验检测共培养上清中SBD-1蛋白的表达及标准曲线的绘制收集对照组和不同浓度酿酒酵母菌及其灭活菌刺激诱导绵羊瘤胃外植体2、4、8、12、16、20、24 h后的共培养上清,采用绵羊防御素β1(DEFβ1)ELISA试剂盒,按照说明进行操作,再通过多功能酶标仪测定各样品OD值(450 nm)。运用Curve expert 1.4软件以标准品浓度作横坐标,OD值(450 nm)作纵坐标,用平滑线连接各标准品的坐标点,绘制标准曲线,得到二次多项式拟合方程。
1.4.8 统计分析结果用“平均值±标准差”表示,P < 0.01和P < 0.05分别表示差异极显著和显著水平,试验在同一批次外植体内重复5次,数据采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA)和邓肯氏法(Duncan)多重比较。
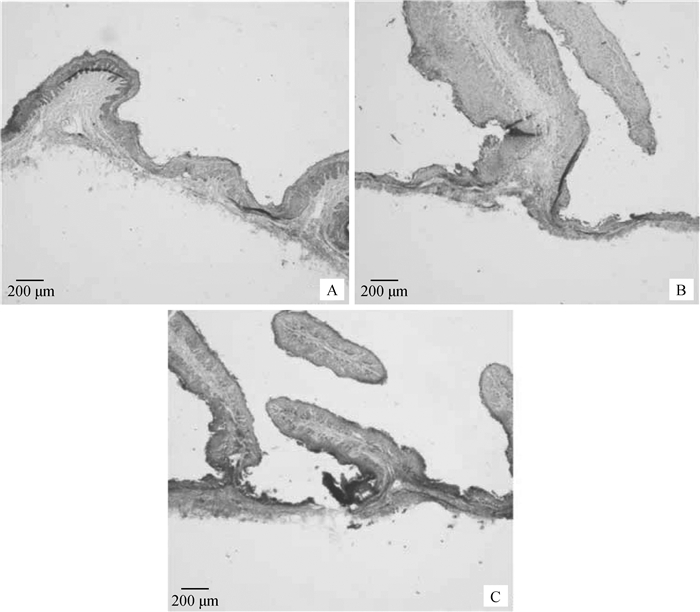
2 结果 2.1 组织形态学观察绵羊瘤胃外植体结构完整度以0 h作为空白对照组,取培养24、48 h外植体做H.E染色评估绵羊瘤胃外植体结构完整度,H.E染色结果(图 1)表明,培养24 h外植体与培养0 h的对照组镜下观察对比其组织结构完整,瘤胃乳头基本无脱落现象,而培养48 h的外植体瘤胃乳头部分脱落,并且组织出现断裂部分。
|
A.0 h;B.24 h;C.48 h 图 1 培养不同时间绵羊瘤胃外植体H.E染色结果 Fig. 1 H.E staining results of rumen explants in sheep at different culture times |
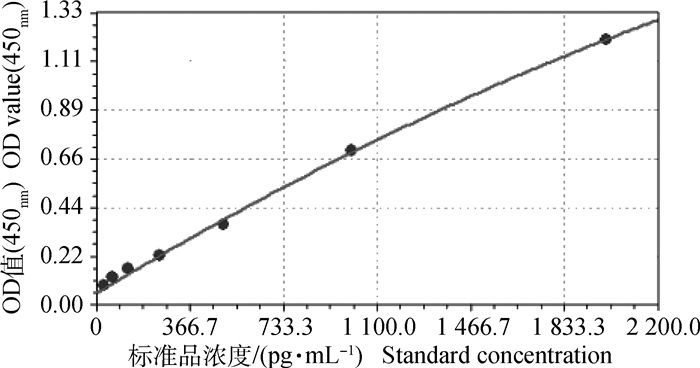
标准曲线的二次多项式拟合方程为y=a+bx+cx2(其中,a=5.508×10-2,b=7.019×10-4,c=-6.276×10-8),相关系数r=0.997 899 23,标准差s = 0.096 0,样品浓度可以利用此标准曲线计算(图 2)。
|
图 2 ELISA试验标准曲线 Fig. 2 ELISA test standard curve |
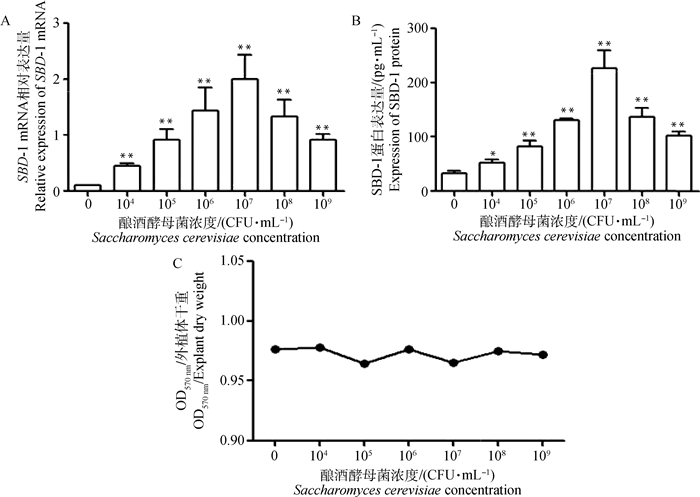
通过qPCR及ELISA试验方法检测不同浓度酿酒酵母菌刺激诱导24 h的绵羊瘤胃外植体SBD-1 mRNA转录水平和蛋白表达。qPCR结果显示,各浓度酿酒酵母菌(104、105、106、107、108、109CFU·mL-1)刺激诱导绵羊瘤胃外植体均能上调SBD-1 mRNA的表达,且均极显著高于对照组(P < 0.01,图 3A)。随着菌液浓度的增加,SBD-1 mRNA呈现先升高后降低的趋势,并在浓度为107CFU·mL-1时达到峰值。ELISA检测结果显示,SBD-1在蛋白水平的表达趋势与在mRNA水平的表达趋势基本一致。酿酒酵母菌浓度为104 CFU·mL-1时蛋白表达情况显著高于对照组(P < 0.05),浓度为105、106、107、108、109CFU·mL-1时蛋白表达极显著高于对照组(P < 0.01,图 3B),在菌液浓度为107 CFU·mL-1时蛋白表达达到峰值。MTT法检测不同浓度酿酒酵母菌对绵羊瘤胃外植体活力的影响,结果显示,各浓度菌液与对照组相比数值相近(图 3C),说明各浓度菌液对绵羊瘤胃外植体活力几乎无影响。所以在浓度为107CFU·mL-1的酿酒酵母菌刺激诱导绵羊瘤胃外植体以后,SBD-1 mRNA及蛋白的表达量达到最大。
|
A.不同浓度酿酒酵母菌对SBD-1 mRNA转录的影响;B.不同浓度酿酒酵母菌对SBD-1蛋白表达的影响;C.不同浓度酿酒酵母菌对外植体活力的影响。*P < 0.05;**P < 0.01,下同 A. Effects of different concentrations of Saccharomyces cerevisiae on SBD-1 mRNA transcription; B.Effects of different concentrations of Saccharomyces cerevisiae on SBD-1 protein expression; C.Effects of different concentrations of Saccharomyces cerevisiae on the activity of rumen explants. *P < 0.05;**P < 0.01, the same as below 图 3 不同浓度酿酒酵母菌对瘤胃外植体SBD-1表达的影响(x±s) Fig. 3 Effects of different concentrations of Saccharomyces cerevisiae on SBD-1 expression in rumen explants (x±s) |
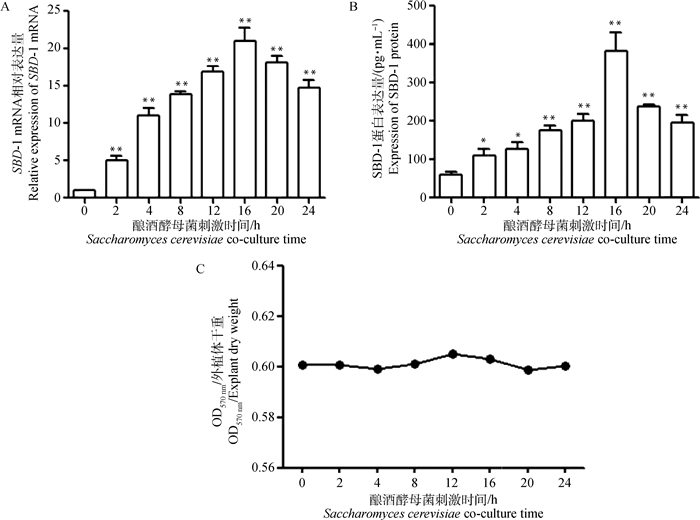
用SBD-1表达量最大时的酿酒酵母菌浓度(107 CFU·mL-1)分别刺激绵羊瘤胃外植体2 h后诱导培养2、4、8、12、16、20、24 h,同时设置未刺激组作为空白对照。利用qPCR和ELISA对SBD-1的表达变化进行检测,结果如图 4所示。qPCR结果显示,酿酒酵母菌刺激绵羊瘤胃外植体完成后,诱导培养各时间段(2、4、8、12、16、20、24 h)与空白组对比均能极显著增加SBD-1 mRNA的表达,随着诱导时间的延长SBD-1 mRNA呈现先升高后降低的趋势,当诱导16 h时SBD-1 mRNA表达量达到最大(P < 0.01,图 4A)。ELISA结果显示,诱导2和4 h外植体SBD-1蛋白表达量与对照组相比差异显著(P < 0.05),此后8~24 h差异极显著(P < 0.01),且诱导时间为16 h时SBD-1蛋白表达量达到最大(图 4B)。同时MTT结果显示,酿酒酵母菌刺激诱导绵羊瘤胃外植体不同时间后其外植体活力与未刺激组相比差异不明显,说明刺激诱导后的绵羊瘤胃外植体均存活(图 4C)。因此,浓度为107 CFU·mL-1酿酒酵母菌刺激诱导绵羊瘤胃外植体16 h时,SBD-1 mRNA及蛋白的表达量达到最大。
|
A.酿酒酵母菌刺激不同时间对SBD-1 mRNA转录的影响;B.酿酒酵母菌刺激不同时间对SBD-1蛋白表达的影响;C.酿酒酵母菌刺激不同时间对外植体活力的影响 A. Effects of Saccharomyces cerevisiae stimulating for different times on SBD-1 mRNA transcription; B. Effects of Saccharomyces cerevisiae stimulating for different times on SBD-1 protein expression; C. Effects of Saccharomyces cerevisiae stimulating for different times on the activity of rumen explants 图 4 酿酒酵母菌刺激瘤胃外植体不同时间后对SBD-1表达的影响(x±s) Fig. 4 Effects of Saccharomyces cerevisiae stimulating for different times on SBD-1 expression in rumen explants (x±s) |
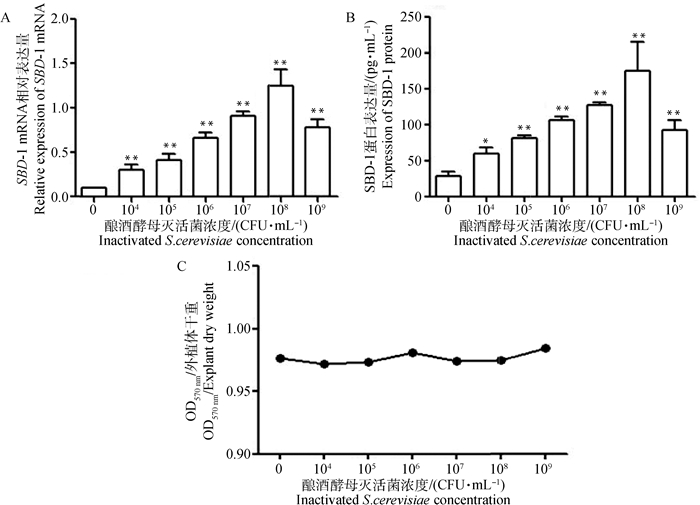
利用qPCR及ELISA试验方法,检测不同浓度酿酒酵母灭活菌刺激2 h后诱导培养24 h的绵羊瘤胃外植体SBD-1表达变化情况。qPCR结果显示,不同浓度酿酒酵母灭活菌刺激诱导绵羊瘤胃外植体均能上调SBD-1 mRNA的表达,随着菌液浓度的增加,SBD-1 mRNA从104CFU·mL-1逐渐升高,当菌液浓度增大为108CFU·mL-1时表达量达到最大,此后SBD-1 mRNA表达量开始降低。各浓度组(104、105、106、107、108、109CFU·mL-1)与空白对照组相比,SBD-1 mRNA表达差异均极显著(P < 0.01,图 5A)。ELISA结果显示,SBD-1在蛋白水平的表达趋势与在mRNA水平的表达趋势基本一致。酿酒酵母灭活菌浓度为104 CFU·mL-1时蛋白表达情况显著高于对照组(P < 0.05),浓度为105、106、107、108、109 CFU·mL-1时蛋白表达极显著高于对照组(P < 0.01),在菌液浓度为108 CFU·mL-1时蛋白表达量最大(图 5B)。常规MTT法检测绵羊瘤胃外植体活力,结果显示,各浓度酿酒酵母灭活菌液与对照组相比无明显变化(图 5C),说明绵羊瘤胃外植体在各浓度酿酒酵母灭活菌液刺激诱导下依然存活。得出结论,在浓度为108 CFU·mL-1的酿酒酵母灭活菌对外植体刺激诱导后,SBD-1 mRNA及蛋白的表达量达到最大。
|
A.不同浓度酿酒酵母灭活菌对SBD-1 mRNA转录的影响;B.不同浓度酿酒酵母灭活菌对SBD-1蛋白表达的影响;C.不同浓度酿酒酵母灭活菌对瘤胃外植体活力的影响 A. Effects of different concentrations of inactivated Saccharomyces cerevisiae on SBD-1 mRNA transcription; B. Effects of different concentrations of inactivated Saccharomyces cerevisiae on the expression of SBD-1 protein; C. Effects of different concentrations of inactivated Saccharomyces cerevisiae on the activity of rumen explants 图 5 不同浓度酿酒酵母灭活菌对瘤胃外植体SBD-1表达的影响(x±s) Fig. 5 Effects of different concentrations of inactivated Saccharomyces cerevisiae on SBD-1 expression in rumen explants (x±s) |
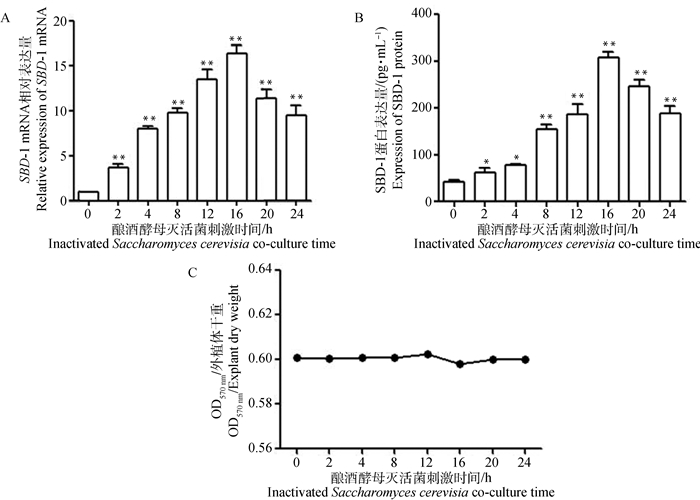
用SBD-1表达量最大时的酿酒酵母灭活菌浓度(108 CFU·mL-1)刺激绵羊瘤胃外植体2 h后分别诱导培养2、4、8、12、16、20、24 h,设置未刺激组为对照组。利用qPCR和ELISA试验对SBD-1的表达变化进行检测,结果如图 6所示。qPCR结果显示,酿酒酵母灭活菌刺激2 h后,诱导培养绵羊瘤胃外植体各时间段(2、4、8、12、16、20、24 h)均使得SBD-1 mRNA表达量增加,均极显著高于对照组(P < 0.01)。随时间的增长SBD-1 mRNA呈现先升高后降低的趋势,当诱导16 h时SBD-1 mRNA表达量达到最大(图 6A)。ELISA结果显示,诱导2、4 h的外植体SBD-1蛋白表达量与对照组相比差异显著(P < 0.05),此后诱导8、12、16、20、24 h时外植体SBD-1的蛋白表达量与对照组相比差异极显著(P < 0.01),且诱导时间为16 h时SBD-1外植体蛋白表达量达到最大(图 6B)。MTT结果显示,酿酒酵母灭活菌刺激诱导绵羊瘤胃外植体不同时间后与未刺激组相比无明显变化,说明刺激诱导完成后的绵羊瘤胃外植体均存活(图 6C)。因此得出结论,浓度为108 CFU·mL-1酿酒酵母灭活菌刺激诱导绵羊瘤胃外植体16 h时,SBD-1 mRNA及蛋白的表达量达到最大。
|
A.酿酒酵母灭活菌刺激不同时间对SBD-1 mRNA转录的影响;B.酿酒酵母灭活菌刺激不同时间对SBD-1蛋白表达的影响;C.酿酒酵母灭活菌刺激不同时间对外植体活力的影响 A. Effects of inactivated Saccharomyces cerevisiae stimulating for different times on SBD-1 mRNA transcription; B. Effects of inactivated Saccharomyces cerevisiae stimulating for different times on SBD-1 protein expression; C. Effects of inactivated Saccharomyces cerevisiae stimulating for different times on the activity of rumen explants 图 6 酿酒酵母灭活菌刺激瘤胃外植体不同时间后对SBD-1表达的影响(x±s) Fig. 6 Effects of inactivated Saccharomyces cerevisiae stimulating for different times on SBD-1 expression in rumen explants(x±s) |
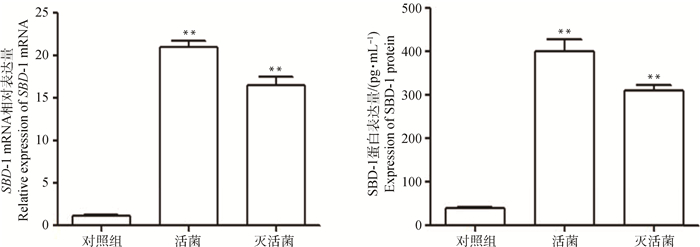
分析比较酿酒酵母活菌及其灭活菌、空白对照组之间SBD-1 mRNA与培养上清液中蛋白表达情况发现,在最佳诱导条件下用活菌及其灭活菌刺激绵羊瘤胃外植体,与对照组相比产生SBD-1 mRNA的相对表达量及培养上清液中SBD-1蛋白的含量均极显著上调(P<0.01),且活菌组高于灭活菌组(图 7)。
|
A.最适条件下酿酒酵母菌及其灭活菌对SBD-1 mRNA转录影响的比较;B.最适条件下酿酒酵母菌及其灭活菌对SBD-1蛋白表达影响的比较 A.Comparison of the effects of Saccharomyces cerevisiae and inactivated Saccharomyces cerevisiae on SBD-1 mRNA transcription under the optimal conditions; B.Comparison of the effects of Saccharomyces cerevisiae and inactivated Saccharomyces cerevisiae on the expression of SBD-1 protein under the optimal conditions 图 7 酿酒酵母菌、灭活菌对SBD-1表达的影响(x±s) Fig. 7 Effects of Saccharomyces cerevisiae and inactivated Saccharomyces cerevisiae on the expression of SBD-1(x±s) |
自然界存在着丰富多样的微生物,其中病原微生物无时无刻不威胁着其他物种的生命。多细胞生物为了抵御病原微生物的侵袭,逐渐进化出了一套完善的免疫防御体系,其中就有一类近年来引起许多学者广泛关注的阳离子内源性抗微生物肽——防御素。防御素拥有独特的作用机制、广谱的抗菌能力和不易使生物产生抗性等诸多优点,能为今后抗菌药物的发展提供新的方向[19-20]。
目前,诱导机体产生防御素的研究大部分以体外培养细胞作为研究对象[21],本试验使用体外培养的绵羊瘤胃外植体为研究对象,能够尽可能模拟绵羊瘤胃的体内环境,相较进行绵羊活体试验能够更加准确细微的阐明,不同浓度及诱导不同时间的益生性酿酒酵母菌及其灭活菌在体内对绵羊瘤胃所带来的影响,而且试验成本更为低廉。此外,益生菌在绵羊体内产生作用会受到多种因素影响,比如胃肠道内的消化酶、胆汁和pH环境等均会影响益生菌的活力和细胞壁组分的完整性。综合上述因素,使用绵羊瘤胃外植体为试验对象将会使得试验不可控因素减少,试验结果更有可信度。2016年Costa等[17]体外培养了猪结肠外植体,并做H.E染色以评估组织完整度,结果表明,培养了0~5 d的猪结肠外植体结构完整,上皮覆盖率达到50%以上,6~9 d的猪结肠外植体组织结构不完整,外植体已经失去猪结肠的基本结构,不具有培养意义。本试验为了保证体外培养外植体的完整度,进行了对不同培养时间的外植体组织形态学观察以评估其组织完整性。从结果上来看,培养24 h外植体与培养0 h的对照组镜下观察对比其组织结构完整,瘤胃乳头无脱落现象,而培养48 h的瘤胃外植体组织结构松散,瘤胃乳头部分脱落。因此确定体外培养绵羊瘤胃外植体24 h以内其结构是完整的,能够用于刺激诱导试验。
大量研究表明,防御素是生物抵御外来微生物入侵的重要物质,防御素的表达受多种因素调控。对于诱导机体产生防御素的研究多数侧重于对生物有害的病原微生物[11-13],近年来益生菌影响生物体防御素的表达变化成为微生物诱导防御素表达的热点问题。早期有关这方面的研究所采用的研究对象并非处于正常生理状态下的组织或细胞[22],在这种特殊情况下得出的结论存在一定的局限性,无法为诱导正常组织或细胞的试验做强有力的理论支撑。随着科技的发展,研究人员开始采用正常生理状态下的组织或细胞作为研究对象。2012年,黎观红等[23]发现,用菌液浓度为2×106 CFU·mL-1的鼠李糖乳酸杆菌LGA对体外培养的鸡小肠上皮细胞刺激12 h,表达量达到峰值,使用相同浓度的活菌与热灭活菌刺激鸡小肠上皮细胞相同时间,活菌与灭活菌均上调β-防御素-9 mRNA表达,但灭活菌上调值显著高于活菌。2016年范燕茹等[24]用干酪乳杆菌与植物乳杆菌两种益生菌活菌及其灭活菌刺激诱导绵羊瘤胃上皮细胞,检测SBD-1 mRNA和蛋白水平发现,两种益生菌均能显著上调SBD-1的表达,植物乳杆菌的效果要强于干酪乳杆菌。活菌组SBD-1的表达情况显著高于灭活菌组及培养上清液组。2018年Jin等[16]用益生性酿酒酵母活菌刺激诱导绵羊瘤胃上皮细胞,通过qPCR及ELISA试验检测SBD-1的表达情况发现,菌液浓度为107 CFU·mL-1刺激诱导12 h时SBD-1表达量达到最大。本试验研究结果与上述研究结果基本吻合,结果均呈现剂量-时间依赖关系,随着菌液浓度升高与诱导时间延长,SBD-1的表达为先升高后降低的趋势,其中达到峰值的作用剂量、作用时间、SBD-1 mRNA及培养上清液中蛋白的相对表达量不同可能是因为研究对象不同所造成的。通过对比活菌组与灭活菌组SBD-1的相对表达量发现,活菌组的表达量要显著高于灭活菌组,这与范燕茹等[24]研究结果类似,而与黎观红等[23]研究结果相反,由此推断可能是不同菌种诱导的有效成分不同所导致的。
研究发现,益生菌细胞壁是影响生物免疫系统的主要成份[25],酿酒酵母菌细胞壁含有葡聚糖、甘露聚糖、蛋白质、脂肪、几丁质和无机盐等成分[26]。酵母葡聚糖为非特异性免疫刺激多糖,能特异性结合机体的免疫细胞受体来调节机体免疫[27]。甘露聚糖是干扰肠道病原体定植的有效成分,能够促进有益菌的生长并抑制有害细菌的繁殖,对改善动物胃肠道内环境有着至关重要的作用[28-29]。几丁质又称壳多糖,其结构与多糖相似。高温灭活酿酒酵母菌会将多糖结构破坏,成为低聚糖或寡糖,使蛋白质变性失活,脂肪分子高温氧化,细胞壁结构也会发生改变,则酿酒酵母灭活菌起诱导作用的是高温灭活后的产物,致使诱导效果低于活菌,具体的诱导成分需要继续探究。本试验采用绵羊瘤胃外植体为研究对象虽然能尽可能的模拟动物的体内环境,但是与给予绵羊直接饲喂含有益生性酿酒酵母活菌及其灭活菌以检测SBD-1在瘤胃中的表达情况有所不同。如何排除绵羊本身的差异及其胃肠道内环境对益生菌的影响和益生性酿酒酵母菌及其灭活菌刺激诱导绵羊瘤胃外植体具体的调控机制等问题还有待探究。
4 结论益生性酿酒酵母菌及其灭活菌能够促进绵羊瘤胃外植体SBD-1的表达,并且表达量与酿酒酵母菌是否失活、刺激浓度和诱导时间有关。当酿酒酵母菌浓度为107 CFU·mL-1、灭活菌浓度为108 CFU·mL-1分别诱导16 h时,绵羊瘤胃外植体内的SBD-1 mRNA及蛋白的表达量分别达到最大,并且益生性酿酒酵母菌的诱导效果高于其灭活菌。
| [1] | MALACZEWSKA J, MILEWSKI S. Immunomodulating effect of Inter Yeast S on the non-specific and specific cellular and humoral immunity in lambs[J]. Pol J Vet Sci, 2010, 13(1): 163–170. |
| [2] | PÉREZ-RUCHEL A, REPETTO J L, CAJARUILLE C. Suitability of live yeast addition to alleviate the adverse effects due to the restriction of the time of access to feed in sheep fed only pasture[J]. J Anim Physiol Anim Nutr (Berl), 2013, 97(6): 1043–1050. DOI: 10.1111/jpn.2013.97.issue-6 |
| [3] | GUEDES C M, GONÇALVES D, RODRIGUES M A M, et al. Effects of a Saccharomyces cerevisiae yeast on ruminal fermentation and fibre degradation of maize silages in cows[J]. Anim Feed Sci Technol, 2008, 145(1-4): 27–40. DOI: 10.1016/j.anifeedsci.2007.06.037 |
| [4] |
陈惠娴, 毛若雨, 滕达, 等. 二硫键及其连接方式对防御素抗菌功能的影响研究进展[J]. 生物技术通报, 2016, 32(9): 32–37.
CHEN H X, MAO R Y, TENG D, et al. Review on effects of disulfide bond and its connection on antimicrobial activity in defensins[J]. Biotechnology Bulletin, 2016, 32(9): 32–37. (in Chinese) |
| [5] | ZHAO P W, CAO G F. Production of bioactive sheep β-defensin-1 in Pichia pastoris[J]. J Ind Microbiol Biotechnol, 2012, 39(1): 11–17. |
| [6] | XIAO Y J, HUGHES A L, ANDO J, et al. A genome-wide screen identifies a single β-defensin gene cluster in the chicken: implications for the origin and evolution of mammalian defensins[J]. BMC Genomics, 2004, 5(1): 56. DOI: 10.1186/1471-2164-5-56 |
| [7] | MONTELEONE G, CALASCIBETTA D, SCATURROM, et al. Polymorphisms of β-defensin genes in Valle del Belice dairy sheep[J]. Mol Biol Rep, 2011, 38(8): 5405–5412. DOI: 10.1007/s11033-011-0694-5 |
| [8] |
李砚, 杨银凤. 家畜体内防御素多态性和表达的研究进展[J]. 中国畜牧兽医, 2013, 40(3): 160–168.
LI Y, YANG Y F. Research progress of polymorphism and expression of defensins in vivo of livestock[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(3): 160–168. DOI: 10.3969/j.issn.1671-7236.2013.03.036 (in Chinese) |
| [9] |
黎观红, 洪智敏, 贾永杰, 等. 抗菌肽的抗菌作用及其机制[J]. 动物营养学报, 2011, 23(4): 546–555.
LI G H, HONG Z M, JIA Y J, et al. Activities and mechanisms of action of antimicrobial peptides[J]. Chinese Journal of Animal Nutrition, 2011, 23(4): 546–555. DOI: 10.3969/j.issn.1006-267x.2011.04.004 (in Chinese) |
| [10] | SEMPLE F, DORIN J R. β-defensins:multifunctional modulators of infection, inflammation and more?[J]. J Innate Immun, 2012, 4(4): 337–348. DOI: 10.1159/000336619 |
| [11] | DASGUPTA T, NWEZE E I, YUE H, et al. Human papillomavirus oncogenic E6 protein regulates human β-defensin 3 (hBD3) expression via the tumor suppressor protein p53[J]. Oncotarget, 2016, 7(19): 27430–27444. |
| [12] | CORLEIS B, LISANTI A C, KÖRNER C, et al. Early type I Interferon response induces upregulation of human β-defensin 1 during acute HIV-1 infection[J]. PLoS One, 2017, 12(3): e0173161. DOI: 10.1371/journal.pone.0173161 |
| [13] | RYAN L K, DAI J H, YIN Z W, et al. Modulation of human β-defensin-1 (hBD-1) in plasmacytoid dendritic cells (PDC), monocytes, and epithelial cells by influenza virus, Herpes simplex virus, and Sendai virus and its possible role in innate immunity[J]. J Leukoc Biol, 2011, 90(2): 343–356. DOI: 10.1189/jlb.0209079 |
| [14] |
李砚.植物乳杆菌对绵羊瘤胃上皮细胞内SBD-1基因表达的影响[D].内蒙古: 内蒙古农业大学, 2013.
LI Y.Effect of Lactobacillus plantarum on the expression of SBD-1 gene in rumen epithelial cells of sheep[D]. Inner Mongolia: Inner Mongolia Agricultural University, 2013.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10129-1013246424.htm |
| [15] |
王佩, 范燕茹, 金鑫, 等. 枯草芽孢杆菌对绵羊瘤胃上皮细胞β-防御素-1表达的影响[J]. 畜牧兽医学报, 2015, 46(5): 760–767.
WANG P, FAN Y R, JIN X, et al. Effects of Bacillus subtilis on the expression of SBD-1 in cultured ruminal epithelial cells of sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(5): 760–767. (in Chinese) |
| [16] | JIN X, ZHANG M, ZHU X M, et al. Modulation of ovine SBD-1 expression by Saccharomyces cerevisiae in ovine ruminal epithelial cells[J]. BMC Vet Res, 2018, 14(1): 134. DOI: 10.1186/s12917-018-1445-9 |
| [17] | COSTA M O, HARDING J C, HILL J E. Development and evaluation of a porcine in vitro colon organ culture technique[J]. in vitro Cell Dev Biol Anim, 2016, 52(9): 942–952. DOI: 10.1007/s11626-016-0060-y |
| [18] | SCHMITTGEN T D, ZAKRAJSEK B A. Effect of experimental treatment on housekeeping gene expression:validation by real-time, quantitative RT-PCR[J]. J Biochem Biophysical Methods, 2000, 46(1-2): 69–81. DOI: 10.1016/S0165-022X(00)00129-9 |
| [19] | NAVA G M, ESCORCIA M, CASTAÑEDA M P.Molecular diversity of the antimicrobial domain of Beta-defensin 3 and homologous peptides[J]. Comp Funct Genomics, 2009, 2009: Article ID 983636. |
| [20] | WANG S, ZENG X F, YANG Q, et al. Antimicrobial peptides as potential alternatives to antibiotics in food animal industry[J]. Int J Mol Sci, 2016, 17(5): 603. DOI: 10.3390/ijms17050603 |
| [21] |
田巧珍, 金鑫, 张曼, 等. 酿酒酵母细胞壁诱导体外培养绵羊瘤胃上皮细胞表达SBD-1的研究[J]. 畜牧兽医学报, 2018, 49(5): 927–934.
TIAN Q Z, JIN X, ZHANG M, et al. Effects of cell wall of Saccharomyces cerevisiae on the expression of SBD-1 in cultured ruminal epithelial cells of sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 927–934. (in Chinese) |
| [22] | SCHLEE M, HARDER J, KÖTEN B, et al. Probiotic lactobacilli and VSL#3 induce enterocyte β-defensin 2[J]. Clin Exp Immunol, 2008, 151(3): 528–535. DOI: 10.1111/(ISSN)1365-2249 |
| [23] |
黎观红, 洪智敏, 贾永杰, 等. 鼠李糖乳酸杆菌LGA对鸡小肠上皮细胞β-防御素-9基因表达的影响[J]. 畜牧兽医学报, 2012, 43(4): 634–641.
LI G H, HONG Z M, JIA Y J, et al. Effect of Lactobacillus rhamnosus LGA on β-defensin 9 expression in cultured chicken small intestinal epithelial cells[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(4): 634–641. (in Chinese) |
| [24] |
范燕茹, 王佩, 金鑫, 等. 乳酸杆菌诱导绵羊瘤胃上皮细胞内SBD-1的表达[J]. 中国兽医学报, 2016, 36(4): 604–612.
FAN Y R, WANG P, JIN X, et al. The expression of SBD-1 in the rumen epithelium cells of sheep induced by lactobacillus[J]. Chinese Journal of Veterinary Science, 2016, 36(4): 604–612. (in Chinese) |
| [25] | OELSCHLAEGER T A. Mechanisms of probiotic actions-A review[J]. Int J Med Microbiol, 2010, 300(1): 57–62. DOI: 10.1016/j.ijmm.2009.08.005 |
| [26] |
邵强, 黄友解, 韩月, 等. 酵母细胞壁的结构组成、生物学功能及在养殖业中的应用[J]. 浙江畜牧兽医, 2017, 42(1): 13–16.
SHAO Q, HUANG Y J, HAN Y, et al. Structural composition, biological function of yeast cell wall and its application in aquaculture[J]. Zhejiang Journal Animal Science and Veterinary Medicine, 2017, 42(1): 13–16. (in Chinese) |
| [27] | XIAO Z G, TRINCADO C A, MURTAUGH M P. β-Glucan enhancement of T cell IFNγ response in swine[J]. Vet Immunol Immunopathol, 2004, 102(3): 315–320. DOI: 10.1016/j.vetimm.2004.09.013 |
| [28] |
刘红芝, 王强, 周素梅. 酵母甘露聚糖分离提取及功能活性研究进展[J]. 食品科学, 2008, 29(5): 465–468.
LIU H Z, WANG Q, ZHOU S M. Research progress on extraction and activated function of yeast Mannan[J]. Food Science, 2008, 29(5): 465–468. DOI: 10.3321/j.issn:1002-6630.2008.05.106 (in Chinese) |
| [29] |
许浩, 申立泉, 康坤, 等. 日粮添加酵母细胞壁对泌乳早期荷斯坦牛生产性能的影响[J]. 中国奶牛, 2017(5): 4–8.
XU H, SHEN L Q, KANG K, et al. Effect of supplementation of yeast cell wall in diets on performance of early lactating dairy cows[J]. China Dairy Cattle, 2017(5): 4–8. (in Chinese) |



