2. 上海师范大学生命与环境科学学院, 上海 200234
2. College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234, China
柔嫩艾美耳球虫(Eimeria tenella)是七种鸡艾美耳球虫中的一员,它会导致鸡严重的肠道寄生虫疾病,为养禽业带来严重的经济损失[1-2]。柔嫩艾美耳球虫是一种专性细胞内寄生虫,具有复杂的生命周期,必须依靠宿主细胞来完成其生命周期,其中孢子生殖和裂殖生殖两个阶段是入侵肠上皮细胞和细胞内发育的两个关键发育阶段[3]。阻止虫体入侵细胞可能成为预防和控制球虫病的有效方法。因此,鉴定与虫体入侵相关的关键分子对于开发新的抗球虫药物和疫苗具有重大作用。
艾美耳球虫属于顶复门寄生虫,都具有独特的细胞器复合体(顶端复合体),包括棒状体、致密颗粒、微线、类锥体、极环和微管[4]。这些细胞器所分泌的蛋白质在虫体入侵宿主中都发挥着十分重要作用。近年来,已经进行许多关于寄生虫入侵机制的研究,并且已经鉴定了一些与入侵相关的蛋白质,如表面抗原[5]、顶膜抗原[6]、微线体蛋白[7]和棒状体蛋白等。然而,这些都是与虫体相关的蛋白,与宿主相关蛋白的报道很少。有研究发现,在隐孢子虫感染中宿主的细胞整合素α2在感染过程中可能参与宿主与隐孢子虫的相互作用,其可能作为感染部位F肌动蛋白募集和重组的上游调控元件的一部分[8]。此外,镰形艾美耳球虫可以逆转宿主干扰素(IFN)-γ信号传导以促进其生长,其卵囊产出在IFN-γ-R(-/-)和IDO1(-/-)小鼠中减少[9]。由此可推论,宿主蛋白在寄生虫入侵细胞和细胞内发育中起着不可或缺的作用。
在前期的研究中,使用相对和绝对定量同位素标记(iTRAQ)技术结合液相色谱串联质谱(LC-MS/MS)技术,筛选获得了一批感染E. tenella子孢子72 h的鸡胚成纤维(CEF)细胞中的差异表达蛋白[10],本研究选取了其中一个上调蛋白——甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)进行克隆和原核表达,并研究该蛋白在E. tenella子孢子入侵过程中的作用。
1 材料与方法 1.1 实验虫株和实验动物柔嫩艾美耳球虫上海株(资源编号:CAAS21111611),由中国农业科学院上海兽医研究所动物原虫病创新团队保存。三黄鸡购自上海阜稷生物科技有限公司,无球虫的条件下饲养,饲料和饮水中不添加任何抗球虫药物。2月龄新西兰大白兔购自上海甲干生物科技有限公司。
1.2 试剂鸡胚成纤维细胞(DF-1)、pGEX-4T-1原核表达载体由中国农业科学院上海兽医研究所动物原虫病创新团队保存,DNA Marker(DL2000)、2×Taq PCR Master Mix、BCA蛋白浓度测定试剂盒、大肠杆菌感受态细胞TOP10、BL21(DE3)购自天根生化科技公司,琼脂糖凝胶回收试剂盒、质粒小提试剂盒、RNeasy® Mini Kit试剂盒、PCR产物纯化试剂盒购自德国QIAGEN公司,Trizol、反转录试剂盒、限制性内切酶EcoRⅠ和XhoⅠ、SYBR® Premix Dimer EraserTM、T4 DNA连接酶购自TaKaRa公司,鼠源GST标签抗体、WB/IP细胞裂解液、BCA蛋白浓度测定试剂盒、Protein A+G Agarose购自碧云天公司,DMEM、FBS、双抗、Vybrant® CFDA SE细胞示踪试剂盒、PageRulerTM蛋白预染Marker购自赛默飞公司,IRDye680RD Donkey anti-Mouse IgG、IRDye800RD Goat anti-rabbit IgG购自Li-COR公司,Cocktail蛋白酶抑制剂购自Sigma,GST·BindTMResin购自Novagen公司。
1.3 cDNA模板的制备取3×106个DF-1细胞,加入1 mL Trizol,并按照说明书提取DF-1细胞总RNA。把提取的总RNA进行0.5%琼脂糖凝胶电泳鉴定其质量,并使用紫外分光光度计在OD260 nm处测定其浓度。以达到要求的总RNA为模板进行反转录得到第一链cDNA。
1.4 GAPDH基因的克隆与鉴定根据已发表的鸡GAPDH的mRNA序列(GenBank登录号:NM_204305.1)设计引物扩增鸡GAPDH编码区(片段大小为1 123 bp),上游引物:5′-CGGAATTCCAGCAGGAACACTATAAAGG -3′,下游引物:5′-CCCTCGAGCTCTCACTGCAGGA-TGCAGAA-3′),并在上、下游引物中分别加入EcoRⅠ、Xho Ⅰ酶切位点(下划线标注)。以DF-1细胞的cDNA为模板对鸡GAPDH基因进行PCR扩增,PCR扩增程序:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃延伸10 min。将得到的PCR产物通过1%的琼脂糖凝胶检测后,对目的片段进行回收纯化。将胶回收产物克隆至pMD18-T并转化至TOP10细胞中,将PCR鉴定正确的菌液送至上海生工公司进行测序。
将测序得到的GAPDH全长序列进行BLAST相似性分析(http://www.ncbi.nlm.nih.gov/BLAST/),并使用ExPASy对其进行氨基酸序列和相对分子质量预测(http://www.expasy.org/tools/protparam.html)。
1.5 GAPDH重组蛋白的表达与纯化将测序正确的GAPDH片段与pGEX-4T-1使用EcoRⅠ和XhoⅠ分别进行双酶切,并通过1%琼脂糖凝胶电泳对双酶切产物进行鉴定,且回收目的片段。将GAPDH双酶切产物与pGEX-4T-1双酶切产物进行连接,并将连接产物转化至BL21(DE3)中,并涂布于LB+Amp固体培养基上,挑取3个单克隆菌落到LB+Amp液体培养基中,将PCR鉴定正确的菌液送至公司进行测序。将鉴定正确的菌接种到200 mL LB+Amp液体培养基内,37 ℃、180 r·min-1条件下培养至OD600 nm=0.6,加入IPTG(1 mmol·L-1)后再培养12 h。低温离心收集菌体沉淀,沉淀经10 mL PBS充分重悬后进行超声裂解, 然后在4 ℃、12 000 g条件下低温离心10 min,对上清和沉淀分别进行分析以确定蛋白的表达形式。对上清中的目的蛋白使用GST·BindTMResin进行纯化。
1.6 GAPDH重组蛋白的验证对纯化后融合重组蛋白进行Western blot验证。取10 μg纯化后的重组蛋白进行12% SDS-PAGE分析后转印至PVDF膜上,膜经5%脱脂乳37 ℃封闭1 h后,PBS洗3遍;一抗使用鼠源抗GST标签抗体(1:1 000稀释),37 ℃孵育2 h,PBS洗3遍;二抗使用驴抗鼠IgG荧光抗体(1:5 000稀释),37 ℃孵育1 h,PBST洗4遍,PBS洗1遍;使用Odyssey双色红外激光成像系统进行成像。
1.7 GAPDH重组蛋白多克隆抗体的制备使用2月龄新西兰大白兔制备抗体。首次免疫,每只兔皮下注射0.2 mg乳化的GAPDH重组蛋白(GAPDH重组蛋白与弗氏完全佐剂1:1充分混合);2周后二免,每只兔皮下注射0.2 mg乳化的GAPDH重组蛋白(GAPDH重组蛋白与弗氏不完全佐剂1:1充分混合),此后每隔1周加强免疫1次,共进行5次免疫。终免1周后采集血液,离心分离血清即为所需的GAPDH重组蛋白多克隆抗体。
1.8 柔嫩艾美耳球虫卵囊的收集、纯化及子孢子的提取1日龄三黄鸡在无球虫的条件下饲养至14日龄后,接种柔嫩艾美耳球虫孢子化卵囊,每只接种2.0×104个卵囊。收集接种后6~8 d鸡粪便中的卵囊,通氧至卵囊孢子化率达90%左右时,用饱和食盐水飘浮法和次氯酸钠法对孢子化的卵囊进行纯化。在纯化好的孢子化卵囊沉淀中加入PBS,用玻璃珠振荡破壁至卵囊破壁率达到90%,3 000 g离心8 min,用HBBS缓冲液重悬沉淀后,转移至三角形锥形瓶内,向其中加入0.5%的胰蛋白酶和7%的鸡胆汁,吸管轻轻吹打后在41 ℃水浴锅中消化1 h左右,镜检若有大部分子孢子释放出来时,离心,洗涤,用G3砂芯漏斗纯化子孢子。收集滤液,子孢子沉淀用PBS洗涤3次后,计数。
1.9 细胞样品的收集DF-1细胞(7 × 105个·孔-1)接入6孔板中,每孔加入2 mL完全培养基(DMEM+10%FBS+1%双抗),培养在37 ℃ 5% CO2细胞培养箱中至汇合度约80%。新鲜子孢子于10 mL DMEM (10% FBS, 5%双抗)中37 ℃孵育2 h后,加入DF-1细胞中,子孢子与细胞比例为3:1。接入子孢子的DF-1细胞在41 ℃ 5%CO2细胞培养箱中培养72 h,然后取出部分细胞样品于-80 ℃保存。同时设置子孢子未感染组为对照组。
1.10 子孢子感染对GAPDH转录水平的影响收集子孢子感染72 h和未感染的细胞样品,用Trizol试剂按说明书提取细胞总RNA。使用DNaseI去除总RNA中基因组DNA,参照RNeasy® Mini Kit说明书对总RNA进行纯化,用SuperScript Ⅲ反转录酶试剂盒进行第一链cDNA的合成,用QIA quick® PCR试剂盒纯化cDNA。本次试验以β-actin作为内参,根据已发表的GAPDH与β-actin的序列设计特异性引物进行q-PCR,引物序列如下,GAPDH上游引物:5′-GGCACTGTCAAGGCTGAGAACG-3′,GAPDH下游引物:5′-TGAGATGATAACACGCTTAGCACCAC-3′;β-actin上游引物:5′-CACCACAGCCGAGAGAG-AAAT-3′,β-actin下游引物:5′-TGACCATCAGGGAGTTCATAGC-3′。按照TaKaRa荧光定量试剂盒说明书进行试验操作,反应体系:cDNA 1 μL,SYBRR Premix Dimer Eraser(2×)10 μL,ROX Reference DyeII 1 μL,无RNase水7.2 μL,10 mmol·L-1正向和反向引物各0.4 μL。使用Q5荧光定量PCR仪进行扩增,扩增条件如下,第一阶段:预变性,1个循环,95 ℃ 30 s;第二阶段:40个循环,95 ℃ 5 s,60 ℃ 30 s;第三阶段:熔解曲线。每个样本设置3个重复,按照公式ΔΔCt=(Ct目的RNA-Ct内参)处理组/(Ct目的RNA-Ct内参)对照组对目的基因mRNA的Ct值作转换,表示试验组表达量于对照组的倍数改变。用SPASS 21.0(https://www.ibm.com)对其进行T检验分析。
1.11 子孢子感染对GAPDH翻译水平的影响子孢子感染72 h和未感染的细胞经PBS洗涤3次后,向细胞中加入WB/IP细胞裂解液,冰上孵育30 min,最后收集于EP管中,4 ℃、12 000 g条件下离心15 min,收集上清。BCA法检测细胞总蛋白浓度。蛋白样品经SDS-PAGE后电转至PVDF膜上,用5% BSA(PBST稀释)4 ℃封闭12 h,PBST洗涤3次;加入兔GAPDH抗体(1:200稀释;本实验室制备),37 ℃孵育2 h,PBST洗涤3次;加入荧光山羊抗兔IgG(1:5 000),孵育1 h后,PBST洗涤4次,再经PBS洗涤1次,使用Odyssey系统观看结果,并使用Image J软件(http://rsb.info.nih.gov/ij/)对图片进行分析。使用β-actin作为内参调整蛋白样品的上样量。
1.12 免疫组化将3 × 104个柔嫩艾美耳球虫卵囊接种2周龄无球虫健康鸡,为感染组,并设置未感染球虫对照组。3 d后取感染组和未感染组鸡的盲肠,PBS洗净后,常规制备4 μm厚的石蜡切片。
切片在二甲苯中脱蜡,使用梯度乙醇溶液进行脱水,滴加快速抗原修复液对切片进行抗原修复,并使用内源性过氧化物酶阻断液阻断内源性过氧化物酶活性,最后在室温下与正常山羊血清一起孵育1 h以减少非特异性结合。抗GAPDH的多克隆兔抗(1:50稀释;本实验室制备)用作一抗,正常兔IgG用作阴性对照。将切片与一抗在37 ℃条件下孵育2 h,PBS洗涤两次;接着与生物素化的山羊抗兔血清IgG在室温下孵育20 min,PBS洗涤两次;将切片与辣根过氧化物酶缀合的链霉抗生物素蛋白-生物素在室温下孵育20 min,使用3, 3-二氨基联苯胺四盐酸盐在室温下进行显色反应(约10 min)。最后切片用苏木精复染,在乙醇中脱水并用树脂封片。使用Olympus显微镜对切片进行观察。
1.13 GAPDH多克隆抗体对子孢子入侵能力的影响使用碧云天Protein A+G agarose纯化GAPDH多克隆抗体,并使用BCA法测定抗体浓度。DF-1细胞(1.5×105个·孔-1)平铺于24孔板中,并加入纯化的兔抗GAPDH IgG或正常兔IgG与细胞共孵育,使抗体终浓度为50、100、200、300或400 μg·mL-1,并设置不添加IgG组为空白对照,于37 ℃ 5% CO2培养箱中至汇合度约80%。根据说明书,使用CFDA SE试剂对新鲜提取的E. tenella子孢子进行标记,标记后的子孢子于10 mL DMEM(10%FBS,5%双抗)37 ℃条件下孵育2 h。DF-1细胞使用PBS洗三遍以去除培养基中的抗体,并加入新鲜培养基,将子孢子加入到DF-1细胞中,子孢子与细胞比例为3:1。接入子孢子的DF-1细胞在41 ℃,5% CO2中培养12 h,将细胞在PBS中洗涤两次,收集细胞,使用流式细胞仪分析子孢子入侵细胞的情况。所有测定均进行三次重复。
2 结果 2.1 GAPDH基因的克隆以DF-1细胞的cDNA为模板,参考已发表的鸡GAPDH的CDs设计引物扩增鸡GAPDH,得到了一条大小约为1 123 bp的条带(图 1)。利用BLASTN对得到的序列进行同源性比对,显示与已知鸡GAPDH基因(NM_204305.1)的相似性为99%,证明扩增到的基因就是鸡GAPDH基因。GAPDH基因所编码的氨基酸序列长333 aa,相对分子质量约35.7 ku。

|
M. DL2000相对分子质量标准;1. GAPDH PCR扩增结果 M. DL2000 DNA marker; 1. The PCR result of GAPDH 图 1 GAPDH的PCR扩增克隆 Fig. 1 The PCR result of GAPDH |
将PCR扩增得到的GAPDH片段克隆至pGEX-4T-1,成功构建了原核重组质粒pGEX-4T-1-GAPDH,并将其转化至BL21(DE3)细胞中,在1 mmol·L-1 IPTG,37 ℃诱导表达10 h,菌体经过超声后,通过SDS-PAGE确定重组蛋白的表达形式。结果显示,上清和沉淀均有目的蛋白(61.7 ku),其中包含35.7 ku GAPDH蛋白和26 ku GST标签蛋白(图 2A)。对上清中的蛋白进行纯化,得到较纯的GAPDH重组蛋白(图 2B)。

|
A. GAPDH的表达;B. GAPDH的纯化;M.蛋白质相对分子质量标准;1.阴性对照(无IPTG诱导);2. IPTG诱导后5 h;3. IPTG诱导后10 h;4.纯化的GAPDH A. Expression of GAPDH; B. Purification of GAPDH; M. Protein marker; 1. Negative control (not induced with IPTG); 2. Induced with IPTG for 5 h; 3. Induced with IPTG for 10 h; 4. Purified GAPDH 图 2 GAPDH重组蛋白的表达与纯化 Fig. 2 Expression and purification of GAPDH recombinant protein |
以鼠源抗GST标签抗体作为一抗鉴定纯化的GAPDH重组蛋白。结果发现在55~70 ku之间有一条带,大小与GAPDH-GST重组蛋白61.7 ku的相对分子质量一致(图 3)。

|
M.蛋白质相对分子质量标准;1.纯化的蛋白 M. Protein marker; 1. Purified protein 图 3 GAPDH重组蛋白的Western blot验证 Fig. 3 Identification of GAPDH recombinant protein by Western blot |
使用荧光定量PCR对子孢子感染72 h和子孢子未感染细胞GAPDH的mRNA水平进行测定。结果表明,与未感染组相比,子孢子感染72 h的细胞中GAPDH的mRNA水平显著上升(图 4)。

|
*. P<0.05 图 4 E. tenella子孢子感染细胞中GAPDH的mRNA表达水平 Fig. 4 GAPDH mRNA expression levels in E. tenella sporozoite-infected cells |
使用Western blot对子孢子感染72 h和子孢子未感染细胞GAPDH的蛋白表达情况进行检测。结果显示,子孢子感染72 h的细胞与未感染组的细胞中GAPDH蛋白的表达量无显著差异(图 5)。
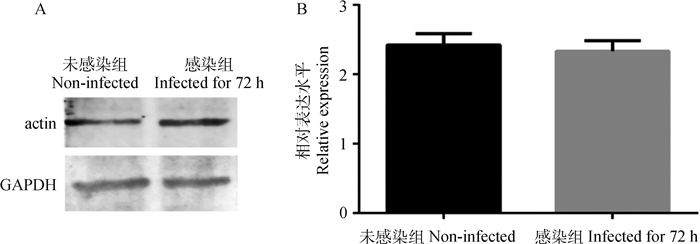
|
A.内参actin和GAPDH的Western blot结果;B. GAPDH蛋白的相对表达量 A. Western blot of the internal reference actin and GAPDH protein; B. Relative expression level of GAPDH protein 图 5 E. tenella子孢子感染细胞中GAPDH的蛋白表达水平 Fig. 5 GAPDH protein expression levels in E. tenella sporozoite-infected cells |
通过免疫组织化学的方法对子孢子感染72 h和子孢子未感染的鸡盲肠组织中GAPDH的表达情况进行分析。结果显示(图 6),子孢子感染72 h的盲肠组织中GAPDH的特异性染色明显多于未感染盲肠组织,表明子孢子感染后GAPDH的表达会增加。

|
图 6 鸡盲肠组织切片中GAPDH的免疫组化染色 Fig. 6 Immunohistochemical staining of GAPDH in chicken cecal tissue sections |
利用子孢子入侵试验分析GAPDH多克隆抗体对子孢子入侵DF-1细胞能力的影响。通过预孵育纯化的多克隆抗体封闭DF-1细胞中GAPDH的功能。结果表明,未处理组子孢子入侵率为27%,不同抗体浓度正常兔IgG组的入侵率与未处理组无明显差异;而50~400 μg·mL-1GAPDH组的入侵率均明显低于相同浓度正常兔IgG组,其中400 μg·mL-1GAPDH组的入侵率仅为15.5%,而正常兔IgG组为26.3%(图 7)。
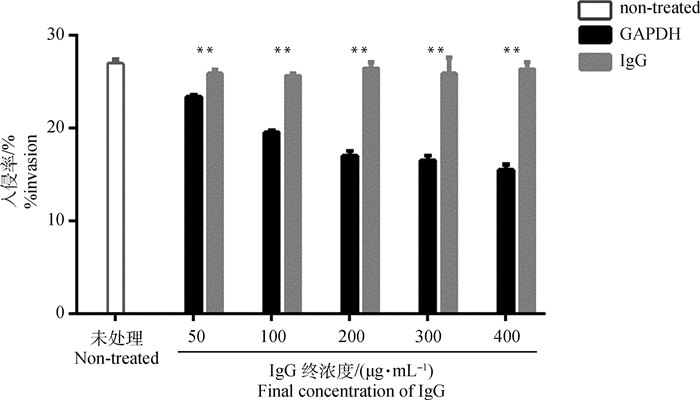
|
未处理.无抗体组;GAPDH.兔抗GAPDH血清纯化后的IgG;IgG.阴性兔血清中IgG;**.与阴性兔血清中IgG组相比t-test检验的P<0.01 Non-treated. Without any antibodies; GAPDH. IgG purified from rabbit antiserum against recombinant GAPDH protein; IgG. IgG from naive rabbit serum; ** means P < 0.05 by Student's t-test versus naive rabbit IgG group 图 7 兔抗GAPDH抗体对E. tenella子孢子入侵细胞的影响 Fig. 7 Effect of rabbit anti-GAPDH antibodies on E. tenella sporozoite invasion of cells |
GAPDH可特异性催化3-磷酸甘油醛向1, 3-二磷酸甘油酸转化的化学反应,是糖酵解过程中的关键酶[11]。此外,GAPDH还参与核tRNA的运输、DNA复制和修复、胞吞胞吐作用、细胞骨架构建、铁代谢、肿瘤发生和细胞死亡等过程[12-13]。长期以来,研究者们认为在各组织中基本高水平恒定表达,因此常被选作标准化内参基因[14]。但随着研究的深入,学者们发现GAPDH的表达并不总是恒定的,因此GAPDH是否适合作为内参存在争议。近年来大量的研究表明,GAPDH在一些肿瘤细胞中呈现上调表达趋势[15]。经研究表明, 大鼠神经胶质瘤中的GAPDH呈表达量上调, 并与肿瘤浸润程度呈正相关,说明GAPDH可能会促进肿瘤的发展[16]。通过使用Western blot和免疫组化技术,Hao等[17]发现肺鳞状细胞癌病变组织中, GAPDH的表达水平显著升高, 使用siRNA抑制GAPDH的表达量后, 肺鳞状癌细胞的增殖能力、迁移能力和侵袭能力都相应减弱。经研究表明,GAPDH的丰度受年龄和肌纤维的影响,在衰老的大鼠骨骼肌中表达量呈现下调[18]。由此可见,GAPDH并不是均恒定表达的,在一些特殊情况下也存在差异表达的现象。作者[10]前期的研究发现,E. tenella子孢子感染72 h的鸡胚成纤维细胞中GAPDH的表达量显著上升,提示宿主GAPDH参与与寄生虫感染过程。
GAPDH分子由4个相同的亚基组成,以四聚体的形式存在,在已知三维结构的GAPDH亚基中,其活性中心周围的氨基酸序列都是相同的,显示GAPDH在各种属间存在高度保守的序列[19]。在本研究中,作者从DF-1细胞中克隆了1 123 bp的鸡GAPDH基因,其中包括1 002 bp的ORF,编码333个氨基酸,分子大小约35.7 ku,等电点8.7。构建原核质粒pGEX-4T-1-GAPDH并成功表达GAPDH重组蛋白,对可溶性蛋白进行了纯化,获得了较纯的GAPDH重组蛋白,并制备了GAPDH重组蛋白的特异性兔抗多克隆抗体。
为了研究宿主GAPDH在E.tenella感染后的表达情况,作者通过q-PCR检测子孢子感染后72 h DF-1细胞中GAPDH的转录水平,并且分别使用Western blot和免疫组织化学方法检测了子孢子感染后72 h DF-1细胞中GAPDH蛋白的翻译水平。q-PCR的结果表明,在子孢子感染72 h的宿主细胞内GAPDH mRNA的水平较不感染的细胞显著上升。免疫组织化学的结果也表明,子孢子感染72 h后,宿主细胞GAPDH蛋白上调表达。但是Western blot结果发现两组间GAPDH蛋白表达情况没有显著的变化。作者推测出现这一情况的原因是,与免疫组织化学法相比,Western blot的灵敏度较低,且在细胞蛋白的提取、电泳转膜过程中也会出现误差,因此可能无法检测蛋白间较小的差异。在Zhang等[8]关于ITGA2在微小隐孢子虫感染中的作用研究中,Western blot检测不到ITGA2-KD的细胞中ITGA2的存在,但通过免疫荧光发现在感染部位仍存在少量的ITGA2,证明免疫组织化学/荧光比Western blot的灵敏性更高。因此,作者采用q-PCR和免疫组织化学的结果,表明子孢子的入侵会导致宿主GAPDH蛋白的上调表达。
为了探索GAPDH对子孢子入侵宿主细胞的影响,使用兔抗GPADH多克隆抗体预先孵育细胞,然后进行子孢子入侵试验。结果显示,未孵育抗体组与正常兔IgG组各个浓度相比入侵率并无显著差异,但GAPDH组50、100、200、300、400 μg·mL-1与同浓度IgG组相比均能显著抑制子孢子的入侵,而且随着抗体浓度的升高抑制效果也升高,表明抑制宿主GAPDH可抑制子孢子的入侵,宿主GAPDH蛋白在子孢子入侵宿主细胞过程中起促进作用。有研究发现,家蚕微孢子虫可能通过特异性结合家蚕的GAPDH蛋白来获得糖酵解产生的ATP, 同时还可摄取宿主细胞糖酵过程中产生的碳骨架, 以满足其生长发育的物质和能量需求[20]。GAPDH不仅是糖酵解过程中的关键酶,还参与糖异生途径[21],产生6-磷酸果糖,从而进一步生成GDP-甘露醇[22]。球虫中存在甘露醇循环,可使多余的能量储存起来,在需要时进入糖酵解途径,并且球虫可能有把宿主糖酵解过程产生的中间产物转化为甘露醇的能力[23]。作者发现子孢子入侵宿主细胞72 h后宿主GAPDH表达量升高,并且使用抗宿主GAPDH蛋白的多克隆抗体处理细胞后可抑制子孢子的入侵,说明球虫可能会利用宿主GAPDH来为其入侵和发育提供能量和原料。
4 结论E. tenella子孢子感染72 h后,宿主GAPDH的表达量显著升高。子孢子入侵试验结果显示,低水平的GAPDH可显著抑制子孢子的入侵过程。这些发现表明GAPDH在子孢子侵入宿主细胞中起正调控作用。子孢子的入侵会导致宿主GAPDH蛋白的上调表达以利于自身的入侵和生长发育,GAPDH促进子孢子入侵和细胞内发育的机制有待进一步研究。
| [1] | BLAKE D P, TOMLEY F M. Securing poultry production from the ever-present Eimeria challenge[J]. Trends Parasitol, 2014, 30(1): 12–19. DOI: 10.1016/j.pt.2013.10.003 |
| [2] | WILLIAMS R B. A compartmentalised model for the estimation of the cost of coccidiosis to the world's chicken production industry[J]. Int J Parasitol, 1999, 29(8): 1209–1229. DOI: 10.1016/S0020-7519(99)00086-7 |
| [3] |
周新锐, 田志英, 古少鹏, 等. 鸡球虫内生发育研究概况[J]. 畜牧兽医科技信息, 2009(10): 4–5.
ZHOU X R, TIAN Z Y, GU S P, et al. A survey of endophytic development of chicken coccidia[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2009(10): 4–5. DOI: 10.3969/J.ISSN.1671-6027.2009.10.005 (in Chinese) |
| [4] | SAM-YELLOWE T Y. Rhoptry organelles of the apicomplexa:their role in host cell invasion and intracellular survival[J]. Parasitol Today, 1996, 12(8): 308–316. DOI: 10.1016/0169-4758(96)10030-2 |
| [5] | RAMLY N Z, ROUZHEINIKOV S N, SEDELNIKOVA S E, et al. Crystallization and preliminary crystallographic analysis of a surface antigen glycoprotein, SAG19, from Eimeria tenella[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2013, 69(12): 1380–1383. DOI: 10.1107/S1744309113029734 |
| [6] | JIANG L L, LIN J J, HAN H Y, et al. Identification and partial characterization of a serine protease inhibitor (serpin) of Eimeria tenella[J]. Parasitol Res, 2012, 110(2): 865–874. DOI: 10.1007/s00436-011-2568-0 |
| [7] | YAN M, CUI X X, ZHAO Q P, et al. Molecular characterization and protective efficacy of the microneme 2 protein from Eimeria tenella[J]. Parasite, 2018, 25: 60. DOI: 10.1051/parasite/2018061 |
| [8] | ZHANG H L, GUO F G, ZHU G. Involvement of host cell integrin α2 in Cryptosporidium parvum infection[J]. Infect Immun, 2012, 80(5): 1753–1758. DOI: 10.1128/IAI.05862-11 |
| [9] | SCHMID M, HEITLINGER E, SPORK S, et al. Eimeria falciformis infection of the mouse caecum identifies opposing roles of IFNγ-regulated host pathways for the parasite development[J]. Mucosal Immunol, 2014, 7(4): 969–982. DOI: 10.1038/mi.2013.115 |
| [10] |
王璐, 朱顺海, 赵其平, 等.基于iTRAQ技术分析柔嫩艾美耳球虫感染后CEF细胞的差异表达蛋白[J/OL].中国动物传染病学报, 1-11. (2019-03-14).http://kns.cnki.net/kcms/detail/31.2031.s.20190313.1710.010.html.
WANG L, ZHU S H, ZHAO Q P, et al. Analysis of differentially expressed proteins in CEF cells infected with Eimeria tenella by iTRAQ technology[J/OL]. Chinese Journal of Animal Infectious Diseases, 1-11. (2019-03-14). http://kns.cnki.net/kcms/detail/31.2031.s.20190313.1710.010.html. (in Chinese) |
| [11] | ZHANG J Y, ZHANG F, HONG C Q, et al. Critical protein GAPDH and its regulatory mechanisms in cancer cells[J]. Cancer Biol Med, 2015, 12(1): 10–22. |
| [12] | COLELL A, GREEN D R, RICCI J E. Novel roles for GAPDH in cell death and carcinogenesis[J]. Cell Death Differ, 2009, 16(12): 1573–1581. DOI: 10.1038/cdd.2009.137 |
| [13] | SHEOKAND N, MALHOTRA H, KUMAR S, et al. Moonlighting cell-surface GAPDH recruits apotransferrin to effect iron egress from mammalian cells[J]. J Cell Sci, 2014, 127(19): 4279–4291. DOI: 10.1242/jcs.154005 |
| [14] | WAN G Q, YANG K, LIM Q, et al. Identification and validation of reference genes for expression studies in a rat model of neuropathic pain[J]. Biochem Biophys Res Commun, 2010, 400(4): 575–580. DOI: 10.1016/j.bbrc.2010.08.106 |
| [15] | GUO C M, LIU S Q, SUN M Z. Novel insight into the role of GAPDH playing in tumor[J]. Clin Transl Oncol, 2013, 15(3): 167–172. DOI: 10.1007/s12094-012-0924-x |
| [16] | GRILLON E, FARION R, REUVENI M, et al. Spatial profiles of markers of glycolysis, mitochondria, and proton pumps in a rat glioma suggest coordinated programming for proliferation[J]. BMC Res Notes, 2015, 8: 207. DOI: 10.1186/s13104-015-1191-z |
| [17] | HAO L H, ZHOU X, LIU S Q, et al. Elevated GAPDH expression is associated with the proliferation and invasion of lung and esophageal squamous cell carcinomas[J]. Proteomics, 2015, 15(17): 3087–3100. DOI: 10.1002/pmic.201400577 |
| [18] | GANNON J, OHLENDIECK K. Subproteomic analysis of basic proteins in aged skeletal muscle following offgel pre-fractionation[J]. Mol Med Rep, 2012, 5(4): 993–1000. DOI: 10.3892/mmr.2012.759 |
| [19] |
付国良, 黄晓红. 甘油醛-3-磷酸脱氢酶功能的研究进展[J]. 生物物理学报, 2013, 29(3): 181–191.
FU G L, HUANG X H. Progress on research of functions of glyceraldehyde-3-phosphate dehydrogenase[J]. Acta Biophysica Sinica, 2013, 29(3): 181–191. (in Chinese) |
| [20] |
安欢迎, 王琴, 李治, 等. 家蚕微孢子虫与家蚕ECH1和GAPDH蛋白的相互作用[J]. 昆虫学报, 2017, 60(1): 45–52.
AN H Y, WANG Q, LI Z, et al. Interaction between Nosema bombycis and proteins BmECH1 and BmGAPDH in Bombyx mori[J]. Acta Entomologica Sinica, 2017, 60(1): 45–52. (in Chinese) |
| [21] | LAO Y M, LU Y, JIANG J G, et al. Six regulatory elements lying in the promoter region imply the functional diversity of chloroplast GAPDH in Duanliella bardawil[J]. J Agric Food Chem, 2012, 60(36): 9211–9220. DOI: 10.1021/jf302659z |
| [22] | GAO J P, WANG D, CAO L Y, et al. Transcriptome sequencing of Codonopsis pilosula and identification of candidate genes involved in polysaccharide biosynthesis[J]. PLoS One, 2015, 10(2): e0117342. DOI: 10.1371/journal.pone.0117342 |
| [23] |
索勋, 李国清.
鸡球虫病学[M]. 北京: 中国农业大学出版社, 1998.
SUO X, LI G Q. Coccidia and coccidiosis of domestic fowl[M]. Beijing: China Agricultural University Press, 1998. (in Chinese) |



