2. 锦州医科大学畜牧兽医学院, 锦州 121001;
3. 上海市农业遗传育种重点实验室动物遗传工程研究室, 上海 201106
2. College of Animal Husbandry & Veterinary, Jinzhou Medical University, Jinzhou 121001, China;
3. Division of Animal Genetic Engineering, Shanghai Municipal Key Laboratory of Agri-genetics and Breeding, Shanghai 201106, China
羊口疮是以山羊和绵羊为易感动物的高度传染性人畜共患病,近年来打破地域界限,严重制约畜牧业经济发展[1]。该病由羊口疮病毒(orf virus, ORFV)所致,为痘病毒科副痘病毒属双链线性DNA病毒[2]。ORFV编码的许多毒力因子能够在免疫系统中发挥其干扰宿主的能力[3],这种免疫逃避机制促使病程反复持续,盛行局面难以控制。在感染动物中除羊外,还包括马鹿、羚羊、麝牛、骆驼、松鼠、海豹、犬猫以及人[4]。与患病动物或其污染物接触感染后,病毒首先侵袭上皮细胞破坏其完整性,其次迅速完成复制,最终患处会出现菜花样增生的典型病灶[5]。通常在口唇、外阴、蹄部可见水泡和脓疱破溃后形成的结痂病变[6],痊愈后,宿主痂皮内残存的病毒颗粒仍保持感染力,可作为传染源导致疾病再度复发。
目前ORFV的预防措施现仍以免疫弱毒疫苗为主,存在毒力返强的可能,且实际免疫效果并不是十分理想,因此新型疫苗的研制意义重大[7]。腺病毒载体系统作为重组腺病毒载体活疫苗应用研究的理想载体,其优势表现在感染能力强、宿主范围广、免疫方式多、载体容量大、病毒滴度高、安全性和免疫性好等诸多方面[8]。本研究从前期分离的ORFV上海株中扩增F1L和B2L保护性抗原基因,构建串联表达该双基因的重组腺病毒,并通过小鼠免疫试验初步评价其免疫特性,为ORFV新型疫苗的研发奠定基础。
1 材料与方法 1.1 细胞、病毒、主要试剂及实验动物腺病毒表达系统(含CMV启动子、T2A、P2A肽及EGFP荧光蛋白等)、大肠杆菌stbl3株、HEK-293细胞和转染试剂Polybrene均为广州赛业生物科技有限公司产品;ORFV-F416上海分离株、MDBK细胞、羊抗ORFV血清由本实验室保存;限制性内切酶HindⅢ、XhoⅠ购自Thermo公司,限制性内切酶PacⅠ购自NEW ENGLAND BioLabs;Alexa Fluor 647-兔抗山羊IgG购自Jackson ImmunoResearch;Mouse IgG ELISA Kit购自上海研生实业有限公司;6~8周龄ICR雌性小鼠,购于北京维通利华实验动物技术有限公司。
1.2 引物设计与基因扩增F1L和B2L基因的引物信息见表 1。经PCR扩增和测序,获得ORFV-F416上海分离株的F1L和B2L基因序列。
|
|
表 1 扩增F1L和B2L基因的引物序列 Table 1 Nucleotide sequences of the primers used for amplification of F1L and B2L genes |
F1L和B2L基因经测序比对后,与腺病毒穿梭载体pAd-CMV、T2A、P2A和EGF基因连接,转化DH5α感受态株,提取阳性克隆,将PCR、HindⅢ和XhoⅠ双酶切鉴定正确的重组质粒命名pAd-CMV-F1L-T2A-B2L-P2A-EGFP。PacⅠ内切酶线性化pAd-CMV-F1L-T2A-B2L-P2A-EGFP,与骨架质粒pAdEasy-1转入大肠杆菌stbl3感受态株实现同源重组并提取质粒,经PCR、酶切鉴定正确的重组质粒命名pAdEasy-CMV-F1L-T2A-B2L-P2A-EGFP。该质粒与Polybrene共转染细胞融合度为70%~85%的HEK-293细胞,培养至细胞内可见细胞病变效应(CPE)及大范围的荧光绿团,-80 ℃反复冻融收获重组病毒,命名为pAV-CMV-F1L-T2A-B2L-P2A-EGFP。同理,制备不含ORFV目的基因的重组腺病毒pAV-CMV-EGFP为对照。
1.4 重组腺病毒MDBK细胞内扩增与滴度测定pAV-CMV-F1L-T2A-B2L-P2A-EGFP和pAV-CMV-EGFP分别转染MDBK细胞,待细胞出现CPE和绿色光团后反复冻融3次收毒,以3 000 r·min-1离心10 min取上清,并以10-1~10-10梯度稀释病毒上清,接种于96孔板内单层MDBK细胞,每个稀释度对应纵排8个孔,末端两纵排为对照孔,37 ℃、5% CO2培养箱内吸附2 h后,弃上清补加5% FBS的细胞维持液,于相同条件下继续培养5 d,按Karber法测定病毒液效价。
1.5 重组腺病毒表达后检测 1.5.1 重组腺病毒F1L、B2L基因检测使用病毒基因组试剂盒提取重组腺病毒(pAV-CMV-F1L-T2A-B2L-P2A-EGFP、pAV-CMV-EGFP)DNA,PCR鉴定目的基因。
1.5.2 重组腺病毒间接免疫荧光(IFA)检测转染后的MDBK细胞经固定、透化、封闭、一抗(羊抗ORFV血清)、二抗(Alexa Fluor 647-兔抗山羊IgG)孵育及清洗干燥后,荧光显微镜下观察荧光生成情况。
1.6 重组腺病毒免疫小鼠及免疫效果评价 1.6.1 小鼠免疫接种将20只ICR雌性小鼠随机分2组,每组10只,分别在同一位置肌内注射ORFV重组腺病毒和PBS。初免后间隔2周实施二免。免疫方案见表 2。各组小鼠在0~5周断尾采血,分离所获血清经56 ℃ 30 min灭活,-20 ℃存放备用。
|
|
表 2 小鼠免疫方案 Table 2 Mouse immunization program |
使用小鼠IgG ELISA定量检测试剂盒检测免疫0~5周小鼠的IgG抗体水平。通过标准物质量浓度(800、400、200、100、50 ng·mL-1)与OD值计算标准曲线的直线回归方程。
1.6.3 免疫小鼠MTT法测定脾淋巴细胞增殖每组各取二免后第3周小鼠2只,颈椎脱臼处死,无菌分离脾制备小鼠脾淋巴细胞悬液。用RPMI-1640培养基调整细胞浓度为2×105·mL-1,以每孔100 μL接入96孔板内,培养孔内各加入50 μL刀豆素(ConA 5 μg·mL-1)、50 μL灭活ORFV及50 μL RPMI-1640培养液,每孔各3个重复,另设3个空白对照孔。各孔混匀后于37 ℃、5% CO2培养箱内培养48 h,在临结束前4 h加入10 μL MTT(5 mg·mL-1)继续培养4 h后,每孔加入100 μL Formanzan溶液,培养箱内再次孵育4 h,用酶标仪在570 nm处测定各孔的OD值。
1.6.4 小鼠攻毒试验2组小鼠在第5周使用ORFV-F416毒株细胞上清液(1×105.6TCID50)进行攻毒试验,每只皮下接种500 μL,另取同期饲养的健康小鼠作为空白对照。逐日观察小鼠的精神状态,并记录各组小鼠发病情况和体重。
1.7 数据的统计与分析采用SPSS18软件进行ANOVA单因素方差分析法分析,采用Duncan’s检验法进行各组间的多重比较,用“x±sx”表示。
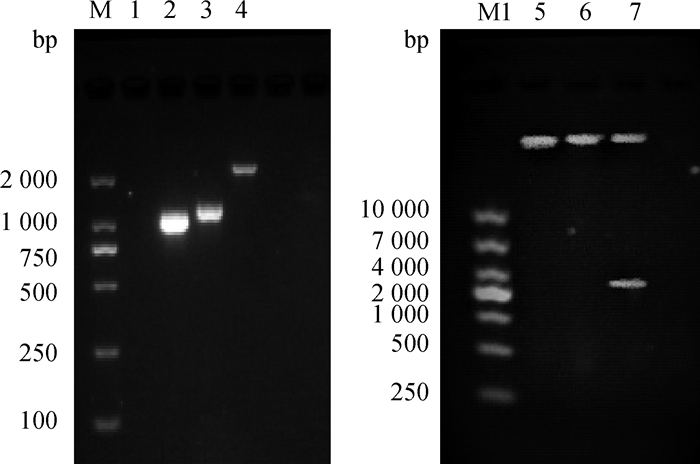
2 结果 2.1 重组穿梭质粒和重组腺病毒的构建先构建的ORFV重组腺病毒载体pAd-CMV-F1L-T2A-B2L-P2A-EGFP,经PCR扩增,显示F1L(1 026 bp)、B2L(1 134 bp)、F1L-T2A-B2L(2 223 bp)基因的大小与预期符合;HindⅢ和Xho Ⅰ双酶切后出现35 283和2 203 bp两条带,表明ORFV目的基因成功插入腺病毒穿梭载体(图 1)。构建重组腺病毒质粒pAdEasy-CMV-F1L-T2A-B2L-P2A-EGFP,经PacⅠ酶切鉴定,酶切后有约2和35 kb的片段,与预期大小符合(图略)。
|
M. DL2000相对分子质量标准;1. pAd-CMV-F1L-T2A-B2L-P2A-EGFP阴性对照;2. pAd-CMV-F1L-T2A-B2L-P2A-EGFP F1L基因;3. pAd-CMV-F1L-T2A-B2L-P2A-EGFP B2L基因;4. pAd-CMV-F1L-T2A-B2L-P2A-EGFP F1L-T2A-B2L基因;M1. DL10000相对分子质量标准;5. HindⅢ单酶切产物;6. XhoⅠ单酶切产物;7. HindⅢ、XhoⅠ双酶切产物 M. DL2000 marker; 1. pAd-CMV-F1L-T2A-B2L-P2A-EGFP negative control; 2. pAd-CMV-F1L-T2A-B2L-P2A-EGFP F1L gene; 3. pAd-CMV-F1L-T2A-B2L-P2A-EGFP B2L gene; 4. pAd-CMV-F1L-T2A-B2L-P2A-EGFP F1L-T2A-B2L gene; M1. DL10000 marker; 5. HindⅢ single digestion products; 6. XhoⅠ single digestion products; 7. HindⅢ, XhoⅠ double digestion products 图 1 重组腺病毒载体的PCR鉴定和HindⅢ、XhoⅠ酶切鉴定 Figure 1 PCR identification of recombinant adenovirus vector and HindⅢ, XhoⅠ digestion identification |
重组腺病毒质粒经转染HEK-293细胞,出现病变效应绿色荧光,表明成功获得重组腺病毒pAV-CMV-F1L-T2A-B2L-P2A-EGFP和pAV-CMV-EGFP。
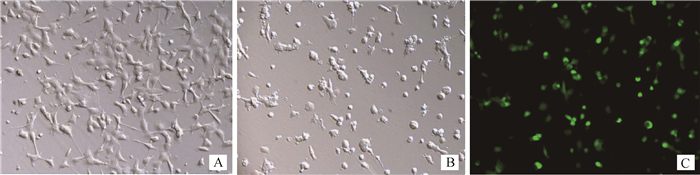
2.2 重组腺病毒MDBK细胞内表达与毒力测定pAV-CMV-F1L-T2A-B2L-P2A-EGFP和pAV-CMV-EGFP分别感染MDBK细胞,研究其能否在细胞中表达,结果转染后72 h观察到细胞圆缩、病变效应明显,荧光显微镜下细胞内可见绿色光团,而对照组MDBK细胞生长良好,无CPE和荧光(图 2)。将纯化后的重组腺病毒连续10倍10个梯度稀释后,感染MDBK细胞,Karber法进行毒力计算,结果:pAV- CMV-F1L-T2A-B2L-P2A-EGFP的TCID50=1× 10-5.375·mL-1;pAV-CMV-EGFP的TCID50=1×10-6.875·mL-1。
|
A.感染前MDBK细胞;B.感染后72 h的DMBK细胞;C.感染后荧光下MDBK细胞 A. Pre-infected MDBK cells; B. DMBK cells at 72 h after infection; C. MDBK cells after infection under fluorescence 图 2 重组腺病毒感染MDBK细胞 Figure 2 Recombinant adenovirus infects MDBK cells |
以MDBK细胞扩增的重组腺病毒DNA为底物,用F1L上下游引物、B2L上下游引物及F1L上游引物和B2L下游引物分别扩增F1L、B2L、F1L-T2A-B2L基因,结果见图 3。pAV-CMV-F1L-T2A-B2L-P2A-EGFP的DNA中扩增出F1L(1 026 bp)、B2L(1 134 bp)、F1L-T2A-B2L(2 223 bp),与预期大小一致,而pAV-CMV-EGFP无目的条带出现。

|
M. DL2000相对分子质量标准;1. pAV-CMV-F1L-T2A-B2L-P2A-EGFP F1L基因;2. pAV-CMV-F1L-T2A-B2L-P2A-EGFP B2L基因;3. pAV-CMV-F1L-T2A-B2L-P2A-EGFP F1L-T2A-B2L基因;4. pAV-CMV-EGFP F1L基因;5. pAV-CMV-EGFP B2L基因;6. pAV-CMV-EGFP F1L-T2A-B2L基因 M. DL2000 marker; 1. pAV-CMV-F1L-T2A-B2L-P2A-EGFP F1L gene; 2. pAV-CMV-F1L-T2A-B2L-P2A-EGFP B2L gene; 3. pAV-CMV-F1L-T2A-B2L-P2A-EGFP F1L-T2A-B2L gene; 4. pAV-CMV-EGFP F1L gene; 5. pAV-CMV-EGFP B2L gene; 6. pAV-CMV-EGFP F1L-T2A-B2L gene 图 3 重组腺病毒F1L、B2L基因PCR鉴定 Figure 3 PCR amplification for identifying F1L, B2L genes of the recombinant adenovirus |
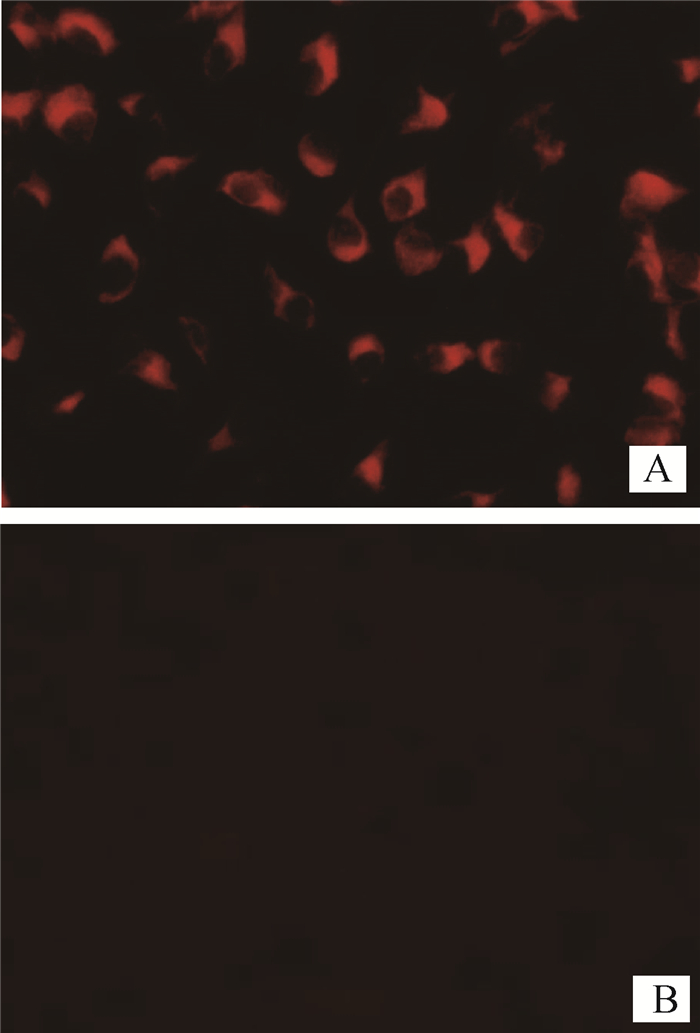
结果见图 4,转染pAV-CMV-F1L-T2A-B2L-P2A-EGFP的细胞样品有红色荧光,表明与抗体发生反应,F1L、B2L蛋白有表达,而转染pAV-CMV-EGFP的样品并无该现象。
|
A.转染pAV-CMV-F1L-T2A-B2L-P2A-EGFP;B.转染pAV-CMV-EGFP A. Transfection of pAV-CMV-F1L-T2A-B2L-P2A-EGFP; B. Transfection of pAV-CMV-EGFP 图 4 IFA间接免疫荧光检测 Figure 4 IFA indirect immunofluorescence assay |
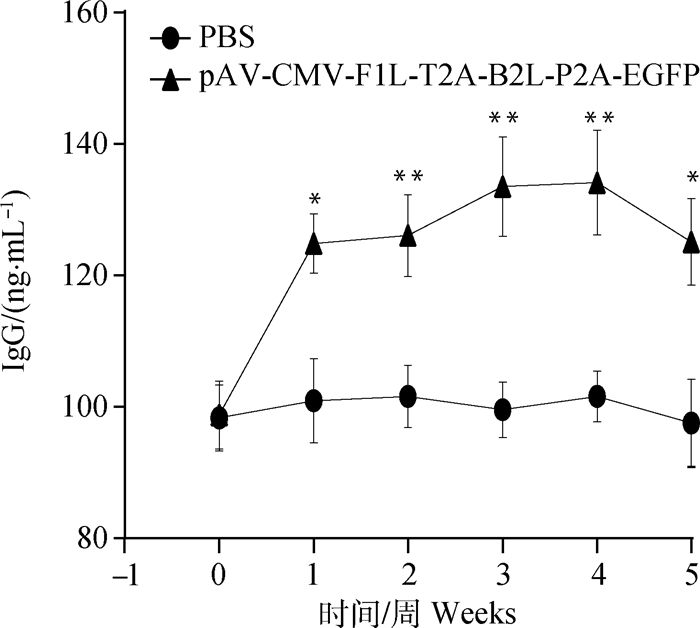
IgG酶联免疫分析结果见图 5:pAV-CMV-F1L-T2A-B2L-P2A-EGFP免疫组小鼠初免第1周抗体水平明显升高,且与PBS组差异显著(P<0.05),第2、3周抗体水平极显著高于PBS组(P<0.01),二免后第4周达到峰值——(134.13±8.01) ng·mL-1,极显著高于PBS组(P<0.01),第5周抗体水平开始下降,仍显著高于PBS组(P<0.05);PBS组小鼠抗体水平稳定无明显波动。
|
与PBS组比较, **.P<0.01, *.P<0.05,下同 Compared with PBS group, **.P < 0.01, *.P < 0.05. The same as below 图 5 小鼠血清IgG含量测定 Figure 5 Determination of serum IgG in mice |
小鼠脾淋巴细胞经非特异性刺激(ConA)、特异性刺激(灭活ORFV)和无刺激(RPMI-1640)处理后,淋巴细胞增殖情况如图 6所示。ConA刺激后,ORFV重组腺病毒组OD值高于PBS组,但两者之间均无显著差异(P>0.05);ORFV重组腺病毒组对特异性抗原ORFV表现出明显的T淋巴细胞增殖能力,其OD值极显著高于PBS组(P<0.01);无刺激组显示,ORFV重组腺病毒组OD值极显著高于PBS组(P<0.01)。ORFV重组腺病毒组在3种处理下脾淋巴细胞均出现增殖现象。
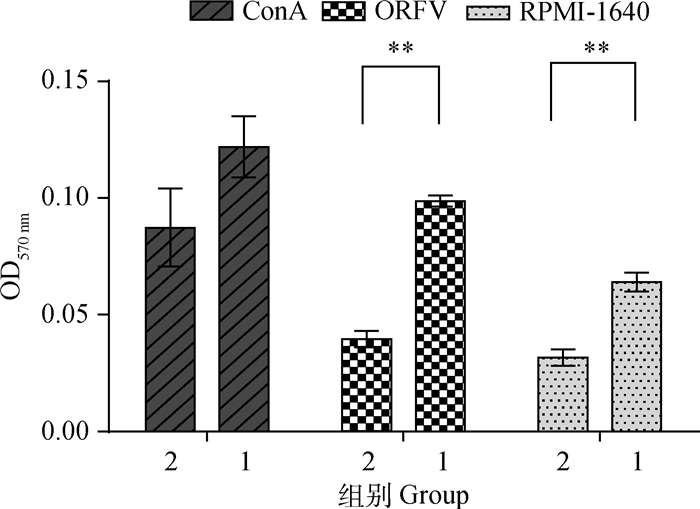
|
1. pAV-CMV-F1L-T2A-B2L-P2A-EGFP; 2. PBS 图 6 小鼠脾淋巴细胞增殖试验 Figure 6 Spleen lymphocyte proliferation test in mice |
小鼠攻毒后第9~11天,PBS和pAV-CMV-F1L-T2A-B2L-P2A-EGFP两组剩余的8只小鼠中分别有4只(50%)、1只(12.5%)小鼠出现精神沉郁、弓背,攻毒部位可见皮毛松乱,有啃咬现象。攻毒后6~8周内PBS组小鼠体重明显降低,整体采食量减少;pAV-CMV-F1L-T2A-B2L-P2A-EGFP组小鼠体重逐渐增加,接近空白对照组;而未攻毒组小鼠体重值趋于稳定,说明ORFV重组腺病毒呈现一定的保护效果,见图 7。
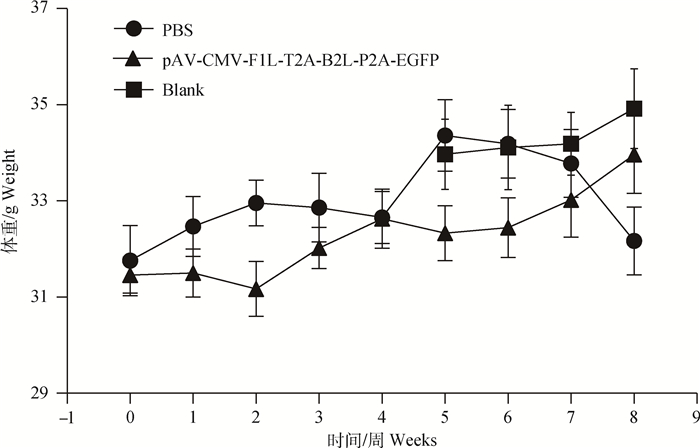
|
图 7 重组腺病毒对小鼠体重的影响 Figure 7 Effect of recombinant adenovirus on the weight of mice |
羊口疮作为一种病毒性传染病已呈现全球性暴发,毒株的类型日新月异,易感物种日益扩增,活病毒逃逸且尚无特效药物治愈,这些现象致使病程持续蔓延,严重牵制着世界各地养羊业规模化的迅速良好发展。腺病毒基因表达载体其基因组能够承载多种异源基因,对静止和分裂期细胞均可转染,目前广泛用于基因疫苗的研究[9],在人和动物的腺病毒载体构建及临床应用上均有成功的案例[10-13]。ORFV的F1L和B2L基因是两个重要的保护性抗原基因,其中F1L蛋白可介导细胞免疫,引起机体产生免疫反应,被认为是羊口疮亚单位疫苗研制的标准抗原[14];B2L蛋白则可刺激机体产生抗体反应,促使淋巴细胞增殖[15]。尽管ORFV以细胞免疫为主,而体液免疫水平相对较低,但因该两种蛋白具有较好的免疫原性,本研究将F1L、B2L两基因串联,构建ORFV双基因重组腺病毒载体,以期对动物机体产生更好的免疫保护作用。
本研究成功包装出ORFV重组腺病毒,可根据绿色荧光蛋白基因在转染细胞中是否产生绿色荧光进行鉴定筛选。获得pAV-CMV-F1L-T2A-B2L-P2A-EGFP重组腺病毒并感染MDBK细胞,经PCR、IFA检测,结果表明,该重组腺病毒能够稳定携带F1L、B2L基因。毒力测定结果显示,空载体pAV-CMV-EGFP的滴度(TCID50=1×10-6.875·mL-1)远高于pAV-CMV-F1L-T2A-B2L-P2A-EGFP的滴度(TCID50=1×10-5.375·mL-1),可能由于羊口疮病毒重组腺病毒导入的外源基因(F1L、B2L、T2A、P2A)较多,进而对腺病毒的繁殖速度有所影响。这与杨玉艾等[16]研究的猪瘟病毒E0、E2基因构建的重组腺病毒rAd-E0-E2滴度低于其空载体rAd-CMV滴度的结果相一致。
在免疫策略上研究证明,初次免疫后再次加强免疫方式可全面激发体液免疫和细胞免疫应答水平[17-18]。本研究采用相同免疫方式免疫ICR小鼠,ORFV重组腺病毒组IgG OD值明显高于PBS对照组,由此可见ORFV重组腺病毒可快速刺激机体产生抗体,说明所构建的羊口疮病毒重组腺病毒能够迅速刺激小鼠机体产生体液免疫应答。此外,小鼠脾淋巴细胞增殖试验结果显示,ORFV重组腺病毒免疫小鼠对细胞免疫应答水平也有所促进,它对特异性抗原ORFV和非特异性ConA蛋白抗原的刺激均可诱导T淋巴细胞增殖,但对非特异性抗原刺激表现的增殖能力较强,符合赵魁[19]的试验结果,这表明经pAV-CMV-F1L-T2A-B2L-P2A-EGFP免疫后,小鼠的免疫系统在一定程度上处于高活化状态。
以小鼠攻毒试验对所构建的羊口疮病毒重组腺病毒进行安全性和效果评价,ORFV重组腺病毒免疫组小鼠体重趋于稳定,在ORFV攻毒后体重仍呈上升趋势,接近于未攻毒组,说明该免疫组并未影响小鼠整体正常采食生长状况,仅有1只小鼠攻毒后精神状态不佳,结果提示能够提供一定的安全免疫保护作用。但本研究中,各免疫组小鼠在攻毒部位均未见特征性结痂病变及死亡情况,这可能与小鼠品系、病原毒性、攻毒剂量等因素相关。另外,腺病毒大剂量使用通常会引起严重的免疫反应[20],甚至引发组织损伤[21],因而免疫方法、免疫剂量、疫苗的种类及抗原蛋白表达水平都有待于进一步优化和研究。
4 结论成功构建ORFV的F1L、B2L基因串联表达的重组腺病毒,免疫小鼠后能够刺激小鼠产生体液免疫和细胞免疫应答,且未影响小鼠正常采食,保护效力较好。该研究可为ORFV DNA疫苗的研制提供应用和理论依据。
| [1] |
张家确, 吴景央. 一起人畜共患羊传染性脓疱病的调查[J]. 中国兽医杂志, 2006, 42(9): 53–54.
ZHANG J Q, WU J Y. An investigation of infectious pustular disease in zoonotic sheep[J]. Chinese Journal of Veterinary Medicine, 2006, 42(9): 53–54. (in Chinese) |
| [2] | TSAI S M, CHAN K W, HSU W L, et al. Development of a loop-mediated isothermal amplification for rapid detection of Orf virus[J]. J Virol Methods, 2009, 157(2): 200–204. DOI: 10.1016/j.jviromet.2009.01.003 |
| [3] | WISE L M, SAVORY L J, DRYDEN N H, et al. Major amino acid sequence variants of viral vascular endothelial growth factor are functionally equivalent during Orf virus infection of sheep skin[J]. Virus Res, 2007, 128(1-2): 115–125. DOI: 10.1016/j.virusres.2007.04.018 |
| [4] | KLEIN J, TRYLAND M. Characterisation of parapoxviruses isolated from Norwegian semi-domesticated reindeer (Rangifer tarandus tarandus)[J]. Virol J, 2005, 2(1): 79–88. DOI: 10.1186/1743-422X-2-79 |
| [5] | SONNBERG S, FLEMING S B, MERCER A A. Phylogenetic analysis of the large family of poxvirus ankyrin-repeat proteins reveals orthologue groups within and across chordopoxvirus genera[J]. J Gen Virol, 2011, 92(Pt 11): 2596–2607. |
| [6] | LI W, NING Z Y, HAO W B, et al. Isolation and phylogenetic analysis of orf virus from the sheep herd outbreak in northeast China[J]. BMC Vet Res, 2012, 8(1): 229–241. DOI: 10.1186/1746-6148-8-229 |
| [7] |
王勇, 杨侃侃, 王元红, 等. 表达羊口疮病毒B2L基因重组腺病毒的构建及鉴定[J]. 扬州大学学报(农业与生命科学版), 2017, 38(3): 6–10.
WANG Y, YANG K K, WANG Y H, et al. Construction and identification of recombinant adenovirus expressing B2L gene of the orf virus[J]. Journal of Yangzhou University (Agriculture and Life Science Edition), 2017, 38(3): 6–10. (in Chinese) |
| [8] | PATTERSON L J, KUATE S, DALTABUIT-TEST M, et al. Replicating adenovirus-simian immunodeficiency virus (SIV) vectors efficiently prime SIV-specific systemic and mucosal immune responses by targeting myeloid dendritic cells and persisting in rectal macrophages, regardless of immunization route[J]. Clin Vaccine Immunol, 2012, 19(5): 629–637. DOI: 10.1128/CVI.00010-12 |
| [9] | RAUSCHHUBER C, WOLF A, EHRHARDT A. Transcriptional activity of inverted terminal repeats of various human adenovirus serotypes[J]. J Gen Virol, 2011, 92(3): 669–674. DOI: 10.1099/vir.0.026542-0 |
| [10] |
陈奕, 贾宝辉, 黄敏, 等. 绿色荧光蛋白标记的人血管内皮生长因子165基因重组腺病毒载体的构建与鉴定[J]. 生物医学工程与临床, 2017, 21(1): 74–78.
CHEN Y, JIA B H, HUANG M, et al. Construction and identification of green fluorescent protein labeled recombinant adenovirus containing human vascular endothelial growth factor 165 gene[J]. Biomedical Engineering and Clinical Medicine, 2017, 21(1): 74–78. (in Chinese) |
| [11] |
曾钰然, 高原. 动物腺病毒载体应用的研究进展[J]. 黑龙江畜牧兽医, 2012(17): 36–39.
ZENG Y R, GAO Y. Research progress on the application of animal adenovirus vector[J]. Heilongjiang Animal Science and Veterinary Medicine, 2012(17): 36–39. (in Chinese) |
| [12] | ROJAS J M, MORENO H, VALCáRCEL F, et al. Vaccination with recombinant adenoviruses expressing the peste des petits ruminants virus F or H proteins overcomes viral immunosuppression and induces protective immunity against PPRV challenge in sheep[J]. PLoS One, 2014, 9(7): e101226. DOI: 10.1371/journal.pone.0101226 |
| [13] |
王定坤, 陆付耳, 邹欣, 等. 大鼠靶向α7nAchR基因shRNA真核表达载体及重组腺病毒构建[J]. 华中科技大学学报(医学版), 2017, 46(4): 374–379.
WANG D K, LU F E, ZOU X, et al. Construction of eukaryotic expression vector for short hairpin RNA targeting gene of Rat α7nAchR and production of recombinant adenovirus[J]. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2017, 46(4): 374–379. (in Chinese) |
| [14] | GALLINA L, SCAGLIARINI A, CIULLI S, et al. Cloning and expression of the Orf virus F1L gene:Possible use as a subunit vaccine[J]. Vet Res Commun, 2004, 28(Suppl 1): 291–293. |
| [15] |
向智龙, 卓建华, 程振涛, 等. 贵州地区羊口疮病毒B2L基因克隆及原核表达载体构建[J]. 中国畜牧兽医, 2011, 38(7): 76–79.
XIANG Z L, ZHUO J H, CHENG Z T, et al. Cloning and construction of prokaryotic expression vector of B2L gene of orf virus in Guizhou[J]. China Animal Husbandry & Veterinary Medicine, 2011, 38(7): 76–79. (in Chinese) |
| [16] |
杨玉艾, 初晓辉, 毕保良, 等. 猪瘟病毒E0和E2蛋白融合表达的重组腺病毒构建及免疫保护性研究[J]. 中国预防兽医学报, 2010, 32(6): 419–423.
YANG Y A, CHU X H, BI B L, et al. Immune protective efficacy of the recombinant adenovirus fusion-expressing the E0-E2 gene of classical swine fever virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2010, 32(6): 419–423. (in Chinese) |
| [17] | ZHENG L Y, WANG F Y, YANG Z D, et al. A single immunization with HA DNA vaccine by electroporation induces early protection against H5N1 avian influenza virus challenge in mice[J]. BMC Infect Dis, 2009, 9(1): 17–25. DOI: 10.1186/1471-2334-9-17 |
| [18] | CHOI Y K, NGUYEN T D, OZAKI H, et al. Studies of H5N1 influenza virus infection of pigs by using viruses isolated in Vietnam and Thailand in 2004[J]. J Virol, 2005, 79(16): 10821–10825. DOI: 10.1128/JVI.79.16.10821-10825.2005 |
| [19] |
赵魁. 羊传染性脓疱病毒重组DNA疫苗的构建与实验免疫研究[D]. 长春: 吉林大学, 2010.
ZHAO K. Study on the construction and experimental immunity of recombinant DNA vaccine against Orf virus[D]. Changchun: Jilin University, 2010. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10183-2010107128.htm |
| [20] | RHEE E G, BLATTMAN J N, KASTURI S P, et al. Multiple innate immune pathways contribute to the immunogenicity of recombinant adenovirus vaccine vectors[J]. J Virol, 2011, 85(1): 315–323. DOI: 10.1128/JVI.01597-10 |
| [21] | LE ROUX I, JOLIOT A H, BLOCH-GALLEGO E, et al. Neurotrophic activity of the Antennapedia homeodomain depends on its specific DNA-binding properties[J]. Proc Natl Acad Sci U S A, 1993, 90(19): 9120–9124. DOI: 10.1073/pnas.90.19.9120 |



