2. 四川农业大学动物遗传育种研究所, 成都 611130;
3. 宁夏回族自治区中卫山羊选育场, 吴忠 751706
2. Institute of Animal Genetics and Breeding, Sichuan Agricultural University, Chengdu 611130, China;
3. The Ningxia Hui Autonomous Region Breeding Ground of Zhongwei Goat, Wuzhong 751706, China
表皮、毛皮质以及毛髓质(部分毛发具有)组成毛发的基本结构,它们也是毛发形态直接的表现形式。毛发的弯曲具有复杂的调控机制和结构现象,这些现象包括简单的单一弯曲(bending)以及较复杂的螺旋扭曲(twisting);并且在物种间和物种内,以及不同时期存在特异性,单一的机制假说不能支撑整个毛发弯曲现象[1]。
动物毛发纤维一直作为人类毛纺织品的原材料,其形态的变化决定了质量的好坏。羊毛的弯曲情况对加工过程、最终纺织品的特性以及所带来的产品价值都有直接的影响。几十年来,从通过对不同地域和血统的人类毛发弯曲程度的不同进行逐渐深入的研究,到对其他哺乳动物毛发特征性或异常性弯曲的研究,已经探索出许多可能存在的产生特异性弯曲现象的机制假说和机理,甚至是可能仅适用于某一物种的调节通路和参与的具体基因和因子。近年的研究已经逐渐对这些不同弯曲现象的产生进行了系统化的归纳总结和网络构建,这让不同的特征现象可以做出多种调控方式的预测,但是这些较详细的机理仍有不完整的结构[2]。另外,同一物种可能会出现不同生长周期其毛发弯曲程度不同的现象,这样的动态调控机制也尚不明确[3],如绵、山羊羔羊裘皮存在不同生长时期的羊毛弯曲差异性。中卫山羊、滩羊的羔羊裘皮是著名的裘皮产品,羔羊在35日龄时具有质量上乘的裘皮,随着生长其裘皮上的羊毛弯曲程度、形态的整齐度及美观程度下降,失去了整体价值。随着高通量测序技术的日趋成熟,对特异性的基因表达以及表观遗传信息进行探究变为可能。不断发展的生物技术也使我们可以对人类、小鼠等哺乳动物毛发以及羊毛弯曲现象产生的相关机理进行探究和综述,对造成羔羊毛发动态弯曲现象的因素进行探索,为今后改善羊毛弯曲程度,使其在较长日龄的情况下依然保持其花案的清晰和美观性,为获得品质优良的羊毛制品和精美裘皮提供可能性。
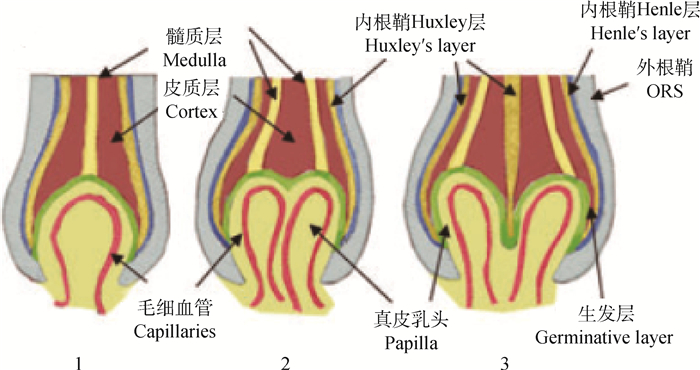
1 毛囊结构及其形态的发生 1.1 毛囊结构特点发育完全的成熟初级毛囊组织除了毛囊本身以外,一般还具有立毛肌、皮脂腺以及汗腺等附属结构,毛囊就像一个层层包裹的洋葱一样,共有7层细胞以围绕毛发纤维的方式有序排列(图 1)。大多数的细胞层都接受特异性的分化调控,具有独特的分化特性。大多数细胞的类型都属于上皮细胞,除了位于毛球底部的真皮乳头其余均位于真皮层,属于间充质细胞。真皮乳头两端分别与毛囊的上皮细胞和底端结缔组织鞘相连,在功能上通过不同的分裂、增殖、分化程度来调节毛发生长速度和周期。

|
图 1 毛囊球部的细胞组成情况[4] Figure 1 A detailed drawing of the cellular compartments of the hair follicle bulb[4] |
初级毛囊生长过程的启动是从胚胎时期开始的,对于绵羊来说在胚胎期70 d左右毛囊开始发育,在绵羊中初级毛囊在皮肤上的密度基本上都相差无几[4-5]。次级毛囊在绵羊胚胎期85 d左右开始发育,并且次级毛囊包围在初级毛囊周围,与初级毛囊形成较明显的簇集现象。短暂扩增细胞(transit-amplifying cells,TACs)是作为上皮祖细胞经过间充质细胞诱导后的过渡细胞,以毛囊中央为轴心特异性分化出不同的上皮终末端细胞,形成毛囊结构不同细胞层,从而行使着不同的功能[6]。
2 毛发弯曲的形态特征及各组分对弯曲形成的作用通常毛发根据弯曲程度的不同,将弯曲的类型分为普通弯曲(bend)、波纹状弯曲(wave)、扭曲无规则弯曲(twist)和紧密螺旋状弯曲(crimp),而这些不同的弯曲结果被认为是毛发结构蛋白的不同组合以及毛发生长调节因子的差异分布造成的[2]。通常情况下,并不存在绝对意义上的直发,只是在相对意义上相同自然长度(不受拉伸影响)的毛发经过外力的拉伸(不过度拉伸,不引发弹性势力的变化),一般认为,长度变化较大的毛发拥有更大的弯曲程度。2015年李新海等[7]对中卫山羊两个不同时期的羊毛弯曲进行了表型分析,发现在17.5日龄后弯曲的羊毛开始变直,这一现象为今后羊毛弯曲生长发育机制的研究提供了依据。从形成弯曲形态的表面因素考虑,不难发现这是因为毛干两侧的组织生长速度不同造成的,毛发弯曲的凸侧面生长速度更快,而凹侧面生长速度相对较慢。这种两侧的生长速度差异被认为是胚胎发育时期甚至更早就存在的非对称表达现象造成的[8-9]。一般来说,具有弯曲现象的毛发横截面都会呈现单轴对称的星状、椭圆或豆样的形状[10-11],并且内外两侧毛发的表面由于角化的时间不同,通常生长速度较慢的内侧表面角质的过程较早完成,呈现出“V”型的角化鳞片痕迹[11]。近年来,对各种弯曲现象可能形成的机制也有较多的研究,为今后在羊毛弯曲现象的探究奠定了较深厚的基础。
2.1 皮质层对毛发弯曲形成的影响构成羊毛纤维的主体是皮质层,它大约占羊毛总重量的90%,因此通过成分比例以及近年的研究报道,可以推断皮质层在羊毛弯曲中有着重要的结构支撑。皮质层大体可以分为正皮质、副皮质和少数的中间皮质[12],早期在羊毛上的研究认为,生长速度较慢的副皮质细胞和生长速度更快的正皮质细胞是导致毛发弯曲的主要原因[13]。两种不同的皮质区域也拥有不一样的结构特征。正皮质含有的是富含甘氨酸/酪氨酸的角蛋白关联蛋白(keratin associated protein, KAP),副皮质含有高硫型KAPS,导致正皮质受到失水的影响更大,从而让更多的角蛋白中间丝(keratin intermediate filament, KIF)倾向于在正皮质聚集,因此,许多研究通过不同皮质结构蛋白成分的特异排布将正、副皮质区分开来[14-15]。早期就有研究发现,羊毛具有正、副皮质双边排列的特征,结合上述结构蛋白的特异分布,认为这样的特点与羊毛弯曲有直接的关系[16]。有研究发现,虽然各结构蛋白在不同区域有明显的分布特点,Harland等[17]发现,羊毛的正皮质相比于副皮质虽然拥有更多的KIF成分,但是其结果与毛发弯曲并没有显著的关联。2014年Harland等[18]报道,人毛发中KIF排列形成的巨纤维束(macrofibrils)的直径大小与形成的双扭结构(double-twist architecture)的角度成反比关系,也就是说,毛发纤维中的中间丝形成的巨纤维束大小与这样的扭转压力有直接的关系,然而这种单位面积上的扭转强度对皮质层结构以及毛发特性的影响有待进一步探究。Wortmann等[1]使用差示扫描热量法对美利奴羊毛、非洲人和亚洲人毛发进行反褶积的过程来消除毛发不同程度的弯曲,发现各皮质区域的组分与所预期的结果一致,但是组分和弯曲并没有很大的关系,说明正、副皮质排列的特性引起毛发弯曲的假说有待商榷。Hynd等[15]在对美利奴羊毛的研究中提出,皮质细胞在毛球上方附近的角化区域(keratinisation zone)进行角化修饰,毛发纤维生长速度和在此区域的角化速度是造成毛发是否弯曲以及弯曲程度大小的决定因素,他们认为,从毛球向上生长速度较角化速度慢的纤维会导致其角化过程在毛囊近端就已经完成,因此会导致羊毛产生大的扭转压力,使纤维快速地偏转,从而形成弯曲程度较明显的羊毛。在某一毛发生长周期整个过程中(如生长期到休止期)会出现生长速度的差异,而同一根毛发弯曲程度的不同就间接地证明了这一过程。
2.2 内根鞘对毛发弯曲形成的影响毛囊内的内根鞘层由外到内大体分为Henle层、Huxley层和内根鞘角质层[19]。最初在对人毛发进行研究时认为,最里层的内根鞘角质层与毛干结合非常牢固,认为它只具有包裹向外生长的毛干,保护及稳定其位置的作用。Henle层由于其较慢的生长速度是最早被角化的区域,因此具有保护其他两层内根鞘以及毛干的作用[2]。随后发现,位于中间的Huxley层细胞具有分泌角蛋白的作用,而与其有互作效应的毛透明蛋白(trichohyalin, TCHH)只有在角蛋白表达的区域出现[20-21],拥有使角蛋白硬化的作用。有研究发现,人类的TCHH基因以及相关肽基精氨酸脱亚胺酶(PAD)和转谷氨酰胺酶3(TGM3)的变异会导致内根鞘硬化过程受阻,从而导致蓬发综合征的产生,也是使弯曲毛发产生的原因之一[22]。另外,在Henle和Huxley层之间还发现有名为Flügelzellen的空间结构,最新的研究认为这个结构与内根鞘的空间稳定有一定的关系[23-24]。
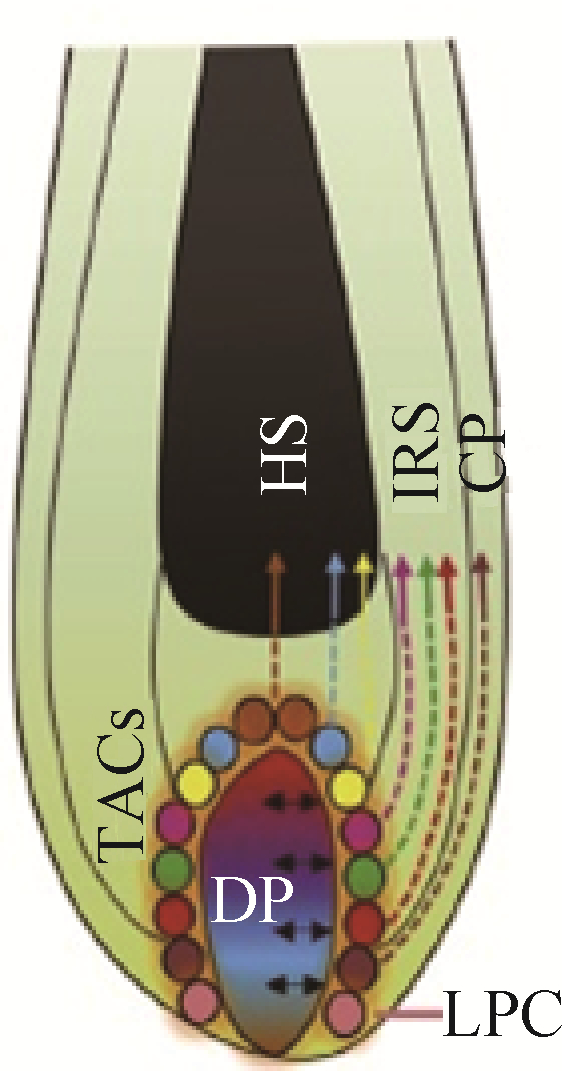
2.3 真皮乳头对毛发弯曲形成的影响真皮乳头作为镶嵌在毛囊内部为数不多的间充质细胞,对间充质-上皮细胞互相转化(MET/EMT)、诱导上皮祖细胞形成毛囊各细胞层、上皮细胞的生长与分化以及对后来毛发的形态和生长周期起到调节作用[25-26]。真皮乳头在毛球底部不均匀分布被认为是造成不同区域的角化上皮细胞生长速度产生差异的重要原因,因此真皮乳头的分布情况对于毛发弯曲起到了至关重要的作用。Chi等[25]利用可在体内对真皮乳头细胞进行选择性消融的小鼠进行试验,发现适当地进行真皮乳头细胞的消融会对接下来的毛发生长周期产生影响,正常的直发会变成锯齿状毛发(zigzag hair),并且过度的细胞消融会导致接下来的生长周期里毛发生长缓慢甚至停止生长。另外,由于毛囊基底的增殖基质细胞的不对称分布导致了横截面为扁平非规则的毛发纤维的产生,而增殖基质细胞(为有丝分裂细胞)的生长正是受真皮乳头所控制,这也巩固了真皮乳头分布与纤维形状的对应关系。Nissimov和Das Chaudhuri[11]在2014年提出了人类毛囊生长受毛球基底分裂的多个真皮乳头中心(multiple papillary centres, MPC)调控的假说,认为毛干横截面因为具有大的椭圆率(ellipticity index, 最长轴/最短轴)而导致的毛发弯曲是因为毛囊底部的真皮乳头出现了部分分离,从而产生以不同的分离乳头顶端为轴心生长的多个经角质层包裹在一起的毛发纤维,并且乳头细胞分离的程度越大,每个亚单位结构越独立,不同的调控中心使它们的生长速度有所差异而导致弯曲的产生(图 2)。2017年Yang等[6]在已知毛囊形成过程中MET/EMT互作效应的基础上,对小鼠被毛毛干细胞进行单细胞测序,发现真皮乳头的某种分子信号异质性导致与其产生信号沟通的上皮干细胞出现特异性的细胞分化,根据真皮乳头不同区域的间充质信号形成以同心圆形式排列的7种不同细胞类型的TACs,从而分化为毛囊组织的多种结构(图 3)。然而这种真皮乳头异质性导致的上皮细胞特异性分化的机制还不得而知,而这种间充质信号出现障碍或失调是否是引起毛发纤维生长速度差异的原因也尚待进一步研究验证。
|
图 2 真皮乳头多中心调控机制的产生及对各上皮细胞层的影响[11] Figure 2 Schematic representation of the development of a multi-papilla follicle and its effects on hair follicle formation[11] |
|
CP.外根鞘伴生层;DP.真皮乳头;HS.毛干;IRS.内根鞘;LPC.真皮乳头近端细胞;TACs.短暂扩增细胞 CP. Companion layer; DP. Dermal papilla; HS. Hair shaft; IRS. Inner root sheath; LPC. Lower proximal cup; TACs. Transient-amplifying cells 图 3 真皮乳头的异质性诱导上皮短暂扩增细胞(TACs)特异性分化示意图[6] Figure 3 Schematic representations of TACs specified differentiations induced by heterogeneous dermal papilla[6] |
随着研究技术的发展,人们逐渐发现了在人、小鼠、羊等哺乳动物毛囊发育过程中对毛发形状有直接或间接影响的分子调控机理,为更深入地探寻毛发弯曲形态以及羊毛动态弯曲现象的复杂调控过程提供了可能性。
3.1 毛囊各结构影响毛发弯曲的生物分子基础TCHH是一种在毛囊内根鞘特异性表达的基因,它与内根鞘生长过程的角蛋白硬化相关。Medland等[27]利用全基因组关联分析(GWAS)发现,在全球范围内的人种中,北欧人拥有最高的TCHH(rs11803731)变异率,与原始等位基因相比存在针对于欧洲人群更高比例的直发性状,这与Wu等[28]发现的外异蛋白受体(ectodysplasin receptor, EDAR) (rs3827760)在汉族人群中具有较高的突变率相对应,而这两种基因并没有较大的相关性。再根据它们不同的表达部位和作用功能[29-31],可以推断,这两个基因是在不同的机制下对毛发的形状进行着调节。Adhikari等[32]同样使用GWAS对拥有欧洲、美洲土著、非洲血统的拉丁裔人群(6 630人)进行毛发特征的关联分析,除了发现以前在其他人群有过报道与毛发弯曲相关的基因TCHH和EDAR有多态变异外,还发现了尚未报道过的丝氨酸蛋白酶S1家族成员53a(protease serine S1 family member 53a, PRSS53)也存在较大的毛发形状关联性,这是一种在内根鞘特异性高表达的蛋白修饰酶。通过试验验证也发现,PRSS53的rs11150606位点的非同义突变导致的氨基酸替换,影响了基因编码的丝氨酸蛋白酶的活性,从而影响了内根鞘角质细胞对纤维的结构角化和内根鞘的角化,从而对纤维形状进行改变,也再一次强调了内根鞘结构对毛发形状塑造的重要性。同样采用GWAS的方法,狄江等[33]对新疆细毛羊的羊毛弯曲频率进行基因分型,检测到18个与细羊毛弯曲频率性状显著关联的SNPs,为进一步揭示羊毛弯曲性状的遗传机理提供可能。2017年,张文建等[34]利用CCNY基因的前期研究报道,在知道其与羊毛细度相关的情况下,使用Sanger法混池测序找到3个SNPs位点,这些位点为今后控制羊毛细度的分子选育提供了参考。
毛发纤维主要由角蛋白组成,角蛋白的成分差异也是造成毛发形态多样化的直接因素,而表达这些结构蛋白的是角蛋白(KRT)和KAP基因[35]。Yu等[36]在建立的绵羊cDNA文库中发现了9个以前未见报道的KRT基因,并且发现KRT40、KRT82和KRT84是在纤维角质层特异性表达的基因,另外11个KRT基因在皮质层特异性表达,因此认为,这些不同的组织间隔区域是这些基因行使它们调控作用的原因。2013年Gandolfi等[37]发现,塞尔凯克卷毛猫具有蓬松卷曲和相对粗直的两种毛发特征,分析认为是KRT71基因编码区的一个非同义突变导致了蛋白结构的变化,形成蓬松卷曲性状。中国滩羊从羔羊到成年会发生毛发弯曲性状的动态变化,通过高通量转录组测序发现,存在性状差异的两个时期(1和48月龄)包括TCHH、KRT基因家族等与毛发纤维结构相关的差异表达的转录本,另外,可变剪接分析发现,金属硫蛋白亚型3(metallothionein 3 isoform)在1月龄羔羊皮肤中高表达,这可能和早期弯曲羊毛的形成有很大的相关性[38]。进一步研究发现,在滩羊羔羊生长成为成年羊的过程中,其毛发卷曲的消失是因为KRT71受到骨髓锌指转录因子MZF1在其启动子区域的负调控作用导致它的表达量下降造成的[39]。同样是滩羊在生长过程中的羊毛卷曲消失的现象,新的研究发现,环化酶相关蛋白转录因子CAP1对KRT83 5′UTR区的结合会导致其表达量下降,从而引起弯曲的消失[40]。除了序列上游区域专一控制其下游编码基因之外,Zhao等[41]还发现,绵羊KRTAP11-1的启动子区域可以控制其他与毛发特征相关的基因,从而控制毛发的生长。除了角蛋白和角蛋白关联蛋白的控制外,毛发的特征可能还会受到普通调控因子的影响。Demars等[42]利用数量性状基因座(QTL)定位克隆的方式对全球范围内不同品种绵羊的毛发特征进行关联性分析,发现IRF2BP2基因由于DNA序列被EIF2S2基因的反义链插入到3'端,导致翻译后的mRNA与正常的EIF2S2 mRNA产生互补,引起RNA-RNA杂交的现象形成双链RNA,从而造成两个基因的正常翻译受阻,导致绵羊羊毛卷曲。
真皮乳头细胞作为间充质细胞,通过信号传导的方式对上皮祖细胞的分化起到精细的调控作用,是毛发各层细胞生长的“总控室”[43]。在离体的人真皮乳头细胞中使用雄性激素进行处理发现其增殖的标志基因KRT6的表达量减少,证明了雄性激素是通过促进Wnt拮抗剂GSK3β的表达来抑制毛发诱导分化的进程[44]。人的真皮乳头细胞对毛发生长的诱导能力是通过Wnt/β-catenin通路进行控制的,对下游T细胞因子TCF4基因的表达进行抑制后发现,真皮乳头的增殖能力下降,并且其诱导能力受到阻碍[45]。CD133作为真皮乳头细胞中Wnt通路的上游激活剂以及诱导毛发生长的标志基因,其可以维持真皮乳头细胞在离体情况下依然拥有较良好的诱导角质形成细胞生长的能力[46]。有研究发现,真皮乳头诱导能力的具体机制中还包括了H19、HOTAIR等长链非编码基因对Wnt通路中编码基因的调节,从而控制它们诱导上皮细胞的能力[47]。
3.2 相关分子的网络调控关系毛发弯曲的调节机制与毛囊形态发育的通路密切相关,通路的活性异常以及通路调控分子呈现的多态性是导致毛囊形态以及衍生物多样性的原因。近年的研究发现,Wnt、EDA/EDAR、EGFR、BMP、NF-κB、Shh等经典信号通路与毛发弯曲有着直接或间接的联系(图 4)[48-51]。除此之外,由于具有通过真皮乳头诱导调节毛发重新生长的功能,哺乳动物的雷帕霉素靶蛋白(mTOR)通路也被提出与真皮乳头的差异生长导致毛发弯曲有关[11]。

|
图 4 毛发形态发育相关基因的调控网络图 Figure 4 Gene regulation network related to hair formation |
Wnt复合物通过对GSK3β的超磷酸化促进β-连环蛋白(β-catenin)表达,使其作为衔接分子促使E-钙黏着蛋白(E-cadherin)和中间丝进行附着连接,稳定细胞结构[52]。活化的β-catenin影响一系列转录因子的表达,淋巴增强因子1(LEF1)作为上游基因促进另一个转录因子homeobox(Hox)的表达,Hox作为KRTs、KAPs和其他毛发相关蛋白基因的启动子结合区域对毛发结构生长起着重要的作用[53]。EDAR作为Wnt/β-catenin通路的重要转录产物,其对下游重要的枢纽基因NF-κB有着调节作用,并且EDAR本身对人毛发的直径和弯曲就有影响[54]。牛姝等[55]利用免疫组织化学技术发现,绵羊不同部位皮肤KRT71和β-catenin的蛋白水平有差异,且它们的表达量与毛发弯曲呈正相关,证明这些蛋白在毛发弯曲中可能起着促进作用。作为调控网络中重要的枢纽,转录因子NF-κB对下游多个与毛发生长相关的通路及标志基因起着调控作用,如Wnt10a和Wnt10b,它们对上皮细胞的分化和毛干的生长有重要影响[56]。作为EDAR通过NF-κB的靶基因,Dkk4具有抑制Wnt通路活性的作用,并且已有报道其对锯齿状毛发的形成有促进作用[57]。内根鞘特异性定位的GATA3蛋白通过上游SMAD4通路的激活呈现高表达的状态,与毛纤维的角化修饰具有关联性,从而影响其区域性的硬化程度,同时也会促进下游TCHH的表达[27]。SMAD4同样会激活Msx,从而决定上皮细胞增殖或分化的速度[58]。COX2通过IL-1激活PLA而获得花生四烯酸底物,从而激活反馈机制,促进NF-κB[59],影响毛发生长周期[60]。Sostdc1具有调节毛发生长和成骨过程的作用,受到维生素D受体基因(VDR)的负调控[61],而VDR通常和维甲类X受体(RXR)形成二聚化复合物来调节细胞内的钙离子代谢。在小鼠模型中,上皮生长因子受体(EGFR)受到COX2/GPCRs通路的调控,其非同义突变导致小鼠出现波浪毛发[62]。Wnt通过促使GSK3β超磷酸化以及随后一系列的磷酸化负调控作用导致mTOR通路被激活,从而在毛囊发育早期引起增殖抑制而促进分化的过程,mTOR通路在真皮乳头的局部性激活可能导致真皮乳头的不对称生长,从而引起毛发弯曲[11]。
4 弯曲毛发发育与个体发育进程的关系毛囊是在胚胎早期有规律的表皮退化,上皮组织内陷而形成的[63],因此可以推测,毛发的形态变化可能在不同时期会受到不同基因通路的调控。例如与毛发形态相关的Wnt10a基因在开始的毛发生长周期与随后的生长周期相比是上调的,它的位点突变也会导致毛发生长障碍[64]。具有非洲血统的小孩可能在出生后的12个月内都是疏松的卷发,而这段时间以后会长出更加紧致、弯曲程度更强的卷发[65]。对敖汉细毛羊从出生前到羔羊共4个时期的EphA2及其配体基因EphrinA2在毛囊中的表达规律进行探究,发现它们与出生前的毛囊形态发生、发育密切相关[66]。此外,在美利奴羊中存在一种“felting lustre mutant”的羊毛现象,即出生后相继生长出3种差异卷曲的羊毛[3],推测可能第一毛囊生长周期受到了与胚胎发育过程相关的分子调控,而其余时期并没有,但这样的可能性有待进一步研究验证。
5 总结与展望皮质层作为毛发纤维的结构基础,近年提出的正、副皮质特征分布、中间丝的巨纤维束与毛发纤维扭转压力的关系以及皮质细胞的生长与角化的相对速度对羊毛和动物毛发弯曲的影响都有待进一步的探究。另外,内根鞘的存在不仅支撑和保护了毛发纤维的生长,并且对其形状、大小有参与的作用,甚至在结构上对毛发纤维的弯曲都有可能进行较广范围的塑造。真皮乳头作为有丝分裂细胞生长增殖以及分化的调解中心,可以认为它是调节纤维形态的启动者,因此真皮乳头的诱导若出现障碍或失调会导致毛囊细胞层的不对称生长,因而导致毛发弯曲等现象产生。
在人以及小鼠的试验模型上,逐渐发现了调节毛囊结构分化、毛干形态发生等过程的重要信号通路以及受其调控的关键基因,但有些功能基因在物种内也存在很低的保守性,因此直接借鉴的方式不一定可取。若要了解绵、山羊确切的控制毛发形态的调控机理,需要在借鉴已知与毛发弯曲相关信号通路的基础上,再对该物种的基因组序列、转录组表达谱以及蛋白质组学方面对毛发弯曲的关联性分析进行系统性的研究,找到真正与羊毛弯曲相关的调控基因以及所属信号通路。
羊毛作为纺织业主导的毛发纤维产品,了解其品质的本质即形态结构产生的机理是十分有必要的。此外,绵、山羊出生后的羊毛动态弯曲现象可能与胚胎发育过程的调节通路相关,若能以人、小鼠等前沿的毛发结构形态研究为参考基础,了解羊毛弯曲形态在经典遗传学和表观遗传学上确切的调控机理,可以为延长羔羊到成年羊屠宰前生长日期,获得大量、优良、精致、美观的羊毛和裘皮制品提供可能性。
| [1] | WORTMANN F J, WORTMANN G. A somewhat unexpected result from the deconvolution of DSC curves for human hair:there is no apparent relation between cortical cell fractions and hair curliness[J]. Exp Dermatol, 2018, 27(3): 292–294. DOI: 10.1111/exd.2018.27.issue-3 |
| [2] | WESTGATE G E, GINGER R S, GREEN M R. The biology and genetics of curly hair[J]. Exp Dermatol, 2017, 26(6): 483–490. DOI: 10.1111/exd.2017.26.issue-6 |
| [3] | ROGERS G E. Biology of the wool follicle:an excursion into a unique tissue interaction system waiting to be rediscovered[J]. Exp Dermatol, 2006, 15(12): 931–949. DOI: 10.1111/exd.2006.15.issue-12 |
| [4] | WESTGATE G E, BOTCHKAREVA N V, TOBIN D J. The biology of hair diversity[J]. Int J Cosmet Sci, 2013, 35(4): 329–336. DOI: 10.1111/ics.12041 |
| [5] | HARDY M H, LYNE A G. The pre-natal development of wool follicles in Merino sheep[J]. Aust J Biol Sci, 1956, 9: 423–441. |
| [6] | YANG H, ADAM R C, GE Y J, et al. Epithelial-mesenchymal micro-niches govern stem cell lineage choices[J]. Cell, 2017, 169(3): 483–496. DOI: 10.1016/j.cell.2017.03.038 |
| [7] |
李新海, 张洋, 冯彤, 等. 中卫山羊羊毛弯曲的表型分析[J]. 中国草食动物科学, 2015, 35(6): 11–13.
LI X H, ZHANG Y, FENG T, et al. Phenotypic analysis of the wool curvature in Zhongwei goat[J]. China Herbivore Science, 2015, 35(6): 11–13. (in Chinese) |
| [8] | VANDENBERG L N, LEVIN M. Perspectives and open problems in the early phases of left-right patterning[J]. Semin Cell Dev Biol, 2009, 20(4): 456–463. DOI: 10.1016/j.semcdb.2008.11.010 |
| [9] | VANDENBERG L N, LEVIN M. Far from solved:a perspective on what we know about early mechanisms of left-right asymmetry[J]. Dev Dyn, 2010, 239(12): 3131–3146. DOI: 10.1002/dvdy.v239:12 |
| [10] | SRIWIRIYANONT P, HACHIYA A, PICKENS W L, et al. Effects of IGF-binding protein 5 in dysregulating the shape of human hair[J]. J Invest Dermatol, 2011, 131(2): 320–328. DOI: 10.1038/jid.2010.309 |
| [11] | NISSIMOV J N, DAS CHAUDHURI A B. Hair curvature:a natural dialectic and review[J]. Biol Rev, 2014, 89(3): 723–766. DOI: 10.1111/brv.2014.89.issue-3 |
| [12] | ORWIN D F, WOODS J L, RANFORD S L. Cortical cell types and their distribution in wool fibres[J]. Aust J Biol Sci, 1984, 37(4): 237–256. DOI: 10.1071/BI9840237 |
| [13] | ROGERS G E. Electron microscopy of wool[J]. J Ultrastruct Res, 1959, 2(3): 309–330. DOI: 10.1016/S0022-5320(59)80004-6 |
| [14] | KASSENBECK P. Morphology and fine structure of hair[M]//ORFANOS C E, MONTAGNA W, STÜTTGEN G. Hair Research. Berlin, Heidelberg: Springer, 1981. https://link.springer.com/chapter/10.1007%2F978-3-642-81650-5_9 |
| [15] | HYND P I, EDWARDS N M, HEBART M, et al. Wool fibre crimp is determined by mitotic asymmetry and position of final keratinisation and not ortho-and para-cortical cell segmentation[J]. Animal, 2009, 3(6): 838–843. DOI: 10.1017/S1751731109003966 |
| [16] | KAPLIN I J, WHITELEY K J. An electron microscope study of fibril:matrix arrangements in high-and low-crimp wool fibres[J]. Aust J Biol Sci, 1978, 31(3): 231–240. DOI: 10.1071/BI9780231 |
| [17] | HARLAND D P, CALDWELL J P, WOODS J L, et al. Arrangement of trichokeratin intermediate filaments and matrix in the cortex of Merino wool[J]. J Struct Biol, 2011, 173(1): 29–37. DOI: 10.1016/j.jsb.2010.08.009 |
| [18] | HARLAND D P, WALLS R J, VERNON J A, et al. Three-dimensional architecture of macrofibrils in the human scalp hair cortex[J]. J Struct Biol, 2014, 185(3): 397–404. DOI: 10.1016/j.jsb.2014.01.010 |
| [19] | FIETZ M J, ROGERS G E, EYRE H J, et al. Mapping of the trichohyalin gene:co-localization with the profilaggrin, involucrin, and loricrin genes[J]. J Invest Dermatol, 1992, 99(5): 542–544. DOI: 10.1111/1523-1747.ep12667301 |
| [20] | BIRBECK M S C, MERCER E H. The electron microscopy of the human hair follicle:Part 3.The inner root sheath and trichohyaline[J]. J Biophys Biochem Cytol, 1957, 3(2): 223–230. DOI: 10.1083/jcb.3.2.223 |
| [21] | O'KEEFE E J, HAMILTON E H, LEE S C, et al. Trichohyalin:a structural protein of hair, tongue, nail, and epidermis[J]. J Invest Dermatol, 1993, 101(1S): 65S–71S. |
| [22] | BASMANAV F B Ü, CAU L, TAFAZZOLI A, et al. Mutations in three genes encoding proteins involved in hair shaft formation cause uncombable hair syndrome[J]. Am J Hum Genet, 2016, 99(6): 1292–1304. DOI: 10.1016/j.ajhg.2016.10.004 |
| [23] | LANGBEIN L, PRAETZEL S, ROGERS M A, et al. A novel epithelial keratin, hK6irs1, is expressed differentially in all layers of the inner root sheath, including specialized huxley cells (Flügelzellen) of the human hair follicle[J]. J Invest Dermatol, 2002, 118(5): 789–799. DOI: 10.1046/j.1523-1747.2002.01711.x |
| [24] | ROGERS M A, WINTER H, SCHWEIZER J, et al. K6irs1, K6irs2, K6irs3, and K6irs4 represent the inner-root-sheath-specific type Ⅱ epithelial keratins of the human hair follicle[J]. J Invest Dermatol, 2003, 120(4): 512–522. DOI: 10.1046/j.1523-1747.2003.12087.x |
| [25] | CHI W, WU E, MORGAN B A. Dermal papilla cell number specifies hair size, shape and cycling and its reduction causes follicular decline[J]. Development, 2013, 140(8): 1676–1683. DOI: 10.1242/dev.090662 |
| [26] | MORGAN B A. The dermal papilla:an instructive niche for epithelial stem and progenitor cells in development and regeneration of the hair follicle[J]. Cold Spring Harb Perspect Med, 2014, 4(7): a015180. DOI: 10.1101/cshperspect.a015180 |
| [27] | MEDLAND S E, NYHOLT D R, PAINTER J N, et al. Common variants in the trichohyalin gene are associated with straight hair in Europeans[J]. Am J Hum Genet, 2009, 85(5): 750–755. DOI: 10.1016/j.ajhg.2009.10.009 |
| [28] | WU S J, TAN J Z, YANG Y J, et al. Genome-wide scans reveal variants at EDAR predominantly affecting hair straightness in Han Chinese and Uyghur populations[J]. Hum Genet, 2016, 135(11): 1279–1286. DOI: 10.1007/s00439-016-1718-y |
| [29] | THIBAUT S, BARBARAT P, LEROY F, et al. Human hair keratin network and curvature[J]. Int J Dermatol, 2007, 46(Suppl 1): 7–10. |
| [30] | FUJIMOTO A, KIMURA R, OHASHI J, et al. A scan for genetic determinants of human hair morphology:EDAR is associated with Asian hair thickness[J]. Hum Mol Genet, 2008, 17(6): 835–843. DOI: 10.1093/hmg/ddm355 |
| [31] | KAMBEROV Y G, WANG S J, TAN J Z, et al. Modeling recent human evolution in mice by expression of a selected EDAR variant[J]. Cell, 2013, 152(4): 691–702. DOI: 10.1016/j.cell.2013.01.016 |
| [32] | ADHIKARI K, FONTANIL T, CAL S, et al. A genome-wide association scan in admixed Latin Americans identifies loci influencing facial and scalp hair features[J]. Nat Commun, 2016, 7: 10815. DOI: 10.1038/ncomms10815 |
| [33] |
狄江, 刘剑锋, 徐新明, 等. 中国美利奴(新疆型)羊毛弯曲频率性状的全基因组关联分析[J]. 新疆农业科学, 2015, 52(11): 2129–2135.
DI J, LIU J F, XU X M, et al. Genome-wide association studies on the wool staple crimp frequency in Chinese merino sheep (Xinjiang type)[J]. Xinjiang Agricultural Sciences, 2015, 52(11): 2129–2135. (in Chinese) |
| [34] |
张文建, 马广伟, 张潇飞, 等. 羊毛品质性状相关基因CCNY的验证和分析[J]. 畜牧兽医学报, 2017, 48(8): 1389–1400.
ZHANG W J, MA G W, ZHANG X F, et al. Verification and analysis of wool quality traits-associated CCNY gene[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(8): 1389–1400. (in Chinese) |
| [35] | JOLLES P, ZAHN H, HOCKER H. Formation and structure of human hair[J]. Text Res J, 1997, 67(11): 853. |
| [36] | YU Z D, WILDERMOTH J E, WALLACE O A M, et al. Annotation of sheep keratin intermediate filament genes and their patterns of expression[J]. Exp Dermatol, 2011, 20(7): 582–588. DOI: 10.1111/exd.2011.20.issue-7 |
| [37] | GANDOLFI B, ALHADDAD H, JOSLIN S E K, et al. A splice variant in KRT71 is associated with curly coat phenotype of Selkirk Rex cats[J]. Sci Rep, 2013, 3: 2000. DOI: 10.1038/srep02000 |
| [38] | KANG X L, LIU G, LIU Y F, et al. Transcriptome profile at different physiological stages reveals potential mode for curly fleece in Chinese tan sheep[J]. PLoS One, 2013, 8(8): e71763. DOI: 10.1371/journal.pone.0071763 |
| [39] | KANG X L, LIU Y F, ZHANG J B, et al. Characteristics and expression profile of KRT71 screened by suppression subtractive hybridization cDNA library in curly fleece Chinese tan sheep[J]. DNA Cell Biol, 2017, 36(7): 552–564. DOI: 10.1089/dna.2017.3718 |
| [40] | LIU Y F, KANG X L, YANG W J, et al. Differential expression of KRT83 regulated by the transcript factor CAP1 in Chinese Tan sheep[J]. Gene, 2017, 614: 15–20. DOI: 10.1016/j.gene.2017.03.007 |
| [41] | ZHAO Z C, LIU G B, LI X Y, et al. Characterization of the promoter regions of two sheep keratin-associated protein genes for hair cortex-specific expression[J]. PLoS One, 2016, 11(4): e0153936. DOI: 10.1371/journal.pone.0153936 |
| [42] | DEMARS J, CANO M, DROUILHET L, et al. Genome-wide identification of the mutation underlying fleece variation and discriminating ancestral hairy species from modern woolly sheep[J]. Mol Biol Evol, 2017, 34(7): 1722–1729. DOI: 10.1093/molbev/msx114 |
| [43] | LEI M X, YANG L, CHUONG C M. Getting to the core of the dermal papilla[J]. J Invest Dermatol, 2017, 137(11): 2250–2253. DOI: 10.1016/j.jid.2017.07.824 |
| [44] | LEIROS G J, ATTORRESI A I, BALAÁ M E. Hair follicle stem cell differentiation is inhibited through cross-talk between Wnt/β-catenin and androgen signalling in dermal papilla cells from patients with androgenetic alopecia[J]. Br J Dermatol, 2012, 166(5): 1035–1042. DOI: 10.1111/j.1365-2133.2012.10856.x |
| [45] | XIONG Y, LIU Y, SONG Z Q, et al. Identification of Wnt/β-catenin signaling pathway in dermal papilla cells of human scalp hair follicles:TCF4 regulates the proliferation and secretory activity of dermal papilla cell[J]. J Dermatol, 2014, 41(1): 84–91. DOI: 10.1111/1346-8138.12313 |
| [46] | ZHOU L L, YANG K, XU M G, et al. Activating β-catenin signaling in CD133-positive dermal papilla cells increases hair inductivity[J]. FEBS J, 2016, 283(15): 2823–2835. DOI: 10.1111/febs.13784 |
| [47] | LIN C M, LIU Y, HUANG K, et al. Long noncoding RNA expression in dermal papilla cells contributes to hairy gene regulation[J]. Biochem Biophys Res Commun, 2014, 453(3): 508–514. DOI: 10.1016/j.bbrc.2014.09.119 |
| [48] | TELERMAN S B, ROGNONI E, SEQUEIRA I, et al. Dermal blimp1 acts downstream of epidermal TGFβ and WNT/β-catenin to regulate hair follicle formation and growth[J]. J Invest Dermatol, 2017, 137(11): 2270–2281. DOI: 10.1016/j.jid.2017.06.015 |
| [49] | LU C P, POLAK L, KEYES B E, et al. Spatiotemporal antagonism in mesenchymal-epithelial signaling in sweat versus hair fate decision[J]. Science, 2016, 354(6319): aah6102. DOI: 10.1126/science.aah6102 |
| [50] | TOMANN P, PAUS R, MILLAR S E, et al. Lhx2 is a direct NF-κB target gene that promotes primary hair follicle placode down-growth[J]. Development, 2016, 143(9): 1512–1522. DOI: 10.1242/dev.130898 |
| [51] | RISHIKAYSH P, DEV K, DIAZ D, et al. Signaling involved in hair follicle morphogenesis and development[J]. Int J Mol Sci, 2014, 15(1): 1647–1670. DOI: 10.3390/ijms15011647 |
| [52] | FUCHS E, NOWAK J A. Building epithelial tissues from skin stem cells[J]. Cold Spring Harb Symp Quant Biol, 2008, 73: 333–350. DOI: 10.1101/sqb.2008.73.032 |
| [53] | LORENZ K, GRASHOFF C, TORKA R, et al. Integrin-linked kinase is required for epidermal and hair follicle morphogenesis[J]. J Cell Biol, 2007, 177(3): 501–513. DOI: 10.1083/jcb.200608125 |
| [54] | MOU C Y, THOMASON H A, WILLAN P M, et al. Enhanced ectodysplasin-A receptor (EDAR) signaling alters multiple fiber characteristics to produce the East Asian hair form[J]. Hum Mutat, 2008, 29(12): 1405–1411. DOI: 10.1002/humu.v29:12 |
| [55] |
牛姝, 李淑敏, 何清, 等. 毛发弯曲度相关蛋白KRT71和β-catenin在绵羊毛囊的定位表达[J]. 中国兽医科学, 2017, 47(5): 660–663.
NIU S, LI S M, HE Q, et al. Expression and localization of KRT71 and β-catenin in sheep hair follicle[J]. Chinese Veterinary Science, 2017, 47(5): 660–663. (in Chinese) |
| [56] | ZHANG Y H, TOMANN P, ANDL T, et al. Reciprocal requirements for EDA/EDAR/NF-κB and WNT/β-catenin signaling pathways in hair follicle induction[J]. Dev Cell, 2009, 17(1): 49–61. DOI: 10.1016/j.devcel.2009.05.011 |
| [57] | CUI C Y, KUNISADA M, PIAO Y L, et al. Dkk4 and Eda regulate distinctive developmental mechanisms for subtypes of mouse hair[J]. PLoS One, 2010, 5(4): e10009. DOI: 10.1371/journal.pone.0010009 |
| [58] | ELLIS T, GAMBARDELLA L, HORCHER M, et al. The transcriptional repressor CDP (Cutl1) is essential for epithelial cell differentiation of the lung and the hair follicle[J]. Genes Dev, 2001, 15(17): 2307–2319. DOI: 10.1101/gad.200101 |
| [59] | TILSTRA J S, CLAUSON C L, NIEDERNHOFER L J, et al. NF-κB in aging and disease[J]. Aging Dis, 2011, 2(6): 449–465. |
| [60] | TSURUKI T, TAKAHATA K, YOSHIKAWA M. Mechanism of the protective effect of intraperitoneally administered agonists for formyl peptide receptors against chemotherapy-induced alopecia[J]. Biosci Biotechnol Biochem, 2007, 71(5): 1198–1202. DOI: 10.1271/bbb.60656 |
| [61] | HAUSSLER M R, HAUSSLER C A, WHITFIELD G K, et al. The nuclear vitamin D receptor controls the expression of genes encoding factors which feed the "Fountain of Youth" to mediate healthful aging[J]. J Steroid Biochem Mol Biol, 2010, 121(1-2): 88–97. DOI: 10.1016/j.jsbmb.2010.03.019 |
| [62] | CHENG X P, JIN J, HU L, et al. TRP channel regulates EGFR signaling in hair morphogenesis and skin barrier formation[J]. Cell, 2010, 141(2): 331–343. DOI: 10.1016/j.cell.2010.03.013 |
| [63] | ROBINS E J, BREATHNACH A S. Fine structure of the human foetal hair follicle at hair-peg and early bulbous-peg stages of development[J]. J Anat, 1969, 104(Pt 3): 553–569. |
| [64] | ERIKSSON N, MACPHERSON J M, TUNG J Y, et al. Web-based, participant-driven studies yield novel genetic associations for common traits[J]. PLoS Genet, 2010, 6(6): e1000993. DOI: 10.1371/journal.pgen.1000993 |
| [65] | AJOSE F O. Diseases that turn African hair silky[J]. Int J Dermatol, 2012, 51(Suppl 1): 12–16. |
| [66] |
贺建宁, 王春亮, 赵金山, 等. EphA2及EphrinA2在敖汉细毛羊皮肤中的表达及分布规律研究[J]. 畜牧兽医学报, 2016, 47(3): 509–514.
HE J N, WANG C L, ZHAO J S, et al. Expression and distribution of EphA2 and EphrinA2 in skin of Aohan fine wool sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(3): 509–514. (in Chinese) |



