新城疫病毒(Newcastle disease virus,NDV)属于副黏病毒科禽腮腺炎病毒属成员,是一种有囊膜、含有单股负链不分节段基因组的RNA病毒,其基因组可编码8种病毒蛋白[1]。M蛋白是NDV基因组编码的一种非糖基化膜相关蛋白,位于病毒囊膜内表面,在病毒基因组复制转录以及子代病毒粒子组装和释放过程中发挥了重要作用[2]。与大多数副黏病毒的M蛋白一样,NDV M蛋白也是一种细胞核-细胞质穿梭蛋白[3],其细胞核定位主要是由核转运受体蛋白importin β1识别和结合M蛋白中存在的核定位信号(nuclear localization signal,NLS),然后在RanGTP的帮助下完成入核转运[4-5]。近年来的研究结果表明,NLS介导的病毒蛋白细胞核定位与病毒的复制增殖过程密切相关,如Sanchez等[6]对A型流感病毒NP蛋白NLS进行突变,发现突变体病毒不能有效地形成病毒核糖核蛋白体,并且病毒粒子的装配受到严重影响,导致病毒的复制能力显著下降;Li等[7]发现NLS介导的禽呼肠孤病毒p17蛋白细胞核定位能有效促进病毒诱导的细胞自噬并且增强病毒的复制能力;Chen等[8]首次鉴定了杆状病毒LEF-11蛋白NLS,发现该NLS介导的LEF-11蛋白细胞核定位对病毒基因组DNA的复制非常重要。
目前,对其他副黏病毒(如呼吸道合胞体病毒、麻疹病毒和尼帕病毒)M蛋白功能的研究发现,NLS介导的M蛋白细胞核定位对副黏病毒的复制进程和致病性均有重要作用[9]。作为副黏病毒重要成员之一的NDV,其M蛋白细胞核定位与NDV致病性的关系尚不清楚。课题组前期通过反向遗传操作技术拯救出M蛋白NLS突变体NDV,发现其M蛋白不能进入病毒感染细胞的细胞核,并且突变体病毒的毒力、HA效价和在细胞中的复制能力均显著降低[5]。为进一步研究M蛋白NLS突变对NDV致病性的影响,本研究将M蛋白NLS突变体NDV感染4周龄SPF鸡,检测鸡喉头和泄殖腔排毒情况、组织脏器中病毒含量,并对免疫器官进行组织病理切片观察,以及分析免疫器官中M蛋白的表达量和相关细胞因子的表达变化,为后续深入研究M蛋白细胞核定位在NDV致病性中的作用奠定工作基础。
1 材料与方法 1.1 病毒、鸡胚和SPF鸡表达GFP的重组NDV rSS1GFP(MDT为54 h、ICPI为1.88,TCID50为108.79·mL-1,HA效价为8log2)以及M蛋白NLS突变的重组NDV rSS1GFP-M/NLSm(MDT>120 h、ICPI为1.67,TCID50为106.17·mL-1,HA效价为4log2)经过3次空斑纯化后由本实验室保存[5]。SPF鸡胚购自北京梅里亚维通实验动物公司,孵化至10日龄使用;4周龄SPF鸡由SPF鸡胚孵化饲养而成。
1.2 主要试剂TRIzol Reagent、cDNA第一链合成试剂盒购自Thermo Fisher公司;TB GreenTM Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)荧光定量PCR试剂盒购自宝日医生物技术(北京)有限公司;青链霉素混合液(100×)、10×PBS缓冲液购自北京索莱宝科技有限公司;10%中性甲醛固定液、苏木素伊红(HE)染色试剂盒购自上海歌凡生物科技有限公司;NP-40裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液、预染蛋白质分子量标准、抗β-actin鼠单克隆抗体、HRP标记山羊抗小鼠IgG(H+L)、ECL化学发光试剂盒购自碧云天生物技术有限公司;抗NDV M蛋白鼠多克隆抗体由实验室制备保存;其他试剂均为国产分析纯。
1.3 病毒对SPF鸡的致病性试验 1.3.1 试验鸡分组与设计将48只4周龄SPF鸡随机分为3组,每组16只(其中10只用于临床症状观察、6只用于样品采集),分别接种rSS1GFP、rSS1GFP-M/NLSm和PBS。试验组鸡以点眼滴鼻的方式接种106.0 TCID50的病毒,0.1 mL·只-1;对照组的鸡接种0.1 mL PBS。每天观察和记录各组鸡的临床症状、发病数和死亡数,及时解剖死亡鸡并观察其组织病理变化。
1.3.2 试验鸡喉头和泄殖腔排毒检测在病毒感染后的第3、5天分别采集各组鸡的喉头和泄殖腔拭子,经过处理后接种10日龄SPF鸡胚分离病毒,检测喉头和泄殖腔的排毒情况。对接种后24 h内死亡的鸡胚,收集鸡胚尿囊液再次接种,并检测各代尿囊液血凝性,根据文献方法计算病毒的EID50[10]。
1.3.3 试验鸡组织器官病毒含量检测在病毒感染后的第5天分别剖杀各组试验鸡,每组3只,无菌采集心、肝、脾、肺、肾、脑、气管、十二指肠、胸腺、法氏囊等10种组织样品(质量在0.1~0.5 g),研磨后离心分离上清并接种10日龄SPF鸡胚,根据文献方法计算病毒的EID50[10]。
1.3.4 试验鸡免疫器官病理组织学观察在病毒感染后的第5天,分别采集各组鸡的免疫器官(脾、胸腺、法氏囊)固定于10%中性甲醛固定液,按病理切片制作方法对组织样品进行脱水、石蜡包埋、切片和HE染色,观察各组鸡免疫器官的病理组织学变化。
1.4 M蛋白在试验鸡免疫器官中的表达量检测分别采集病毒感染试验鸡后第5天的免疫器官(脾、胸腺、法氏囊),液氮研磨后进行裂解,4 ℃高速离心后取上清并测定组织蛋白含量。从不同试验组组织中各取20 μg总蛋白,加入蛋白上样缓冲液煮沸处理后进行SDS-PAGE电泳,随后将蛋白转印到PVDF膜。用5%脱脂乳把PVDF膜于37 ℃封闭1 h,然后加入1:1 000稀释的抗M蛋白鼠多克隆抗体和抗β-actin鼠单克隆抗体于37 ℃孵育2 h;TBST洗3次,加入1:2 000稀释的HRP标记的山羊抗小鼠IgG(H+L)于37 ℃孵育1 h;TBST洗3次,用ECL化学发光试剂盒进行显色。使用ImageJ 1.2.4软件分析不同试验组免疫器官中M蛋白的相对表达量。
1.5 试验鸡免疫器官细胞因子基因表达水平检测在病毒感染后的第5天,分别采集各组鸡的免疫器官(脾、胸腺、法氏囊),采用荧光定量PCR方法检测鸡感染病毒后免疫器官中相关细胞因子(包括IL-1β、IL-6、IL-10、IFN-α、IFN-β、IFN-λ)的基因表达变化。参照GenBank收录的细胞因子基因序列,设计特异性引物(表 1),利用TB GreenTM Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)试剂盒进行荧光定量PCR,反应体系为20 μL。细胞因子基因的相对表达水平以β-actin作为内参基因,采用2-△△Ct法计算细胞因子基因在免疫器官中的相对表达水平。
|
|
表 1 荧光定量PCR检测细胞因子基因表达的引物序列 Table 1 Primers used to detect the expression of cytokines by qRT-PCR |
4周龄SPF鸡感染亲本病毒rSS1GFP后的第3天开始出现食欲减退、精神沉郁、呆立不动、排黄绿色稀粪、翅膀下垂;第4天表现为张口呼吸、头颈震颤、歪头、转圈等神经症状,并且有2只鸡死亡;第5天鸡全部死亡。剖检观察发现病死鸡具有典型的ND病理变化,如气管和腺胃乳头严重出血、脾肿大坏死、胰充血和出血、肠黏膜出血、胸腺和法氏囊萎缩(图略)。
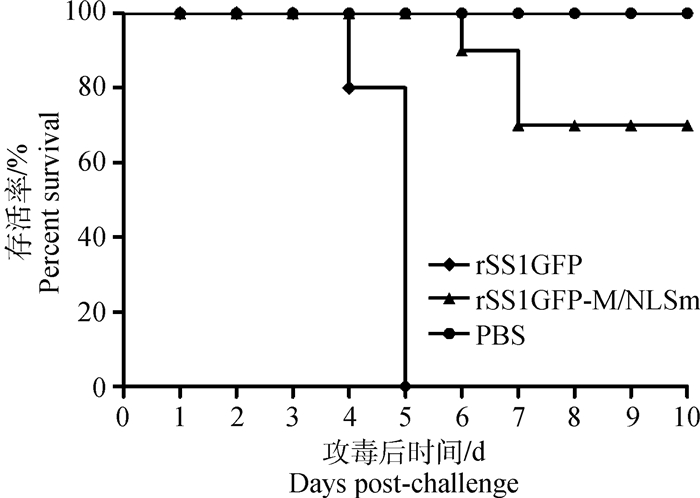
4周龄SPF鸡感染突变体病毒rSS1GFP-M/NLSm后于第5天部分鸡出现轻微的精神沉郁;到第6天有2只鸡出现严重的精神沉郁、张口呼吸、头颈震颤和歪头,并且有1只鸡死亡;第7天有2只鸡死亡,在后续试验中未出现鸡的死亡。剖检观察发现病死鸡仅有轻微的病理变化,如脾肿大、胸腺出血(图略)。接种PBS的对照组鸡均未表现临床症状和出现死亡。rSS1GFP感染组、rSS1GFP-M/NLSm感染组和PBS对照组的鸡存活率分别为0%、70%和100%(图 1)。以上结果说明M蛋白NLS突变降低NDV对鸡的致死率。
|
图 1 鸡感染病毒后的存活率 Figure 1 The survival rate of virus-infected experimental chickens |
对鸡感染病毒后的喉头和泄殖腔排毒情况进行检测,结果显示鸡感染rSS1GFP后的第3天喉头和泄殖腔排毒量最高,分别为103.4±0.3和101.9±0.5EID50·0.1 mL-1,但在第5天出现下降;而鸡感染rSS1GFP-M/NLSm后的第3天喉头和泄殖腔未检测到排毒,但在第5天检测到的喉头和泄殖腔排毒量要明显比rSS1GFP感染组低;对照组鸡的喉头和泄殖腔未检测到排毒(表 2)。以上结果说明M蛋白NLS突变减弱了病毒感染鸡后的排毒能力。
|
|
表 2 试验鸡喉头和泄殖腔排毒情况检测(x±s) Table 2 Virus titers in the laryngeal and cloacal swabs of experimental chickens (x±s) |
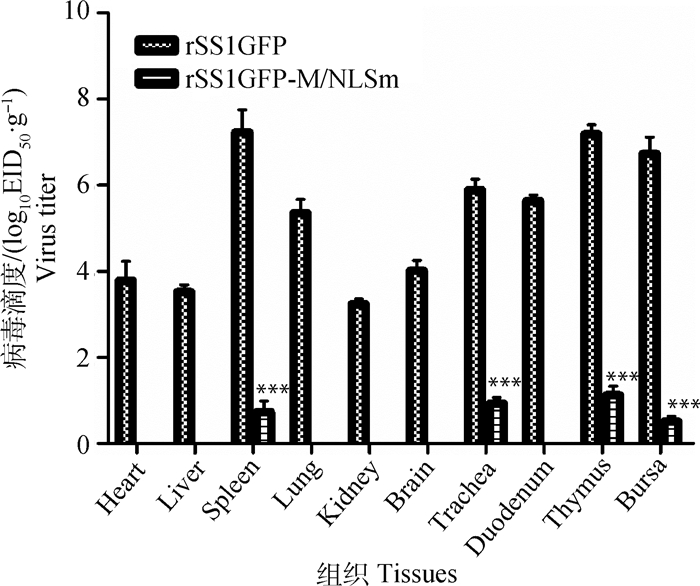
对鸡感染病毒后第5天不同组织中的病毒含量进行测定,结果显示rSS1GFP感染鸡后可在鸡的不同组织器官中有效复制,尤其以脾、胸腺、法氏囊和气管中的病毒含量高;而rSS1GFP-M/NLSm感染鸡后仅在鸡的脾、气管、胸腺和法氏囊中检测到病毒,并且病毒含量低(P < 0.001)(图 2)。以上结果说明M蛋白NLS突变降低病毒在鸡组织中的复制能力。
|
图 2 鸡感染病毒后的组织病毒含量检测 Figure 2 Detection of virus titers in different tissues of experimental chickens |
在鸡感染病毒后的第5天,对鸡的免疫器官(脾、胸腺、法氏囊)进行组织病理学观察,结果显示鸡感染rSS1GFP后脾出现多处坏死灶、淋巴细胞显著减少以及大量的巨噬细胞浸润;胸腺中有明显的组织增生、坏死以及淋巴细胞减少,胸腺小体结构被破坏;法氏囊中出现大面积的坏死,滤泡髓质区淋巴细胞和网状细胞数量明显减少(图 3)。而鸡感染rSS1GFP-M/NLSm后的脾、胸腺和法氏囊出现的病变与对照组相似,没有明显的病理学变化(图 3)。以上结果说明M蛋白NLS突变降低病毒对鸡免疫器官的损伤。
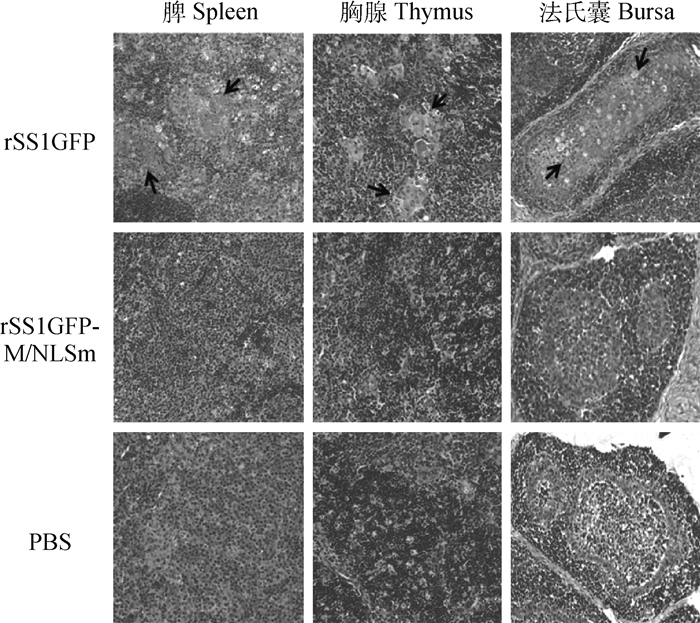
|
图 3 鸡感染病毒后免疫器官组织病理学观察(200×) Figure 3 Microscopic lesions in the immune organs of experimental chickens (200×) |
对试验鸡感染病毒后第5天的免疫器官(脾、胸腺、法氏囊)中NDV M蛋白表达情况进行Western blotting检测,结果显示rSS1GFP M蛋白在感染鸡的免疫器官中可大量表达,其中以胸腺中的表达量最高;而rSS1GFP-M/NLSm M蛋白在鸡的免疫器官中表达量均低于rSS1GFP M蛋白(图 4)。以上结果说明M蛋白NLS突变降低NDV M蛋白在鸡免疫器官中的表达。

|
图 4 M蛋白在试验鸡免疫器官中的表达检测 Figure 4 The expression of M protein in the immune organs of experimental chickens |
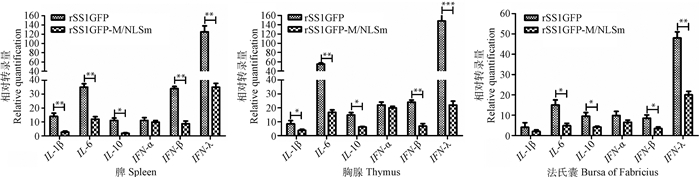
通过荧光定量PCR方法检测鸡感染病毒后第5天免疫器官中相关细胞因子的转录变化,结果显示:鸡感染病毒后的免疫器官中不同细胞因子的转录水平变化趋势基本一致,除IFN-α外,rSS1GFP感染所诱导的细胞因子转录能力均高于rSS1GFP-M/NLSm,其中IFN-λ在脾、胸腺和法氏囊中的转录量均为最高,IL-6的转录量次之;IFN-β和IL-1β在脾中的表达量高于胸腺和法氏囊,而IL-10在胸腺中的转录量高于脾和法氏囊(图 5)。以上结果说明M蛋白NLS突变降低了病毒诱导的鸡免疫器官中细胞因子的转录水平。
|
图 5 鸡感染病毒后免疫器官中细胞因子的转录变化 Figure 5 Transcription analysis of the cytokine genes in the immune organs of experimental chickens |
近年来,许多研究表明病毒蛋白细胞核定位对病毒的复制过程具有重要作用。例如Mori等[11]拯救了核心蛋白NLS突变的日本乙型脑炎病毒,与野生型病毒相比,突变型病毒由于抑制细胞基因的转录和翻译能力下降,导致在细胞内的复制增殖能力显著降低。Lee等[12]研究发现猪繁殖与呼吸综合征病毒NP蛋白细胞核定位可抑制宿主细胞的抗病毒免疫应答以及促进病毒在细胞内的有效复制。最近Rowe等[13]研究证实狂犬病病毒P蛋白在细胞核中能抑制宿主细胞基因转录,调节病毒基因组的复制和转录水平,干扰细胞抗病毒信号通路,从而促进病毒的复制。因此,病毒如何劫持和利用宿主细胞的转录、翻译和免疫系统,促进病毒的复制和致病进程逐渐成为国内外研究热点。
副黏病毒是一类对人和动物高度致病的、含有囊膜和单股负链不分节段基因组的RNA病毒,其M蛋白也被证实是一种多功能病毒蛋白。目前,对副黏病毒成员的呼吸道合胞体病毒和麻疹病毒M蛋白细胞核定位的功能研究发现[14-15],M蛋白在细胞核中主要有两个方面的作用:一是抑制宿主细胞基因的转录和翻译过程,促进病毒自身基因组的复制和转录;二是在病毒感染早期保证病毒基因组在细胞质中的复制和转录达到一定水平,才指导M蛋白进入细胞质进行子代病毒粒子的组装和释放。本课题组前期在拯救M蛋白NLS突变体NDV时,需要将收获的鸡胚尿囊液在SPF鸡胚上盲传3代才出现HA效价;与亲本病毒rSS1GFP相比,突变体病毒rSS1GFP-M/NLSm的毒力和空斑形成能力大大减弱,并且在鸡胚成纤维细胞中的复制效率和产生细胞病变能力明显降低[5],说明M蛋白NLS突变极大地影响了NDV的复制增殖能力。本研究中,M蛋白NLS突变体病毒感染SPF鸡后在鸡喉头和泄殖腔排毒量明显减少,致病时间延迟且引起的死亡率显著降低,同时造成的免疫器官组织病变明显减轻,说明M蛋白NLS突变引起的NDV复制增殖能力减弱可以明显降低NDV的致病力。另外,Duan等[16]前期拯救了M蛋白R42A突变体NDV,发现该病毒的M蛋白不能定位在细胞核,并且仅能在鸡的肺和免疫器官中少量复制。在本研究中,M蛋白NLS突变体病毒感染SPF鸡后仅在鸡的气管和免疫器官中复制且病毒滴度低,这与Duan等[16]的研究结果相符,其原因可能是NDV具有组织嗜性[17-18],虽然M蛋白突变降低了NDV的复制增殖能力,但是突变体病毒感染鸡后仍然能在免疫器官中少量复制。此外,本研究发现M蛋白NLS突变体病毒感染鸡后的第7—42天均未能检测到NDV抗体,这与以往的研究结果均不同,原因可能与病毒在免疫器官中的复制能力大大减弱且病毒滴度低有关,未能达到刺激机体产生相应抗体的病毒滴度。
有研究表明,除了病毒的复制效率对病毒致病性有重要影响外,病毒感染诱发的宿主免疫应答对病毒的致病性也有重要作用[19]。本研究对鸡分别感染亲本病毒rSS1GFP和突变体病毒rSS1GFP-M/NLSm后脾、胸腺和法氏囊中相关细胞因子的转录情况进行了比较,结果发现亲本病毒感染组的免疫器官中除IFN-α外,IL-1β、IL-6、IL-10、IFN-β和IFN-λ的转录水平均高于突变体病毒感染组。Nakamura等[20]研究发现NDV感染鸡后造成的过度免疫应答会对宿主自身细胞造成损伤,加剧炎症反应,进而加速鸡的死亡。笔者的研究结果发现亲本病毒感染鸡后在免疫器官中具有高复制效率,并且上调了免疫器官中IL-1β、IL-6、IL-10、IFN-β和IFN-λ的转录水平,诱发的细胞强烈炎性应答造成了免疫器官的严重损伤。相比之下,突变体病毒感染鸡后在免疫器官中复制效率低且诱发的免疫应答弱,所以造成的病理变化轻微。本研究与多个已发表的研究结果相一致[21-23],即:NDV在免疫器官中诱发的强烈免疫应答与病毒的致病性和病理变化保持一致。
在M蛋白NLS突变引起副黏病毒复制能力和致病性下降的机制研究方面,Pentecost等[24]拯救了M蛋白NLS突变的重组仙台病毒和腮腺炎病毒,通过鸟枪法蛋白质组学研究发现与病毒增殖和致病相关的细胞核蛋白和核仁蛋白发生了变化,这是导致突变体病毒复制和致病力下降的原因。综合国内外对副黏病毒M蛋白细胞核定位的功能研究,笔者推测M蛋白NLS突变导致的NDV复制和致病力降低可能与NDV基因组在细胞中的转录水平下降有关,因为突变体NDV在鸡免疫器官中的M蛋白表达量发生了显著降低;另外M蛋白NLS突变还可能会影响病毒感染后期子代病毒粒子的装配和释放,但是以上推测还需要更多的研究来证实。总之,本试验确定了M蛋白NLS突变可明显降低NDV的致病性,这为下一步开展M蛋白NLS突变对NDV基因组复制转录、病毒装配和出芽的影响,筛选和分析M蛋白NLS突变型和野生型NDV感染细胞的差异表达蛋白,阐明M蛋白NLS突变影响NDV复制和致病的作用机制奠定了基础。
4 结论M蛋白NLS突变可明显减弱NDV对SPF鸡的致病性,减少病毒在鸡喉头和泄殖腔的排毒量,降低病毒在鸡组织器官中的复制能力和对鸡免疫器官的病理损伤,以及降低免疫器官中M蛋白的表达量和细胞因子的表达水平。
| [1] | DUAN Z Q, XU H Q, JI X Q, et al. Recombinant Newcastle disease virus-vectored vaccines against human and animal infectious diseases[J]. Future Microbiol, 2015, 10(8): 1307–1323. DOI: 10.2217/FMB.15.59 |
| [2] |
段志强, 胡顺林, 刘秀梵. 新城疫病毒与其它副黏病毒基质蛋白功能的比较[J]. 微生物学报, 2016, 56(7): 1070–1078.
DUAN Z Q, HU S L, LIU X F. Function comparison of the matrix protein between Newcastle disease virus and other paramyxoviruses-a review[J]. Acta Microbiologica Sinica, 2016, 56(7): 1070–1078. (in Chinese) |
| [3] | HARRISON M S, SAKAGUCHI T, SCHMITT A P. Paramyxovirus assembly and budding:Building particles that transmit infections[J]. Int J Biochem Cell Biol, 2010, 42(9): 1416–1429. DOI: 10.1016/j.biocel.2010.04.005 |
| [4] | COLEMAN N A, PEEPLES M E. The matrix protein of Newcastle disease virus localizes to the nucleus via a bipartite nuclear localization signal[J]. Virology, 1993, 195(2): 596–607. DOI: 10.1006/viro.1993.1411 |
| [5] | DUAN Z Q, XU H X, JI X Q, et al. Importin α5 negatively regulates importin β1-mediated nuclear import of Newcastle disease virus matrix protein and viral replication and pathogenicity in chicken fibroblasts[J]. Virulence, 2018, 9(1): 783–803. DOI: 10.1080/21505594.2018.1449507 |
| [6] | SANCHEZ A, GUERRERO-JUAREZ C F, RAMIREZ J, et al. Nuclear localized Influenza nucleoprotein N-terminal deletion mutant is deficient in functional vRNP formation[J]. Virol J, 2014, 11: 155. DOI: 10.1186/1743-422X-11-155 |
| [7] | LI C X, WEI H C, YU L P, et al. Nuclear localization of the p17 protein of avian reovirus is correlated with autophagy induction and an increase in viral replication[J]. Arch Virol, 2015, 160(12): 3001–3010. DOI: 10.1007/s00705-015-2598-5 |
| [8] | CHEN T T, DONG Z Q, HU N, et al. Baculovirus LEF-11 nuclear localization signal is important for viral DNA replication[J]. Virus Res, 2017, 238: 133–140. DOI: 10.1016/j.virusres.2017.06.016 |
| [9] | AUDSLEY M D, JANS D A, MOSELEY G W. Roles of nuclear trafficking in infection by cytoplasmic negative-strand RNA viruses:Paramyxoviruses and beyond[J]. J Gen Virol, 2016, 97(10): 2463–2481. DOI: 10.1099/jgv.0.000575 |
| [10] | REED L J, MUENCH H. A simple method of estimating fifty percent endpoints[J]. Am J Epidemiol, 1938, 27(3): 493–497. DOI: 10.1093/oxfordjournals.aje.a118408 |
| [11] | MORI Y, OKABAYASHI T, YAMASHITA T, et al. Nuclear localization of Japanese encephalitis virus core protein enhances viral replication[J]. J Virol, 2005, 79(6): 3448–3458. DOI: 10.1128/JVI.79.6.3448-3458.2005 |
| [12] | LEE C, HODGINS D, CALVERT J G, et al. Mutations within the nuclear localization signal of the porcine reproductive and respiratory syndrome virus nucleocapsid protein attenuate virus replication[J]. Virology, 2006, 346(1): 238–250. DOI: 10.1016/j.virol.2005.11.005 |
| [13] | ROWE C L, WAGSTAFF K M, OKSAYAN S, et al. Nuclear trafficking of the rabies virus interferon antagonist P-Protein is regulated by an importin-binding nuclear localization sequence in the C-terminal domain[J]. PLoS One, 2016, 11(3): e0150477. DOI: 10.1371/journal.pone.0150477 |
| [14] | GHILDYAL R, HO A, JANS D A. Central role of the respiratory syncytial virus matrix protein in infection[J]. FEMS Microbiol Rev, 2006, 30(5): 692–705. DOI: 10.1111/j.1574-6976.2006.00025.x |
| [15] | IWASAKI M, TAKEDA M, SHIROGANE Y, et al. The matrix protein of measles virus regulates viral RNA synthesis and assembly by interacting with the nucleocapsid protein[J]. J Virol, 2009, 83(20): 10374–10383. DOI: 10.1128/JVI.01056-09 |
| [16] | DUAN Z Q, LI J, ZHU J, et al. A single amino acid mutation, R42A, in the Newcastle disease virus matrix protein abrogates its nuclear localization and attenuates viral replication and pathogenicity[J]. J Gen Virol, 2014, 95(5): 1067–1073. |
| [17] | HUANG Z H, PANDA A, ELANKUMARAN S, et al. The hemagglutinin-neuraminidase protein of Newcastle disease virus determines tropism and virulence[J]. J Virol, 2004, 78(8): 4176–4184. DOI: 10.1128/JVI.78.8.4176-4184.2004 |
| [18] | KRISTEEN-TEO Y W, YEAP S K, TAN S W, et al. The effects of different velogenic NDV infections on the chicken bursa of Fabricius[J]. BMC Vet Res, 2017, 13(1): 151. DOI: 10.1186/s12917-017-1071-y |
| [19] | ECCO R, BROWN C, SUSTA L, et al. In vivo transcriptional cytokine responses and association with clinical and pathological outcomes in chickens infected with different Newcastle disease virus isolates using formalin-fixed paraffin-embedded samples[J]. Vet Immunol Immunopathol, 2011, 141(3-4): 221–229. DOI: 10.1016/j.vetimm.2011.03.002 |
| [20] | NAKAMURA K, OHTSU N, NAKAMURA T, et al. Pathologic and immunohistochemical studies of Newcastle disease (ND) in broiler chickens vaccinated with ND:Severe nonpurulent encephalitis and necrotizing pancreatitis[J]. Vet Pathol, 2008, 45(6): 928–933. DOI: 10.1354/vp.45-6-928 |
| [21] | RUE C A, SUSTA L, CORNAX I, et al. Virulent Newcastle disease virus elicits a strong innate immune response in chickens[J]. J Gen Virol, 2011, 92(4): 931–939. DOI: 10.1099/vir.0.025486-0 |
| [22] | HU Z L, HU J, HU S L, et al. High levels of virus replication and an intense inflammatory response contribute to the severe pathology in lymphoid tissues caused by Newcastle disease virus genotype VIId[J]. Arch Virol, 2015, 160(3): 639–648. DOI: 10.1007/s00705-014-2301-2 |
| [23] |
程欣.基因VIId亚型新城疫病毒感染LaSota疫苗免疫鸡引起的免疫器官损伤及其对疫苗免疫效果的影响[D].扬州: 扬州大学, 2016.
CHENG X. Infections with genotype VIId Newcastle disease virus induces damages of immuolymphoid organs in chickens vaccinated with LaSota and affects vaccination efficacies thereafter[D]. Yangzhou: Yangzhou University, 2016. (in Chinese) |
| [24] | PENTECOST M, VASHISHT A A, LESTER T, et al. Evidence for ubiquitin-regulated nuclear and subnuclear trafficking among Paramyxovirinae matrix proteins[J]. PLoS Pathog, 2015, 11(3): e1004739. DOI: 10.1371/journal.ppat.1004739 |



