据调查,全世界约有25%的谷物被霉菌毒素污染[1],猪摄入真菌污染的饲料后,生长性能、繁殖性能、存活率下降。近年来,霉菌毒素对母畜繁殖系统的影响及其毒性作用已被广泛关注。
脱氧雪腐镰刀菌烯醇又名呕吐素(deoxynivalenol, DON), 与玉米赤酶烯酮(zearalenone, ZEA/ZEN)是镰刀菌毒素中污染饲料和谷物最为严重的两种污染菌毒素。镰刀菌毒素能够导致家畜一系列生殖障碍疾病。DON不仅能抑制猪卵母细胞成熟、胚胎发育[2],还会影响猪颗粒细胞类固醇的合成[3]。此外,若家畜短期摄入大量DON会引起呕吐、腹泻甚至死亡[4],长期摄入含DON的饲粮,会导致采食量降低,从而引起体重减轻,影响发育与产仔[5]。ZEA与雌激素结构相似,可与雌激素受体结合。ZEA可导致母猪外阴肿胀、充血[6],并能抑制小鼠卵母细胞成熟[7]。高剂量的ZEA还能抑制猪卵巢颗粒细胞的增殖,导致细胞凋亡和坏死[8]。但是目前关于DON与ZEA联合作用对断奶仔猪卵巢的影响鲜有报道。
乳果糖是人工合成的不容易被人体吸收的双糖,口服后不能被人体吸收,但能被大肠内细菌分解,产生大量氢气。氢气作为一种还原性气体,能够有效抑制氧化应激、炎症反应以及细胞凋亡[9]。富氢水灌胃与直接吸入氢气效果相近。Zheng等[10]发现,乳果糖能够改善用大豆苷元处理公猪的肝抗氧化状态;此外,Tamaki等[11]进一步研究发现,富氢水会诱导大鼠腭组织中抗氧化防御通路的激活,从而减少全身氧化应激和降低促炎细胞因子水平。但是,乳果糖与富氢水能否缓解DON、ZEA对机体造成的影响未见有文献报道。
本试验以断奶仔猪为研究对象,探究在乳果糖、富氢水作用下,采食镰刀菌污染玉米的仔猪卵巢组织形态、抗氧化状态以及NOS水平的变化情况。探讨霉菌毒素、乳果糖与富氢水的作用机制,为研究霉菌毒素对雌性生殖系统的毒性机理以及脱毒方法提供理论依据。
1 材料与方法 1.1 主要试剂与仪器过氧化氢酶(CAT)测定试剂盒、谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒、总超氧化物歧化酶(T-SOD)测定试剂盒、琥珀酸脱氢酶(SDH)测定试剂盒、一氧化氮(NO)、一氧化氮酶(NOS)试剂盒、苏木素伊红染料均购自南京建成生物工程研究所;SABC免疫组化试剂盒、3种兔源多克隆抗体(nNOS、iNOS、eNOS)、DAB显色试剂盒、Caspase-3活性检测试剂盒均购自武汉博士德生物工程有限公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术有限公司;其他试剂均为国产分析纯。全自动酶标仪Multiskan GO购于Thermo Scientificr公司,组织匀浆机购于OMMI公司。
1.2 试验动物以及样品采集选取健康的21日龄,平均体重为(7.25±1.02)kg的杜洛克×长白×大白三元杂交断奶母猪24头进行试验,随机分为4个处理,每个处理组6个重复,每个重复1头猪,试验期25 d。4个处理组的日粮分别为:对照组饲喂基础日粮;霉变玉米组、乳果糖缓解组和富氢水缓解组饲喂霉变饲料。此外,乳果糖缓解组和富氢水缓解组分别用乳果糖和富氢水进行每天2次灌胃。灌胃时间为每天的08:00和14:00,乳果糖灌胃量为500 mg·kg-1,富氢水的灌胃量为10 mL·kg-1。在试验结束时屠宰仔猪,采集卵巢,将一侧卵巢组织放入-80 ℃进行抗氧化各项指标的测定,另一侧卵巢固定于4%多聚甲醛中,以便对卵巢进行组织学分析以及检测NOS在卵巢上的表达定位。
1.3 试验饲粮以及动物饲养管理以玉米和豆粕配制基础日粮,基础日粮配方参照NRC(1998)营养需要配置,基础日粮组成以及营养水平见表 1;并且乳果糖缓解组与富氢水缓解组另外灌胃乳果糖和富氢水(每300 mL富氢水氢气含量为1.2 mg·kg-1)。
|
|
表 1 试验日粮组成及营养水平(风干基础) Table 1 Compositions and nutrient levels of experimental diets(air-dry basis) |
试验在江苏句容某猪场进行,每天加料2次,保证断奶仔猪自由采食与饮水,猪舍温度控制在27 ℃,湿度保持在60%,保证通风环境,每日打扫卫生,及时更换垫料。
1.4 试验方法 1.4.1 仔猪卵巢形态学观察用4%的多聚甲醛溶液固定仔猪卵巢24 h,随后用酒精逐级脱水,并用二甲苯透明。再通过包埋机浸蜡、包埋等处理后,切片机切片(5 μm),经过苏木素-伊红染色后,在光学显微镜下观察并拍照。
每组选择3个样本,每个样本选3张切片,每间隔100 μm(约20张切片)选一张片子进行观察与统计,每张切片选3~4个视野。统计原始卵泡(健康/闭锁)和生长卵泡(健康/闭锁)(尽量选择结构完整的卵泡)的数量。按照Schoevers等[12]的试验方法统计原始卵泡和生长卵泡的比例以及单位视野中各级卵泡数与总卵泡数之比。
1.4.2 仔猪卵巢免疫组织化学分析为了验证nNOS、iNOS、eNOS在断奶仔猪卵巢的表达定位,本研究使用ABC法进行免疫组织化学测定。组织切片脱蜡后,用5%小牛血清白蛋白(BSA)封闭2 h, 一抗nNOS、iNOS、eNOS(兔源,稀释倍数1:150)4 ℃孵育过夜,生物素标记的抗兔IgG抗体(稀释倍数1:200)室温孵育2 h, 之后与ABC试剂反应1 h, 3,3-二氨基联苯胺(DAB)显色30~60 s,最后用苏木素复染、脱水透明、封片。PBS取代一抗作为空白对照,YS100光学显微镜观察并拍照,细胞内棕褐色代表阳性表达。随机抽取3名免疫组化研究人员对染色强度进行观察测定:-表示无染色,﹢表示染色弱,﹢﹢表示染色适中,﹢﹢﹢表示染色强烈。
1.4.3 仔猪卵巢中NO含量以及NOS活性的测定试验采用硝酸还原酶法测定卵巢组织中NO含量,试验步骤按照NO试剂盒说明书进行。采用NOS试剂盒测定卵巢组织匀浆中总NOS活力,试验步骤严格按照试剂盒说明书进行。
1.4.4 仔猪卵巢组织中Caspase-3活性的测定Caspase-3是细胞凋亡过程中最重要的终末剪切酶,检测其活性可以有效评估细胞组织发生凋亡的程度,试验加样顺序按照Caspase-3活性测定试剂盒说明书进行,用酶标仪在405 nm处测定吸光值。
1.4.5 仔猪卵巢组织中各种酶活性测定仔猪卵巢组织中过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、总超氧化物歧化酶(T-SOD)、琥珀酸脱氢酶(SDH)活性的测定均严格按照相应试剂盒试验步骤以及加样顺序进行。
1.5 统计学分析试验数据用SPSS19.0软件进行单因素方差分析(one-way ANOVA), 使用最小显著差异法(least significant difference,LSD)进行显著性分析,以P<0.05表示差异显著,结果用“平均值±标准误(Mean±SEM)”表示。
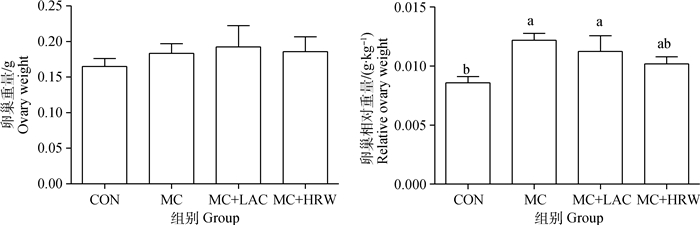
2 结果 2.1 霉变玉米、乳果糖、富氢水对断奶仔猪卵巢重量的影响为了测定ZEA与DON对卵巢发育的影响,本研究称量了卵巢重量(图1)。结果显示,4组仔猪卵巢重量无显著差异(P>0.05),但霉变玉米组与对照组相比卵巢重量有上升趋势。此外,霉变玉米组的卵巢相对重量显著高于对照组(P<0.05);而与霉变玉米组相比,乳果糖与富氢水缓解组卵巢相对重量有下降趋势。
|
CON.对照组;MC.霉变玉米组;MC+LAC.乳果糖缓解组;MC+HRW.富氢水缓解组。标记字母不同表示差异显著(P<0.05),下同 CON. Control group; MC. Mildew corn group; MC+LAC. Lactulose relieving group; MC+HRW. Hydrogen-rich water relieving group. Different superscript letters indicate significant differences among groups(P < 0.05), the same as follows 图 1 霉变玉米、乳果糖和富氢水对断奶仔猪卵巢重量和卵巢相对重量的影响 Figure 1 Effects of contaminated corn, lactulose and hydrogen-rich water on the ovarian weight and relative ovarian weight of weaned piglets |
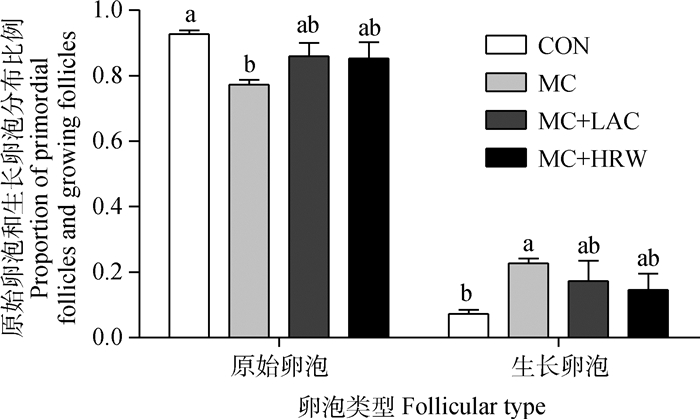
为了观察DON与ZEA对仔猪卵巢形态学的影响,本研究进行了HE染色(图 2)。结果显示,4组均未发现肉眼可见的病理变化,但与对照组相比,霉变玉米组加速了仔猪卵巢的发育(图 2、图 3)。对照组在卵巢皮质部浅部存在大量原始卵泡,在皮质深层部位,出现较多生长卵泡,未见有腔卵泡(图 2A);而霉变玉米组在不同发育状态的卵泡数量发生明显的变化(图 2B),原始卵泡数量显著低于对照组(P<0.05),生长卵泡数量显著高于对照组(P<0.05)(图 3);用富氢水与乳果糖处理后,与霉变玉米组相比仔猪卵巢原始卵泡数量明显增加,生长卵泡数量明显减少(图 2、图 3)。

|
A.对照组;B.霉变玉米组;C.富氢水处理组;D.乳果糖处理组; Pm.原始卵泡; Pr.初级卵泡; Se.次级卵泡 A. Control group; B. Contaminated corn group; C. Hydrogen-rich water treatment group; D. Lactulose treatment group. Pm. Primordial follicle; Pr. Primary follicle; Se. Secondary follicle 图 2 霉变玉米、乳果糖和富氢水对断奶仔猪卵巢形态学的影响 Figure 2 Effects of contaminated corn, lactulose and hydrogen-rich water on ovarian morphology of weaned piglets |
|
图 3 仔猪卵巢原始卵泡和生长卵泡的分布比例 Figure 3 The proportion of primordial follicles and growing follicles in the ovary of piglets |
为了测定ZEA与DON对卵巢组织抗氧化状态的影响,以及乳果糖、富氢水的缓解作用,本研究测定了抗氧化指标CAT、GSH-PX与T-SOD活性(图 4)。结果显示,与对照组相比,霉变玉米组CAT活性显著升高(P<0.05);GSH-PX活性显著下降(P<0.05);T-SOD活性虽无显著变化(P>0.05),但有下降趋势。与霉变玉米组比较,乳果糖与富氢水缓解组CAT活性有下降趋势,但是变化不显著(P>0.05);乳果糖缓解组GSH-PX活性显著升高,富氢水缓解组其活性虽然无显著变化(P>0.05),但有上升趋势;T-SOD活性在乳果糖与富氢水缓解组有上升趋势(P>0.05)。SDH是线粒体三羧酸循环标志酶,其活性标志着三羧酸循环的活跃程度,可以间接反映线粒体功能。为了研究霉变玉米对断奶仔猪线粒体功能的影响,本研究测定了SDH活性。结果表明,霉变玉米组SDH活性显著低于对照组(P<0.05);此外,与霉变玉米组相比,乳果糖缓解组SDH活性显著升高(P<0.05);富氢水缓解组SDH活性虽变化不显著(P>0.05),但有上升趋势。

|
图 4 霉变玉米、乳果糖和富氢水对断奶仔猪卵巢CAT、GSH-PX、T-SOD与SDH活性的影响 Figure 4 Effects of contaminated corn, lactulose and hydrogen-rich water on the activities of CAT, GSH-PX, T-SOD and SDH in the ovary of weaned piglets |
为了评估断奶仔猪卵巢组织细胞的凋亡程度以及乳果糖、富氢水的缓解作用,本研究测定了Caspase-3活性(图 5)。与对照组相比,霉变玉米组Caspase-3活性显著升高(P<0.05);而乳果糖和富氢水缓解组与霉变玉米组相比Caspase-3活性显著降低(P<0.05)。

|
图 5 霉变玉米、乳果糖和富氢水对断奶仔猪卵巢Caspase-3活化程度的影响 Figure 5 Effects of contaminated corn, lactulose and hydrogen-rich water on the levels of Caspase-3 in the ovary of weaned piglets |
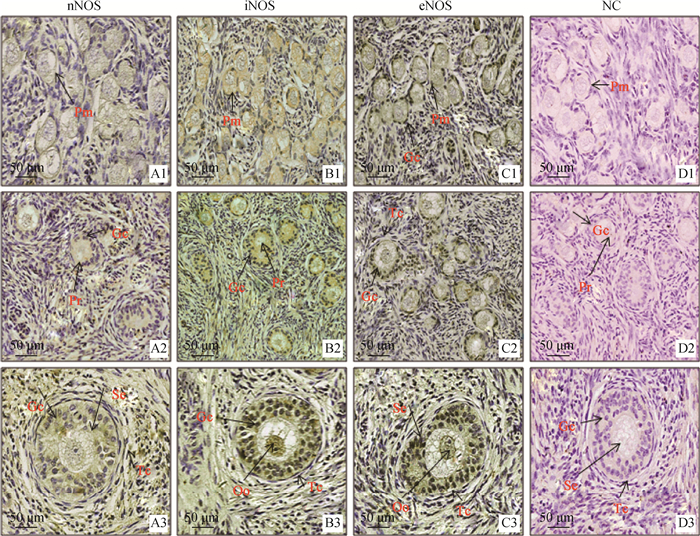
为了测定3种NOS亚型在断奶仔猪卵巢的表达定位,本研究进行了免疫组化试验。由图 6和表 2可知,nNOS在断奶仔猪各级卵泡的卵母细胞弱表达,在初级卵泡、次级卵泡的颗粒细胞和次级卵泡的膜细胞中也有适度表达,但在原始卵泡的颗粒细胞中未见表达(图 6 A1~A3);iNOS在断奶仔猪各级卵泡的卵母细胞中强表达,在初级卵泡和次卵泡的颗粒细胞中同样表达强烈,但在原始卵泡的颗粒细胞表达适中,次级卵泡的膜细胞中弱表达(图 6 B1~B3);eNOS在断奶仔猪原始卵泡、初级卵泡、次级卵泡的卵母细胞表达适中,次级卵泡的膜细胞中弱表达。此外还发现,随着卵泡的发育,eNOS在颗粒细胞中的表达逐渐增强(图 6 C1~C3);阴性对照组无特异性免疫染色(图 6 D1~D3)。3种NOS亚型在卵巢不同细胞的相对表达水平见表 2。
|
NC.阴性对照。Pm.原始卵泡(A1、B1、C1、D1);Pr.初级卵泡(A2、B2、C2、D2);Se.次级卵泡(A3、B3、C3、D3)。Oo.卵母细胞;Gc.颗粒细胞;Tc.膜细胞 NC. Negative control. Pm. Primordial follicles (A1, B1, C1, D1); Pr. Primary follicles (A2, B2, C2, D2); Se. Secondary follicles (A3, B3, C3, D3). Oo. Oocyte; Gc. Granulosa cell; Tc. Theca cell 图 6 3种NOS(nNOS、iNOS、eNOS)在断奶仔猪卵巢中的免疫组织化学检测 Figure 6 Immunolocalization of 3 NOS isoforms(nNOS, iNOS, eNOS)in ovaries of weaned piglets |
|
|
表 2 3种NOS亚型在断奶仔猪卵巢中的相对表达水平 Table 2 Relative expression levels of 3 NOS isoforms in ovaries of weaned piglets |
由图 7可知,霉变玉米会改变仔猪卵巢NO含量和NOS活性。与对照组相比,NO含量和NOS活性在霉变玉米组中显著升高(P<0.05);此外,与霉变玉米组相比,乳果糖和富氢水缓解组NO含量显著下降(P<0.05),富氢水缓解组总NOS活力与霉变玉米组相比也显著下降(P<0.05),乳果糖缓解组总NOS活力虽然与霉变玉米组没有显著差异(P>0.05),但有下降趋势。

|
图 7 霉变玉米、乳果糖和富氢水对断奶仔猪卵巢中NO含量和NOS活力的影响 Figure 7 Effects of contaminated corn, lactulose and hydrogen-rich water on the NO content and NOS activity in the ovary of weaned piglets |
世界各地的谷物和动物饲料中几乎都存在霉菌毒素,严重危害了人和动物健康。DON与ZEA是主要的镰刀菌属毒素,会诱导机体氧化应激。而乳果糖能被厌氧细菌分解产生氢气,氢气能缓解氧化应激。本研究结果发现,乳果糖和富氢水能有效缓解霉菌毒素对卵巢造成的氧化应激影响。
本课题组前期研究已经表明,霉变玉米组仔猪体重、平均日增重、平均日采食量均显著低于对照组,可能是由于仔猪免疫和消化系统尚未发育完善,容易受到有毒物质的影响,导致仔猪生产性能降低。用乳果糖处理后,仔猪体重、平均日增重与平均日采食量与霉变玉米组相比显著增加[13]。这可能是由于乳果糖能够选择性地改变肠道微生物群的组成和提高肠道完整性。因为乳果糖是通过肠道微生物发酵产生氢气来发挥作用的,所以富氢水同样能提高仔猪生长性能。因此乳果糖与富氢水能有效缓解霉菌毒素对仔猪生长性能产生的影响。
Schoevers等[12]研究发现,向母猪饲料中添加1 mg·kg-1 ZEA使得子代仔猪卵巢中初级卵泡和次级生长卵泡的密度增高,促进仔猪卵泡发育。黄丽娜等[14]报道,向母猪饲粮中添加100 mg·kg-1 ZEA,能够促进初级和次级卵泡发育。杨立杰等[15]同样研究表明,日粮中添加0~1 mg·kg-1 ZEA使得仔猪卵巢指数线性升高。本研究结果与之一致。由于ZEA结构与雌激素类似,所以霉变玉米可能短时间促进仔猪卵巢发育,导致成年猪卵母细胞过早凋亡;本研究发现,用乳果糖和富氢水处理后,卵泡提早发育现象得到缓解。可能是由于乳果糖和其产生的氢气改善了仔猪肠道环境,从而提高了仔猪的免疫力和消化力,降低了霉菌毒素对仔猪的伤害。但是其具体分子机制尚不清楚,需要做进一步研究。
氧化应激主要表现为自由基增多,当自由基含量超过机体本身的抗氧化能力时,就会造成机体氧化系统与抗氧化系统失去平衡,从而导致氧化损伤。Ren等[16]研究发现,分别用0.06 μg·mL-1 DON和0.08 μg·mL-1 ZEA、0.3 μg·mL-1 DON和0.4 μg·mL-1 ZEA以及1.5 μg·mL-1 DON和2 μg·mL-1 ZEA处理猪脾淋巴细胞,发现SOD、CAT、GPx、GSH和Bcl-2的信使核糖核酸和蛋白表达水平显着降低,总抗氧化能力下降。本试验结果发现,仔猪采食了霉变饲料后,卵巢组织GSH-PX、T-SOD活性下降,这与Ren等[16]的研究结果一致,而CAT在霉变玉米组显著升高,3种抗氧化酶为何变化趋势不同,目前很难解释,需做进一步研究。抗氧化酶活性的改变可能是由于卵巢组织抗氧化水平的改变,由此说明霉变玉米中含有的DON与ZEA介导仔猪卵巢抗氧化能力变化,导致仔猪氧化应激;Zheng等[13]研究发现,用富氢水和乳果糖处理氧化应激的仔猪,发现MDA水平下降,而CAT、T-SOD、Mn-SOD水平升高,氧化应激状态得到显著缓解。Shigeta等[17]研究发现,对缺血再灌注损伤的大鼠腔内注射富氢溶液可以缓解氧化应激,从而改善缺血再灌注损伤。这与本试验结果一致。研究表明,羟基自由基(·OH)和过氧化亚硝酸离子(ONOO-)是非常强的氧化剂,能够使得脂质过氧化以及蛋白质失活。而氢气能够有效清除机体内的·OH和ONOO-。氢气具有抗氧化作用[18],因此仔猪灌胃乳果糖与富氢水后,通过氢气形式在体内发挥作用,从而GSH-PX、T-SOD活性上升,仔猪卵巢抗氧化水平升高;SDH是脱氢酶中最重要的酶,是线粒体三羧酸循环标志酶,其活性在一定程度上反映了线粒体功能。Yang等[19]报道称,用DON处理人胃上皮细胞后,线粒体功能下降、呼吸链受损、氧消耗率降低。本试验结果表明,霉变玉米组SDH活性低于对照组,与Yang等[19]的研究结果一致。说明DON与ZEA损害了线粒体功能,影响了线粒体电子传递和氧化呼吸作用,使得仔猪体内的细胞呼吸作用减弱, 产生的能量减少和物质代谢速率降低。本试验研究的乳果糖与富氢水对断奶仔猪线粒体功能影响未见有其他文献报道。已有研究指出,若体内产生过多的超氧化物未被内源性抗氧化剂或相关酶清除,便会导致线粒体功能障碍[20]。由此可知,抗氧化水平降低会影响线粒体功能。而乳果糖与富氢水具有抗氧化作用,因此用乳果糖与富氢水处理仔猪后,卵巢抗氧化水平升高,从而线粒体功能得到改善。
细胞凋亡是细胞正常的程序化死亡,在机体具有一个平衡状态,如果平衡被打破,就易发生自身免疫病、肿瘤等疾病。已有研究证明,ZEA诱导凋亡的关键途径是含半胱氨酸的天门冬氨酸蛋白水解酶途径(Caspase)与线粒体通路。Sun等[21]将大鼠肝细胞用DON处理48 h,发现Caspase-3和Caspase-8蛋白水平升高,Caspase-3 mRNA水平升高。此外,王冰洁等[22]研究发现,ZEA、DON联合染毒后,Cleaved Caspase-3、Cleaved Caspase-8、Cleaved Caspase-9蛋白的表达量均上升,这与本研究一致,表明DON、ZEA联合作用影响仔猪卵巢组织抗氧化水平和线粒体功能,从而进一步导致细胞凋亡程度增加,造成机体损伤;Du等[23]研究发现,用富氢生理盐水处理小鼠能够抑制Caspase-3表达,降低细胞凋亡率。Xie等[24]用甲基苯丙胺腹腔注射5周龄雄性大鼠发现其Cleaved Caspase-3活性升高,而口服乳果糖后发现Cleaved Caspase-3活性显著降低。研究发现,氢气通过上调或下调凋亡相关因子而发挥抗细胞凋亡作用[18]。因此在本试验中,用乳果糖、富氢水处理仔猪后,其产生的氢气通过下调Caspase-3表达,从而抑制卵巢组织凋亡。
NO是哺乳动物体内一种半衰期极短的信号分子,在维持生殖系统尤其是卵巢的正常生理过程中发挥重要作用。NOS是NO生产中的关键酶。本试验中,免疫组化结果显示,3种NOS(nNOS、iNOS、eNOS)在仔猪卵巢不同细胞中特异性表达和定位。这与Ding等[25]的研究结果一致,表明NO和NOS在仔猪卵泡发育过程中发挥重要作用;Liang等[26]连续4 d对小鼠腹腔注射DON与ZEA,发现其NO水平升高,机体发生氧化应激损伤。此外,还发现DON与ZEA表现出协同效应。NO不仅是一种活性氮自由基,也是一个良好的氧化应激评价指标。NO可以引起氧化反应,改变机体的抗氧化水平。当机体NO水平过高时,就会造成氧化应激和中毒。研究表明,雌激素含量升高时,NO合成以及nNOS表达升高[27]。因此由于ZEA与雌激素结构相似,所以卵巢组织NO含量和NOS活性显著升高,从而引起抗氧水平改变,最终导致线粒体功能下降和细胞凋亡;有研究报道,富氢盐液可以通过抑制iNOS酶活性与NO含量来保护大脑[28]。低聚乳果糖可以有效提高患有结肠炎大鼠的抗氧化水平,有效降低iNOS活性和炎性细胞浸润[29]。本试验结果与之一致,用乳果糖与富氢水灌胃后,仔猪NO与NOS水平下降。因此可推测,乳果糖与富氢水可以通过降低NO水平来影响抗氧化水平,但是其具体机制还有待进一步研究。
总之,镰刀菌毒素对断奶仔猪卵巢抗氧化状态具有重要影响,通过影响卵巢NO水平来诱导氧化应激,从而导致线粒体功能下降和细胞凋亡;乳果糖、富氢水能够缓解仔猪卵巢抗氧化状态。但DON、ZEA诱导的氧化应激与NO信号相互关系以及乳果糖和富氢水缓解作用的具体分子机制尚不十分清楚,需要进一步探究。
4 结论霉变玉米中的DON与ZEA可能介导仔猪卵巢组织抗氧化水平降低,从而导致细胞凋亡程度加深;而乳果糖与富氢水通过升高抗氧化水平有效缓解DON与ZEA对仔猪卵巢造成的危害。
| [1] |
霍星华, 高开国, 胡友军, 等. 霉菌毒素对母猪繁殖性能影响及解毒研究进展[J]. 广东饲料, 2015, 24(10): 32–36.
HUO X H, GAO K G, HU Y J, et al. Research progress in the influence of mycotoxins on sow reproductive performance and detoxification[J]. Guangdong Feed, 2015, 24(10): 32–36. DOI: 10.3969/j.issn.1005-8613.2015.10.010 (in Chinese) |
| [2] | HAN J, WANG Q C, ZHU C C, et al. Deoxynivalenol exposure induces autophagy/apoptosis and epigenetic modification changes during porcine oocyte maturation[J]. Toxicol Appl Pharmacol, 2016, 300: 70–76. DOI: 10.1016/j.taap.2016.03.006 |
| [3] | GUERRERO-NETRO H M, CHORFI Y, PRICE C A. Effects of the mycotoxin deoxynivalenol on steroidogenesis and apoptosis in granulosa cells[J]. Reproduction, 2015, 149(6): 555–561. DOI: 10.1530/REP-15-0018 |
| [4] | PESTKA J J. Deoxynivalenol:mechanisms of action, human exposure, and toxicological relevance[J]. Arch Toxicol, 2010, 84(9): 663–679. DOI: 10.1007/s00204-010-0579-8 |
| [5] | ALIZADEH A, BRABER S, AKBARI P, et al. Deoxynivalenol impairs weight gain and affects markers of gut health after low-dose, short-term exposure of growing pigs[J]. Toxins, 2015, 7(6): 2071–2095. DOI: 10.3390/toxins7062071 |
| [6] |
王定发, 彭运智, 张妮娅, 等. 日粮中玉米赤霉烯酮和大豆异黄酮联合作用对后备母猪生殖器官发育和雌激素受体基因转录的影响[J]. 畜牧兽医学报, 2011, 42(2): 243–250.
WANG D F, PENG Y Z, ZHANG N Y, et al. Interactive effects of dietary zearalenone and soybean isoflavone on development of reproductive organs and transcription of estrogen receptors gene in replacement gilts[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(2): 243–250. (in Chinese) |
| [7] | ZHU C C, ZHANG Y, DUAN X, et al. Toxic effects of HT-2 toxin on mouse oocytes and its possible mechanisms[J]. Arch Toxicol, 2016, 90(6): 1495–1505. DOI: 10.1007/s00204-015-1560-3 |
| [8] | ZHU L, YUAN H, GUO C Z, et al. Zearalenone induces apoptosis and necrosis in porcine granulosa cells via a caspase-3-and caspase-9-dependent mitochondrial signaling pathway[J]. J Cell Physiol, 2012, 227(5): 1814–1820. DOI: 10.1002/jcp.22906 |
| [9] | YU J H, ZHANG W G, ZHANG R G, et al. Lactulose accelerates liver regeneration in rats by inducing hydrogen[J]. J Surg Res, 2015, 195(1): 128–135. DOI: 10.1016/j.jss.2015.01.034 |
| [10] | ZHENG W J, HOU Y J, YAO W. Lactulose increases equol production and improves liver antioxidant status in barrows treated with Daidzein[J]. PLoS One, 2014, 9(3): e93163. DOI: 10.1371/journal.pone.0093163 |
| [11] | TAMAKI N, ORIHUELA-CAMPOS R C, FUKUI M, et al. Hydrogen-rich water intake accelerates oral palatal wound healing via activation of the nrf2/antioxidant defense pathways in a rat model[J]. Oxid Med Cell Longev, 2016, 2016: 5679040. |
| [12] | SCHOEVERS E J, SANTOS R R, COLENBRANDER B, et al. Transgenerational toxicity of Zearalenone in pigs[J]. Reprod Toxicol, 2012, 34(1): 110–119. DOI: 10.1016/j.reprotox.2012.03.004 |
| [13] | ZHENG W J, JI X, ZHANG Q, et al. Hydrogen-rich water and lactulose protect against growth suppression and oxidative stress in female piglets Fed fusarium toxins contaminated diets[J]. Toxins, 2018, 10(6): 228. DOI: 10.3390/toxins10060228 |
| [14] |
黄丽娜, 彭双清, 刘宁. 玉米赤霉烯酮生殖发育毒性的研究进展[J]. 中国地方病防治杂志, 2014, 29(3): 181–1841.
HUANG L N, PENG S Q, LIU N. Research progress in reproductive developmental toxicity of zearalenone[J]. Chinese Journal of Control of Endemic Diseases, 2014, 29(3): 181–1841. (in Chinese) |
| [15] |
杨立杰, 黄丽波, 李思梦, 等. 玉米赤霉烯酮对断奶小母猪卵巢指数及孕激素受体分布和表达的影响[J]. 动物营养学报, 2017, 29(12): 4510–4517.
YANG L J, HUANG L B, LI S M, et al. Effects of zearalenone on ovary index, distribution and expression of progesterone receptors in ovaries of weaned gilts[J]. Chinese Journal of Animal Nutrition, 2017, 29(12): 4510–4517. DOI: 10.3969/j.issn.1006-267x.2017.12.032 (in Chinese) |
| [16] | REN Z H, DENG H D, DENG Y T, et al. Combined effects of deoxynivalenol and zearalenone on oxidative injury and apoptosis in porcine splenic lymphocytes in vitro[J]. Exp Toxicol Pathol, 2017, 69(8): 612–617. DOI: 10.1016/j.etp.2017.05.008 |
| [17] | SHIGETA T, SAKAMOTO S, LI X K, et al. Luminal injection of hydrogen-rich solution attenuates intestinal ischemia-reperfusion injury in rats[J]. Transplantation, 2015, 99(3): 500–507. DOI: 10.1097/TP.0000000000000510 |
| [18] | GE L, YANG M, YANG N N, et al. Molecular hydrogen:a preventive and therapeutic medical gas for various diseases[J]. Oncotarget, 2017, 8(60): 102653–102673. |
| [19] | YANG Y X, YU S, LIU N, et al. Transcription factor FOXO3a is a negative regulator of cytotoxicity of Fusarium mycotoxin in GES-1 cells[J]. Toxicol Sci, 2018. DOI: 10.1093/toxsci/kfy216 |
| [20] |
秦双立, 官志忠. 线粒体损伤和氧化应激的关系[J]. 国外医学(医学地理分册), 2013, 34(3): 197–201.
QIN S L, GUAN Z Z. Correlation between mitochondrial injury and oxidative stress[J]. Foreign Medical Sciences (Section of Medgeography), 2013, 34(3): 197–201. DOI: 10.3969/j.issn.1001-8883.2013.03.017 (in Chinese) |
| [21] | SUN L H, LEI M Y, ZHANG N Y, et al. Individual and combined cytotoxic effects of aflatoxin B1, zearalenone, deoxynivalenol and fumonisin B1 on BRL 3A rat liver cells[J]. Toxicon, 2015, 95: 6–12. DOI: 10.1016/j.toxicon.2014.12.010 |
| [22] |
王冰洁, 潘顺叶, 李茜, 等. ZEA与DON联合染毒对CTLL-2细胞凋亡及凋亡相关蛋白Bax、Bcl-2和Caspase3等表达的影响[J]. 黑龙江畜牧兽医, 2017(4): 36–41.
WANG B J, PAN S Y, LI Q, et al. The combined effects of deoxynivalenol and zearalenone on apoptosis and the expression of Bax, Bcl-2 and apoptosis-related proteins of CTLL-2[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(4): 36–41. (in Chinese) |
| [23] | DU H Y, SHENG M W, WU L S, et al. Hydrogen-rich saline attenuates acute kidney injury after liver transplantation via activating p53-mediated autophagy[J]. Transplantation, 2016, 100(3): 563–570. DOI: 10.1097/TP.0000000000001052 |
| [24] | XIE X L, HE J T, WANG Z T, et al. Lactulose attenuates METH-induced neurotoxicity by alleviating the impaired autophagy, stabilizing the perturbed antioxidant system and suppressing apoptosis in rat striatum[J]. Toxicol Lett, 2018, 289: 107–113. DOI: 10.1016/j.toxlet.2018.03.015 |
| [25] | DING W, ZHANG W, HUI F M, et al. Cell-specific expression and immunolocalization of nitric oxide synthase isoforms and soluble guanylyl cyclase α1 and β1 subunits in the ovary of fetal, neonatal and immature pigs[J]. Anim Reprod Sci, 2012, 131(3-4): 172–180. DOI: 10.1016/j.anireprosci.2012.02.013 |
| [26] | LIANG Z, REN Z H, GAO S, et al. Individual and combined effects of deoxynivalenol and zearalenone on mouse kidney[J]. Environ Toxicol Pharmacol, 2015, 40(3): 686–691. DOI: 10.1016/j.etap.2015.08.029 |
| [27] | RAVELLA K, AL-HENDY A, SHARAN C, et al. Chronic estrogen deficiency causes gastroparesis by altering neuronal nitric oxide synthase function[J]. Dig Dis Sci, 2013, 58(6): 1507–1515. DOI: 10.1007/s10620-013-2610-4 |
| [28] |
周玉弟, 张杰, 崔耀梅, 等. 富氢盐液对脑缺血-再灌注损伤大鼠缺血半暗带区诱导性一氧化氮合酶表达和细胞凋亡的影响[J]. 江苏医药, 2016, 42(14): 1540–1543.
ZHOU Y D, ZHANG J, CUI Y M, et al. Influence of hydrogen-rich saline on focal cerebral ischemia-reperfusion injury-induced iNOS expression and apoptosis in the ischemic penumbra in rats[J]. Jiangsu Medical Journal, 2016, 42(14): 1540–1543. (in Chinese) |
| [29] |
李玲, 印遇龙, 阮征, 等. 低聚乳果糖对结肠炎大鼠血浆抗氧化系统的影响[J]. 食品科学, 2011, 32(13): 321–324.
LI L, YIN Y L, RUAN Z, et al. Effect of lactosucrose on plasma antioxidant system in colitis rats[J]. Food Science, 2011, 32(13): 321–324. (in Chinese) |



