2. 中西兽医结合与动物保健福建省高等学校重点实验室, 福州 350002
2. University Key Laboratory for Integrated Chinese Traditional and Western Veterinary Medicine and Animal Healthcare in Fujian Province, Fuzhou 350002, China
集约化养殖模式、疫病以及抗生素滥用等多种刺激因素,导致氧化应激问题在生猪养殖过程中普遍存在[1-2],而氧化应激又是众多疾病发生和发展的重要诱导或促进因素[3-5]。肠道作为食物、药物以及众多病原微生物进入机体的主要门户,大量的物质交换、新陈代谢、免疫反应等均发生于此,因此也就成为氧化应激的“重灾区”[6]。由此可见,缓解或抑制肠道氧化应激,对于生猪肠道健康具有重要意义。肠道发生应激损伤的同时,大多数都伴有肠上皮细胞通透性的改变[7]。紧密连接(tight junction, TJ)是调控肠上皮细胞通透性最重要的机械屏障[8],目前己有40多种胃、肠黏膜上皮细胞TJ相关蛋白陆续被发现,ZO-1是构成TJ的重要成分之一,能与其同源异构体ZO-2、ZO-3一起,为TJ的许多跨膜蛋白搭建具有连接作用的平台。多数情况下只要ZO-1受到破坏,TJ的功能大多数会随之发生变化,所以ZO-1常被用来作为观察TJ屏障功能和通透性的指标[9]。
猴头菇(Hericium erinaceus)是珍贵的药膳兼用菌,随着猴头菇人工载培的产业化,其成本也大幅降低。猴头菇多糖(hericium erinaceus polysaccharide,HEPs)是猴头菇中最重要的活性物质,现代研究表明,HEPs对胃肠黏膜上皮的再生和修复起重要作用,能增强胃肠黏膜屏障机能,对胃部幽门螺杆菌感染[10]、胃癌[11]、慢性胃炎、十二指肠溃疡等消化道疾病都有显著疗效[12]。本实验室研究发现[13-14],HEPs对病毒感染导致的番鸭肠道抗氧化能力降低和上皮结构破坏,均有显著的改善作用。但是,将HEPs用于对抗猪肠道氧化应激的研究鲜见报道。本研究采用H2O2构建猪小肠上皮细胞(IPEC-J2 cells)氧化应激模型,以评价HEPs对致敏IPEC-J2细胞的抗氧化功能和ZO-1表达的影响,为其在生猪肠道保健方面的应用提供借鉴。
1 材料与方法 1.1 试验材料 1.1.1 猴头菇多糖及IPEC-J2细胞市售猴头菇干品根据响应面优化后的方法[15],采用水提醇沉法提取猴头菇多糖,Sevage法去除蛋白质,DEAE G-52纤维素纯化,苯酚硫酸法测得多糖含量为75.05%。
猪小肠上皮细胞(intestinal porcine epithelial cells,IPEC-J2 cells)购自广州吉妮欧生物科技有限公司。
1.1.2 试剂噻唑蓝(MTT)、二甲基亚砜(DMSO)购自北京索莱宝科技有限公司;DMEM/F-12(1:1) 培养基购自Hyclone公司;胎牛血清购自北京CellMax公司;30%过氧化氢购自上海阿拉丁生化科技股份有限公司;乳酸脱氢酶(LDH)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、丙二醛(MDA)、活性氧(ROS)检测试剂盒均购自南京建成生物工程研究所;RNAiso Plus(9109 TaKaRa)、PrimeScriptTM RT Reagent Kit(Perfect Real Time, RR037A Takara)购自大连宝生物工程公司;UltraSYBR Mixture(CW0957T)购自北京康为世纪生物科技有限公司;Rabbit Anti-ZO-1 antibody购自北京博奥森生物技术有限公司;Beta Actin Antibody购自美国Proteintech公司。
1.1.3 主要仪器倒置荧光显微镜(EVOS FLc);V-1200型可见分光光度计(上海美谱达仪器有限公司);GloMax96孔多功能发光检测仪(Promega);CFX96TMReal-time System、C1000TM thermal Cycler、电泳仪购自美国Bio-Rad公司;电泳槽、转膜仪购自北京六一生物科技有限公司。
1.2 试验方法 1.2.1 细胞培养IPEC-J2细胞使用含有10%胎牛血清、1%双抗的DMEM/F-12完全培养基培养于25 cm2培养瓶中,置于37 ℃、5% CO2的培养箱中。当细胞密度达到80%~90%时传代。
1.2.2 IPEC-J2细胞氧化应激模型的建立IPEC-J2细胞以5.0×105 ·mL-1的密度接种于96孔板中,每个处理6个重复。分别加入终质量浓度为0、10、20、50、100、200、500 μg·mL-1的HEPs培养12 h后,加入5 mg·mL-1 MTT继续培养4 h。弃上清,每孔加入150 μL DMSO,振荡10 min,490 nm波长下测定每孔吸光度值(A值),计算细胞存活率,细胞存活率=(A处理/A对照)×100%。在HEPs的安全浓度范围内,选取细胞存活率变化较为稳定的3个浓度用于后续试验。
细胞处理方法同上,分别加入终浓度为0、0.1、0.2、0.4、0.5、1、2、4、5 mmol·L-1的H2O2培养1 h,MTT法测定细胞存活率,选取适于造模的H2O2浓度。
1.2.3 HEPs对氧化应激状态下IPEC-J2细胞释放ROS的影响IPEC-J2细胞分为5组,每组6个重复,分别为空白对照组,模型组,HEPs低、中、高剂量组。空白对照组只加完全培养基;模型组加完全培养基培养12 h,加H2O2处理1 h;3个多糖组分别加不同浓度的HEPs培养12 h,加H2O2处理1 h。去除培养液,PBS清洗2遍,加入0.01 mmol·L-1的DCFH-DA溶液,37 ℃孵育30 min,PBS清洗2遍,置于倒置荧光显微镜下观察并拍照,使用多功能发光检测仪检测各试验组ROS的含量。
1.2.4 HEPs对氧化应激状态下IPEC-J2细胞抗氧化能力和LDH释放的影响IPEC-J2细胞接种于6孔板中,按照“1.2.3 ”的方法分组。培养结束后,细胞培养液4 ℃、1 500 r·min-1离心5 min后取上清待测;细胞用0.25%胰酶消化,4 ℃、1 000 r·min-1离心5 min,弃上清,加适量PBS,重复离心1次,收集细胞沉淀,加适量PBS制成细胞悬液,冰浴条件下超声破碎(功率300 W,1 s·次-1,间隔10 s,重复20次)。Braford法测定细胞悬液蛋白质含量。按照试剂盒说明书检测SOD、CAT活力、MDA含量及LDH释放率。
1.2.5 HEPs对氧化应激状态下IPEC-J2细胞ZO-1的影响IPEC-J2细胞接种于6孔板中,按照“1.2.3 ”的方法分组。使用TaKaRa总RNA提取试剂盒提取细胞总RNA,核酸蛋白测定仪检测A260 nm/A280 nm值,判定RNA纯度;使用1%的琼脂糖凝胶进行电泳(120 V,30 min),检验RNA完整性。使用PrimesciptTM RT reagent kit试剂盒制备cDNA,以之为模板,使用表 1所列的引物,按照UltraSYBR Mixture说明书配制反应液,进行Real-time PCR检测,反应条件为95 ℃预变性10 min,然后进入“95 ℃变性15 s、60 ℃退火1 min、72 ℃延伸50 s”的循环,进行40次,12 ℃保存。分别绘制目的基因ZO-1和内参基因β-actin的标准曲线,进行线性回归分析,以验证引物及Real-time PCR程序的可靠性。以2-ΔΔCt法进行相对定量分析,计算公式如下:
|
|
表 1 引物序列及反应产物大小 Table 1 The primer sequences and the reaction product sizes |
ΔCt=CtZO-1-Ctβ-actin
基因转录比例=2-[(ΔCt试验组)-(ΔCt空白对照组)]
式中:Ct为每个反应管内的荧光信号达到设定的阈值时所经历的循环数。
按照上述方法处理细胞,RIPA buffer提取细胞总蛋白质,按照Braford蛋白定量试剂盒说明书测定蛋白质样品的浓度,以60 μg为各组上样量进行SDS-PAGE电泳,半干法转至PVDF膜,置于一抗稀释液(用含5%脱脂奶粉的TBST按1:1 000稀释)中,4 ℃孵育过夜,TBST漂洗3次。将结合 一抗的PVDF膜放到HRP标记的二抗稀释液(用含5%脱脂奶粉的TBST按1:6 000稀释)中,室温下孵育1 h,TBST漂洗3次。加入ECL发光,X胶片曝光,洗片,扫描,分析目的蛋白质条带相对分子质量及灰度值。
1.2.6 数据分析采用SPSS 19.0分析软件对数据进行分析,结果以“ x±s”表示。P<0.05为差异显著、P<0.01为差异极显著。
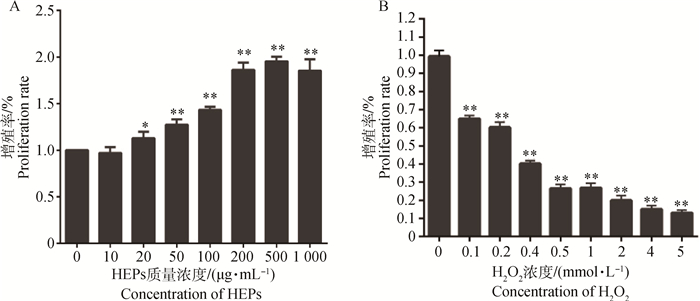
2 结果 2.1 IPEC-J2细胞氧化应激模型的建立HEPs对细胞增殖的影响见图 1A。与空白组相比,10 μg·mL-1的HEPs对IPEC-J2细胞增殖无显著影响(P>0.05),20 μg·mL-1的HEPs可显著促进IPEC-J2细胞增殖(P < 0.05),50~1 000 μg·mL-1的HEPs可极显著促进IPEC-J2细胞增殖(P < 0.01),但HEPs浓度为1 000 μg·mL-1时,生长曲线呈下降趋势。因此,选择50、100、200 μg·mL-1的HEPs用于后续试验。
|
与空白对照组比较,*.差异显著(P < 0.05);**.差异极显著(P < 0.01) Compared with control group, means with *superscripts differ significantly (P < 0.05), while with ** superscripts differ extremely significantly (P < 0.01) 图 1 HEPs(A)和H2O2(B)对IPEC-J2细胞增殖的影响(x±s, n=6) Figure 1 Effects of HEPs (A) and H2O2 (B) on the viability of IPEC-J2 cells (x±s, n=6) |
H2O2对细胞增殖的影响见图 1B。与空白组相比,0.1~5 mmol·L-1的H2O2均能极显著抑制细胞增殖(P < 0.01),且呈明显的剂量依赖关系。H2O2浓度为0.4 mmol·L-1时,细胞抑制率为40.48%,因此选择该浓度用于建立IPEC-J2细胞氧化应激模型。
2.2 HEPs对氧化应激状态下IPEC-J2细胞释放ROS的影响IPEC-J2细胞经DCFH-DA染色后的荧光照片如图 2A所示,H2O2处理后细胞荧光强度明显高于空白对照组,而HEPs预处理可使荧光强度不同程度的降低,表明HEPs能够抑制H2O2引起的ROS过度释放。图 2B为荧光酶标仪定量检测结果,其趋势与图 2A的定性结果一致,即H2O2使细胞ROS释放量极显著上升(P < 0.01),而低、中、高剂量的HEPs均可使ROS极显著下降(P < 0.01)。

|
A.不同浓度HEPs影响IPEC-J2细胞释放ROS的荧光照片(DCFH-DA,40×);B.不同浓度HEPs影响IPEC-J2细胞释放ROS的影响(x±s, n=6)。与空白对照组比较,*.差异显著(P < 0.05);**.差异极显著(P < 0.01)。与H2O2组比较,#.差异显著(P < 0.05);##.差异极显著(P < 0.01)。下同 A. Images of ROS generation probed with DCFH-DA were obtained by fluorescence microscope(40×); B. ROS generation probed with DCFH-DA was obtained by fluorence microplate reader (x±s, n=6). Compared with control group, means with * superscripts differ significantly (P < 0.05), while with ** superscripts differ extremely significantly (P < 0.01). Compared with H2O2 group, means with # superscripts differ significantly (P < 0.05), while with ## superscripts differ extremely significantly (P < 0.01). The same as follows 图 2 HEPs对IPEC-J2细胞释放ROS的影响 Figure 2 Effects of HEPs on ROS production from IPEC-J2 cells |
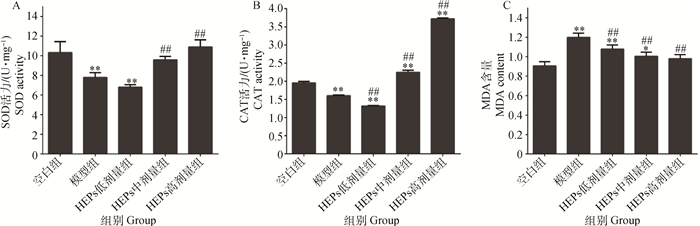
由图 3可知,与空白对照组相比,H2O2处理可使SOD和CAT活力均极显著降低(P<0.01),MDA含量极显著升高(P<0.01)。低剂量的HEPs虽能使MDA含量极显著降低(P<0.01),但对SOD活力影响不显著(P>0.05)、且CAT活力极显著低于模型组(P<0.01);而中、高剂量的HEPs可使SOD和CAT活力均极显著升高(P<0.01)、MDA含量均极显著降低(P<0.01)。
|
A. HEPs对IPEC-J2细胞SOD活力的影响;B. HEPs对IPEC-J2细胞CAT活力的影响;C. HEPs对IPEC-J2细胞MDA含量的影响 A. Effects of HEPs on SOD activities in IPEC-J2 cells; B. Effects of HEPs on CAT activities in IPEC-J2 cells; C. Effects of HEPs on MDA contents in IPEC-J2 cells 图 3 HEPs对IPEC-J2细胞抗氧化能力的影响(x±s, n=3) Figure 3 Effects of HEPs on antioxidants of IPEC-J2 cells (x±s, n=3) |
由图 4可知,与空白对照组相比,H2O2处理可使IPEC-J2细胞培养液上清LDH活力极显著上升(P < 0.01),而细胞内LDH活力极显著下降(P < 0.01);而3个浓度的HEPs处理均可使上述趋势发生逆转。以胞外酶活力除以胞内外酶总活力得到LDH释放率,图 4C的结果表明,H2O2处理可使IPEC-J2的LDH释放率极显著上升(P < 0.01),即细胞通透性严重下降,而HEPs则可使LDH释放率极显著下降(P < 0.01),细胞通透性得以恢复,且呈一定的剂量依赖关系。

|
A. HEPs对IPEC-J2细胞培养上清液LDH活力的影响;B. HEPs对IPEC-J2细胞中LDH活力的影响;C. HEPs对IPEC-J2细胞LDH释放率的影响 A. Effects of HEPs on LDH activities in cell-culture supernatant; B. Effects of HEPs on LDH activities in IPEC-J2 cells; C. Effects of HEPs on LDH release rate of IPEC-J2 cells 图 4 HEPs对IPEC-J2细胞乳酸脱氢酶(LDH)的影响(x±s, n=3) Figure 4 Effects of HEPs on LDH of IPEC-J2 cells (x±s, n=3) |
由图 5A可知,与空白对照组相比,H2O2处理可使IPEC-J2细胞ZO-1基因转录极显著下降(P < 0.01);低剂量的HEPs处理组中,ZO-1基因转录与模型组差异不显著(P>0.05),但是中、高剂量的HEPs处理细胞时,ZO-1基因转录极显著高于模型组(P < 0.01)。

|
A. HEPs对IPEC-J2细胞ZO-1 mRNA的影响;B、C. HEPs对IPEC-J2细胞ZO-1蛋白的影响 A. Effects of HEPs on ZO-1 mRNA in cell-culture supernatant; B, C. Effects of HEPs on ZO-1 protein in IPEC-J2 cells 图 5 HEPs对IPEC-J2细胞ZO-1表达的影响(x±s, n=3) Figure 5 Effects of HEPs on ZO-1 expression of IPEC-J2 cells (x±s, n=3) |
由图 5B可知,经过H2O2处理的IPEC-J2细胞的ZO-1蛋白表达量极显著下降(P < 0.01);而经过HEPs处理的IPEC-J2细胞的ZO-1蛋白表达量呈剂量依赖性地升高,在HEPs中、高剂量时,ZO-1蛋白表达极显著升高(P < 0.01)。
3 讨论氧化应激和细胞内氧化还原平衡的破坏已经被确定为动物疾病发生的关键基础因素。有研究表明,ROS过量的产生是导致断奶仔猪肠道屏障功能障碍的一个主要原因[16]。H2O2经常被用于研究氧化还原反应过程,因为在生物体内,H2O2相比于其他氧化应激物相对稳定,而且在生物体外,只有2.7%的H2O2会在1 h内分解[17]。因此,使用H2O2作为氧化应激物构建细胞氧化应激模型。MTT试验结果分析显示,0.4 mmol·L-1的H2O2作用1 h就能显著地抑制细胞的生长。
本试验研究猴头菇多糖在细胞氧化应激状态下改变细胞通透性的能力,提高IPEC-J2细胞对抗外界的氧化应激的能力。需氧细胞在代谢过程中会产生一系列的活性氧簇(reactive oxygen species, ROS),包括:O2-、H2O2、·OH等。当细胞受到外界的氧化应激,细胞内会产生高浓度的ROS,而高浓度的ROS会进一步诱导细胞凋亡甚至导致其坏死[18]。本试验结果说明当IPEC-J2细胞在受到H2O2氧化应激的时候,细胞内ROS含量升高,细胞受到氧化损伤;经过HEPs预处理后,HEPs能够对细胞内ROS的产生起到一定的抑制作用,减少细胞内产生过多的ROS,缓解IPEC-J2细胞因氧化应激出现的损伤。
SOD和CAT是重要的抗氧化酶。SOD在平衡氧化和抗氧化作用中起着至关重要的作用。SOD为自由基清除剂,能够清除超氧阴离子自由基,SOD活力的高低间接反映了机体清除自由基的能力。CAT是一种普遍存在的酶,它能高效地促进H2O2分解成为H2O和O2,防止细胞氧化损伤[19]。MDA是氧自由基脂质过氧化的最终产物[20],MDA含量的高低间接反映了机体细胞受自由基攻击的严重程度。LDH水平的变化也能间接反映细胞损伤程度。本研究结果说明大量ROS存在于细胞内,导致细胞抗氧化功能降低。同时HEPs能够保护损伤细胞中的抗氧化物酶,有效的保护细胞抗氧化能力,降低细胞受自由基攻击和细胞膜的损伤程度,帮助机体重建一个新的氧化还原平衡。
紧密连接位于上皮细胞质膜基底外侧区域,在调节上皮细胞细胞通透性和保持底侧极性起着至关重要的作用[21-22]。ZO-1蛋白是第一个被确认的紧密连接蛋白[23],一直被认为在紧密连接的构成和维持上皮细胞的极性发挥重要作用[24]。本试验中,IPEC-J2细胞在0.4 mmol·L-1 H2O2处理1 h后,ZO-1基因和蛋白质的表达量明显下降,细胞膜上紧密连接蛋白间接地减少,使得细胞膜的通透性增大,不利于IPEC-J2细胞的正常生长。经过HEPs预处理后,ZO-1基因和蛋白质的表达量均呈剂量依赖性地升高,说明HEPs能够有效的提高氧化应激状态下IPEC-J2细胞的ZO-1基因和蛋白质的表达量,促进紧密连接蛋白的分泌,降低细胞膜的通透性,从而降低细胞受到氧化损伤的程度。
4 结论猴头菇多糖可以有效缓解H2O2引起的IPEC-J2细胞氧化损伤,提高细胞的抗氧化能力,有效地提高IPEC-J2细胞氧化损伤过程中ZO-1基因和蛋白质的相对表达量,保护细胞紧密连接的屏障作用,使细胞存活率上升。
| [1] |
吴永魁, 胡仲明. 动物应激医学及应激的分子调控机制[J]. 中国兽医学报, 2005, 25(5): 557–560.
WU Y K, HU Z M. Animal stress medicine and the molecular mechanism of stress[J]. Chinese Journal of Veterinary Science, 2005, 25(5): 557–560. (in Chinese) |
| [2] |
顾立伟, 刘杨. 关于中国养猪业的思考[J]. 中国畜牧杂志, 2013, 49(2): 50–54.
GU L W, LIU Y. Reflections on China's pig industry[J]. Chinese Journal of Animal Science, 2013, 49(2): 50–54. (in Chinese) |
| [3] |
刘亚华, 张杰, 代正, 等. 山莨菪碱对心搏骤停猪氧化应激致心肌线粒体损伤的保护作用[J]. 中华危重病急救医学, 2013, 25(5): 290–293.
LIU Y H, ZHANG J, DAI Z, et al. Protection of anisodamine on the mitochondrial injury induced by oxidative stress in swine with cardiac arrest[J]. Chinese Critical Care Medicine, 2013, 25(5): 290–293. (in Chinese) |
| [4] | HE R R, LI Y, LI X D, et al. A new oxidative stress model, 2, 2-azobis (2-amidinopropane) dihydrochloride induces cardiovascular damages in chicken embryo[J]. PLoS One, 2013, 8(3): e57732. DOI: 10.1371/journal.pone.0057732 |
| [5] | PIEKARSKI A L, KONG B W, LASSITER K, et al. Cell bioenergetics in Leghorn male hepatoma cells and immortalized chicken liver cells in response to 4-hydroxy 2-nonenal-induced oxidative stress[J]. Poult Sci, 2014, 93(11): 2870–2877. DOI: 10.3382/ps.2014-04113 |
| [6] | WANG W W, WU Z L, LIN G, et al. Glycine stimulates protein synthesis and inhibits oxidative stress in pig small intestinal epithelial cells[J]. J Nutr, 2014, 144(10): 1540–1548. DOI: 10.3945/jn.114.194001 |
| [7] | WANG Y, TONG J, CHANG B, et al. Effects of alcohol on intestinal epithelial barrier permeability and expression of tight junction-associated proteins[J]. Mol Med Rep, 2014, 9(6): 2352–2356. DOI: 10.3892/mmr.2014.2126 |
| [8] | AL-SADI R, YE D M, BOIVIN M, et al. Interleukin-6 modulation of intestinal epithelial tight junction permeability is mediated by JNK pathway activation of claudin-2 gene[J]. PLoS One, 2014, 9(3): e85345. DOI: 10.1371/journal.pone.0085345 |
| [9] |
高红梅. ETEC对断奶腹泻仔猪胃肠道紧密连接蛋白ZO-1的影响[D]. 武汉: 华中农业大学, 2010.
GAO H M. Effects of ETEC with gastrointestinal tight junction protein ZO-1 on early weanling and diarrhea pigs[D]. Wuhan:Huazhong Agricultural University, 2010. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10504-1010010073.htm |
| [10] | ZHU Y, CHEN Y, LI Q, et al. Preparation, characterization, and anti-Helicobacter pylori activity of Bi3+-Hericium erinaceus polysaccharide complex[J]. Carbohydr Polym, 2014, 110: 231–237. DOI: 10.1016/j.carbpol.2014.03.081 |
| [11] | ZAN X Y, CUI F J, LI Y H, et al. Hericium erinaceus polysaccharide-protein HEG-5 inhibits SGC-7901 cell growth via cell cycle arrest and apoptosis[J]. Int J Biol Macromol, 2015, 76: 242–253. DOI: 10.1016/j.ijbiomac.2015.01.060 |
| [12] |
邵梦茹. 猴头菇多糖对胃肠黏膜保护作用的实验研究[D]. 广州: 广州中医药大学, 2014: 3-4.
SHAO M R. Protective role of Hericium erinaceus polysaeeharides on gastrointestinal mucosal barrier function[D]. Guangzhou:Guangzhou University of Chinese Medicine, 2014:3-4. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10572-1014355186.htm |
| [13] |
黄丽娜, 姜慧慧, 王洁, 等. 猴头菇多糖对呼肠孤病毒感染番鸭肠道黏膜免疫及抗氧化能力的影响[J]. 畜牧兽医学报, 2015, 46(9): 1671–1677.
HUANG L N, JIANG H H, WANG J, et al. Effects of Hericium erinaceus polysaccharide on Intestinal mucosal immune and antioxidant capacity of Muscovy ducks infected with reovirus[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(9): 1671–1677. (in Chinese) |
| [14] |
孙雪宁, 陈景杰, 黄诗杭, 等. 猴头菇多糖对MDRV感染雏番鸭肠道修复作用与MAdCAM-1分泌量关系的研究[J]. 中国家禽, 2016, 38(9): 24–28.
SUN X N, CHEN J J, HUANG S H, et al. Relationship between intestinal tract restoration by Hericium erinaceus polysaccharide and MAdCAM-1 secretion in MDRV-infected Muscovy ducklings[J]. China Poultry, 2016, 38(9): 24–28. (in Chinese) |
| [15] |
陈新瑶, 董星, 陈景杰, 等. 响应曲面法优化猴头菇粗多糖的提取工艺[J]. 中国农业科技导报, 2017, 19(3): 131–136.
CHEN X Y, DONG X, CHEN J J, et al. Optimization of extraction process for crude polysaccharide from Hericium erinaceus by response surface methodology[J]. Journal of Agricultural Science and Technology, 2017, 19(3): 131–136. (in Chinese) |
| [16] | ZHU L H, ZHAO K L, CHEN X L, et al. Impact of weaning and an antioxidant blend on intestinal barrier function and antioxidant status in pigs[J]. J Anim Sci, 2012, 90(8): 2581–2589. DOI: 10.2527/jas.2011-4444 |
| [17] | PASZTI-GERE E, CSIBRIK-NEMETH E, SZEKER K, et al. Acute oxidative stress affects IL-8 and TNF-α expression in IPEC-J2 porcine epithelial cells[J]. Inflammation, 2012, 35(3): 994–1004. DOI: 10.1007/s10753-011-9403-8 |
| [18] | ZHAO X M, XIANG H L, BAI X Y, et al. Porcine parvovirus infection activates mitochondria-mediated apoptotic signaling pathway by inducing ROS accumulation[J]. Virol J, 2016, 13: 26. DOI: 10.1186/s12985-016-0480-z |
| [19] | ALFONSO-PRIETO M, BIARNÉS X, VIDOSSICH P, et al. The molecular mechanism of the catalase reaction[J]. J Am Chem Soc, 2009, 131(33): 11751–11761. DOI: 10.1021/ja9018572 |
| [20] | KIN H, ZHAO Z Q, SUN H Y, et al. Postconditioning attenuates myocardial ischemia-reperfusion injury by inhibiting events in the early minutes of reperfusion[J]. Cardiovasc Res, 2004, 62(1): 74–85. DOI: 10.1016/j.cardiores.2004.01.006 |
| [21] | ANDERSON J M, VAN ITALLIE C M, FANNING A S. Setting up a selective barrier at the apical junction complex[J]. Curr Opin Cell Biol, 2004, 16(2): 140–145. DOI: 10.1016/j.ceb.2004.01.005 |
| [22] | MATTER K, BALDA M S. Functional analysis of tight junctions[J]. Methods, 2003, 30(3): 228–234. DOI: 10.1016/S1046-2023(03)00029-X |
| [23] | STEVENSON B R, SILICIANO J D, MOOSEKER M S, et al. Identification of ZO-1:A high molecular weight polypeptide associated with the tight junction (zonula occludens) in a variety of epithelia[J]. J Cell Biol, 1986, 103(3): 755–766. DOI: 10.1083/jcb.103.3.755 |
| [24] | NASU Y, IDO A, TANOUE S, et al. Hepatocyte growth factor stimulates the migration of gastric epithelial cells by altering the subcellular localization of the tight junction protein ZO-1[J]. J Gastroenterol, 2013, 48(2): 193–202. DOI: 10.1007/s00535-012-0615-y |



