鹿茸是梅花鹿(Cervus nippon)或马鹿(Cervus elaphus)的雄性未骨化密生茸毛的幼角[1],是现今为止发现的唯一可完全周期性脱落、再生的哺乳动物器官,并被作为器官再生模型受到广泛关注。春天骨质鹿角脱落,角柄萌生新茸,并迅速生长,梅花鹿鹿茸生长速度可以达到12.5 mm·d-1[2],北美马鹿鹿茸可以达到27.5 mm·d-1[3],随后生长速度减慢,骨化速度逐渐增加,茸皮迅速干燥脱落,最终完全骨质化。完全骨质化鹿角在第二年春天脱落,进入下一生长周期。此外,鹿茸还是一种名贵的中药材,《本草纲目》记载:“生精补髓,养血益阳,强健筋骨。治一切虚损、耳聋、目暗、眩晕、虚痢”[4]。现代研究发现,鹿茸多肽、多糖、细胞因子等具有抑制肿瘤细胞,促进细胞增殖分化,促进伤口愈合,拮抗骨质疏松,增强免疫,抗氧化、衰老以及肝损伤等作用[5-8]。鹿茸中相对于其他成分,蛋白质含量较高(51%~57%)[9],视为主要的药理活性成分。加之蛋白质作为生命活动的主要承担者,对各项生命过程的顺利进行至关重要。因此对鹿茸蛋白质组进行研究,将有助于鹿茸快速生长、骨化、脱落、再生,以及药用机理的阐明。韩国学者H.J.Park等[10]首次采用双向凝胶电泳结合MALDI-TOF质谱技术建立了鹿茸蛋白质表达谱,并成功鉴定出130种蛋白质,张然然等[11]以4个时期梅花鹿鹿茸为材料,运用双向凝胶电泳技术成功鉴定64种差异表达蛋白,靳梦亚等[12]以7种不同处理鹿茸为材料,运用iTRAQ技术成功鉴定1 015种蛋白,87种差异表达蛋白。Z.G.Sui等[13]以30天排血茸为材料,成功鉴定1 523种蛋白,所鉴定蛋白主要为结构蛋白、酶活性蛋白、分泌蛋白等。
本试验采用双向电泳、MALDI-TOF-MS质谱鉴定技术,结合生物信息学分析方法,对天山马鹿三杈茸(65 d)、四杈茸(75 d)不同部位(上、中、下)进行差异蛋白质筛选,以期为鹿茸快速生长机制的阐明和药理活性成分的筛选提供理论依据。
1 材料与方法 1.1 主要化学试剂尿素、硫脲、3-[(3-胆酰胺基丙基)二甲基氨基]-2-羟基-1-丙磺酸盐(CHAPS)、二硫苏糖醇(DTT)、两性电解质(Bio-Lyte, pH 3~10)、2-D Clean-up Kit、RC DC Protein Assay Kit Ⅱ、IPG胶条(17 cm pH 4~7,非线性)、矿物油、碘乙酰胺、丙烯酰胺、甲叉双丙烯酰胺、十二烷基硫酸钠(SDS)、N, N, N’, N’-四甲基乙二胺(TEMED)、Tris、过硫酸铵(AP)、甘氨酸均为Bio-Rad公司产品(Hercules, CA, USA)。
1.2 试验材料三杈茸(65 d)、四杈茸(75 d)均取自新疆昌吉市的4锯天山马鹿(图 1)。

|
图 1 不同部位天山马鹿鹿茸 Figure 1 Velvet antlers of Cervus elaphus songaricus of different parts |
新鲜3杈茸(65 d)、四杈茸(75 d)取上、中、下3段,切成1 mm3小块,PBS溶液快速清洗样品表面残留血液,经液氮研磨仪研磨成粉末,三杈茸上、中、下段与四杈茸上、中、下段依次标记为1、2、3、4、5、6(图 1、图 2、表 1),-80 ℃冰箱保存,备用。每份样品分别称取0.2 g,加入1 mL裂解液(7 mol·L-1尿素,2 mol·L-1 硫脲,4% CHAPS,65 mmol·L-1 DTT,0.2% Bio-lyte,1% PMSF),超声3 min,冰浴2 h,每隔30 min漩涡震荡1 min,4 ℃ 20 000×g离心20 min,收集上清液,使用2D Clean-up蛋白质纯化试剂盒对蛋白质原液做进一步的纯化,以去除蛋白质溶液中的脂质、盐离子等杂质。RCDC法测定蛋白质浓度,分装、-80 ℃保存备用。
|
|
表 1 天山马鹿鹿茸不同时期、不同部位差异表达蛋白质谱鉴定结果 Table 1 Identification of differentially expressed proteins by MS in different parts of three-branched and four-branched antlers from Cervus elaphus songaricus |

|
图 2 双向电泳图与鉴定蛋白点 Figure 2 2-DE maps and identified spots of differentially expressed proteins |
采用17 cm, pH 4~7非线性IPG胶条进行蛋白质等电聚焦,上样体积300 μL,第一向等电聚焦程序设置:被动水化2 h,50 V主动水化14 h,100 V快速升压1.5 h,200 V快速升压1.5 h,500 V快速升压1 h,1 000 V快速升压1.5 h,10 000 V线性升压5 h,10 000 V快速升压,最终累积增压达到90 000 V·h-1,完成蛋白质等电聚焦。取出胶条,湿润滤纸擦除胶条表面矿物与残留的蛋白质溶液,用5 mL胶条平衡缓冲液Ⅰ(1% DTT,6 mol·L-1尿素,2% SDS,0.05 mol·L-1 Tris-HCl,30%甘油)平衡15 min,取出胶条,湿润滤纸除残液后,用5 mL胶条平衡缓冲液Ⅱ(4% IAA,6 mol·L-1尿素,2% SDS,0.05 mol·L-1 Tris-Hcl,30%甘油)避光平衡15 min。双向电泳液漂洗胶条,将胶条转移至12%聚丙烯酰胺凝胶(带有0.5 cm的5%浓缩胶)顶部,0.75%低熔点琼脂糖封胶,进行第二向电泳,10 mA·gel-1, 1 h,20 mA·gel-1至溴酚蓝距胶板下缘0.5 cm时停止电泳,考马斯亮蓝G-250法染色。
1.5 图像分析与质谱鉴定PowerLook 2100XL-USB彩色扫描仪(UMAX)扫描凝胶,分辨率300 dpi,每个样品3次技术重复。用PDQuestTM 8.0(Bio-Rad Hercules,CA,USA)分析凝胶图像,获取差异蛋白质(变化倍数2倍及以上),手动切取凝胶上的差异蛋白质点(图 2),并送至上海中科新生命生物科技有限公司进行质谱鉴定,检测仪器型号:5800 MALDI-TOF/TOF质谱仪(AB SCIEX)。用Mascot 2.2软件搜索UniProt数据库。检索参数:胰蛋白酶,最大不完全酶切位点数为1,固定修饰Carbamidomethyl (C),可变修饰Oxidation (M),肽段匹配数≥2,蛋白得分≥95(P<0.05)。
1.6 生物信息学分析用PANTHER (http://www.pantherdb.org/)对成功鉴定的差异蛋白进行生物过程、分子功能以及蛋白类别分析。通过DAVID (https://david.ncifcrf.gov/home.jsp)进行信号通路富集分析。
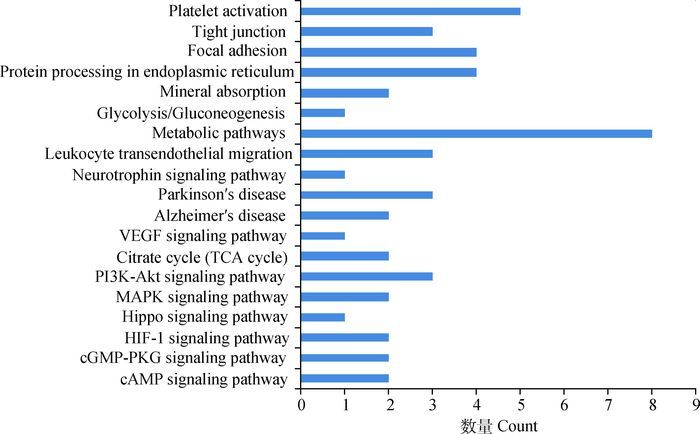
2 结果 2.1 差异表达蛋白质谱鉴定与分类成功鉴定出104个蛋白点,归属于65种蛋白质(表 1),pI为4.51~9.23,Mr为8.73~224.15 ku。分子功能涉及抗氧化活性、结合、催化活性、结构分子活性、翻译调节活性以及转运活性,生物学过程主要涉及代谢过程、细胞过程、发育、定位以及应激,蛋白类别主要涉及细胞骨架蛋白、氧化还原酶、信号分子、转移酶,如图 3所示。代谢通路(图 4)主要涉及代谢途径、血小板活化、黏着斑、PI3K-Akt信号通路等。以上65种蛋白经UniProt查询,抗氧化、内质网应激相关蛋白4种(P81623、Q9BGI3、Q922R8、Q8NBS9);骨发育相关蛋白4种(Q5E9B7、P02459、Q2KIS7、P02465);神经发育相关蛋白3种(P60984、Q9QXT0、P48616);免疫相关蛋白7种(P46193、P22226、O46414、P02676、Q2TQ89、Q9XS08、P04264);血管发育相关蛋白2种(P02465、P04264);凋亡相关蛋白5种(P63103、P81623、Q9BGI3、Q922R8、Q8NBS9)。

|
图 3 鉴定蛋白功能分析 Figure 3 Functional clustering analysis of identified proteins by PANTHER |
|
图 4 鉴定蛋白信号通路分析 Figure 4 Pathway analysis identified proteins by DAVID |
1号样品中上调蛋白质19种,以发育相关蛋白(P02459、P19623、P60984、Q17QQ1、Q2KIS7、Q9QXT0) 和结构蛋白(A0S012、P02567、P24844、Q3SYX9、Q3T0F7、Q6IG01、Q8K4T4) 为主;2号样品中上调蛋白质3种:发育相关蛋白(P02465)、结构蛋白(A4IFE3)、转运蛋白(Q29443);3号样品中上调蛋白质18种,以免疫(P22226、P46193、Q9XS08) 和信号转导(P19803、P29762、P86214、Q95ME3) 为主;4号样品中上调蛋白11种,以蛋白质合成(Q3T149、Q5E983、Q922R8) 和转运蛋白(O46375、Q28104、Q5E9B7) 为主;5号样品中上调蛋白11种,以结构蛋白(A1L595、P02534、P02676、Q2Q1M7、Q6EIY9) 和碳水化合物代谢(A6H768、P16116) 为主;6号样品中上调蛋白3种,以转运蛋白(O46414、P02074) 为主。
3 讨论马鹿鹿茸多在三杈、四杈时期收取,此时鹿茸体积大,致密,质量大,药效被多数人认可。本试验以天山马鹿三杈茸(65 d)、四杈茸(75) 为样品,成功鉴定了104个蛋白点,65种蛋白,主要涉及细胞凋亡、骨发育、神经发育、血管形成、止血、抗炎以及免疫等过程,有助于鹿茸快速生长发育、抗炎特性机理的阐明。
3.1 多点重复蛋白鉴定结果显示,凝胶中部分不同蛋白点为同种蛋白,如,血清白蛋白:6208、7116、7139、7202、3202、5202、7116、9103;波形蛋白:1213、1205、1209、1303;甲状腺运载蛋白:7011、7212、6005;四连接素:3005、6002、4001等。究其原因,生物体内环境复杂,各种生命活动相协调,共同维持机体正常运转。这也就决定了体内多数物质有着不同状态,尤其是生命活动的承担者——蛋白质,蛋白质常见修饰中的甲基化、酰基化、磷酸化等可以改变蛋白质分子量、等电点,使得不同状态的同种蛋白在2-DE凝胶上出现在不同位置。
3.2 与梅花鹿鹿茸蛋白组异同点鹿茸温补,强身,治虚损,长久以来作为名贵中药为大家喜爱,众多鹿茸中又以梅花鹿鹿茸最受欢迎,自用或送礼多选用梅花鹿鹿茸。又因国内梅花鹿鹿茸产量有限,各药厂以及鹿茸加工单位多以马鹿鹿茸、赤鹿鹿茸作为主要原料进行加工,生产相关产品。本试验选用马鹿鹿茸为试验材料,鉴定得到了65种差异表达蛋白,虽然与张然然,勒梦亚等人用梅花鹿鹿茸鉴定所得的差异表达蛋白在种类上大致一半重叠[11-12],但总体分类上一致。此外与其他研究数据相比较,发现60种蛋白一致,新鉴定到5种蛋白,分别为抗药蛋白、亚精胺合成酶、抗菌肽-1、细丝蛋白-A-互作蛋白1、半乳糖激酶, 其中抗药蛋白与肿瘤多药耐药性相关[14-15], 并有望成为肿瘤耐药的预测指标和靶点[16]。这5种蛋白可能在梅花鹿鹿茸中也有表达,未检测到的原因可能是样品获取以及处理上存在差异。
3.3 部分已鉴定蛋白质与鹿茸生物学特性、药效的关系四杈茸与三杈茸收取时间间隔短,但相对于三杈茸,四杈茸的骨化速度更快,程度明显增加,更加致密。骨组织比重快速大量增加,其他组织迅速退化,势必伴随着旺盛的代谢活动,各种相关细胞大量增殖、分化或凋亡。
本试验鉴定得到3种生长发育相关蛋白:甲状腺素运载蛋白(TTR)、视黄醇结合蛋白(RBP4) 以及视黄酸结合蛋白(CRABP1),表达量由茸尖至茸基均呈上升趋势,且含量较高。RBPs与CRABPs同属于iLBP (细胞内脂结合蛋白超家族)成员,在视黄醇代谢中发挥重要作用。视黄酸(RA)作为视黄醇代谢产物,对多种组织、细胞起诱导分化作用,并且被广泛用于肿瘤的治疗。CRABP与RA作用,封闭其活性,传递给微粒体氧化酶进行降解,或转入细胞核,经异二聚体RAR-AXR与靶DNA紧密结合,调节转录活性。CRABP包含两种蛋白,CRABP1和CRABP2。CRABP1与RA结合,促进RA与微粒体酶之间的反应,负调节RA活性。研究显示,CRABP1在RA诱导细胞增殖与分化的过程中有重要作用[17]。但也有学者认为,CRABP1只在表达RA代谢酶的细胞中对RA转录活性有抑制作用[18]。此外,表观遗传修饰中的CpG岛甲基化研究显示,CRABP基因异常甲基化和肿瘤存在相关性。结肠癌中CRABP1基因异常甲基化与周期蛋白D1的高表达相关[19]。食管鳞癌细胞中诱导CRABP1基因表达,可诱导细胞停滞在G0/G1期[20],抑制肿瘤细胞增殖[21]。综上,CRABP1可能通过促进胞质RA降解,调节胞质与核内RA正常浓度,以发挥促进细胞增殖、分化,抑制细胞异常增殖作用。TTR含量可以很好的体现体内蛋白合成水平[22]。较高含量的TTR预示着鹿茸内较高的甲状腺素水平,以及较大的蛋白合成强度。在三杈茸、四杈茸组织被骨组织快速取代的过程中,CRABP1以及甲状腺素可能起协同作用,既促进了相关组织细胞的快速增殖与分化,又尽可能避免了细胞的异常增殖。为三杈茸向四杈茸过渡中骨相关组织的快速发育,以及其他相关组织迅速退化机理的阐明提供了一定的理论基础。
鹿茸内组织细胞快速增值、分化以及凋亡,其旺盛的物质代谢引起活性氧成分增加,内质网内未折叠/错误折叠等有害蛋白量增加等,影响细胞自身正常生理功能。本研究发现了样品中的凋亡相关蛋白:过氧化物氧化还原酶-2(PRDX2)、含硫氧还蛋白结构域蛋白5(TXNDC5)、内质网分子伴侣蛋白29(ERP29)、蛋白二硫键异构酶A6(PDIA6) 含量较高。PRDX2可有效清除活性氧,使其维持在正常水平,调节细胞生理功能。折叠酶(如ERP29)、PDI家族(如TXNDC5、PDIA6) 可在内质网应激(ERS)引发的非折叠蛋白反应(URP)中起重要作用。PDIA6作为分子伴侣,属于内质网常驻蛋白,主要存在于内质网中。能够帮助新生肽链正确折叠成有生物学活性的成熟蛋白质,与错误聚集肽链非特异性相结合,诱导其正确折叠,以及参与损伤蛋白质的修复与再折叠。基于以上功能,PDIA6在ERS引发的URP信号通路中,能够降低去折叠蛋白质的聚集程度,增加可溶态蛋白数量,以及帮助其正确折叠,对URP信号通路平衡有害蛋白质的去留起作用,激活MEK1/ERK途径和PI3K/AKT途径,抑制细胞凋亡[23],使应激状态细胞逐渐恢复正常。如果内质网中未折叠/错误折叠等有害蛋白质浓度居高不下,长时间的URP引发细胞凋亡途径、内质网相关性死亡(ERAD)途径以及线粒体诱导的凋亡途径,使细胞发生凋亡[24-27]。PDIA6与ERP29、TXNDC5、PRDX2 4种蛋白可从抗氧化、内质网应激角度,部分揭示鹿茸细胞内活性氧和内质网中有害蛋白积累时的应对措施。对鹿茸内存在大量增殖、分化细胞的同时,出现众多凋亡细胞这一现象机理的阐明有一定作用。
神经胶质成熟因子-β(GMFβ),在三杈、四杈茸尖含量最高,往下降低,三杈茸尖含量高于四杈茸尖,GMFβ是一种17 ku的小分子酸性蛋白,高度保守,主要表达于中枢神经系统内的星形胶质细胞和神经元,脑组织中优势表达,被定义为神经发育调节子。初期研究主要集中在对神经源性细胞生长发育、增殖、分化以及凋亡作用[28-31]的研究。后续研究显示,该因子是具有多种功能的适应性蛋白,具体功能依赖于所处微环境,参与多种生理、病理过程。促进星形胶质细胞分化[32-34]、神经元的生长与再生修复[35-36],参与免疫调节、应激反应[37-39]、氧化还原反应[40]。其表达水平和磷酸化修饰异常与神经系统炎性疾病(早老年性痴呆(AD)[41]、帕金森病(PD)、自身免疫性脑脊髓炎(EAE)[42-45])、神经肿瘤和某些非神经源性肿瘤的发生相关[46]。提示茸尖相对于其他部位,三杈茸尖相对于四杈茸尖,神经组织相对含量更高,且生长发育代谢更加旺盛,以便满足鹿茸快速生长的需要,以及匹配逐渐加深的骨化程度。此外,通过激活GMF-β-MEK3 /6-p38通路、抑制ERK1 /2-BCL-2和BCL-X /L通路的活化,GMF-β可介导榄香烯的抗人胶质瘤细胞增殖作用[47],提示该因子可作为抑制胶质瘤增殖的靶点。
抗菌肽(CATHL1) [48-51]是一类广泛存在于自然界的小分子多肽,在有机体先天性免疫中起重要作用,具有广谱抗菌性,抗真菌,抗寄生虫和原虫,抗病毒,抗肿瘤,以及免疫调节等功能。因其抗菌性不逊色于抗生素,对一些抗生素耐受型菌又有很好的杀灭作用,不易产生耐药性,无残留,不污染环境,在临床、医药与基因工程、水产养殖业、禽畜养殖业(猪、家禽、反刍动物)、食品行业应用较多,拥有广泛的应用前景。鉴于鹿茸作为名贵中药可显著提升机体机能,提示鹿茸药效可能与抗菌肽有关,或许可以作为优质天然抗菌肽备选来源之一。
4 结论本次试验较梅花鹿鹿茸新鉴定到5种差异表达蛋白:抗药蛋白、亚精胺合成酶、抗菌肽-1、细丝蛋白-A-互作蛋白1、半乳糖激酶。TTR、RBP4、CRABP1在鹿茸由三杈茸过渡到四杈茸的过程中对鹿茸组织的细胞增殖和分化具有一定调控作用。PRDX2、TXNDC5、ERP29、Pdia6在内质网应激、抗氧化中起重要作用。内质网应激、内质网相关性死亡途径、线粒体凋亡途径可在一定程度上阐明鹿茸细胞快速增殖、分化的同时存在大量细胞凋亡现象的机理,以满足其快速生长、发育的需要。GMFβ、CATHL1分别在神经发育和炎症抗性中起作用,其具体药效需要进一步验证。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (2010 English Edition)[M]. Beijing: China Medical Science Press, 2011: 303. |
| [2] |
高志光, 李春义, 刘钟安, 等. 梅花鹿鹿茸生长速度、骨化程度与睾酮、雌二醇、碱性磷酸酶关系的研究[J]. 畜牧兽医学报, 1988, 19(3): 171–176.
GAO Z G, LI C Y, LIU Z A, et al. The study on the relationship between antler's growth rate, relative bone mass and circulating testosterone, estradiol, AKP in Sika Deer (Cervus Nippon Hortulorum)[J]. Acta Veterinaria et Zootechnica Sinica, 1988, 19(3): 171–176. (in Chinese) |
| [3] | GOSS R J. Problem of antlerogenesis[J]. Ortopaedics, 1970, 69: 227–238. |
| [4] | GOSS R J. Future directions in antler research[J]. Anat Rec, 1995, 241(3): 291–302. DOI: 10.1002/(ISSN)1097-0185 |
| [5] |
陶荣珊, 胡太超, 李金伟, 等. 鹿茸多肽提取分离纯化及药理作用研究进展[J]. 经济动物学报, 2014, 18(4): 238–242.
TAO R S, HU T C, LI J W, et al. Advances on extraction, purification and pharmacological effect of polypeptide from velvet antler[J]. Journal of Economic Animal, 2014, 18(4): 238–242. (in Chinese) |
| [6] |
韩春梅, 王姗姗, 高庆华, 等. TGF-β1诱导马鹿茸MSCs软骨分化及c-myc基因的表达[J]. 生物技术通报, 2016, 32(3): 109–114.
HAN C M, WANG S S, GAO Q H, et al. TGF-β1-induced differentiation of wapiti antler mesenchymal stem cells to cartilage and expression profile of gene c-myc[J]. Biotechnology Bulletin, 2016, 32(3): 109–114. (in Chinese) |
| [7] |
张传奇, 郑毅男, 张成中, 等. 鹿茸多糖的研究概况[J]. 经济动物学报, 2013, 17(1): 45–48.
ZHANG C Q, ZHENG Y N, ZHANG C Z, et al. The general research situation of the polysaccharides in Pilose Antler[J]. Journal of Economic Animal, 2013, 17(1): 45–48. (in Chinese) |
| [8] |
何忠梅, 吕伟, 孙玉滨, 等. 鹿茸抗骨质疏松症研究进展[J]. 经济动物学报, 2015, 19(3): 172–175.
HE Z M, LV W, SUN Y B, et al. Current status of the anti-osteoporosis research of Cervi Cornu Pantotrichum[J]. Journal of Economic Animal, 2015, 19(3): 172–175. (in Chinese) |
| [9] |
赵磊, 李继海, 朱大洲, 等. 5种鹿茸营养成分的主成分分析[J]. 光谱学与光谱分析, 2010, 30(9): 2571–2575.
ZHAO L, LI J H, ZHU D Z, et al. Principal component analysis of nutrients in five varieties of velvet antler (Cornu Cervi Pantotrichum)[J]. Spectroscopy and Spectral Analysis, 2010, 30(9): 2571–2575. (in Chinese) |
| [10] | PARK H J, LEE D H, PARK S G, et al. Proteome analysis of red deer antlers[J]. Proteomics, 2004, 4(11): 3642–3653. DOI: 10.1002/(ISSN)1615-9861 |
| [11] |
张然然, 刘华淼, 邵元臣, 等. 不同生长时期梅花鹿鹿茸差异蛋白质组学分析[J]. 畜牧兽医学报, 2016, 47(3): 493–501.
ZHANG R R, LIU H M, SHAO Y C, et al. Comparative proteomic analysis in different growth stages of sika deer velvet antler[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(3): 493–501. (in Chinese) |
| [12] |
靳梦亚, 董玲, 罗元明, 等. 利用iTRAQ技术联合2D LC-MS研究不同加工工艺鹿茸的差异蛋白质组学[J]. 药学学报, 2015, 50(12): 1637–1644.
JIN M Y, DONG L, LUO Y M, et al. Comparative proteomics study of different processing technology for pilose antler using iTRAQ technology coupled with 2D LC-MS[J]. Acta Pharmaceutica Sinica, 2015, 50(12): 1637–1644. (in Chinese) |
| [13] | SUI Z G, WENG Y J, ZHAO Q, et al. Ionic liquid-based method for direct proteome characterization of velvet antler cartilage[J]. Talanta, 2016, 161: 541–546. DOI: 10.1016/j.talanta.2016.08.083 |
| [14] |
刘明艳, 张虹. Sorcin沉默表达对人卵巢癌耐药细胞SKOV3/CDDP耐药性的影响及机制[J]. 中国癌症杂志, 2013, 23(6): 439–446.
LIU M Y, ZHANG H. The effect and mechanism of Sorcin silencing on drug resistance of human ovarian cancer SKOV3/CDDP cell lines[J]. China Oncology, 2013, 23(6): 439–446. (in Chinese) |
| [15] |
王涛, 裴复阳, 王琪, 等. Sorcin蛋白高表达与肺癌细胞株NCI-H446多药耐药的关系[J]. 大连医科大学学报, 2013, 35(5): 420–423, 433.
WANG T, PEI F Y, WANG Q, et al. Relationship of Sorcin over-expression to multidrug resistance of human lung cancer cell line NCI-H446[J]. Journal of Dalian Medical University, 2013, 35(5): 420–423, 433. DOI: 10.11724/jdmu.2013.05.03 (in Chinese) |
| [16] |
刘巧营. P-gp、Sorcin及GCS在三阴乳腺癌及非三阴乳腺癌中的表达及意义[D]. 锦州: 辽宁医学院, 2015.
LIU Q Y. Expression and significance of P-gp, Sorcin and GCS in TNBC and non-triple-negativebreast cancer[D]. Jinzhou:Liaoning Medical University, 2015. (in Chinese) http://xuewen.cnki.net/CMFD-1015445156.nh.html |
| [17] | BANZ C, UNGETHUEM U, KUBAN R J, et al. The molecular signature of endometriosis-associated endometrioid ovarian cancer differs significantly from endometriosis-independent endometrioid ovarian cancer[J]. Fertil Steril, 2010, 94(4): 1212–1217. DOI: 10.1016/j.fertnstert.2009.06.039 |
| [18] | TANG X H, VIVERO M, GUDAS L J. Overexpression of CRABPI in suprabasal keratinocytes enhances the proliferation of epidermal basal keratinocytes in mouse skin topically treated with all-trans retinoic acid[J]. Exp Cell Res, 2008, 314(1): 38–51. DOI: 10.1016/j.yexcr.2007.07.016 |
| [19] | NOSHO K, KAWASAKI T, CHAN A T, et al. Cyclin D1 is frequently overexpressed in microsatellite unstable colorectal cancer, independent of CpG island methylator phenotype[J]. Histopathology, 2008, 53(5): 588–598. DOI: 10.1111/j.1365-2559.2008.03161.x |
| [20] | TANAKA K, IMOTO I, INOUE J, et al. Frequent methylation-associated silencing of a candidate tumor-suppressor, CRABP1, in esophageal squamous-cell carcinoma[J]. Oncogene, 2007, 26(44): 6456–6468. DOI: 10.1038/sj.onc.1210459 |
| [21] | PARK J C, CHAE Y K, SON C H, et al. Epigenetic silencing of human T (brachyury homologue) gene in non-small-cell lung cancer[J]. Biochem Biophys Res Commun, 2008, 365(2): 221–226. DOI: 10.1016/j.bbrc.2007.10.144 |
| [22] | ANDO Y. Immunological and serological laboratory tests:transthyretin[J]. Rinsho Byori, 2005, 53(6): 554–557. |
| [23] | NOVOA I, ZENG H Q, HARDING H P, et al. Feedback inhibition of the unfolded Protein response by GADD34-mediated dephosphorylation of eIF2α[J]. J Cell Biol, 2001, 153(5): 1011–1022. DOI: 10.1083/jcb.153.5.1011 |
| [24] | FRIEDMAN A D. GADD153/CHOP, a DNA damage-inducible Protein, reduced CAAT/enhancer binding protein activities and increased apoptosis in 32D cl3 myeloid cells[J]. Cancer Res, 1996, 56(14): 3250–3256. |
| [25] | MCCULLOUGH K D, MARTINDALE J L, KLOTZ L O, et al. Gadd153 sensitizes cells to endoplasmic reticulum stress by down-regulating Bcl2 and perturbing the cellular redox state[J]. Mol Cell Biol, 2001, 21(4): 1249–1259. DOI: 10.1128/MCB.21.4.1249-1259.2001 |
| [26] | URANO F, WANG X Z, BERTOLOTTI A, et al. Coupling of stress in the ER to activation of JNK protein kinases by transmembrane protein kinase IRE1[J]. Science, 2000, 287(5453): 664–666. DOI: 10.1126/science.287.5453.664 |
| [27] | REIMERTZ C, KÖGEL D, RAMI A, et al. Gene expression during ER stress-induced apoptosis in neurons:induction of the BH3-only protein Bbc3/PUMA and activation of the mitochondrial apoptosis pathway[J]. J Cell Biol, 2003, 162(4): 587–597. DOI: 10.1083/jcb.200305149 |
| [28] |
朱廷准. GMFβ-MKK3/6信号通路在β-榄香烯抗脑胶质瘤细胞增殖中的作用[D]. 大连: 大连医科大学, 2011.
ZHU T Z. β-elemene inhibits proliferation of glioblastoma cells through activation of GMFβ-MKK3/6 signaling pathway[D]. Dalian:Dalian Medical University, 2011. (in Chinese) http://d.wanfangdata.com.cn/Thesis/Y2029481 |
| [29] | WANF B R, ZAHEER A, LIM R. Polyclonal antibody localizes glia maturation factor β-like immunoreactivity in neurons and glia[J]. Brain Res, 1992, 591(1): 1–7. DOI: 10.1016/0006-8993(92)90971-B |
| [30] | ZAHEER A, LIM R. Protein kinase A (PKA)-and protein kinase C-phosphorylated glia maturation factor promotes the catalytic activity of PKA[J]. J Biol Chem, 1997, 272(8): 5183–5186. DOI: 10.1074/jbc.272.8.5183 |
| [31] | INAGAKI M, AOYAMA M, SOBUE K, et al. Sensitive immunoassays for human and rat GMFB and GMFG, tissue distribution and age-related changes[J]. Biochim Biophys Acta, 2004, 1670(3): 208–216. DOI: 10.1016/j.bbagen.2003.12.006 |
| [32] | LIM R, TURRIFF D E, TROY S S, et al. Glia maturation factor:effect on chemical differentiation of glioblasts in culture[J]. Science, 1977, 195(4274): 195–196. DOI: 10.1126/science.188136 |
| [33] | LIM R, MITSUNOBU K. Brain cells in culture:morphological transformation by a protein[J]. Science, 1974, 185(4145): 63–66. DOI: 10.1126/science.185.4145.63 |
| [34] | SUZUKI T, KATO T, FUJⅡ T, et al. Cytoskeletal changes of glioblasts after morphological differentiation induced by glia maturation factor[J]. Neurochem Int, 1986, 9(2): 305–313. DOI: 10.1016/0197-0186(86)90067-7 |
| [35] | ZAHEER A, WEISS J L, GOYAL P, et al. Enhanced expression of neurotrophic factors by C6 rat glioma cells after transfection with glia maturation factor[J]. Neurosci Lett, 1999, 265(3): 203–206. DOI: 10.1016/S0304-3940(99)00253-0 |
| [36] | PANTAZIS N J, ZAHEER A, DAI D, et al. Transfection of C6 glioma cells with glia maturation factor upregulates brain-derived neurotrophic factor and nerve growth factor:trophic effects and protection against ethanol toxicity in cerebellar granule cells[J]. Brain Res, 2000, 865(1): 59–76. DOI: 10.1016/S0006-8993(00)02194-6 |
| [37] | ZAHEER A, ZAHEER S, SAHU S K, et al. A novel role of glia maturation factor:induction of granulocyte-macrophage colony-stimulating factor and pro-inflammatory cytokines[J]. J Neurochem, 2007, 101(2): 364–376. DOI: 10.1111/jnc.2007.101.issue-2 |
| [38] | UTSUYAMA M, SHIRAISHI J, TAKAHASHI H, et al. Glia maturation factor produced by thymic epithelial cells plays a role in T cell differentiation in the thymic microenvironment[J]. Int Immunol, 2003, 15(5): 557–564. DOI: 10.1093/intimm/dxg056 |
| [39] | YAMAZAKI H, TATEYAMA H, ASAI K, et al. Glia maturation factor-β is produced by thymoma and may promote intratumoral T-cell differentiation[J]. Histopathology, 2005, 47(3): 292–302. DOI: 10.1111/his.2005.47.issue-3 |
| [40] | KAIMORI J Y, TAKENAKA M, NAKAJIMA H, et al. Induction of glia maturation factor-β in proximal tubular cells leads to vulnerability to oxidative injury through the p38 pathway and changes in antioxidant enzyme activities[J]. J Biol Chem, 2003, 278(35): 33519–33527. DOI: 10.1074/jbc.M301552200 |
| [41] | KEMPURAJ D, KHAN M M, THANGAVEL R, et al. Glia maturation factor induces interleukin-33 release from astrocytes:implications for neurodegenerative diseases[J]. J Neuroimmune Pharmacol, 2013, 8(3): 643–650. DOI: 10.1007/s11481-013-9439-7 |
| [42] | KHAN M M, KEMPURAJ D, ZAHEER S, et al. Glia maturation factor deficiency suppresses 1-methyl-4-phenylpyridinium-induced oxidative stress in astrocytes[J]. J Mol Neurosci, 2014, 53(4): 590–599. DOI: 10.1007/s12031-013-0225-z |
| [43] | KHAN M M, ZAHEER S, NEHMAN J, et al. Suppression of glia maturation factor expression prevents 1-methyl-4-phenylpyridinium (MPP+)-induced loss of mesencephalic dopaminergic neurons[J]. Neuroscience, 2014, 277: 196–205. DOI: 10.1016/j.neuroscience.2014.07.003 |
| [44] | KHAN M M, ZAHEER S, THANGAVEL R, et al. Absence of glia maturation factor protects dopaminergic neurons and improves motor behavior in mouse model of parkinsonism[J]. Neurochem Res, 2015, 40(5): 980–990. DOI: 10.1007/s11064-015-1553-x |
| [45] | ZAHEER S, WU Y H, SAHU S K, et al. Overexpression of glia maturation factor reinstates susceptibility to myelin oligodendrocyte glycoprotein-induced experimental autoimmune encephalomyelitis in glia maturation factor deficient mice[J]. Neurobiol Dis, 2010, 40(3): 593–598. DOI: 10.1016/j.nbd.2010.08.003 |
| [46] |
匡晓燕. 神经胶质成熟因子-β介导胶质瘤源性血管新生的作用及其机制初探[D]. 重庆: 第三军医大学, 2015.
KUANG X Y. An inductive role of glia maturation factor-beta in the formation of glioma cell-derived neovessels and its preliminary mechanism[D]. Chongqing:Third Military Medical University, 2015. (in Chinese) |
| [47] |
朱廷准, 徐英辉, 李晓明, 等. GMF-β与MEK信号通路cross-talk介导榄香烯的抗胶质瘤作用[J]. 实用药物与临床, 2013, 16(3): 181–184.
ZHU T Z, XU Y H, LI X M, et al. Cross-talk between GMF-β and MEK signaling pathway mediates the inhibitory effect of elemene on glioblastoma[J]. Practical Pharmacy and Clinical Remedies, 2013, 16(3): 181–184. (in Chinese) |
| [48] |
李冠楠, 夏雪娟, 隆耀航, 等. 抗菌肽的研究进展及其应用[J]. 动物营养学报, 2014, 26(1): 17–25.
LI G N, XIA X J, LONG Y H, et al. Research progresses and applications of antimicrobial peptides[J]. Chinese Journal of Animal Nutrition, 2014, 26(1): 17–25. (in Chinese) |
| [49] |
苗建银, 柯畅, 郭浩贤, 等. 抗菌肽的提取分离及抑菌机理研究进展[J]. 现代食品科技, 2014, 30(1): 233–240.
MIAO J Y, KE C, GUO H X, et al. Extraction, isolation and antibacterial mechanism of antibacterial peptides[J]. Modern Food Science and Technology, 2014, 30(1): 233–240. (in Chinese) |
| [50] |
李孟孟, 王文策, 杨琳. 抗菌肽的研究进展及应用[J]. 中国家禽, 2015, 37(6): 42–46.
LI M M, WANG W C, YANG L. Research advances and application of antibacterial peptides[J]. China Poultry, 2015, 37(6): 42–46. (in Chinese) |
| [51] |
朱飞, 程建波. 抗菌肽的来源、生物学功能及其在畜牧业中应用的研究进展[J]. 中国家禽, 2016, 38(16): 47–52.
ZHU F, CHENG J B. Research advances on origin, biological functions and application of antibacterial peptides in livestock husbandry[J]. China Poultry, 2016, 38(16): 47–52. (in Chinese) |



