2. 空军军医大学 天然药物研究所,陕西 西安 710032
2. Institute of Material Medical, the Fourth Military Medical University, Xi′an 710032, China
脓毒症是由感染引起的全身炎症反应综合征, 持续发展, 将导致多器官衰竭和死亡[1]。尽管近几十年来在抗生素治疗和及时生命支持方面取得了重大进展, 但是脓毒症仍然是重症监护室主要死因[2]。巨噬细胞和嗜中性粒细胞过度产生炎症分子所引发的高炎症状态是免疫反应的主要特征[3-4]。因此, 大多数研究注重于改善脓毒症高炎症反应。然而, 临床试验证实抗炎治疗并不能减少脓毒症总死亡率[5]。脓毒症患者中超过40%的患者伴随有心血管损害[6],且心血管功能障碍与患者预后不良密切相关。研究证实, 且伴随心脏功能障碍的患者死亡率高达40~70%[7]。因此, 探索有效的治疗手段改善脓毒症引起心功能不全, 对于改善脓毒症愈后具有非常重大的临床意义。
和厚朴酚(honokiol, HKL)是中药厚朴的有效成分之一, 属于联苯酚类化合物, 具有抗氧化、抗炎、抗肿瘤和神经保护等多种生物学活性[8-10]。以往研究表明, HKL可通过减轻氧化应激损伤和炎症反应来缓解脓毒症肺损伤和肾损伤[11-12], 但是HKL对于脓毒症心肌损伤是否有保护作用及其具体机制尚无人报道。本研究旨在评价HKL处理对脓毒症心肌损伤的保护作用以及对脓毒症心肌氧化应激和凋亡的影响。
1 材料和方法 1.1 实验材料 1.1.1 主要试剂和厚朴酚、二甲基亚砜(DMSO)、蛋白酶抑制剂、磷酸酶抑制剂(Sigma公司, 美国); 抗Bax,Bcl-2,Caspase-3抗体(Cell signaling公司, 美国); 抗β-actin抗体(Santa-Cruz公司, 美国); BCA蛋白定量试剂盒(Pierce公司, 美国); TUNEL试剂盒(Roche公司, 瑞士); 羊抗兔、羊抗鼠二抗(北京中杉金桥公司, 中国); 二氢乙锭(dihydroethidium, DHE)检测试剂盒(Invitrogen公司, 美国); 丙二醛(malonaldehyde, MDA)含量、超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活性检测试剂盒(南京建成生物工程研究所, 中国)。
1.1.2 实验动物8~10周龄雄性C57BL/6小鼠, 体重20~22 g, 购买自空军军医大学实验动物中心。
1.2 实验方法 1.2.1 动物模型的建立如前所述, 通过盲肠结扎和穿刺(cecal ligation and puncture, CLP)诱导小鼠脓毒血症[11]。具体操作流程如下:①手术前禁食24h以保证各小鼠肠内容物一致; ②腹腔注射戊巴比妥钠(50 mg/kg)麻醉小鼠; ③剔除小鼠腹部毛发; ④消毒铺巾; ⑤行剖腹术并暴露盲肠; ⑥在回盲瓣下方结扎盲肠并用18号针刺穿两次, 挤出小鼠肠内容物; ⑦将盲肠放回腹腔并关腹。假手术小鼠除了不进行盲肠结扎穿孔, 其他手术操作完全相同。
1.2.2 实验分组及给药方式将60只C57BL/6小鼠随机分为4组, 每组15只, 即假手术组(Sham组); 单纯HKL处理组(HKL组); 盲肠结扎穿孔组(CLP组); 盲肠结扎穿孔+HKL处理组(CLP+HKL组)。CLP+HKL组小鼠盲肠结扎穿孔后腹腔注射溶解于DMSO中的和厚朴酚(5 mg/kg)。对照小鼠腹腔注射相似体积的溶剂。
1.2.3 心脏功能检测盲肠结扎穿孔24 h后, 剔除小鼠胸前毛发。用VEVO 770(VisualSonics公司, 加拿大)小动物超声仪和30-MHz超声探头(型号:RMV707B)检测左室射血分数(left ventricular ejection fraction, LVEF)与左室短轴缩短率(left ventricular fractional shortening, LVFS)等心功能指标[13]。
1.2.4 血清LDH水平检测盲肠结扎穿孔24 h后, 解剖分离左侧颈动脉, 离断动脉并取血, 待血液自然凝固后, 离心3 000 r/min, 3 min。取血清, 严格按照试剂盒说明书检测血清中LDH水平。
1.2.5 心肌组织ROS含量检测盲肠结扎穿孔24 h后, 用预冷的PBS洗涤心脏, 在液氮中快速冷冻并切成5 μm厚度组织切片。然后,用DHE和DAPI染料对组织切片进行染色。用Olympus FV1000激光共聚焦显微镜(Olympus公司, 日本)检查组织切片。使用Image-Pro Plus软件(NIH, 美国)测定每组中的乙锭荧光。
1.2.6 心肌组织SOD活性、GSH-Px活性以及MDA含量检测盲肠结扎穿孔24 h后, 迅速取下心脏, 用生理盐水(1:9)制备蛋白匀浆。按照说明书分别检测心肌组织中抗氧化酶SOD和GSH-Px活性以及脂质过氧化产物MDA含量。
1.2.7 心肌组织末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)检测盲肠结扎穿孔24 h后, 用PBS从冠状动脉主动脉口处逆行灌注预冷的PBS,并取出心脏。将心脏用4%(体积分数)多聚甲醛固定48 h, 石蜡包埋并纵切。使用TUNEL试剂盒照制造商的说明进行TUNEL分析以测量细胞凋亡的程度。在TUNEL反应后进行DAPI染色以显示细胞核。TUNEL阳性的心肌细胞百分比由凋亡心肌细胞数目/心肌细胞总数×100%来表示。
1.2.8 心肌组织Bax,Bcl-2和Caspase-3蛋白表达测定盲肠结扎穿孔24 h后, 迅速取下心脏, 提取蛋白样品并进行蛋白电泳, 具体操作流程如前所述[14]。在电泳加样孔内蛋白样品经电泳、转膜、封闭等步骤后于4℃孵育抗Bax(1:1 000),Bcl-2(1:1 000), Caspase-3(1:1 000)和β-actin(1:1 000)一抗, 过夜; 继而室温孵育相应二抗(1:5 000)1.5 h。使用BioRad成像系统检测蛋白质条带并使用Image Lab软件定量。
1.3 统计分析用SPSS13.0统计学软件进行统计分析, 实验数据均以均数±标准误(x±SEM)表示; 差异显著性检验采用单因素方差分析, 比较两组间差异用LSD-t检验。P < 0.05表示有统计学意义。
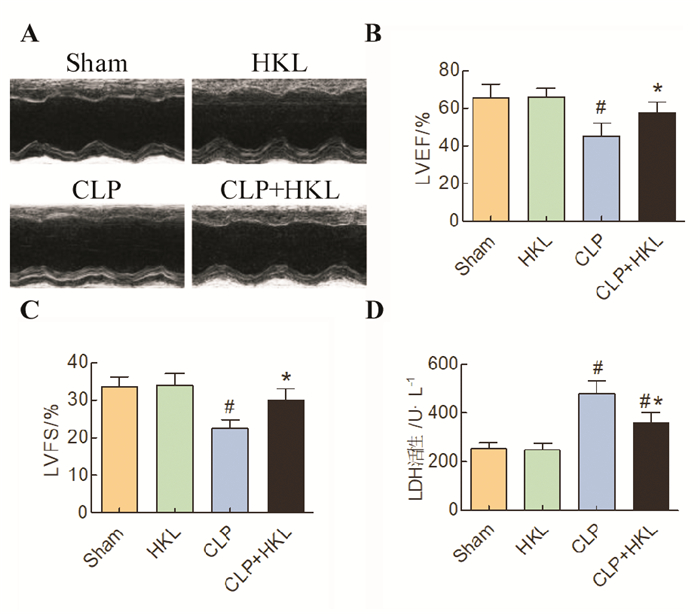
2 结果 2.1 HKL处理改善脓毒症小鼠心脏收缩功能障碍和心肌损伤小鼠盲肠结扎穿孔24 h后用小动物超声检测小鼠心脏功能。与Sham组小鼠相比, CLP组小鼠心脏功能显著受损, 表现为LVEF与LVFS显著降低(P < 0.05)。与CLP组相比, HKL处理(CLP+HKL组)能显著提高LVEF与LVFS(P < 0.05)。与Sham组小鼠相比, 单纯给予HKL处理对于小鼠心脏功能无显著影响(见图 1A-C, P > 0.05)。此外, 检测了各组小鼠血清中LDH水平。结果显示, 脓毒症小鼠血清中LDH水平较Sham组小鼠显著升高, 而给予HKL处理。可以显著降低血清中LDH水平(P < 0.05)。与Sham组小鼠相比, 单纯给予HKL处理对于小鼠血清中LDH水平无显著影响(见图 1D, P > 0.05)。
|
图 1 HKL处理对盲肠结扎穿孔后心脏功能和血清LDH水平的影响(#P < 0.05, 与Sham组相比;*P < 0.05,与CLP组相比) Fig. 1 The effects of honokiol treatment on cardiac contractile function and serum LDH level following cecal ligation and puncture |
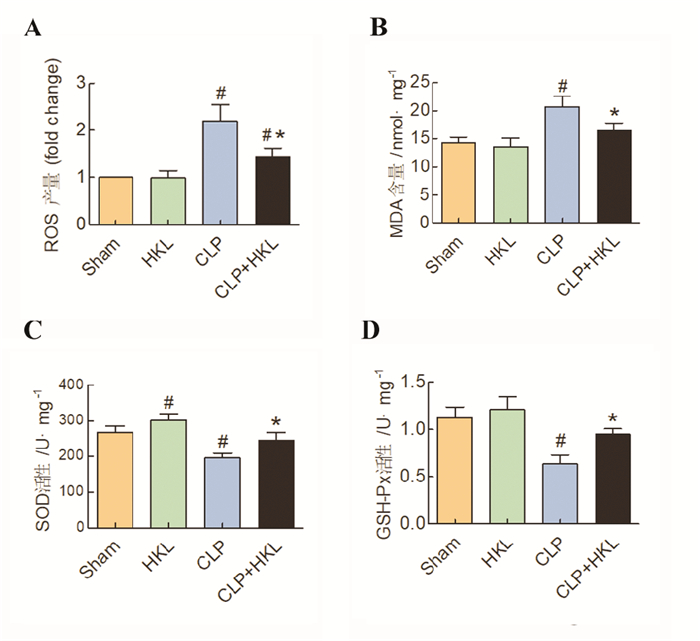
盲肠结扎穿孔24 h后,首先采用心肌组织冰冻切片DHE染色法检测了心肌组织内ROS产量。结果显示, 与Sham组小鼠相比, CLP组小鼠心肌组织内ROS产量显著上升, 而HKL处理可以显著降低脓毒症小鼠心肌组织ROS产量(P < 0.05)。与Sham组小鼠相比, 单纯给予HKL处理对于小鼠心肌组织ROS产量无显著影响(见图 2A, P > 0.05)。以往研究发现, 过量ROS可以进一步诱发脂质发生过氧化反应, 进而损害心肌细胞[14]。本实验通过检测脂质过氧化产物MDA发现, 与Sham组小鼠相比, CLP组小鼠心肌组织内MDA含量显著上升, 而HKL处理可以显著降低脓毒症小鼠心肌组织MDA含量(P < 0.05)。与Sham组小鼠相比, 单纯给予HKL处理对于小鼠心肌组织MDA含量无显著影响(见图 2B, P > 0.05)。SOD是机体抗氧化应激的关键分子之一[15], 可以将体内过量的过氧化物还原为过氧化氢[16]。与Sham组小鼠相比, CLP组小鼠心肌组织内SOD的活性显著下降, 而HKL处理可以显著提高脓毒症小鼠心肌组织SOD活性(P < 0.05)。与Sham组小鼠相比, 单纯给予HKL处理可以轻度增加小鼠心肌组织SOD活性(见图 2C, P < 0.05)。此外, GSH-Px也是机体抗氧化应激主要酶之一, 可将过氧化氢还原为水以及将脂质氢过氧化物还原为相应醇类[17]。与Sham组小鼠相比, CLP组小鼠心肌组织内GSH-Px活性显著下降, 而HKL处理可以显著提高脓毒症小鼠心肌组织GSH-Px活性(P < 0.05)。与Sham组小鼠相比, 单纯给予HKL处理可提高小鼠心肌组织GSH-Px活性, 但无统计学意义(见图 2D, P > 0.05)。
|
图 2 HKL处理对盲肠结扎穿孔后心肌氧化应激水平的影响(#P < 0.05, 与Sham组相比;*P < 0.05,与CLP组相比) Fig. 2 The effects of honokiol treatment on myocardial oxidative stress following cecal ligation and puncture |
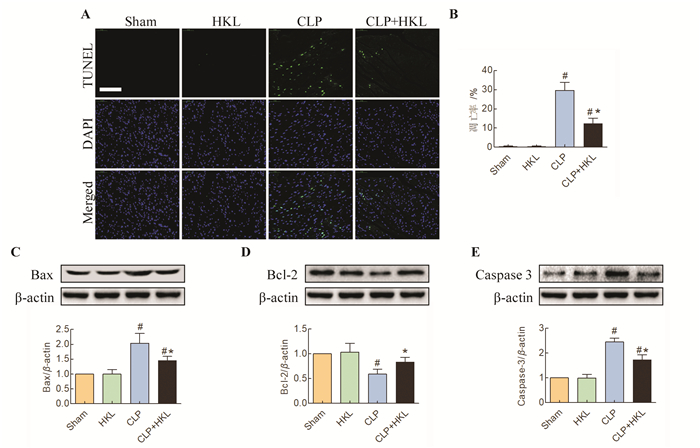
盲肠结扎穿孔24 h后通过TUNEL染色检测心肌组织凋亡率。结果显示, 与Sham组小鼠相比, CLP组小鼠心肌组织凋亡率显著上升, 而HKL处理可以显著降低脓毒症小鼠心肌组织凋亡率(P < 0.05)。与Sham组小鼠相比, 单纯给予HKL处理对于小鼠心肌组织凋亡率无显著影响(见图 3A~B, P > 0.05)。此外,检测了凋亡相关蛋白的表达情况。结果显示, 与Sham组小鼠相比, CLP组小鼠心肌组织中Bax与Caspase-3的表达量显著增高, 而Bcl-2的表达量显著下降(P < 0.05)。与CLP组相比, HKL处理可以显著提高心肌组织Bcl-2的表达, 降低Bax与Caspase-3的表达(P < 0.05)。与Sham组小鼠相比, 单纯给予HKL处理对于小鼠心肌组织中Bax,Bcl-2,Caspase-3的表达量无显著影响(P > 0.05, 见图 3C-E)。
|
图 3 HKL处理对盲肠结扎穿孔后心肌凋亡的影响(400×)(#P < 0.05, 与Sham组相比;*P < 0.05,与CLP组相比) Fig. 3 The effects of honokiol treatment on myocardial apoptosis following cecal ligation and puncture (400×) |
脓毒症是重症监护病房的主要死因。临床观察发现, 脓毒症具有双相死亡分布特征[18-19]。心脏功能障碍是脓毒症引起的多器官功能衰竭的重要表现, 是导致脓毒症患者死亡的重要因素。因此, 寻找有效治疗药物缓解脓毒症心脏损害对于改善脓毒症患者愈后具有重要临床意义。
以往研究表明,和厚朴酚对于缓解脓毒症引起的多种器官损害发挥了积极作用。Li等发现和厚朴酚可以显著改善脓毒症大鼠的生存情况、减轻CLP后大鼠肾组织病理学改变、氧化应激、炎性因子的产生以及抑制NF-κB信号传导通路的激活,从而减轻脓毒症引起的急性肾损伤[12]。Weng等发现和厚朴酚可以显著降低脓毒症小鼠血清TNF-α、一氧化氮和高迁移率族蛋白1(HMGB1)的产量、降低脓毒症小鼠血脂过氧化和硝基酪氨酸、缓解脓毒症小鼠肺水肿、肺部病理变化并改善脓毒症小鼠生存情况[11]。然而和厚朴酚能否缓解脓毒症引起的心肌损伤尚未见报道。值得注意的是,近年来研究证实,和厚朴酚具有显著的心肌保护作用。本课题组前期研究发现,和厚朴酚可通过激活SIRT1-Nrf2信号通路改善心肌氧化损伤损伤和凋亡,从而缓解Ⅰ型糖尿病小鼠心肌缺血再灌注损伤[20]。此外,多项研究表明,和厚朴酚还能够减轻多柔比星引起的心肌损伤[21]以及压力负荷引起的心肌肥厚[9]。本研究就和厚朴酚与脓毒症引起的心脏功能障碍进行研究,首次证实和厚朴酚能够有效缓解脓毒症引起的心脏收缩功能障碍和心肌损伤。
目前研究表明,能量代谢受损、能量产生改变以及ROS产生增加引起的氧化应激等线粒体功能障碍参与了脓毒症心肌损伤的发生发展,其中,氧化应激被认为最主要的启动因素之一[22]。因此, 应用抗氧化剂理论上可有效减轻炎症并提高脓毒症患者的存活率。然而, 有关抗氧化剂治疗脓毒症的多项临床试验却取得了不一致的结果。其主要原因在于常规抗氧化剂作用范围过于广泛、剂量不足和效力过低等。由于线粒体是产生ROS的主要细胞器, 特异性地降低线粒体中ROS产量并提高抗氧化酶活性可有效减轻脓毒症心肌组织氧化应激损伤。最近, Pillai等证实和厚朴酚可以直接结合线粒体内主要去乙酰化酶SIRT3, 减轻线粒体氧化应激水平, 进而减轻压力负荷引起的心肌肥厚[9], 提示和厚朴酚是一种线粒体抗氧化剂。本研究发现, 盲肠结扎穿孔24 h后, 小鼠心肌组织内ROS的产量显著增加, 伴随脂质过氧化产物MDA含量增多。此外, 脓毒症小鼠心肌自身抗氧化酶SOD和GSH-Px的活性也显著受损。腹腔注射和厚朴酚可以显著减少脓毒症小鼠心肌ROS产量, 降低MDA含量并且提高抗氧化酶活性。
心肌细胞凋亡是人体和动物脓毒症心肌损伤的显著特征之一。研究发现, 过量ROS的产生能够导致蛋白、DNA以及脂类发生过氧化反应, 破坏细胞膜完整性, 进而引起细胞凋亡[14]。充分证据显示, 缓解脓毒症心肌损伤的治疗药物多与抑制心肌细胞凋亡有关。Peng等发现, 激活PPAR-γ主要通过抑制心肌细胞凋亡和程序性坏死, 抵抗脓毒症引起的心肌损伤[23]。An等发现, 褪黑素主要听过激活PI3K/Akt信号通路, 抑制心肌细胞凋亡, 减轻脓毒症心功能不全[24]。本研究发现,盲肠结扎穿孔24 h后, 小鼠心肌组织凋亡率和促凋亡蛋白的表达量显著增加, 而抗凋亡蛋白表达量显著降低。而腹腔注射和厚朴酚可以显著降低凋亡率和促凋亡蛋白表达, 并上调抗凋亡蛋白表达。
综上所述,本研究首次证实和厚朴酚处理能够显著改善脓毒症心肌损伤, 其主要机制在于抑制线粒体氧化应激及其诱导的心肌凋亡。本研究为临床上应用和厚朴酚治疗脓毒症心肌损害提供了新的理论依据。
| [1] |
HOTCHKISS R S, MONNERET G, PAYEN D. Immunosuppression in sepsis: A novel understanding of the disorder and a new therapeutic approach[J]. Lancet Infect Dis, 2013, 13(3): 260-268. DOI:10.1016/S1473-3099(13)70001-X |
| [2] |
MAYR F B, YENDE S, ANGUS D C. Epidemiology of severe sepsis[J]. Virulence, 2014, 5(1): 4-11. DOI:10.4161/viru.27372 |
| [3] |
WILLIAMS D L, HA T, LI C, et al. Modulation of tissue Toll-like receptor 2 and 4 during the early phases of polymicrobial sepsis correlates with mortality[J]. Crit Care Med, 2003, 31(6): 1808-1818. DOI:10.1097/01.CCM.0000069343.27691.F3 |
| [4] |
RIALDI A, CAMPISI L, ZHAO N, et al. Topoisomerase 1 inhibition suppresses inflammatory genes and protects from death by inflammation[J]. Science, 2016, 352(6289): aad7993. DOI:10.1126/science.aad7993 |
| [5] |
COHEN J, OPAL S, CALANDRA T. Sepsis studies need new direction[J]. Lancet Infect Dis, 2012, 12(7): 503-505. DOI:10.1016/S1473-3099(12)70136-6 |
| [6] |
FERNANDES C J, AKAMINE N, KNOBEL E. Cardiac troponin: A new serum marker of myocardial injury in sepsis[J]. Intensive Care Med, 1999, 25(10): 1165-1168. DOI:10.1007/s001340051030 |
| [7] |
BLANCO J, MURIEL-BOMBIN A, SAGREDO V, et al. Incidence, organ dysfunction and mortality in severe sepsis: A Spanish multicentre study[J]. Crit Care, 2008, 12(6): R158. DOI:10.1186/cc7157 |
| [8] |
YU Y, LI M, SU N, et al. Honokiol protects against renal ischemia/reperfusion injury via the suppression of oxidative stress, iNOS, inflammation and STAT3 in rats[J]. Mol Med Rep, 2016, 13(2): 1353-1360. DOI:10.3892/mmr.2015.4660 |
| [9] |
PILLAI V B, SAMANT S, SUNDARESAN N R, et al. Honokiol blocks and reverses cardiac hypertrophy in mice by activating mitochondrial Sirt3[J]. Nat Commun, 2015, 6: 6656. DOI:10.1038/ncomms7656 |
| [10] |
FRIED L E, ARBISER J L, HONOKIO L. A multifunctional antiangiogenic and antitumor agent[J]. Antioxid Redox Signal, 2009, 11(5): 1139-1148. DOI:10.1089/ars.2009.2440 |
| [11] |
WENG T I, WU H Y, KUO C W, et al. Honokiol rescues sepsis-associated acute lung injury and lethality via the inhibition of oxidative stress and inflammation[J]. Intensive Care Med, 2011, 37(3): 533-541. DOI:10.1007/s00134-010-2104-1 |
| [12] |
LI N, XIE H, LI L, et al. Effects of honokiol on sepsis-induced acute kidney injury in an experimental model of sepsis in rats[J]. Inflammation, 2014, 37(4): 1191-1199. DOI:10.1007/s10753-014-9845-x |
| [13] |
Zhai M, Liu Z, Zhang B, et al. Melatonin protects against the pathological cardiac hypertrophy induced by transverse aortic constriction through activating PGC-1beta: In vivo and in vitro studies[J]. J Pineal Res, 2017, 63(3): e12433. DOI:10.1111/jpi.2017.63.issue-3 |
| [14] |
ZHAI M, LI B, DUAN W, et al. Melatonin ameliorates myocardial ischemia reperfusion injury through SIRT3-dependent regulation of oxidative stress and apoptosis[J]. J Pineal Res, 2017, 63(2): e12419. DOI:10.1111/jpi.2017.63.issue-2 |
| [15] |
TAO R, COLEMAN M C, PENNINGTON J D, et al. Sirt3-mediated deacetylation of evolutionarily conserved lysine 122 regulates MnSOD activity in response to stress[J]. Mol Cell, 2010, 40(6): 893-904. DOI:10.1016/j.molcel.2010.12.013 |
| [16] |
TAO R, VASSILOPOULOS A, PARISIADOU L, et al. Regulation of MnSOD enzymatic activity by Sirt3 connects the mitochondrial acetylome signaling networks to aging and carcinogenesis[J]. Antioxid Redox Signal, 2014, 20(10): 1646-1654. DOI:10.1089/ars.2013.5482 |
| [17] |
DE HAAN J B, CRACK P J, FLENTJAR N, et al. An imbalance in antioxidant defense affects cellular function: the pathophysiological consequences of a reduction in antioxidant defense in the glutathione peroxidase-1 (Gpx1) knockout mouse[J]. Redox Rep, 2003, 8(2): 69-79. DOI:10.1179/135100003125001378 |
| [18] |
MOORE F A, MOORE E E. Evolving concepts in the pathogenesis of postinjury multiple organ failure[J]. Surg Clin North Am, 1995, 75(2): 257-277. DOI:10.1016/S0039-6109(16)46587-4 |
| [19] |
DELANO M J, WARD P A. Sepsis-induced immune dysfunction: Can immune therapies reduce mortality?[J]. J Clin Invest, 2016, 126(1): 23-31. DOI:10.1172/JCI82224 |
| [20] |
ZHANG B, ZHAI M, Li B, et al. Honokiol ameliorates myocardial Ischemia/reperfusion injury in type 1 diabetic rats by reducing oxidative stress and apoptosis through activating the SIRT1-Nrf2 signaling pathway[J]. Oxid Med Cell Longev, 2018, 2018: 3159801. |
| [21] |
PILLAI V B, KANWAL A, FANG Y H, et al. Honokiol, an activator of Sirtuin-3 (SIRT3) preserves mitochondria and protects the heart from doxorubicin-induced cardiomyopathy in mice[J]. Oncotarget, 2017, 8(21): 34082-34098. |
| [22] |
RINALDI S, LANDUCCI F, DE GAUDIO A R. Antioxidant therapy in critically septic patients[J]. Curr Drug Targets, 2009, 10(9): 872-880. DOI:10.2174/138945009789108774 |
| [23] |
PENG S, XU J, RUAN W, et al. PPAR-gamma activation prevents septic cardiac dysfunction via inhibition of apoptosis and necroptosis[J]. Oxid Med Cell Longev, 2017, 2017: 8326749. |
| [24] |
AN R, ZHAO L, XI C, et al. Melatonin attenuates sepsis-induced cardiac dysfunction via a PI3K/Akt-dependent mechanism[J]. Basic Res Cardiol, 2016, 111(1): 8. |
 2018, Vol. 48
2018, Vol. 48
