2. 空军军医大学 第一附属医院 心血管外科, 陕西 西安 710032;
3. 西北大学生命科学医学部,陕西 西安 710069
2. Department of Cardiovascular Surgery, the First Affiliated Hospital, the Fourth Military Medical University, Xi′an 710032, China;
3. College of Life Science and Medicine, Northwest University, Xi′an 710069, China
糖尿病心肌病(diabetic cardiomyopathy, DCM)是糖尿病患者在排除高血压和冠心病的前提下, 出现的心脏结构改变和功能障碍, 即使在血糖控制良好的糖尿病患者中亦有将近75%的发病率, 是糖尿病患者发生心衰和导致死亡的主要原因[1]。因此, 对DCM病理改变和特点的研究, 有利于阐明其发病机制, 并为糖尿病患者实施心脏手术和体外循环时保护策略的优化以及特异性保护药物的研发, 提供客观高效的病理评价方式和指标。长期高血糖对心肌组织和各级血管的损伤是DCM病理改变中最为主要且相互关联的两个方面[2]。但是,目前DCM的研究主要集中在炎症、凋亡、纤维化等病理因素造成心肌损伤的特点和机制, 而这些因素对血管病理改变的影响和作用特点则尚未完全阐明[3-5]。本实验通过构建DCM模型, 重点关注DCM中各级血管中的炎症、凋亡、纤维化等主要病理特点, 探索更为精准的血管损伤与保护评价指标, 为DCM血管损伤机制的研究和临床相关保护策略提供理论基础和新的探索思路。
1 材料和方法 1.1 材料成年雄性C57BL/6小鼠, 体重20~25g, 均由空军军医大学实验动物中心提供。链脲佐菌素(STZ, 美国Sigma公司), 高糖高脂饮食(美国Dysts公司), 原位缺口末端标记法(TUNEL)检测试剂盒(Roche公司), DAPI染液(美国Sigma公司), 戊巴比妥钠(北京索莱宝有限公司), 辣根过氧化物酶标记的羊抗兔IgG二抗(北京中杉金桥生物技术有限公司)。
1.2 方法 1.2.1 实验分组将40只成年雄性C57BL/6小鼠随机分为2组:①正常对照组(Control组):持续正常饮食喂养, 4周时注射和DCM造模组相同剂量不含STZ柠檬酸钠缓冲液; ② DCM组:持续高糖高脂饮食喂养, 第4周时连续3天腹腔注射链脲佐菌素(streotozotocin, STZ, 溶于pH=4.5柠檬酸钠缓冲液中)60mg/kg·d-1, 1周后测空腹血糖, 血糖值≥11.1mmol/L即为造模成功。
1.2.2 心肌HE染色迅速取出心脏, 以预冷的PBS冲洗干净, 然后置于4%(质量分数)多聚甲醛固定24h。经脱水、包埋后, 垂直于心脏长轴将其切成5 μm厚的切片, 进行苏木精-伊红染色。普通光镜下拍照并观察各级血管损伤情况。
1.2.3 心肌细胞凋亡指数检测迅速取出心脏, 以预冷的PBS冲洗干净, 经多聚甲醛溶液中固定后进行石蜡包埋切片。常规脱蜡至水后, 严格按照TUNEL试剂盒说明书要求操作。
1.2.4 免疫组织化学染色迅速取出心脏, 以预冷的PBS冲洗干净, 经多聚甲醛溶液中固定后进行石蜡包埋切片, 切成5 μm厚的切片。将心脏组织切片进行胶原蛋白Ⅰ和胶原蛋白Ⅲ的免疫组织化学染色。将切片用稀释的0.1%(质量分数)牛血清白蛋白封闭30min; 将切片用抗collagen Ⅰ(1:200,体积比)和collagen Ⅲ(1:1 000,体积比)抗体在4℃孵育过夜; 用0.1 mol/L PBS洗涤3次后, 切片与辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗在37℃孵育30分钟。用0.1 mol/l PBS洗涤3次后, 通过用DAB HRP底物试剂盒(Vector lab, Burlingame, CA, USA)显色来检测collagen Ⅰ和collagen Ⅲ表达情况。
1.2.5 免疫荧光染色迅速取出心脏, 以预冷的PBS冲洗干净, 经多聚甲醛溶液中固定后进行石蜡包埋切片, 切成5 μm厚的切片。将切片用稀释的0.1%(质量分数)牛血清白蛋白封闭30min; 轻轻甩掉封闭液, 在切片上滴加PBS按一定比例配好的一抗, 切片平放于湿盒内4℃孵育过夜; 用0.1 mol/L PBS洗涤3次后。滴加与一抗相应种属的二抗覆盖组织, 避光室温孵育50min; 用0.1 M PBS洗涤3次后, DAPI染液, 避光室温孵育10min; 用0.1M PBS洗涤3次后, 用抗荧光淬灭封片剂封片。切片于Olympus FV10C-W3激光共聚焦显微镜(Olympus, Japan)下观察并采集图像。
1.2.6 EVG染色(Verhoeff’s Van Gieson, EVG)迅速取出心脏, 以预冷的PBS冲洗干净, 经多聚甲醛溶液中固定后进行石蜡包埋切片, 切成5 μm厚的切片。将切片放入v(酒精苏木素):v(三氯化铁):v(碘液)5:2:2混合成的EVG染液中, 染30 min, 自来水冲洗; 三氯化铁分化液稍分化一下, 自来水洗一下, 如此反复操作, 在显微镜下控制分化程度, 至弹力纤维呈紫黑色, 背景呈灰白色近无色; 将v(饱和苦味酸):v(酸性品红)9:1混合成VG染液, 染1~3min, 快速水洗, 无水乙醇三缸快速脱水。用干净的二甲苯透明1~5min, 中性树胶封片。普通光学显微镜下镜检, 观察各级血管形态结构变化。
1.2.7 统计学处理实验结果数据均以均值±标准差(x±s)表示, 采用Prism 5.0软件进行统计学分析, 以t检验分析两组间的差异显著性, P < 0.05为具有统计学差异。
2 结果 2.1 DCM中各级血管形态结构病变严重并发生纤维化DCM小鼠心脏血管HE染色显示, 与Control组相比, 各级血管结构紊乱, 血管壁明显增厚(图 1(c), P < 0.01), 炎性细胞聚集浸润(图 1(a)); Masson染色显示糖尿病心肌病中, 心肌组织中和血管纤维化显著加重(图 1(b), 图中蓝色染色部分; 图 1(d), P < 0.01;图 1(e), P < 0.01), 而血管周围的纤维化程度较心肌中又显得更为严重(P < 0.01)。

|
(a)心脏切片血管HE染色(×500);(b)心脏切片血管Masson染色(×500);(c)血管壁厚度(以所观察到最大管径血管进行测量分析); (d)心肌区域纤维占比; (e)血管周围纤维占比; */**两组间比较P < 0.01/0.05, n=6 图 1 糖尿病心肌病中各级血管形态结构病变严重, 纤维化显著加重 Fig. 1 Vessels at all levels suffered serious pathologic changes of structural disordered with markedly aggravated fibrosis in DCM |
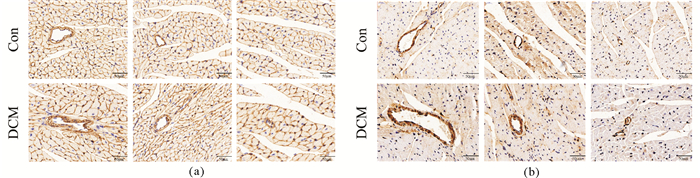
DCM组心脏血管胶原纤维collagen Ⅰ与collagen Ⅲ免疫组化显示, 胶原纤维collagen Ⅰ在血管周围和心肌组织间隙中均有分布, 与Control组相比有所增加, 但并不显著, 且以伴随血管壁增厚而增加为主(图 2(a)); DCM组胶原纤维collagen Ⅲ主要分布在心脏血管及周围, 较Control组增加显著(图 2(b))。
|
(a)心脏切片血管胶原纤维collagen Ⅰ免疫组化染色(×500);(b)心脏切片血管胶原纤维collagen Ⅲ染色(×500);n=6 图 2 糖尿病心肌病血管胶原纤维聚积, collagen Ⅲ尤为显著 Fig. 2 Accumulation of collagenous fiber was increased in walls of vessels and collagen Ⅲ is even more obviousin DCM |
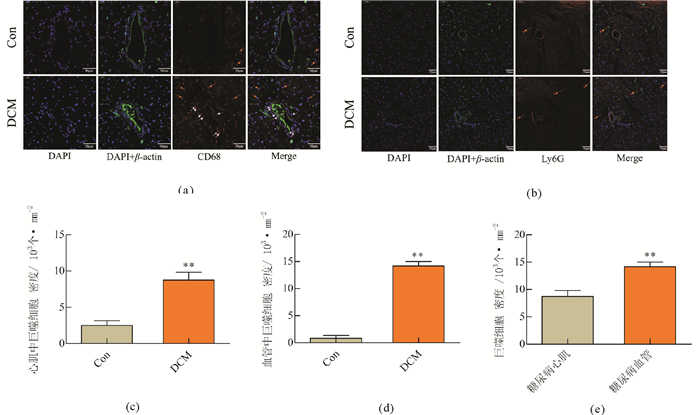
DCM小鼠心脏炎性细胞巨噬细胞特异性标记分子CD68与中性粒细胞特异性标记分子ly6G分别与非特异性的细胞骨架微丝蛋白β-actin双标免疫荧光显示, 与Control组相比, DCM组中炎性细胞不论是巨噬细胞还是中性粒细胞均明显增加(图 3(c), P < 0.01;图 3(d), P < 0.01;图 4(c), P < 0.01), 而其中以巨噬细胞的增加尤为显著(图 3(a), 黄色与白色箭头指向处; ), 并且在血管壁的分布聚积的密集程度(图 3(a), 白色箭头指向处)远较心肌组织中高(图 3(a), 黄色箭头指向处; 图 3(e), P < 0.01);中性粒细胞在DCM中亦明显增加(图 4(c), P < 0.01黄色箭头指向处), 但较巨噬细胞增加幅度相对较小, 且分布相对随机, 并未出现在血管壁额外的富集浸润(图 3(b))。
|
(a)心脏切片血管巨噬细胞特异性标记分子CD68与细胞骨架微丝蛋白β-actin免疫荧光双标染色(×500);(b)心脏切片血管中性粒细胞特异性标记分子Ly6G与细胞骨架微丝蛋白β-actin免疫荧光双标染色(×250);(c)心肌区域中巨噬细胞密度; (d)血管中巨噬细胞密度; (e)DCM组中心肌区域和血管中巨噬细胞密度; */**两组间比较P < 0.01/0.05, n=6 图 3 糖尿病心肌病炎性细胞明显增加, 血管周围以巨噬细胞浸润为主 Fig. 3 Infiltrationof inflammatory cell was aggravated in DCM with more serious infiltration of macrophages in vascular walls |
|
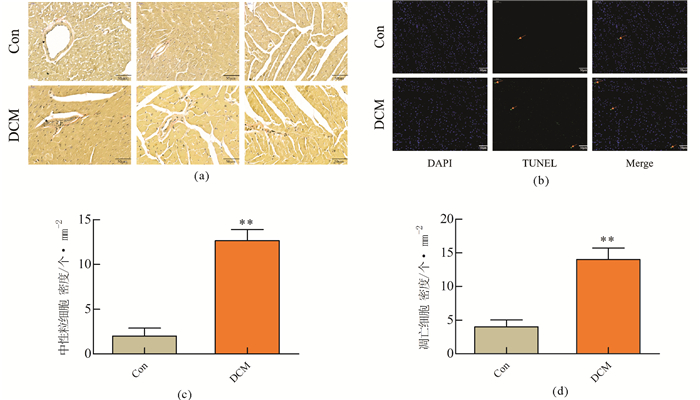
(a)心脏切片血管弹力纤维EVG染色(×500);(b)心脏切片凋亡TUNEL染色(×250);(c)中性粒细胞密度; (d)凋亡细胞密度; */**两组间比较P < 0.01/0.05, n=6 图 4 糖尿病心肌病血管弹力纤维紊乱变形, 特异性发生于血管的细胞凋亡并不显著 Fig. 4 Elastic fibers of vessels in DCM were disorganized and inconsecutive without specially increased cell apoptosis in vascular walls |
EVG染色显示, Control组血管壁结构完整有序, 管壁厚度适中, 弹力纤维连贯(黑色箭头指向处)。然而,DCM组则可见明显的血管壁结构紊乱, 完整性破坏, 弹力纤维断裂(图 4(a)); TUNEL凋亡染色显示DCM中, 凋亡细胞较正常组明显增加(图 4(d), P < 0.01), 但凋亡细胞的分布亦相对的随机, 未见在血管的特异性分布增加(图 4(b), 黄色箭头指向处)。
3 讨论DCM是糖尿病患者的主要严重并发症之一, 是造成糖尿病患者死亡的主要原因。检测其病理改变对于阐明其发病机制, 指导和制定临床上糖尿病患者心脏手术时的体外循环等保护策略均具有重要意义。现有研究表明, 高血糖状态下诱发的炎症、凋亡、纤维化是造成血管和心肌组织损伤和病变最为主要的因素, 但目前对继发病理因素在DCM血管病理损伤中的作用特点缺乏较全面的研究[2, 4, 6-8]。因此, 深入研究和探讨炎症、凋亡、纤维化等因素在DCM血管病理改变中的作用特点, 对于精准评价DCM的发生发展程度尤为重要。
血管壁增厚、结构紊乱、炎性细胞聚集以及纤维化, 是DCM血管病理改变中最为显著的特点[2, 4]。在研究中, DCM组心脏血管同样明显观察到了以上特征, 从侧面验证了实验模型的成功, 同样证明了这些病理变化在DCM血管病变中的关键性。在对纤维化的观察和分析中, 我们发现纤维化程度在DCM的心肌组织和血管中都明显加重, 而血管周围及血管壁的纤维化程度比心肌组织中更为严重。DCM中血管结构和功能破坏、血管管腔狭窄、血栓形成机率增加、血液运输能力下降、血管壁氧/二氧化碳交换受阻, 是最终导致心脏功能障碍的重要原因。
胶原纤维collagen Ⅰ,collagen Ⅲ是DCM中改变最为明显的胶原纤维类型[9-11], 为进一步研究DCM中血管胶原纤维堆积的特点, 本研究通过免疫组化的方法对这两类胶原纤维的分布和改变进行观察。发现胶原纤维collagen Ⅰ在心肌组织间隙和血管壁均有较广泛的分布, 而胶原纤维collagen Ⅲ则主要分布血管中。与Control组比较, DCM组心脏collagen Ⅰ,collagen Ⅲ均有所增加, 两者在血管壁的增加均较心肌组织更为明显, 其中以collagen Ⅲ在血管壁的堆积最为突出。由此说明, 血管是DCM纤维化病理改变和损伤最为敏感的组织, 而胶原纤维collagen Ⅲ的堆积是其主要特征。
炎症反应, 包括炎性细胞的浸润与炎性因子的释放等, 在DCM的病理改变中亦发挥着重要的作用。其中, 巨噬细胞和中性粒细胞是机体局部参加炎性浸润、吞噬坏死细胞和病菌、释放炎性因子最为主要的炎性细胞[10, 12-14]。为进一步探讨这两种炎性浸润细胞在DCM血管损伤炎症反应中的作用和特点, 本研究分别对巨噬细胞特异性标志物CD68、中性粒细胞特异性标志物ly6G与细胞骨架蛋白β-actin实施免疫荧光双标法, 确定其数量变化和位置分布特点。发现在DCM组中, 两种炎性细胞的数量较正常组均明显增多, 其中中性粒细胞的增加幅度相对较小, 且分布随机, 未见在血管周围的特异性分布增加; 而巨噬细胞的增加尤为明显, 且在血管壁中的分布密集程度较心肌组织更高。由此进一步提示在DCM的病理性炎症反应中, 血管是炎性细胞最先浸润且较为严重的组织, 而这种浸润以巨噬细胞为主。
为了对DCM血管结构的病理破坏程度进行更深入和直观的了解, 本研究的创新点在于对心脏的血管弹性纤维环和结构实施EVG染色。发现正常组各级血管管壁薄厚均一, 结构完整, 较大血管有一层位于血管壁内侧的弹性纤维环, 分布连贯; 而DCM组的血管壁则明显增厚, 厚薄不一, 结构紊乱, 弹性纤维环参差断裂。为进一步确定DCM中严重的心脏各级的血管损伤是否与血管壁上细胞凋亡增加有关, 又对DCM中细胞的凋亡进行了进一步的观察。细胞凋亡增加是DCM的重要病理改变之一, 且在糖尿病小鼠的胸腹主动脉病变中亦观察到了相同的情况[15-16]。实验发现, 与正常Control组比较, DCM组心脏中凋亡的细胞明显增加, 但呈现出随机分布, 未见血管壁上额外的增加和密集。提示DCM中心脏严重的血管损伤与血管壁上细胞的凋亡无明显相关性, 而炎性细胞浸润和纤维化是其损伤的主要原因。
综上所述, 本实验发现, DCM的心脏各级血管病理改变明显, 尤其是炎性细胞浸润和纤维化程度较心肌组织更为严重。其中, 血管壁纤维化胶原堆积以collagen Ⅲ最为显著, 炎性细胞对血管的浸润以巨噬细胞为主。可见, collagen Ⅲ、巨噬细胞不仅可以作为DCM血管纤维化及炎性浸润程度的评价指标, 而且还能够依据collagen Ⅲ的堆积和巨噬细胞的浸润程度来客观的评价临床受治病人或动物药效学实验的疗效。
| [1] |
FENG B, CAO Y, CHEN S, et al. miR-200b mediates endothelial-to-mesenchymal transition in diabetic cardiomyopathy[J]. Diabetes, 2016, 65: 768-779. DOI:10.2337/db15-1033 |
| [2] |
WILSON A J, GILL E K, ABUDALO R A, et al. Reactive oxygen species signalling in the diabetic heart: emerging prospect for therapeutic targeting[J]. Heart, 2018, 104(4): 293-299. |
| [3] |
段云燕, 赵雯, 张军. 糖尿病心肌病发病机理研究进展[J]. 心血管病学进展, 2011, 32(4): 524-527. |
| [4] |
FARHANGKHOEE H, KHAN Z A, KAUR H, et al. Vascular endothelial dysfunction in diabetic cardiomyopathy: Pathogenesis and potential treatment targets[J]. Pharmacology & Therapeutics, 2006, 111(2): 384-399. |
| [5] |
颜贵英, 胡松, 毛拥军. 糖尿病心肌病中微血管病变的研究进展[J]. 中国循环杂志, 2015(5): 505-507. DOI:10.3969/j.issn.1000-3614.2015.05.022 |
| [6] |
SHARMA V, MCNEILL J H, VERMA S. Diabetic cardiomyopathy: Where are we 40 years later?[J]. Canadian Journal of Cardiology, 2006, 22(4): 305-308. DOI:10.1016/S0828-282X(06)70914-X |
| [7] |
CAMICI P G, CREA F. Coronary microvascular dysfunction[J]. The new england journal of medicine, 2007, 356: 830-840. DOI:10.1056/NEJMra061889 |
| [8] |
王静娜, 侯瑞田, 史亦男, 等. 糖尿病心肌病发病机制及病理改变研究进展[J]. 心血管病学进展, 2016, 24(4): 412-415. |
| [9] |
LIAO H, ZHU J, FENG H, et al. Myricetin possesses potential protective effects on diabetic cardiomyopathy through inhibiting IκBα/NFκB and enhancing Nrf2/HO-1[J]. Oxid Med Cell Longev, 2017, 2017: 1-14. |
| [10] |
ZHANG Y, EDGLEY A J, COX A J, et al. FT011, a new anti-fibrotic drug, attenuates fibrosis and chronic heart failure in experimental diabetic cardiomyopathy[J]. European Journal of Heart Failure, 2012, 14(5): 549-562. DOI:10.1093/eurjhf/hfs011 |
| [11] |
GONZALEZ-QUESADA C, CAVALERA M, BIERNACKA A, et al. Thrombospondin-1 induction in the diabetic myocardium stabilizes the cardiac matrix in addition to promoting vascular rarefaction through angiopoietin-2 upregulation[J]. Circulation Research, 2013, 113(12): 1331-1344. DOI:10.1161/CIRCRESAHA.113.302593 |
| [12] |
谭毅, 王越晖, 李校堃, 等. 心脏炎症反应在糖尿病心肌病发生发展中的病理作用[J]. 中国糖尿病杂志, 2008(04): 250-256. DOI:10.3321/j.issn:1006-6187.2008.04.019 |
| [13] |
BAJPAI A, TILLEY D G. The role of leukocytes in diabetic cardiomyopathy[J]. Frontiers in Physiology, 2018, 9: 1-12. DOI:10.3389/fphys.2018.00001 |
| [14] |
BUSCHE M N, WALSH M C, MCMULLEN M E, et al. Mannose-binding lectin plays a critical role in myocardial ischaemia and reperfusion injury in a mouse model of diabetes[J]. Diabetologia, 2008, 51(8): 1544-1551. DOI:10.1007/s00125-008-1044-6 |
| [15] |
LIU Y, WANG Y, MIAO X, et al. Inhibition of JNK by compound C66 prevents pathological changes of the aorta in STZ-induced diabetes[J]. Journal of Cellular and Molecular Medicine, 2014, 18(6): 1203-1212. DOI:10.1111/jcmm.2014.18.issue-6 |
| [16] |
MA S, FENG J, ZHANG R, et al. SIRT1 activation by resveratrol alleviates cardiac dysfunction via mitochondrial regulation in diabetic cardiomyopathy mice[J]. Oxid Med Cell Longev, 2017, 2017: 1-15. |
 2018, Vol. 48
2018, Vol. 48
