2. 西北大学 化工学院, 陕西 西安 710069;
3. 西北大学 化学与材料科学学院, 陕西 西安 710069
2. School of Chemical Engineering, Northwest University, Xi′an 710069, China;
3. College of Chemistry and Materials Science, Northwest University, Xi′an 710069, China
文冠果(Xanthoceras Sorbifolia B.)别名木瓜、文官果、文登阁等[1], 系无患子科文冠果属[2], 是中国特有的珍稀木本油料植物, 分布在山西、陕西、甘肃、吉林、内蒙古等14个省份, 有着“北方油茶”的美誉[3]。文冠果种仁中油(质量分数)为59.86%, 其中不饱和脂肪酸高达9.00%(体积分数)[4], 具有降低胆固醇、软化血管等药用价值[5]; 蛋白质占比25.75%(质量分数), 有18种氨基酸, 必需氨基酸种类齐全, 且氨基酸评分较高, 具有较高的营养价值[6]。文冠果种仁主要应用于生物柴油的生产[2], 然而, 加工后的种粕除了部分用于饲料加工外, 大多数被丢弃, 不仅造成了资源的极大浪费, 也会造成一定的环境污染[4]。文冠果蛋白本身具有良好的加工性能, 可作为优良的蛋白质来源, 添加在食品生产中。目前国内关于文冠果种仁蛋白的研究多在蛋白组分相关方面, 对于其深加工产品的研究十分有限。
高血压一种全球性的公共健康问题, 可诱发很多慢性疾病, 如中风、心梗、冠心病等[7]。血管紧张素转化酶(Angiotensin converting enzyme, ACE)是一种含锌二肽羧肽酶, 对人体血压有重要的调控作用[8]。ACE抑制肽俗称降血压肽, 是一类从食源性蛋白质中分离得到的具有降高血压活性的多肽[9], 一般只含有2~20个氨基酸残基[10], 可以快速地通过消化黏膜进入血液循环[11]。ACE抑制肽可与ACE两个活动功能区竞争性结合, 抑制ACE活性, 抑制血管紧张素Ⅰ转化为血管紧张素Ⅱ, 从而起到降压作用[9]。从食源蛋白质中得到的降血压肽因其食用安全性高已成为国内外学者研究的热点[12]。目前已经从红松仁[11]、蘑菇[13]、榛果[14]、高粱[15]、罗非鱼[16]、牛乳[17]、大豆[18]、牡蛎[19]等食品的蛋白酶解产物中分离出ACE抑制肽。
本文采用酶解法对脱脂文冠果蛋白进行酶解, 以水解度为指标优化酶解工艺, 同时, 对文冠果多肽的体外抗高血压活性进行研究, 不仅丰富了文冠果副产品的深加工, 也为文冠果功能性多肽的研究提供了数据支撑。
1 材料与方法 1.1 材料与试剂文冠果购于万顺种业有限公司。
木瓜蛋白酶、碱性蛋白酶、复合蛋白酶、中性蛋白酶,西安浩天有限公司; ACE、马尿酰组氨酰亮氨酸(HHL),美国Sigma公司; 牛血清蛋白(纯度≥99%的分析纯),美国Ameresco公司; 电泳蛋白质Marker,重庆科润生物医药研发有限公司; 电泳试剂,美国Usbiological公司; 其余试剂均为国产分析纯。
1.2 仪器与设备超滤杯,美国Millipore公司; 透析袋(3500 Da),奥豪斯仪器(上海)有限公司; 超滤膜(1kDa和5 kDa),OHAOS仪器有限公司; 旋转蒸发器RE-52A、恒温振荡器SHA-B,上海亚荣生化仪器厂; 冷冻干燥机LGJ-FD-1,宇辉仪器有限公司; 紫外可见分光光度计UV-1780,日本岛津; 高速低温冷冻离心机TGL-206R,上海安亭科学仪器厂; 台式电热恒温干燥箱WHL-25A,天津市泰斯特仪器有限公司; 蛋白质电泳仪,美国Bio-Rad公司。
1.3 方法 1.3.1 文冠果种仁的基本成分分析水分的测定方法参照GB5009.3-2016《食品中水分的测定》,灰分的测定方法参照GB5009.4-2016《食品中灰分的测定》,粗脂肪的测定方法参照GB5009.6-2016《食品中脂肪的测定》,蛋白质的测定方法参照GB5009.5-2016《食品中蛋白质的测定》。
1.3.2 文冠果种仁蛋白的制备文冠果去壳—粉碎—正己烷旋蒸去油—油渣风干后称取80g溶于800mL磷酸缓冲盐溶液(Phosphate Buffer Saline, PBS 0.1MpH7.4)—悬浊液过滤后, 得种仁蛋白溶液—分段盐析(硫酸铵饱和度:0~20%,20~40%,40~60%,60~80%,质量分数)—取沉淀, 用少量PBS溶解—透析(48 h)—冷冻干燥—蛋白粉。
1.3.3 文冠果多肽的制备蛋白粉用蒸馏水溶解(底物质量浓度为40 g/L)—80℃恒温震荡10 min—冷却到室温—调节pH 9.0—加入适量酶—恒温震荡一段时间(保持pH 9.0)—90℃灭酶10 min, 立即冷却—4000 r/min冷冻离心15 min—取上清液抽滤—超滤(5 kDa和1 kDa)—冷冻干燥—多肽粉。
1.3.4 酶解工艺优化加酶量4%(质量分数), 酶解时间2 h, 其他条件同1.3.3, 选用中性蛋白酶、复合蛋白酶、碱性蛋白酶和木瓜蛋白酶, 考察酶的种类对水解度的影响; 碱性蛋白酶, 酶解时间2 h, 其他条件同1.3.3, 加酶量分别为4%,6%,8%,10%,12%(质量分数), 考察加酶量对水解度的影响; 碱性蛋白酶、加酶量8%(质量分数), 其他条件同1.3.3, 酶解时间分别为25,50,75,100,125,150,175,200 min, 考察酶解时间对水解度的影响。
1.3.5 水解度的测定参照Adler-Nissen[20]的方法, 采用pH-stat法计算水解度, 在水解过程中, pH值稳定在9.0, 记录加入碱液的体积。水解度计算公式如下:
| $ {\rm{DH}}/{\rm{\% = (}}\mathit{B}{\rm{ \times }}{\mathit{N}_{\rm{b}}}{\rm{)}}/{\rm{(}}{\mathit{h}_{{\rm{tot}}}}{\rm{ \times }}{\mathit{M}_{\rm{p}}}{\rm{ \times }}\mathit{\alpha }{\rm{) \times 100}} $ | (1) |
式中:B为耗碱体积, mL; Nb为碱液浓度, mol/L; α为氨基平均解离度; Mp为蛋白质量, g; htot为底物蛋白总肽键数, mmol/g。
1.3.6 体外ACE抑制率的测定参照Cushman[21]的方法, 并稍作修改。HHL在ACE的催化下快速分解产生马尿酸和二肽His-Leu。当加入酶解液, ACE活性受到抑制, 马尿酸和二肽的生成量减少, 而在228nm处, 乙酸乙酯对马尿酸有特征吸收, 可以通过测定马尿酸的生成量评价ACE抑制率。取酶解液, 对其ACE抑制活性进行测定。依次于试管中加入5 mmol/L HHL溶液200 μL酶解液100 μL, 在37℃恒温水浴中预热10 min, 然后加入20 μL ACE(酶活为0.1 U/mL)启动反应, 在37℃恒温水浴30 min, 加入300 μL盐酸(1.0 mol/L HCl)终止反应, 加入1.5 mL乙酸乙酯, 混合均匀后离心(4 000 r/min, 10 min)取上层乙酸乙酯1.0 mL移于另一个试管, 在120℃烘箱中烘干, 取出试管后冷却到室温, 加入3.0 mL蒸馏水, 在228 nm处测定吸光值, ACE抑制率计算公式如下:
| $ {\rm{ACE/}}\%{\rm{ = }}\left( {{\rm{A - B}}} \right){\rm{/}}\left( {{\rm{A - C}}} \right){\rm{ \times 100}} $ | (2) |
式中:A为样品用硼酸; B为样品酶解液; C为反应前加入HCl。
1.3.7 蛋白浓度的测定参照Bradford[22]的方法, 并稍作修改, 采用考马斯亮蓝法测定蛋白浓度。精确称取牛血清蛋白10 mg, 溶于10 mL蒸馏水中, 稀释为0.2,0.4,0.6,0.8,1.0 mg/mL标准蛋白溶液, 取100 μL蛋白溶液, 加入5 mL考马斯亮蓝染液, 立即旋涡混匀, 5 min后, 在595nm处测定吸光值, 绘制标准曲线。
1.3.8 聚丙烯凝胶电泳(SDS-PAGE)采用5%的浓缩胶、20%的分离胶, 对0~20%,20%~40%,40%~60%,60%~80%(质量分数)分段盐析出的蛋白进行SDS-PAGE电泳分析, 开始选择恒压80 V, 待条带跑到分离胶下端, 调节电压120 V直至电泳结束。染色40min后, 脱色24 h, 凝胶成像系统拍照。
1.4 统计分析采用Origin 2015软件处理数据。采用SPSS 20.0软件(SPSS Inc, Chicago, IL, USA)进行单因素方差分析(p<0.05)所有试验至少重复3次。
2 结果与分析 2.1 文冠果种仁的基本成分分析对文冠果种仁中水分、灰分、蛋白质及粗脂肪含量分析如表 1所示, 其中粗脂肪和蛋白质质量分数最高, 分别为60.9%和21.8%。结果表明:文冠果种仁富含脂肪和蛋白质, 可作为油脂和植物蛋白开发的理想原料。这与张东[23]在文冠果油脂肪酸、甘油三酯组成及其相关性分析研究和阮瑜琳[24]在水酶法同时提取文冠果油及蛋白质的研究中的结果一致。
|
|
表 1 文冠果种仁的化学成分 Tab. 1 The chemical constituents of Xanthocerassorbofolia Bunge seed |
为了得到文冠果蛋白水解肽, 首先采用饱和硫酸铵盐析法制备了蛋白原料, 所用的饱和硫酸铵浓度为0~20%,20%~40%,40%~60%,60%~80%(质量分数)。对透析后的4个区段的文冠果种仁蛋白电泳行为进行分析, SDS-PAGE电泳图谱如图 1所示。结果表明:不同区段的蛋白质种类和组成存在较为明显的差异。在4个区段中60%(质量分数)盐析蛋白质组成最为丰富, 主要由9条谱带构成(Mr分别约为63,55,43,40,36,34,26,22和6~13 kDa); 80%(质量分数)盐析蛋白质主要由5条谱带构成(Mr分别约为55,40,26,17和1~10kDa); 40%(质量分数)盐析蛋白质主要由5条谱带构成(Mr分别约为55,40,24,22和8~13kDa); 20%(质量分数)盐析蛋白质主要由4条谱带构成, 相比40%(质量分数)盐析蛋白少了24kDa1条谱带。比较4个区段, 还可以看出:3条谱带(Mr分别约为55,40和10 kDa)是4个区段共有的, 但同一种蛋白质在不同区段中的含量是不同的(如55 kDa的蛋白质在80%(质量分数)区段中含量最高)。另外, 60%(质量分数)盐析蛋白的22 kDa和80%(质量分数)盐析蛋白的10 kDa两处条带清晰, 未来可以对这两个区域进行进一步的鉴定, 确定分离纯化的片段。
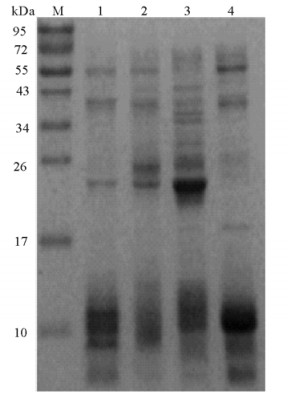
|
泳道M:Marker; 泳道1-4:分别为饱和硫酸铵浓度为0~20%, 20%~40%, 40%~60%,60%~80%(质量分数)的蛋白谱带 图 1 文冠果蛋白质分子量分布电泳图 Fig. 1 The protein molecular weight distribution electrophoresis of Xanthoceras sorbifolia bunge |
将上述各区段饱和硫酸铵浓度下收集的蛋白冷冻干燥后进行酶解, 以水解度为考察指标, 对其制备工艺参数进行单因素优化, 探究酶的种类、加酶量、酶解时间对水解度的影响。pH值改变能影响酶活性中心上必需基团的解离程度, 同时影响底物和辅酶的解离程度, 从而影响酶分子对底物分子的结合和催化作用[25], 选取酶解pH为9.0, 此时文冠果蛋白的溶解度良好, 而且四种酶都未失活。酶解温度适当, 可以加快酶促反应的进行, 温度过高, 会导致酶活性减弱[26], 选取酶解温度55℃。
2.3.1 酶的种类对水解度的影响在底物质量浓度40 g/L、加酶量4%(质量分数)、酶解pH9.0、温度55℃和时间2h的条件下, 比较了中性蛋白酶、复合蛋白酶、碱性蛋白酶和木瓜蛋白酶4种酶对文冠果蛋白的酶解效率。结果表明:碱性蛋白酶的水解效果最好, 水解度达到18.21%;复合蛋白酶次之,水解度为13.79%。相比之下, 中性蛋白酶和木瓜蛋白酶的水解度显著降低, 分别为8.34%和6.96%。酶解pH 9.0时碱性蛋白酶的活性高于其他3种酶, 水解更彻底。因此, 选择碱性蛋白酶作为酶解用酶。
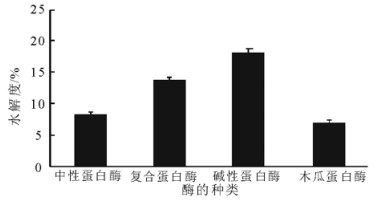
|
图 2 酶的种类对水解度的影响 Fig. 2 Effect of different proteases on degree of hydrolysis |
在底物质量浓度40 g/L、碱性蛋白酶、酶解pH9.0、温度55℃和时间2h的条件下, 比较了加酶量对文冠果蛋白的酶解效率。结果表明:随着酶量的增加, 水解度呈现先升高后降低的趋势。加酶量在4%~6%(质量分数)时, 大量蛋白质分子快速地被水解为小分子多肽, 水解度由10.04%增加至17.12%;加酶量在6%~8%(质量分数)时, 反应体系中酶浓度增大, 底物与酶的结合达到饱和, 水解度上升极为缓慢, 加酶量为8%(质量分数)时, 水解度达到最大值为18.26%;继续加大酶量, 导致酶浓度过大不利于蛋白的水解, 水解度反而下降。因此, 加酶量选择8%(质量分数)。
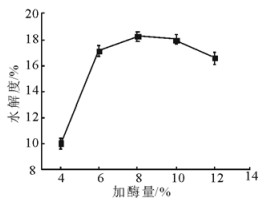
|
图 3 加酶量对水解度的影响 Fig. 3 Effect of the enzyme dosage on degree of hydrolysis |
在底物质量浓度40 g/L、加酶量8%(质量分数)(碱性蛋白酶)、酶解pH9.0和温度55℃的条件下, 比较了酶解时间对文冠果蛋白的酶解效率。结果表明:随着酶解时间的延长, 水解度呈现上升趋势。在25~100 min内, 水解度上升极为迅速。由于酶可作用的肽键逐渐减少, 酶催化反应达到平衡状态, 175 min后水解度已趋于平稳。继续延长时间, 浪费资源且水解度不会大幅上升。因此, 酶解时间选择175 min。
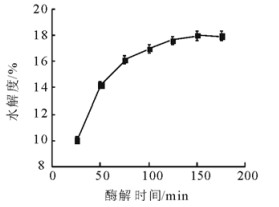
|
图 4 酶解时间对水解度的影响 Fig. 4 Effect of the enzymatic time on degree of hydrolysis |
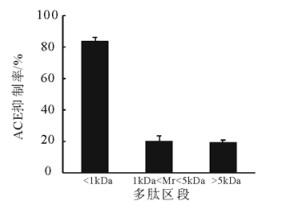
在底物质量浓度40 g/L、酶解pH 9.0、温度55℃、加酶量8%(质量分数)(碱性蛋白酶)和时间175 min的条件下, 酶解文冠果种仁蛋白, 得到的酶解液经超滤划分成3个肽段:<1 kDa,1~5 kDa和>5kDa, 测定3个组分肽段的ACE抑制率。结果表明:3个组分都具有一定的ACE抑制活性, 其中<1kDa组分的ACE抑制活性最高为83.43%, <1 kDa的多肽存在具有高ACE抑制活性的肽片段, 因此, 选择<1 kDa的多肽进一步分离纯化。
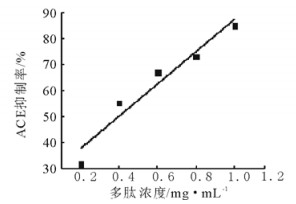
选用<1kDa的文冠果多肽, 探究多肽浓度与ACE抑制率的依赖关系。结果表明:多肽浓度在0.2~1.0 mg/mL时, ACE抑制率随着多肽浓度的增大而升高, 二者呈剂量依赖关系。多肽浓度愈高, 存在的具有ACE抑制活性的片段愈多, 对ACE的抑制效果越强。经计算, 文冠果多肽的IC50为0.394mg/mL。
|
图 5 不同肽段的ACE抑制率 Fig. 5 ACE inhibitory rate of different peptides |
|
图 6 不同浓度的多肽的ACE抑制率 Fig. 6 The ACE inhibition rate of different concentration of polypeptide |
本文采用盐析法提取文冠果蛋白, 以水解度为指标, 优化酶解工艺, 最优条件为:底物质量浓度为40 g/L、酶解pH 9.0、酶解温度55℃、加酶量8%(质量分数)(碱性蛋白酶)和酶解时间175 min, 此条件下水解度最佳, 可达22.97%。采用酶解法制备文冠果多肽, <5kDa的多肽回收率可达75%, 其中<1kDa的多肽具有高的体外抗高血压活性, ACE抑制率可达83.43%, IC50为0.394 mg/mL。可以进一步对ACE抑制肽进行分离纯化, 并配合多种光谱学技术对多肽的结构进行系统的表征研究。
| [1] |
VENEGAS-CALERÓN M, RUÍZ-MÉNDEZ M V, MARTÍNEZ-FORCE E, et al. Characterization of Xanthocerassorbifolium Bunge seeds: Lipids, proteins and saponins content[J]. Industrial Crops & Products, 2017, 109(6): 192-198. |
| [2] |
LI N, WANG Y, LI X, et al. Bioactive phenols as potential neuroinflammation inhibitors from the leaves of Xanthocerassorbifolia Bunge[J]. Bioorganic & Medicinal Chemistry Letters, 2016, 26(20): 5018-5023. |
| [3] |
敖妍, 段劼, 于海燕, 等. 文冠果研究进展[J]. 中国农业大学学报, 2012, 17(6): 197-203. |
| [4] |
WANG D, SU D, YU B, et al. Novel anti-tumourbarringenol-like triterpenoids from the husks of XanthocerassorbifoliaBunge and their three dimensional quantitative structure activity relationships analysis[J]. Fitoterapia, 2017, 116(1): 51-60. |
| [5] |
唐东慧, 阮成江, 孟婷, 等. 不同种质文冠果含油量及油中脂肪酸组成分析[J]. 中国油脂, 2017, 42(3): 77-81. |
| [6] |
孔维宝, 侯明杰, 李万武, 等. 文冠果油渣中蛋白质的提取工艺研究[J]. 中国油脂, 2014, 39(7): 42-45. |
| [7] |
林凯, 韩雪, 张兰威, 等. ACE抑制肽构效关系及其酶法制备的研究进展[J]. 食品科学, 2017, 38(3): 261-270. |
| [8] |
TU M, WANG C, CHEN C, et al. Identification of a novel ACE-inhibitory peptide from casein and evaluation of the inhibitory mechanisms[J]. Food Chemistry, 2018, 256(15): 98-104. |
| [9] |
王晓丹, 薛璐, 胡志和, 等. ACE抑制肽构效关系研究进展[J]. 食品科学, 2017, 38(5): 305-310. DOI:10.7506/spkx1002-6630-201705049 |
| [10] |
MOAYEDIA, MORA L, ARISTOY M C, et al. Peptidomic analysis of antioxidant and ACE-inhibitory peptides obtained from tomato waste proteins fermented using Bacillus subtilis[J]. Food Chemistry, 2018, 250(11): 180-187. |
| [11] |
苗欣宇, 王祖浩, 王鹏, 等. 红松仁清蛋白ACE抑制肽的分离纯化与结构鉴定[J]. 食品科学, 2017, 38(5): 129-133. DOI:10.7506/spkx1002-6630-201705021 |
| [12] |
SAIKUN P, SHUJUN W, LINGLING J, et al. Purification and charaterisation of novel angiotensin-Iconverting enzyme(ACE)-inhibitory peptide derived from the enzymatic hydrolysate of Enteromophaclathrata protein[J]. Food Chemistry, 2016, 211(9): 423-430. |
| [13] |
ZHANG P, ROYTRAKUL S, SUTHEERAWATTANANONDA M. Production and purification of glucosamine and angiotensin-I converting enzyme (ACE) inhibitory peptides from mushroom hydrolysates[J]. Journal of Functional Foods, 2017, 36(6): 72-83. |
| [14] |
LIU C, FANG L, MIN W, et al. Exploration of the molecular interactions between angiotensin-I-converting enzyme (ACE) and the inhibitory peptides derived from hazelnut (Corylus heterophylla Fisch.)[J]. Food Chemistry, 2018, 245(20): 471-480. |
| [15] |
WU Q, DU J, JIA J, et al. Production of ACE inhibitory peptides from sweet sorghum grain protein using alcalase: Hydrolysis kinetic, purification and molecular docking study[J]. Food Chemistry, 2016, 199(23): 140-149. |
| [16] |
TOOPCHAM T, MES J J, WICHERS H J, et al. Bioavailability of angiotensin I-converting enzyme (ACE) inhibitory peptides derived from Virgibacillus halodenitrificans SK1-3-7 proteinases hydrolyzed tilapia muscle proteins[J]. Food Chemistry, 2017, 220(18): 190-197. |
| [17] |
LIN K, ZHANG L, HAN X, et al. Yak milk casein as potential precursor of angiotensin I-converting enzyme inhibitory peptides based on in silico proteolysis[J]. Food Chemistry, 2018, 254(19): 340-347. |
| [18] |
NGOH Y Y, GAN C Y. Identification of Pinto bean peptides with inhibitory effects on α-amylase and angiotensin converting enzyme (ACE) activities using an integrated bioinformatics-assisted approach[J]. Food Chemistry, 2018, 267(21): 124-131. |
| [19] |
邱娟, 沈建东, 翁凌, 等. 利用牡蛎制备ACE抑制肽的工艺优化[J]. 食品科学, 2017, 38(16): 165-172. DOI:10.7506/spkx1002-6630-201716026 |
| [20] |
ADLER-NISSEN J. Enzymic hydrolysis of food proteins[M]. Elsevier applied science publishers, 1986.
|
| [21] |
CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbitlung[J]. Biochemical Pharmacology, 1971, 20(7): 1637-1648. DOI:10.1016/0006-2952(71)90292-9 |
| [22] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1-2): 248-254. DOI:10.1016/0003-2697(76)90527-3 |
| [23] |
张东, 薛雅琳, 段章群, 等. 文冠果油脂肪酸甘油三酯组成及其相关性分析研究[J]. 中国油脂, 2017, 42(2): 26-29. |
| [24] |
阮瑜琳, 万聪, 钟武, 等. 水酶法同时提取文冠果油及蛋白质的研究[J]. 中国油脂, 2016, 41(9): 1-6. |
| [25] |
郑明洋, 王元秀, 张桂香, 等. 响应面法优化玉米黄粉蛋白的酶解工艺[J]. 食品科学, 2012, 33(4): 71-76. DOI:10.3969/j.issn.2095-6002.2012.04.014 |
| [26] |
发崔楠, 陶晓赟, 李娟, 等. 响应面法优化黄粉虫蛋白制备ACE抑制肽的条件[J]. 食品科学, 2014, 35(15): 156-160. DOI:10.7506/spkx1002-6630-201415032 |
 2018, Vol. 48
2018, Vol. 48