水曲柳(Fraxinus Mandshurica R.)属于木犀科(Oleaceae)梣属(Fraxinus)植物, 别名, 东北梣, 主要分布于我国东北黑龙江的大兴安岭东部和小兴安岭、吉林的长白山等地。其树皮具有抗炎镇痛之功效, 常作秦皮的替代品使用[1]。《新华本草纲要》也记载了它的皮味苦, 性寒, 具有清热燥湿, 清肝明目的功能, 用于肠炎、痢疾、月经不调、白带、慢性支气管炎、急性结膜炎、疟疾的治疗[2]。
梣属(Fraxinus)植物种子中所含的化学成分种类比较多, 主要有环烯醚萜类、酚苷类、香豆素类、木脂素类、黄酮类等化合物[3-7]。因此,水曲柳种子具有较高的药用价值和食用价值, 药理研究发现, 其主要有抗炎镇痛、抗病原微生物、利尿、抗肿瘤、抗氧化、降血糖等多种药理作用[8-17]。多不饱和脂肪酸(Polyunsaturated fatty acids, PU-FA)具有抗癌、抗氧化、保肝促进细胞生长抗心脑血管疾病等作用[18]。本文拟采用乙醇提取, 气相色谱与质谱联用技术(Gas Chromatography and Mass Spectrometry, GC-MS)分析水曲柳种子所含有的小极性脂肪酸成分, 为水曲柳种子下一步的研究和开发利用提供实验基础。
1 材料与方法 1.1 材料与试剂水曲柳种子:水曲柳种子2015年12月年于吉林购买, 经西北大学白乃生鉴定, 留样于西北大学。
试剂:水曲柳种子提取分离使用的乙醇、石油醚、乙酸乙酯、二氯甲烷均为工业级; 乙醚(分析纯)购自天津市富宇精细化工有限公司; 正己烷(分析纯)购自天津市富宇精细化工有限公司; 氢氧化钠(分析纯)购自天津市恒兴化学试剂制造公司; 甲醇(分析纯)购自天津市富宇精细化工有限公司; 氯化钠(分析纯)购自天津市河东区红岩试剂厂; 无水硫酸钠(分析纯)购自天津市河东区红岩试剂厂; 纯净水。
1.2 仪器GC-MS 2010-plus气相色谱-质谱联用仪, 配有电子轰击离子源, 四级杆质量分析器; GC-MS-Solution数据处理系统(日本岛津公司); NIST-05版质谱图库; KQ3200DE超声清洗器(昆山市超声仪器有限公司); FA1204电子天平(天津康亨达电子衡器有限公司); QE-500粉碎机(武义县屹立工具有限公司); R-1001VN旋转蒸发仪(郑州长城科工贸有限公司); WB-2000恒温水浴锅(郑州长城科工贸有限公司); SHB-Ⅲ循环水真空泵(郑州长城科工贸有限公司); DLSB-5/10低温冷却液循环泵(郑州长城科工贸有限公司)。
1.3 方法与条件 1.3.1 提取取水曲柳种子30kg, 粉碎后加入3倍体积的乙醇-水(体积比为9:1)在室温下浸泡提取3次。每次48h, 将提取液合并浓缩后, 溶剂回收重复使用, 得到墨绿色的浸膏(1.441 kg)和褐色油状物。将提取浸膏用适量的水分散后, 先后分别用二氯甲烷、乙酸乙酯、正丁醇萃取3次, 将各个萃取部位进行浓缩, 得到二氯甲烷萃取物(0.388 kg)、乙酸乙酯萃取物(0.089 kg)、正丁醇萃取物(0.433 kg)及水层部分(0.485 kg)。对提取后的滤渣先后分别用适当体积50L的体积比为1:1的乙醇和水提取, 分别浓缩成浸膏, 待后续处理。
二氯甲烷层整体极性偏小, 用0.075~0.150mm硅胶, 石油醚(PE)-乙酸乙酯(EtOAc)梯度洗脱, 柱分离粗分划断为7个馏分(组分1~7), 组分1~3为大量的黄褐色油状物质, 在TLC跟踪检测时发现极性很小, 但其中的化合物极性很相近。因此,为了全面掌握二氯甲烷层中的主要成分, 对组分1~3极性很小的油脂性成分进行脂肪酸GC-MS组成分析。
1.3.2 脂肪酸甲酯化称取组分1~3各0.200 g, 加入0.5 mol/L氢氧化钠的甲醇溶液6mL, 充分震荡后放入60℃的恒温水浴锅中。放置1h后取出, 加入提前配好的10% H2SO4—MeOH溶液至酸性(大约加入了7mL)。然后放入60℃的恒温水浴锅中, 1h后将样品取出自然放置使其冷却。加入8mL正己烷、4mL水进行萃取, 离心后取出上清液并加入无水硫酸钠进行干燥处理。处理后的样品用0.22μm微孔过滤头进行过滤, 预处理结束待分析。
1.3.3 GC-MS分析气相色谱(GC)条件:Rtx-5MS弹性石英毛细管柱(30m×0.25 mm×0.25 μm); 以99.99%(体积分数)的氦气为载体, 柱前压力为83 kPa; 流速为1.05 mL/min, 进样口的温度为250℃, 进样量为1.0 μL, 分流比30:1(体积比), 计算各峰相对含量。采用程序升温法, 色谱柱的初始温度为100℃, 保持这个温度2min, 然后以10℃/min升温至210℃, 再以1.5℃/min升温至230℃, 保持1min。最后以5℃/min升温至250℃, 此升温过程结束。
质谱(MS)条件:采用EI电离源, 电子能量为70eV, 离子源温度为220℃, 四级杆温度为150℃, 接口温度是280℃, 扫描方式为间歇扫描, 质量范围为m/z 50-500, 数据采集时间为2~22min。
1.3.4 数据处理测定方法。取脂肪酸甲酯化样品1μL, 用GC-MS仪测定, 通过色谱工作站数据处理系统检索NIST-05谱图库, 结合有关文献进行人工谱图解析, 确认脂肪酸及其他化学成分。通过GC-MS Solution色谱工作站数据处理系统按面积归一化法进行定量分析, 分别求出各脂肪酸成分的相对百分含量。
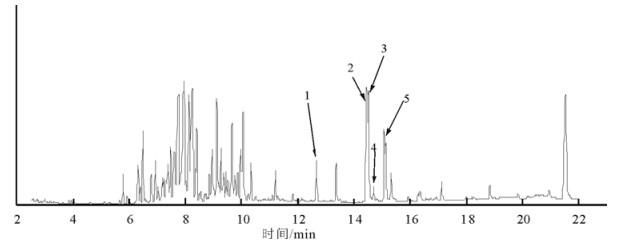
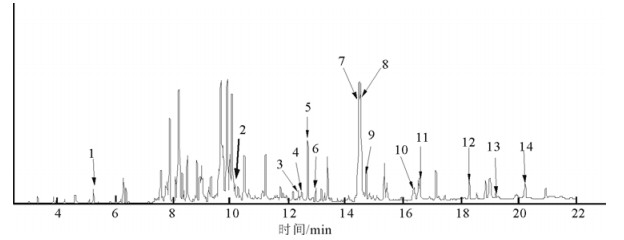
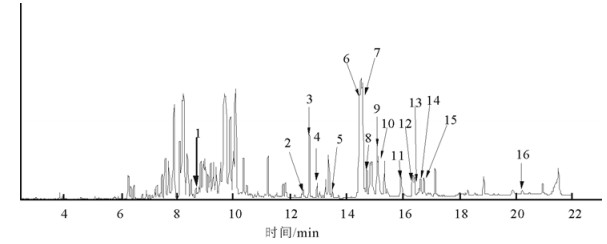
2 结果与分析将组分1,2,3采用上述GC-MS分析条件进行分析, 得到相对应组分的脂肪酸成分总离子流色谱图(图 1, 2, 3),对所含组分进行NIST-05谱库检索, 并根据离子峰质谱解析、结构筛选, 最终初步确认所含组分的可能结构。同时,应用面积归一化法, 通过GC-MS Solution色谱工作站数据处理系统求得各脂肪酸成分的相对质量分数(表 1)。
|
图 1 组分-1脂肪酸GC-MS总离子流谱图 Fig. 1 GC-MS total ion chromatogram of the ingredient-1 |
|
图 2 组分-2脂肪酸GC-MS总离子流谱图 Fig. 2 GC-MS total ion chromatogram of the ingredient-2 |
|
图 3 组分-3脂肪酸GC-MS总离子流谱图 Fig. 3 GC-MS total ion chromatogram of the ingredient-3 |
|
|
表 1 各组分脂肪酸甲酯化后的衍生物 Tab. 1 Fatty acid methylated derivatives of each ingredient |
综合3个组成分来看, 水曲柳种子中含有较高的不饱和脂肪酸, 其中主要为多烯脂肪酸、亚油酸及油酸、芳环脂肪酸及不饱和脂肪酸, 各类脂肪酸成分的含量相对较高, 且在GC-MS中能够做出较好的定性和定量分析。
结果表明, 从组分1中分离鉴定出4种脂肪酸, 均为不饱和脂肪酸, 其占组分1脂肪油总量的14.69%(质量分数), 主要种类有十六烯酸(1.18%,质量分数),(Z, Z)-9, 12-十八碳二烯酸(4.88%,质量分数),9-十八碳烯酸(5.36%,质量分数),8-硬脂酸(2.66%,质量分数)、顺-11-二十烯酸(0.91%,质量分数)等; 这几个脂肪酸均在组分2也有中发现。从组分2中分离鉴定出14种脂肪酸, 其中含10种不饱和脂肪酸, 其占组分2脂肪油总量的30.37%(质量分数), 主要种类有癸烯酸(0.51%,质量分数)、蓖麻油酸(0.80%,质量分数)、亚油酸(0.48%,质量分数)、9-十六烯酸(0.69%,质量分数)、十六烯酸(3.47%,质量分数)、对羟基苯丙酸(0.63%,质量分数)、9, 13-十八碳二烯酸(7.11%,质量分数)、反油酸(5.33%,质量分数)、硬脂酸(1.34%,质量分数)、顺-11-二十烯酸(0.91%,质量分数)等; 含有饱和脂肪酸4种, 其含量占脂肪油总量的6.31%(质量分数), 主要种类有二十烷酸(1.30%,质量分数)、二十二烷酸(1.00%,质量分数)、十九酸(3.60%,质量分数)、二十四碳酸(1.41%,质量分数)等。两类脂肪酸质量分数占组分2脂肪油总量的36.59%。从组分3中分离鉴定出16种脂肪酸, 均为不饱和脂肪酸, 其含量占组分3脂肪油总量的48.96%, 主要种类有9-棕榈油酸和棕榈油酸总共(3.3%,质量分数)、各类亚油酸(17.7%,质量分数)、多烯脂肪酸(24.20%,质量分数)以及其他各种芳环脂肪酸(7.07%,质量分数)。
3 结论水曲柳种子中所含有的脂肪酸成分主要以不饱和脂肪酸为主, 其中有多种多烯脂肪酸(Polyene fatty acid),具有降低血脂、甘油三酯、总胆固醇作用, 提高高密度脂蛋白, 降低血黏度, 减少血小板聚集和血栓形成作用, 以及防止冠心病猝死及抗肿瘤作用[19]。亚油酸(Octadecenoic acid)也有多种药理作用, 可以降低实验鼠和人体的血胆固醇和β脂蛋白, 并可以防治动脉粥样硬化和血栓的形成[20]。多存在于海产品中的棕榈油酸, 在水曲柳种子中有微量存在, 棕榈油酸对肥胖症、高血糖有很好的缓解作用[21]。由此可见, 水曲柳种子中的小极性脂肪酸也有较高的营养价值和药用价值。
| [1] |
TSUKAMOTO H, HISADA S, NISHIBE S. Coumarins from bark of Fraxinus japonica and F. mandshurica var. japonica[J]. Chemical & Pharmaceutical Bulletin, 2008, 33: 4069-4073. |
| [2] |
王铁僧. 《新华本草纲要》出版[J]. 植物资源与环境学报, 1992(3): 39-39. |
| [3] |
雷荣剑, 金圣煊. 梣属植物药用研究进展[J]. 哈尔滨医药, 2008, 28(5): 51-53. |
| [4] |
ARTEM′EVA M V, NIKONOV G K, NEZHINSKAYA G A. Isoquercitrin-A component of the leaves of Fraxinus mandschurica[J]. Chemistry of Natural Compounds, 1973, 9(3): 407-407. DOI:10.1007/BF00565711 |
| [5] |
LOSSIFOVA T, VOGLER B, kOSTOVA I. Escuside, a new Coumarin-secoiridoid from Fraxinus ormusbark[J]. Fitoterapia, 2002, 73: 386-389. DOI:10.1016/S0367-326X(02)00132-6 |
| [6] |
LOSSIFOV T, VOGLER B, KLAIBER I, et al. Caffeic acid esters of phenylethanoid glycosides from Fraxinus ornus bark[J]. Phytochemistry, 1999, 50(2): 297-300. DOI:10.1016/S0031-9422(98)00538-X |
| [7] |
GRUJIC-VASIC J, RAMIC S, BASIC F, et al. Phenolic compounds in the bark and leaves of FraxinusL species[J]. Acta Biol Med Exp, 1989, 14(1): 45-48. |
| [8] |
向小四. 秦皮甲素提取纯化工艺及降尿酸作用研究[D]. 长沙: 中南大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10533-1014145618.htm
|
| [9] |
赵全成. 日本白蜡树皮中的抗血小板凝聚成分[J]. 现代药物与临床, 1982(5): 33-34. |
| [10] |
WELLS J E, BERRY E D, VAREL V H. Effects of common forage phenolic acids on Escherichia coli O157:H7 viability in bovine feces[J]. Applied & Environmental Microbiology, 2005, 71(12): 7974-7979. |
| [11] |
KOSTOVA I N, NIKOLOV N M, CHIPILSKA L N. Antimicrobial properties of some hydroxy coumarins and Fraxinus ornus bark extracts[J]. Journal of Ethnopharmacology, 1993, 39(3): 205-208. DOI:10.1016/0378-8741(93)90037-6 |
| [12] |
林生, 刘明韬, 王素娟, 等. 小蜡树香豆素类成分及其抗氧化活性[J]. 中国中药杂志, 2008, 33(14): 1708-1710. |
| [13] |
IVANOVSKA N, IOSSIFOVA T, VASSILEVA E, et al. Effect of some Hydroxy coumarins on complement-mediated hemolysis in human serum[J]. Methods Find Exp Clin Pharmacol, 1994, 16(8): 557-562. |
| [14] |
WIE M B, KOH J Y, WON M H, et al. BAPTA/AM, an intracellular calcium chelator, induces delayed necrosis by lipoxygenase-nediated free radicals in mouse cortical cultures[J]. Prog Neuropsychop-harmacol Biol Psychiatry, 2001, 25(8): 1641-1659. DOI:10.1016/S0278-5846(01)00202-0 |
| [15] |
KOSTOVA I, IOSSIFOVA T. Chemical components of Fraxinus species[J]. Fitoterapia, 2007, 78: 85-106. DOI:10.1016/j.fitote.2006.08.002 |
| [16] |
BAI N S, HE K, IBARRA A. Iridoids from Fraxinus excelsior with Adipocyte Differentiation-Inhibitory and PPARr Activation Activity[J]. J Nat Prod, 2010, 73: 2-6. DOI:10.1021/np9003118 |
| [17] |
IBARRA A, BAI N S, HE K. Fraxinus excelsior seed extract FraxiPureTM limits weight gains and hyperglycemia in high-fat diet-induced obese mice[J]. Phytomedicine, 2011, 18(6): 479-485. DOI:10.1016/j.phymed.2010.09.010 |
| [18] |
马立红, 王晓梅. 多不饱和脂肪酸药理作用研究[J]. 吉林中医药, 2006, 26(12): 69-70. DOI:10.3969/j.issn.1003-5699.2006.12.057 |
| [19] |
谢克勤, 陈丽宇. 多烯脂肪酸药理研究概述[J]. 天津药学, 1998(2): 1-5. |
| [20] |
陈琼华. 多不饱和脂肪酸的生化、生理、病理和药理[J]. 中国药科大学学报, 1982(1): 57-66. |
| [21] |
张泽生, 高山, 郭擎, 等. 棕榈油酸的研究现状及展望[J]. 中国食品添加剂, 2016(9): 198-202. |
 2018, Vol. 48
2018, Vol. 48
