2. 西安交通大学 基础医学院,陕西 西安 710061;
3. 西安交通大学 生物医学研究实验中心, 陕西 西安 710061
2. School of Basic Medical Science, Xi′an Jiaotong University, Xi′an 710061, China;
3. Biomedical Research Experiment Center, Xi′an Jiaotong University, Xi′an 710061, China
近年来,我国结直肠癌的发病率日益增加, 严重威胁人们的生活质量和生命健康[1]。肿瘤患者往往由于各种应激而出现抑郁情绪, 后者可加重和扩展各种临床表现, 影响甚至决定患者的病情、病程、预后和结局[2-3]。目前, 抗抑郁药开始被应用到肿瘤的临床治疗过程中[3],以单胺转运蛋白为靶点的抑制单胺递质重摄取是当前最成功的抑郁症药物治疗策略[4]。
单胺转运蛋白包括5-羟色胺转运蛋白(5-Serotonin transporter, SERT)、去甲肾上腺素转运蛋白(Norepinephrine transporter, NET)和多巴胺转运蛋白(Dopamine transporter, DAT), 是位于神经元、胶质细胞和外周交感神经纤维支配组织器官(包括胃肠道)的Na+/Cl-依赖性递质转运体[4]。由于基因多态性等因素所造成的NET,SERT功能的缺失或紊乱被证明与许多神经精神系统疾病、心血管疾病以及肿瘤关系甚为密切[5-8]。本研究针对NET在结肠癌中的作用, 从临床生物大数据、实际临床标本和人结肠癌细胞3个水平进行了初步探索。
1 材料与方法 1.1 临床组织标本采集收集西安交通大学第二附属医院2016—2017年间经病理组织学证实, 具有完整病例资料的27例结肠癌患者的结肠癌组织和相应癌旁正常组织。患者年龄26~86岁, 平均61.1岁, 其中男17例, 女10例。所有患者术前均未接受化疗、放疗及其他抗肿瘤治疗, 未同时患有其他恶性肿瘤; 术后均准确记录肿瘤的分化程度和转移情况, 并依据结直肠癌TNM分期(第8版)标准进行分期。其中, 出现转移患者(包括淋巴结转移和远端转移)11例, 无转移患者16例。上述标本严格按照标准流程制成石蜡切片。
1.2 细胞培养结肠癌细胞株HCT116,SW480由西安交通大学医学部环境与疾病相关基因教育部重点实验室惠赠。结肠癌细胞常规培养于含10%(体积分数)胎牛血清、100U/mL青霉素和100μg/mL链霉素的RPMI-1640培养基中。实验时, 细胞均处于对数生长期。
1.3 主要试剂免疫组织化学试剂盒购于北京中杉金桥生物技术有限公司。RPMI-1640培养基购买于澳大利亚PAA公司, 胎牛血清购于以色列Biolnd公司。Polyplus脂质体转染试剂购买于上海泽迈生物技术有限公司, RNA提取试剂Trizol购于美国Invitrogen公司。逆转录试剂盒PrimeScript RT reagent Kit和Real-time qPCR试剂盒SYBR Premix ExTaq购买于日本TaKaRa公司。Transwell小室购于Millicell公司。BCA蛋白定量试剂盒购买于Theromo公司。兔抗人NET抗体为Abcam公司产品, 兔抗人MMP9抗体为Proteintech公司产品, 兔抗人MMP2抗体为Proteintech公司产品, 鼠抗人β-actin为SANTA CRUZ公司产品。
1.4 美国癌症和肿瘤基因组图谱大数据分析提取美国癌症和肿瘤基因组图谱(TCGA)数据库(https://xenabrowser.net/)中所有结肠癌(COAD)的基因表达RNAseq的数据, 运用Kruskal-Wallis秩和检验分析NET的表达量与结肠癌患者的T(肿瘤大小),N(淋巴结转移),M(远端转移)及stage(分期)的关系。
1.5 免疫组织化学检测石蜡切片常规脱蜡, 抗原修复并冷却至室温后, 3%H2O2孵育10min以消除内在过氧化物酶活性。BSA室温30min封闭后, 滴加一抗(抗人NET, 1:50), 4℃孵育过夜。PBS洗涤后滴加二抗, 室温孵育30min。PBS冲洗后行DAB显色和苏木素复染。梯度无水乙醇脱水, 二甲苯透明, 中性树胶封片。PBS代替一抗作为阴性对照。NET以细胞膜或细胞质呈棕黄色为阳性。根据阳性细胞百分比和染色强度综合评分[9]:1)阳性细胞百分比, 没有阳性细胞为0分; < 10%为1分, 10%~50%为2分, 50%~80%为3分, ≥80%为4分; 2)染色强度, 无着色为0分, 淡黄色为1分, 黄色为2分, 深棕黄色为3分; 再计算两者乘积; Wilcoxon秩和检验分析有转移组和无转移组的NET表达差异。
1.6 NET siRNA合成、转染及效率检测设计特异针对NET基因的siRNA序列(见表 1), 由上海吉玛公司合成。转染前更换培养基, 采用Polyplus转染法将siRNA (30nmol/L)转入结肠癌细胞中并设置相应的对照组。转染后继续培养至48h收集细胞行实时荧光定量PCR(qRT-RCR)检测NET siRNA干扰效率和Western Blot检测NET蛋白的表达差异。
|
|
表 1 实验中所用到的oligo序列 Tab. 1 Oligos used in the experiments. |
采用Trizol法提取各组细胞的总RNA。根据日本TaKaRa公司的逆转录试剂盒将各组总RNA逆转为cDNA, 同时用其Real-time qPCR试剂盒(SYBR法)行扩增NET基因, 所需引物由北京擎科新业生物技术有限公司合成, 序列见表 1。
1.8 Transwell迁移实验收集各处理组细胞, 用1mL无血清培养基重悬, 计数, 取6×104cells/200μL加入Transwell小室的上室, 下室加入600μL含10%(体积分数)血清的培养基。在37℃ 5%(体积分数)CO2培养箱中培养36h后, 取出小室, PBS洗涤, 吸净PBS。0.04g/mL多聚甲醛固定15min, 0.001g/mL结晶紫染液染色30min, PBS洗涤两遍。用棉签轻轻拭去上室内未迁移的细胞。在显微镜下观察并拍照。DMSO溶解, 在酶标仪570nm处检测各处理组OD值。独立实验重复3次。
1.9 Western Blot检测NET、MMP9和MMP2蛋白表达提取各组细胞的蛋白裂解液,用BCA法测定各组蛋白质浓度。分别取20μg蛋白样品经SDS-PAGE电泳后转至PVDF膜, 与特异性一抗(抗人NET、抗人MMP9、抗人MMP2,体积比均为1:500)孵育, 4℃过夜。洗膜后与二抗室温孵育1h, 洗膜后与ECL化学发光剂作用并曝光和显影。独立实验重复3次。
1.10 统计学处理所有数据均采用SPSS17.0统计软件进行数据分析。结果以均数±标准差表示, 配对样本比较采用t检验, 非配对样本采用秩和检验。所有结果以P < 0.05为有统计学意义。
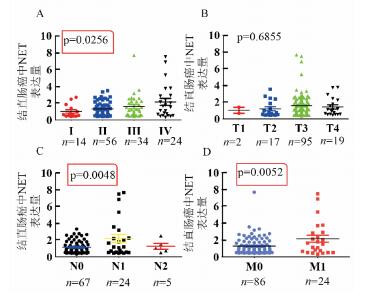
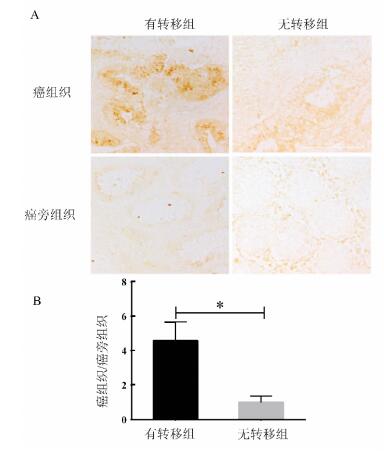
2 结果 2.1 NET与结直肠癌患者的转移及分期呈正相关利用TCGA数据库中全部结肠癌基因表达RNAseq结果并行统计分析发现结肠癌组织中NET的表达与患者的淋巴结转移、远端转移和临床分期呈紧密相关, 随患者出现转移和分期变晚, NET的表达升高(见图 1)。并收集27例结直肠癌患者的癌组织和配对正常组织, 通过制备石蜡切片、行免疫组织化学染色并定量分析后, 发现有转移结肠癌患者的癌组织中NET的表达较配对正常组织显著升高(见图 2A), 且其升高倍数明显高于无转移的结肠癌患者(见图 2B)。
|
A结肠癌的不同分期对NET表达的影响; B结肠癌T分期对NET表达的影响; C结肠癌中淋巴结转移与否对NET表达的影响; D结肠癌中远端转移与否对NET表达的影响 图 1 TCGA大数据分析NET与结肠癌T,N,M和分期的关系 Fig. 1 The analysis of NET and human colon cancerusing TCGA database |
|
图 2 NET在结肠癌组织和其癌旁正常组织中的表达×200(*P<0.05) Fig. 2 The expression of NET in colon cancer tissuesand adjacent normal tissues ×200 |
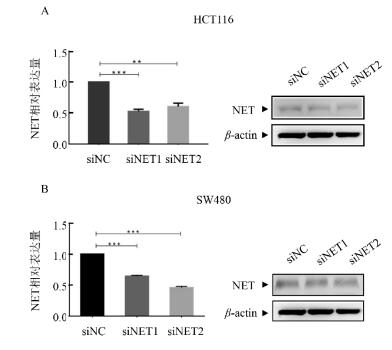
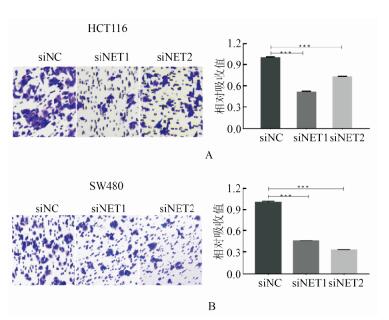
NET在出现转移的结肠癌患者中表达升高, 故设计并合成了两条针对人NET的siRNA (siNET1和siNET2), 将它们与对照(siNC)分别转染至人结肠癌细胞HCT116和SW480中, 48h后提取细胞总RNA和总蛋白。qRT-RCR检测结果和Western Blot结果显示, 这两条siRNA在两种人结肠癌细胞中均明显下调了NET的mRNA和蛋白的表达量(见图 3)。运用Transwell迁移实验观察下调NET对结肠癌细胞迁移能力的影响。结果显示转染siNET1组、转染siNET2组细胞的迁移能力较对照组明显下降: HCT116细胞中, 转染siNET1组,siNET2组的穿膜细胞数较对照组分别下降48.4%和26.9%; SW480细胞中, 转染siNET1组、siNET2组的穿膜细胞数较对照组分别下降53.9%和66.4%(见图 4)。
|
图 3 在人结肠癌细胞中,转染siNET,使NET的表达量下调 Fig. 3 The expression of NET was decreased by siNET transfection in human colon cancer cells |
|
图 4 在人结肠癌细胞中,siNET使细胞迁移能力下降 Fig. 4 The invasion of colon caner cells was inhibited by siNET |
基质金属蛋白酶家族(MMPs)与肿瘤的转移关系密切, 其中MMP2和MMP9表达量的改变常被用于辅助判断肿瘤细胞迁移转移能力的改变[10]。Western Blot的结果(见图 5)显示, 与对照组相比, 转染siNET1组,转染siNET2组的HCT116和SW480细胞中MMP2蛋白略有减少, 而MMP9的蛋白表达均被明显抑制。
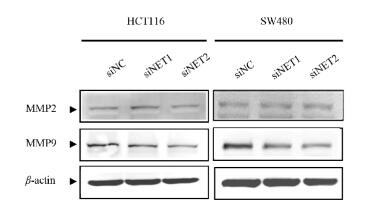
|
图 5 在人结肠癌细胞中,siNET使MMP9表达量明显被抑制 Fig. 5 The protein level of MMP9 was inhibited by siNET |
去甲肾上腺素转运蛋白(NET)属于神经递质-钠协同转运体家族, 分布于中枢神经系统的神经元和神经胶质细胞以及外周器官中交感神经节后纤维支配的组织器官, 包括心脏、肾上腺髓质、胃肠道及胎盘等。NET通过重摄取由突触前膜释放到突触间隙的去甲肾上腺素(NE)水平而维持突触的稳态, 在中枢神经系统疾病、精神兴奋、抗抑郁药作用机制、心血管疾病及肿瘤的治疗中扮演着重要的角色。NET的功能受到多种细胞内、外信号分子(包括cAMP-PKA,PKC等)和神经递质、激素的调节[11-12]。
目前临床上使用的抗抑郁药物被认为主要通过阻断NET和SERT而达到抗抑郁的效果。近年来, 抗抑郁药物逐渐开始伴随应用于肿瘤治疗过程中[3]。国外临床病例回顾性研究指出, 抗抑郁药的应用除治疗患者抑郁症状之外, 亦可改变肿瘤的发病风险[13-15]。并且,Stopper H教授课题组通过进行体外实验提出抗抑郁药使结肠癌细胞出现G1-S阻滞, 增殖减缓, 出现凋亡,且能够减轻由致癌物质MNNG引起的小鼠大肠癌变, 周围组织中微血管形成减少[16]。而Kim JS教授课题组亦报道了抗抑郁药可以通过抑制NF-κB的活性, 减少炎症介质产生, 进而缓解小鼠肠炎以及肠肿瘤的形成[17]。这些研究结果均提示NET或SERT与结肠癌细胞的增殖、凋亡以及转移能力存在相关性。在我们的实验结果中通过对TCGA数据库的大数据分析和实际临床标本的组化实验结果亦发现NET在有转移的结肠癌患者癌组织中表达明显升高, 且利用siRNA技术将NET表达下调, 显著抑制了人结肠癌细胞的迁移能力和迁移相关分子MMP9的蛋白水平。这些实验结果与上述研究结论保持一致, 说明NET参与了对人结肠癌细胞迁移的调控。
肿瘤细胞的迁移能力增强是构成肿瘤转移的一个重要环节。基质金属蛋白酶家族(MMPs)是在自然进化中高度保守的一类锌离子依赖性内肽酶, 几乎能降解细胞外基质的所有成分; 现已发现26种MMP, 其中MMP2和MMP9表达量的改变常被用于辅助判断肿瘤细胞迁移转移能力的改变[10, 18]。在结肠癌中MMP9被报道调节细胞粘附,控制肿瘤细胞的移行, 与肿瘤的进展和预后紧密相关[19-20]。Notch信号通路是一种细胞间接触依赖性的细胞通讯方式。其被活化后, 释放被两次切割后得到的Notch蛋白的胞质片段,转位到细胞核内而调节靶基因(如Snail和NF-κB等)的表达, 在胚胎发育和肿瘤上皮-间质转化中起作用[21]。Notch被报道在肿瘤细胞中通过结合于MMP9的启动子区域而启动其表达,从而参与对肿瘤转移的调控[22-23]。另外, Hu等研究发现NET基因缺陷小鼠中Numb表达增高, Notch信号通路活性减弱[24]。雷蕾等亦报道了抑郁症患者中NET基因rs2242446位点的多态性与Numb和RBP-jk的表达量升高有关, 从而抑制Notch信号通路活性[6]。据此, 结合我们的实验数据我们推测, NET的表达和功能可以影响Notch信号通路, 从而调控MMP9的表达, 进而对肿瘤细胞的迁移及转移产生影响。我们的结果提示靶向NET的治疗手段有可能为转移性结肠癌的治疗提供新的思路和方法。
| [1] |
张玥, 石菊芳, 黄慧瑶, 等. 中国人群结直肠癌疾病负担分析[J]. 中国流行病学杂志, 2015, 36(7): 709-714. |
| [2] |
刘玉萍, 张静. 大肠癌病人抑郁及其影响因素进展[J]. 护理研究, 2014, 28(3): 774-777. |
| [3] |
ALBERTS D. Supportive Cancer Care[J]. Switzerland:Springer International Publishing, 2016, 45-76. |
| [4] |
张亭亭, 薛瑞, 李云峰, 等. 单胺转运蛋白与单胺重摄取抑制剂研究进展[J]. 中国药理学通报, 2013, 29(6): 741-44. DOI:10.3969/j.issn.1001-1978.2013.06.001 |
| [5] |
曹济民, 蔺彩霞. 去甲肾上腺素转运体与心血管疾病[J]. 医学研究杂志, 2016, 45(3): 1-3. |
| [6] |
雷蕾, 孙宁, 刘志芬, 等. 抑郁症Notch信号通路相关因子与去甲肾上腺素转运体的关系[J]. 中国神经精神疾病杂志, 2015, 41(3): 172-7. |
| [7] |
MATTHAY KK, GEORGE R E, YU A L. Promising therapeutic targets in neuroblastoma[J]. Clin Cancer Res, 2012, 18(10): 2740-53. DOI:10.1158/1078-0432.CCR-11-1939 |
| [8] |
HÖPFNER M, SUTTER A P, HUETHER A, et al. A novel approach in the treatment of neuroendocrine gastrointestinal tumors: Assistive antiproliferative effects of interferon-gamma and meta-iodobenzylguanidine[J]. BMC Cancer, 2004, 4: 23. DOI:10.1186/1471-2407-4-23 |
| [9] |
何华. 如何正确地对免疫组化结果进行半定量评分[J]. 中外健康文摘·临床医师, 2008, 5(7): 162. |
| [10] |
HERSZÉNYⅡ L, HRITZ L, LAKATOS G, et al. The behavior of matrix metalloproteinases and their inhibitors in colorectal cancer[J]. Int J Mol Sci, 2012, 13(10): 13240-13263. |
| [11] |
MANDELA P, ORDWAY G A. The norepinephrine transporter and its regulation[J]. J Neurochem, 2006, 97(2): 310-313. DOI:10.1111/j.1471-4159.2006.03717.x |
| [12] |
仪丹, 侯丛佳, 文学方, 等. 去甲肾上腺素转运体的研究进展[J]. 现代生物医学进展, 2014, 14(14): 2794-2797. |
| [13] |
DUBLIN S, ROSSING M A, HECKBERT S R, et al. Risk of epithelial ovarian cancer in relation to use of antidepressants, benzodiazepines, and other centrally acting medications[J]. Cancer Causes Control, 2002, 13(1): 35-45. DOI:10.1023/A:1013969611593 |
| [14] |
COOGAN P F. Review of the epidemiological literature on antidepressant use and breast cancer risk[J]. Expert Rev Neurother, 2006, 6(9): 1363-1374. DOI:10.1586/14737175.6.9.1363 |
| [15] |
CHUBAK J, BOUDREAU D M, RULYAK S J, et al. Colorectal cancer risk in relation to antidepressant medication use[J]. Int J Cancer, 2011, 128(1): 227-232. DOI:10.1002/ijc.v128:1 |
| [16] |
KANNEN V, HINTZSCHE H, ZANETTE D L, et al. Antiproliferative effects of fluoxetine on colon cancer cells and in a colonic carcinogen mouse model[J]. Plos One, 2012, 7(11): e50043. DOI:10.1371/journal.pone.0050043 |
| [17] |
KOH S J, KIM J M, KIM I K, et al. Fluoxetine inhibits NF-κB signaling in intestinal epithelial cells and ameliorates experimental colitis and colitis-associated colon cancer in mice[J]. Am J PhysiolGastrointest Liver Physiol, 2011, 301(1): G9-G19. DOI:10.1152/ajpgi.00267.2010 |
| [18] |
BOURBOULIA D, STETLER-STEVENSON W G. Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs):Positive and negative regulators in tumor cell adhesion[J]. Semin Cancer Biol, 2010, 20(3): 161-168. DOI:10.1016/j.semcancer.2010.05.002 |
| [19] |
ZENG Z S, HUANG Y, COHEN A M, et al. Prediction of colorectal cancer relapse and survival via tissue RNA levels of matrix metalloproteinase-9[J]. J Clin Oncol, 1996, 14(12): 3133-3140. DOI:10.1200/JCO.1996.14.12.3133 |
| [20] |
BENDRDAF R, BUHMEIDA A, HILSKA M, et al. MMP-9 (gelatinase B) expression is associated with disease-free survival and disease-specific survival in colorectal cancer patients[J]. Cancer Invest, 2010, 28(1): 38-43. DOI:10.3109/07357900802672761 |
| [21] |
WANG Z, LI Y, KONG D, et al. Acquisition of epithelial-mesenchymal transition phenotype of gemcitabine-resistant pancreatic cancer cells is linked with activation of the Notch signaling pathway[J]. Cancer Res, 2009, 69(6): 2400-2407. DOI:10.1158/0008-5472.CAN-08-4312 |
| [22] |
BIN HAFEEZ B, ADHAMI V M, ASIM M, et al. Targeted knockdown of Notch1 inhibits invasion of human prostate cancer cells concomitant with inhibition of matrix metalloproteinase-9 and urokinase plasminogen activator[J]. Clin Cancer Res, 2009, 15(2): 452-459. DOI:10.1158/1078-0432.CCR-08-1631 |
| [23] |
LU L L, WANG J S, WU Y G. Rap1A promotes ovarian cancer metastasis via activation of ERK/p38 and notch signaling[J]. Cancer Med, 2016, 5(12): 3544-3554. DOI:10.1002/cam4.946 |
| [24] |
HU Y F, CARON M G, SIEBER-BLUM M. Norepinephrine transport-mediated gene expression in noradrenergic neurogenesis[J]. BMC Genomics, 2009, 10: 151. DOI:10.1186/1471-2164-10-151 |
 2018, Vol. 48
2018, Vol. 48