2. 陕西省蜂产品工程技术研究中心, 陕西 西安 710065
2. Bee Product Research Center of Shaanxi Province, Xi′an 710065, China
杨树芽是杨柳科(Salicaceae)杨属(Populus)植物中尚未充分发育和伸长的枝条或花, 是自然界中广泛存在的一种胶源物质, 也是生物活性化合物的来源之一[1-2]。大量研究表明, 杨树芽是杨树型蜂胶的主要植物源[3-4], 杨树型蜂胶具有抗菌、抗炎和细胞抑制等性质[5]。已有研究表明, 杨树芽提取物富含多酚类物质[6-7], 包括类黄酮[8]、酚酸及其酯类化合物[9]。杨树芽一直作为民间药用于治疗皮炎, 上呼吸道感染和风湿类疾病[10-11]。现代药理学研究表明, 杨树芽具有调节免疫、保护肝脏、抗炎和抗菌等生物活性[12-14]。由此可见, 杨树芽的研究具有重要的开发利用价值。
本文基于单因素实验, 以提取时间、料液比、乙醇体积分数为自变量, 杨树芽总黄酮提取率为响应值, 利用响应面实验设计方法, 对杨树芽总黄酮提取工艺进行优化, 同时考察杨树芽总黄酮提取物的抗氧化活性。旨为杨树芽资源的高值化开发利用提供依据。
1 材料与方法 1.1 材料与试剂杨树芽陕西省佳县; 芦丁(AR) Aladdin(上海生化股份有限公司); 乙醇、苯、甲醇(国产分析纯,新万达科教仪器厂); 正常熔点琼脂糖(微克生物有限公司); 1, 1-二苯基-2-苦肼基自由基(DPPH)得研实验生物试剂耗材; pBR322DNA生工生物工程股份有限公司; HCL(AR,渤海集团化工有限公司); Trolox、菲洛嗪(AR) SIGMA-ALDRICH公司。
1.2 仪器与设备HH-2J恒温水浴锅莱悦纳格仪器制造厂; 101-00A型鼓风干燥箱鼎昌仪器; RE52CS旋转蒸发仪亚荣生化仪器; SHZ-Ⅲ循环水式真空泵玖蓝科学仪器; 060ST超声波清洗器洁盟电器; 722可见分光光度计力辰实验仪器; UVP Gelstudio touch凝胶成像仪德国耶拿分析仪器股份公司。
1.3 实验方法 1.3.1 杨树芽总黄酮的提取方法杨树芽经自然光晾晒至干, 用粉碎机粉碎成末状并经过250μm的筛子, 得到杨树芽粉末。将杨树芽粉末与一定浓度的乙醇溶剂按比例混合, 置于固定在水浴锅上的圆底烧瓶中, 通过热回流的方式, 同时设置温度和时间进行提取。将所得提取液通过抽滤的方式得到其上清液并进行旋转蒸发浓缩, 对浓缩液进行冷冻干燥, 即为杨树芽提取物, 储藏于-4 ℃备用。
1.3.2 杨树芽中总黄酮的测定方法杨树芽提取物中总黄酮的测定参考孙丽萍等人的方法[15]。杨树芽总黄酮的含量以芦丁计。称取0.5 g杨树芽, 用乙醇溶解并补充体积至25.0 mL, 混匀后超声提取0.5 h, 取1.0 mL上清液置于蒸发皿中, 并加入1 g聚酰胺粉, 于40℃水浴下挥掉乙醇, 并移至层析柱, 先用20.0 mL苯洗脱, 以脱除实验过程中的杂质, 后用甲醇洗脱, 收集甲醇溶液并定容至25 mL, 于360 nm处测定吸光度。杨树芽总黄酮含量按公式(1)计算, 提取率按公式(2)计算。
| $ X = \frac{{A \times {V_2} \times 100}}{{{V_1} \times M \times 1{\rm{ }}000}} $ | (1) |
式中:X为杨树芽提取物中的总黄酮含量, 单位mg/100g;A为由标曲算得被测液黄酮量, 单位μg; M为杨树芽活性成分提取物质量, 单位g; V1为测定用试样体积, 单位mL; V2为试样定容总体积, 单位mL。
| $ 总黄酮提取率 = \frac{Z}{Y} \times 100\% $ | (2) |
式中:Z为提取物中总黄酮的质量, 单位g; Y为杨树芽质量, 单位g。
1.3.3 杨树芽总黄酮提取工艺优化1) 单因素实验
分别考察料液比、提取时间、乙醇体积分数对杨树芽提取物总黄酮提取率的影响。因素水平见表 1。
|
|
表 1 单因素实验因素及水平 Tab. 1 Factors and levels used in single factor analysis |
2) 响应面优化实验设计
基于单因素实验, 选择提取时间X1、料液比X2和乙醇体积分数X3为自变量, 以杨树芽提取物中总黄酮提取率为响应值, 对杨树芽提取工艺进行响应面优化。具体的因素水平见表 2。
|
|
表 2 响应面实验因素及水平 Tab. 2 Factors and levels used in response surface analysis |
1) DPPH·清除活性
测定方法参考Zhao等人的方法[16-17]。移取1 mL杨树芽提取物配置的浓度不同的杨树芽提取液于试管中, 各加入5 mL浓度为0.1 mmol/L的DPPH甲醇溶液, 室温避光反应1 h, 以甲醇为空白, 以Vc为阳性对照, 于517 nm处测定吸光度。DPPH·清除率按下式计算。
| $ {\rm{DPPH}}\cdot清除率 / \% = (1 - \frac{{A样品}}{{A空白}}) \times 100\% $ |
式中:A样品为样品的吸光度; A空白为空白的吸光度。
2) Fe3+还原能力(ferric reducing ability of plasma, FRAP)的测定方法
参考ZHANG X等人的方法[18]。将0.3 mol/L醋酸盐缓冲液(pH=3.6), 0.01 mol/L TPTZ溶液(0.4 mol/L HCl)和0.02 mol/L氯化铁溶液以体积比10:1:1的比例配成FRAP试剂, 37 ℃保存备用。移取0.76 mL一定浓度的杨树芽提取物配置的杨树芽提取液于试管中, 加入7.24 mL FRAP试剂使总体积为8 mL, 常温状态下反应15 min, 以Trolox为阳性对照, 于593 nm处测吸光度。
3) Fe2+络合力的测定方法
测定方法参考Rajapakse等人的方法[19]。准确吸取经适当稀释的杨树芽提取物配置的杨树芽提取液200 μL, 置于小离心管中, 依次加入0.1 mL 1 mmol/L的FeSO4溶液, 0.3 mL浓度为1 mmol/L的菲洛嗪(Ferrozine), 并用甲醇补充体积至3 mL, 反应0.17 h, 以乙二胺四乙酸二钠为标准, 于562 nm处测其吸光度。
4) 杨树芽提取物对OH·介导的DNA链氧化损伤的保护作用
采用本实验室建立的方法。实验组加入0.5 μg pBR322质粒DNA,1 μL 1.0 mmol/LFeSO4,l μL 1%(体积分数)H2O2和4 μL浓度不同的杨树芽样品溶液(1,5,15 μg/mL), 并用50 mmol/L的磷酸缓冲液(pH=7.0)补充体积至15 μL; 模型组不加杨树芽样品溶液; 正常组不加诱导剂FeSO4、H2O2和杨树芽样液。待体系混匀后在37℃温浴反应30 min;然后加入Loading buffer; 再将0.8%(质量分数)琼脂糖凝胶热熔后向其中加入Golden ViewR, 乘热倒胶, 凝固后点样, 即可开始电泳。电泳时间为90min, 电泳所需电压为50V, 电泳方向从负极到正极。结果用呈像仪拍照, Quantity One软件分析电泳条带, 定量分析双螺旋结构剩余含量, 以评价杨树芽提取物对OH·诱导的DNA氧化损伤的抑制作用。
1.4 数据处理与统计分析实验数据用Design-Expert 8.0.6,Origin8.0及Quantity One软件进行处理, 实验均重复3次。
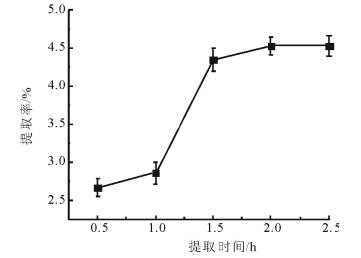
2 结果与分析 2.1 杨树芽总黄酮的提取结果 2.1.1 提取时间对总黄酮提取率的影响固定料液比(1:10,g/mL)及乙醇浓度(75%,体积分数), 本文研究了提取时间对杨树芽总黄酮提取率的影响, 结果见图 1。由图 1可知, 在一定范围内, 杨树芽总黄酮提取率与时间的延长呈正相关, 2.0 h时达到最高。原因可能在于热回流提取过程中, 杨树芽粉末中的黄酮类化合物浓度高于乙醇中的黄酮类化合物浓度, 形成一定浓度梯度, 致使其提取率在时间小于2.0 h时增幅较大, 另一方面, 热回流提取过程中, 物质与条件之间的相互作用加速了分子之间的运动, 导致杨树芽细胞壁破损, 从而加速杨树芽中活性成分的析出。当提取时间大于2.0 h时, 提取率受提取时间的影响较小。这可能是随着时间的延长, 部分黄酮类化合物的析出已达极限, 形成稳定状态。综上所述, 选择2.0 h为杨树芽的最优提取时间。
|
图 1 提取时间对杨树芽总黄酮提取率的影响 Fig. 1 Effect of extraction time on the extraction rate of total flavonoids from poplar buds |
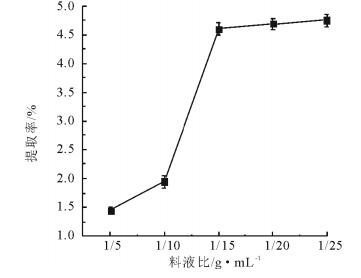
固定提取时间(1.5h)和乙醇浓度(75%,体积分数), 本文考察了料液比对杨树芽总黄酮提取率的影响, 结果见图 2。由图 2可知, 在一定范围内, 提取率与料液比的增加呈正相关, 料液比为1:15时, 提取率达到最高。可能是溶剂体积不断增加过程中, 溶剂传质动力增大, 传质效率增大, 使得杨树芽总黄酮提取率增大[20]。但是,料液比继续增加后其提取率变化趋势平稳。这可能是溶剂体积的增加致使传质扩散达到一种饱和稳定状态。鉴于过高的料液比会使实验过程中回收困难, 损耗增加, 综合考虑, 本研究选取1:15为最优料液比[21]。
|
图 2 料液比对杨树芽总黄酮提取率的影响 Fig. 2 Effect of solid-to-liquid ratio on the extraction rate of total flavonoids from poplar buds |
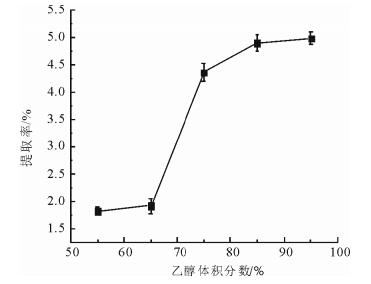
固定料液比(1:10,g/mL)和提取时间(1.5h), 本文考察了乙醇浓度对杨树芽总黄酮提取率的影响。结果如图 3所示, 随着乙醇浓度的增加, 提取率呈递增趋势。当乙醇浓度大于85%时, 提取率增幅较小。这可能与杨树芽中黄酮类化合物的剂性有关。已有研究表明, 杨树芽富含黄酮类物质[22], 其中一些平面性强的分子, 因分子间排列紧凑, 引力较大, 故难溶于水, 易溶于有机溶剂。考虑到乙醇浓度过高会使杨树芽中的一些极性较小的物质如脂溶性色素等容易溶出[21], 因而采用体积分数为85%的乙醇提取杨树芽中的黄酮类化合物比较适宜。
|
图 3 不同浓度乙醇对杨树芽总黄酮提取率的影响 Fig. 3 Effect of different concentrations of ethanol on the extraction rate of total flavonoids from poplar buds |
响应面分析法是将一个体系的响应作为一个或多个因素的函数, 通过图形的方式将此函数关系显现, 以方便实验人员选择试验设计中的最优条件。响应面试验设计及结果见表 3。
|
|
表 3 响应面实验设计及结果 Tab. 3 Experimental design and results for RSM |
利用Design-Expert 8.0.6软件对表 3数据进行回归拟合, 得到该模型方差分析结果, 见表 4。对表 4的数据进行回归拟合, 得到如下回归方程:
|
|
表 4 回归模型方差分析 Tab. 4 Analysis of variance of regression model |
从表 4方差分析可以看出, 该模型回归极显著(P < 0.000 1), 失拟项不显著(P=0.148 8>0.05), 说明该模型符合标准; R2为0.989 9, 说明杨树芽总黄酮提取率的实际实验值与理想预测实验值之间有较好的拟合度。该模型可用于推测提取率的实际情况。
从表 4回归系数检验结果可知, 在回归方程的一次项中, X2和X3差异极显著(P < 0.01), 表明其对该模型的响应值有极大影响, X1差异显著(0.01 < P < 0.05), 表明其对该模型的响应值有影响,且各因素对杨树芽总黄酮提取率的影响顺序为:X3>X2>X1, 即乙醇浓度>料液比>提取时间。交互项X1X2和X2X3差异极显著(P < 0.01), 二次项差异均极显著(P < 0.01)。
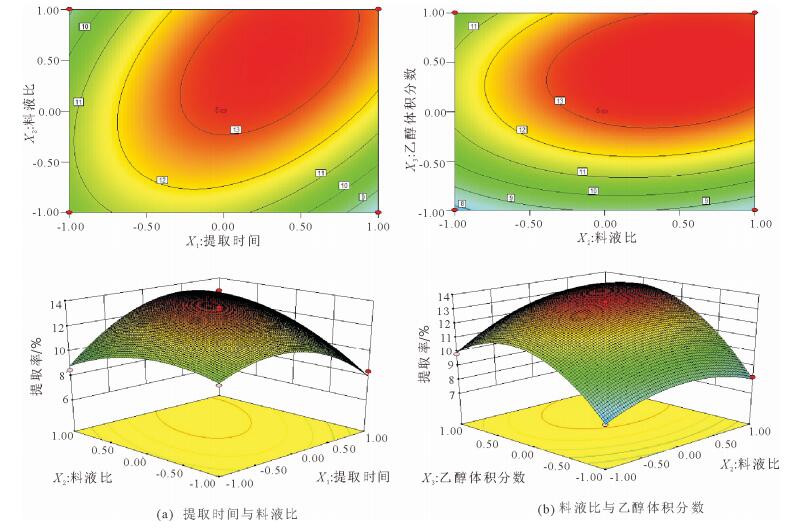
2.2.2 响应面分析结果响应面图形中的曲面斜率越大, 考察因素对响应值影响越大; 等高线图形中的曲线越向中心靠拢, 即形状越相似于椭圆形, 交互作用越显著, 否则则表示交互作用不显著[23]。由图 4可知, 提取时间与料液比的响应面曲面斜率较大, 等高线图形呈椭圆形, 说明其对提取率的交互作用影响极显著(P < 0.01), 且从响应面曲面斜率大小可知, 料液比对提取率的影响更大; 料液比与乙醇体积分数的曲面斜率较大, 等高线图形呈椭圆形, 说明其对提取率影响的交互作用极显著(P < 0.01), 且从响应面曲面斜率大小可知, 乙醇浓度影响作用大于料液比; 与方差分析结果相符。
|
图 4 各因素间交互作用对杨树芽总黄酮提取率影响的响应面和等高线 Fig. 4 Response surface plots showing the effect of interactions among various factors on the total flavonoid extraction rate of poplar bud |
通过响应面软件的数据分析, 得出最佳工艺条件为:提取时间2.16 h、料液比1:16.31 (g/mL)、乙醇体积分数86.26%, 杨树芽总黄酮提取率的预测值为13.00%。为了验证该模型的可靠性, 对得到的工艺条件进行实验验证, 考虑到各方面条件, 将其调整为:提取时间2 h、料液比1:16 (g/mL)、乙醇浓度85%, 该条件下实验3次, 得到杨树芽总黄酮提取率均值为13.14%, 接近预测值, 这说明优化得到的杨树芽提取工艺条件可靠, 预测性好, 合理可行。
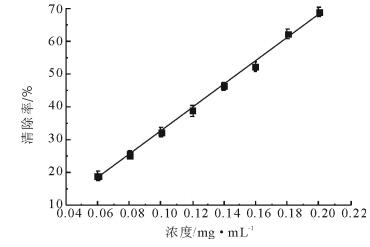
2.3 杨树芽总黄酮的体外抗氧化活性 2.3.1 DPPH·清除能力DPPH·是一种稳定的自由基, 色泽透亮呈深紫色[24], 自由基清除剂可与DPPH·生成稳定的黄色化合物, 体系色泽度与抗氧化剂的供氢能力有关[25-27]。DPPH·清除率与抗氧化能力呈正相关。如图 5所示, 在一定范围内, 杨树芽提取物对DPPH·的清除率与质量浓度有一定的量效关系, 浓度不断增加的过程中, 清除能力也增加。经计算, 杨树芽提取物清除DPPH·的IC50值是0.15 mg/mL, Vc的IC50值是0.023 mg/mL, IC50值越低, 对应物质的抗氧化活性就越强。结果表明,杨树芽提取物对DPPH·有较好的清除能力。
|
图 5 DPPH·清除能力 Fig. 5 The DPPH·scavenging ability |
FRAP法测定还原力的原理是在pH < 7的环境下, 抗氧化物可还原铁离子-三吡啶基三嗪(Fe3+-TPTZ), 得到蓝色的Fe2+-TPTZ, 随后在593 nm处测定吸光度即可通过计算得到样品的还原力。以Trolox(水溶性抗氧化剂)作为标准品与杨树芽提取物进行比较, 可评价杨树芽提取物的总抗氧化活性。由实验结果可知, 杨树芽提取物的总抗氧化能力为152.1 g Trolox/kg, 表明其具有较强抗氧化活性。
2.3.3 Fe2+络合力Ferrozine与Fe2+反应可生成蓝色络合物, 而抗氧化剂与Fe2+可生成无色络合产物, 因此可将溶液色泽度作为抗氧化剂浓度的一种评价方式。抗氧化剂浓度越大, 络合力越强时, 体系的蓝色越浅。以Na2EDTA为标准, 比较样品的络合力[28]。本实验的研究结果表明杨树芽提取物具有络合Fe2+的能力, 络合力为271.03 g Na2EDTA/kg。这说明杨树芽提取物具有很好的Fe2+络合力。
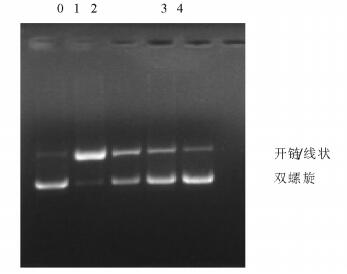
2.3.4 OH·介导的DNA链氧化损伤的保护作用模型组:质粒DNA+H2O2+FeSO4; 实验组:质粒DNA+H2O2+FeSO4+杨树芽提取物(S1-S3)。
在一定场强下, DNA分子的迁移速率与其自身的大小和构型有一定关系, 质粒DNA在通常情况下为双螺旋结构(0号泳道), 移动较快, 当受损后, DNA可能变为开环或线性结构, 条带移动较慢。OH·对pBR322质粒DNA损伤程度的不同, 直观反映的便是双螺旋在3种构象中的比例, 双螺旋结构比例越大, 则OH·对DNA的氧化损伤程度越小[29, 30]。本文结果如图 6,5所示, 在H2O2和FeSO4的存在下, 空白组中的1.95%DNA转化为开链或线状, 而模型组中的68.77%DNA转化为开链或线状, 高出空白对照组约35倍。S1,S2,S3中分别是不同浓度的杨树芽提取物, 可得出,杨树芽提取物对pBR322DNA的氧化损伤具有保护作用。随着杨树芽提取物浓度的增加, pBR322质粒DNA的双螺旋结构从40.69%增加至94.42%, 最高可保护94.42%的DNA免受氧化应激损伤, 说明杨树芽提取物对OH·介导DNA氧化损伤具有显著的保护作用。这可能与杨树芽总黄酮提取物对过渡金属亚铁离子有较强的络合能力有关, 也可能与杨树芽提取物中黄酮类化合物对OH·的清除作用有关, 其机理有待进一步深入研究。
|
注:0号泳道0.5 μgpBR322质粒DNA; 1号泳道0.5 μg pBR322质粒DNA+1 μL1%H2O2+1 μL1.0mMFeSO4; 2-4号泳道0.5 μg pBR322质粒DNA+1 μL1%H2O2+1 μL1.0mMFeSO4+4 μL浓度分别为1,5,15 μg/mL杨树芽提取物。 图 6 杨树芽提取物对OH·介导pBR322DNA链氧化损伤的保护作用 Fig. 6 Protective effect of poplar bud extract on hydroxyl radical-induced cleavage of pBR322 plasmid DNA |
本研究通过热回流提取方法, 以总黄酮提取率和抗氧化活性为考察指标, 在单因素实验基础上, 利用响应面方法优化了杨树芽总黄酮的热回流提取工艺, 得出杨树芽总黄酮的最佳提取工艺为:提取时间2 h、料液比1:16 (g/mL)、乙醇体积分数85%, 该条件下杨树芽总黄酮的提取率为13.14%。体外抗氧化实验结果表明, 杨树芽提取物不仅可以有效地清除自由基, 对过渡金属Fe2+离子也有较强的络合能力, 杨树芽提取物对OH·介导pBR322DNA氧化损伤也有显著的的保护作用。本文的研究结果为杨树芽生物资源的开发利用提供了依据。
|
|
表 5 杨树芽提取物对OH·介导pBR322DNA链氧化损伤的保护作用 Tab. 5 Protective effects of poplar bud extract on hydroxyl radical-induced pBR322DNA oxidative damage |
| [1] |
BANKOVA V, POPOVA M, TRUSHEVA B. Propolis volatile compounds: Chemical diversity and biological activity: A review[J]. Chemistry Central Journal, 2014, 8(1): 1-8. DOI:10.1186/1752-153X-8-1 |
| [2] |
Wu Y W, Sun S Q, Zhao J, et al. Rapid discrimination of extracts of Chinese propolis and poplar buds by FT-IR and 2D IR correlation spectroscopy[J]. Journal of Molecular Structure, 2008, s 883-884(1): 48-54. |
| [3] |
WILSON M B, SPIVAK M, HEGEMAN A D, et al. Metabolomics reveals the origins of antimicrobial plant resins collected by Honey Bees[J]. Plos One, 2013, 8(10): e77512. DOI:10.1371/journal.pone.0077512 |
| [4] |
胡浩, 董捷, 张红城, 等. 工蜂采集蜂胶的行为观察及胶源植物的研究[J]. 食品科学, 2014, 35(15): 54-58. DOI:10.7506/spkx1002-6630-201415011 |
| [5] |
TORETI V C, SATO H H, PASTORE G M, et al. Recent progress of propolis for its biological and chemical compositions and its botanical origin[J]. Evid Based Complement Alternat Med, 2013(1): 69, 73-90. |
| [6] |
BURDOCK G A. Review of the biological properties and toxicity of bee propolis (propolis)[J]. Food and Chemical Toxicology, 1998, 36(4): 347-363. DOI:10.1016/S0278-6915(97)00145-2 |
| [7] |
刘长龙, 李海涛. 杨树芽提取物体外抗氧化活性及抗DNA损伤作用[J]. 现代中药研究与实践, 2014, 28(2): 37-40. |
| [8] |
范文, 伊爱芹, 陈媛梅. 杨树芽和芽胶中化学成分的分析[J]. 林业工程学报, 2009, 23(1): 32-35. |
| [9] |
曹炜, 符军放, 索志荣, 等. 蜂胶与杨树芽提取物成分的比较研究[J]. 食品与发酵工业, 2007, 33(7): 162-166. |
| [10] |
KUS P, JERKOVIC I, JAKOVLJEVIC M, et al. Extraction of bioactive phenolics from black poplar (Populus nigra L.) buds by supercritical CO2 and its optimization by response surface methodology[J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 152: 128-136. DOI:10.1016/j.jpba.2018.01.046 |
| [11] |
MUNOZ C C. Usos medicinales del chopo negro (Populus nigra L.)[J]. Medicina Naturista, 2013, 7: 99-115. |
| [12] |
DUDONNE S, POUPARD P, COUTIERE P, et al. Phenolic composition and antioxidant properties of Poplar Bud (Populus nigra) Extract: Individual antioxidant contribution of phenolics and transcriptional effect on skin aging[J]. Journal of Agricultural and Food Chemistry, 2011, 59(9): 4527-4536. DOI:10.1021/jf104791t |
| [13] |
BURDOCK G A. Review of the biological properties and toxicity of bee propolis (propolis)[J]. Food & Chemical Toxicology, 1998, 36(4): 347-363. |
| [14] |
李骄, 郑光耀, 李海涛. 杨树芽提取物对实验性胃溃疡的防治作用[J]. 现代中药研究与实践, 2012, 26(3): 36-39. |
| [15] |
孙丽萍, 田文礼, 朱晓丽, 等. 聚酰胺-UV法检测蜂花粉总黄酮的研究[J]. 中国蜂业, 2006, 57(8): 8-10. DOI:10.3969/j.issn.0412-4367.2006.08.002 |
| [16] |
HAOAN ZHAO, NI CHENG, LIANG He, et al. Antioxidant and hepatoprotective effects of A. cerana honey against acute alcohol-induced liver damage in mice[J]. Food Research International, 2017, 101: 35-44. DOI:10.1016/j.foodres.2017.08.014 |
| [17] |
马士巧, 马海乐. 黑蜂蜂胶不同极性提取物的体外抗氧化活性[J]. 中国食品学报, 2016, 16(8): 54-55. |
| [18] |
ZHANG X, GUO Y, WANG C, et al. Phenolic compounds from origanum vulgare and their antioxidant and antiviral activities[J]. Food Chemistry, 2014, 152(2): 300-306. |
| [19] |
RAJAPAKSE N, MENDIS E, JUND W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce andits antioxidant properties[J]. Food Research International, 2005, 38(2): 175-182. DOI:10.1016/j.foodres.2004.10.002 |
| [20] |
AMADOU I, LE G W, AMZA T, et al. Purification and characterization of foxtail millet-derived peptides with antioxidant and antimicrobial activities[J]. Food Research International, 2013, 51(1): 422-428. DOI:10.1016/j.foodres.2012.12.045 |
| [21] |
仇燕, 仇彦博. 柚皮总黄酮超声波辅助提取工艺的研究[J]. 河北科技大学学报, 2010, 31(4): 330-333. |
| [22] |
王欣, 王强, 徐国钧, 等. 杨属植物化学成分和药理作用的研究进展[J]. 天然产物研究与开发, 1999, 11(1): 65-74. |
| [23] |
王海燕, 李睿, 曾秀, 等. 响应面优化超声波提取桑叶槲皮素工艺[J]. 食品科学, 2014, 35(22): 56-62. DOI:10.7506/spkx1002-6630-201422011 |
| [24] |
CHEN R, JIN C, TONG Z, et al. Optimization extraction, characterization and antioxidant activities of pectic polysaccharide from tangerine peels[J]. Carbohydrate Polymers, 2016, 136(3): 187-97. |
| [25] |
BONDET V, BRAND-WILLIAMS W, BERSET C. Kinetics and mechanisms of antioxidant activity using the DPPH·free radical method[J]. LWT-Food Science and Technology, 1997, 30(6): 609-615. DOI:10.1006/fstl.1997.0240 |
| [26] |
ES-SAFI N E, KOLLMANN A, KHLIFIC S, et al. Antioxidative effect of compounds isolated from Globularia alypum L. structure-activity relationship[J]. LWT-Food Science and Technology, 2007, 40(7): 1246-1252. DOI:10.1016/j.lwt.2006.08.019 |
| [27] |
林芮昀. 迷迭香精油的抗氧化性研究[J]. 化工管理, 2018, 1(3): 82-83. DOI:10.3969/j.issn.1008-4800.2018.03.061 |
| [28] |
JR M E, KANDASWAMI C, THEOHARIDES T C. The effects of plant flavonoids on mammalian cells: Implications for inflammation, heart disease, and cancer[J]. Pharmacological Reviews, 2000, 52(4): 673-751. |
| [29] |
程妮.蜂蜜植物源鉴别新方法及其保肝活性研究[D].西安: 西北大学, 2012: 54-58. http://cdmd.cnki.com.cn/Article/CDMD-10697-1016054916.htm
|
| [30] |
图尔贡·艾尔肯, 迪丽努尔·塔力甫, 邵龙义, 等. 极干旱区大气PM 2.5对质粒DNA的氧化性损伤研究[J]. 生态环境学报, 2018, 27(4): 730-735. |
 2018, Vol. 48
2018, Vol. 48
