人类活动产生大量氯氟烃等污染气体使臭氧层受到破坏, 导致地表UV-B辐射增强, 对植物的生长发育、次生代谢产生多方面影响[1], 且该影响具有累积效应, 进而使药材质量发生改变[2]。夏枯草(Prunella vulgaris L.)中主要含有黄酮、有机酸和三萜类成分[3-4], 具有抗炎、抗菌、抗病毒、抗肿瘤、降血压等活性[5-6], 黄酮类主要成分为芦丁、金丝桃苷、槲皮素、木犀草素、山奈酚, 有机酸类主要成分为迷迭香酸、咖啡酸, 三萜类主要成分为齐墩果酸、熊果酸。研究发现, 增强UV-B辐射对药用植物生理生化和次生代谢会普遍产生影响[7], 但夏枯草在该方面的研究还未见报道。因此本文以夏枯草幼苗为研究对象, 考察不同强度UV-B辐射对其生理指标和有效成分的影响, 旨在为探索夏枯草优质高产的规范化种植提供资料。
1 仪器与材料 1.1 仪器LC-20AT高效液相色谱仪(日本SHIMADAZU公司); U-3310紫外-可见分光光度计(日本日立公司); 双通道紫外辐射计(北京师范大学光电仪器厂); 40 W中波紫外灯(北京电光源研究所); 可调式灯架(自制); KQ2200DA型数控超声波清洗器(昆山市超声仪器有限公司); HC-3018高速离心机(科大创新股份有限公司); Hcentrifuse5810 R高速冷冻离心机(德国艾本德公司); DZF-6050型真空干燥箱(上海博迅实业有限公司); FA2004型万分之一电子天平(上海良平仪器)。
1.2 试药迷迭香酸(批号:111871-201203)、咖啡酸(批号:110885-200102)、山奈酚(批号:110861-201310)、金丝桃苷(批号:1521-200202)、木犀草素(批号:11520-200504)、芦丁(批号:100080-200707)、槲皮素(批号:100081-200907)、熊果酸(批号:110742-201203)和齐墩果酸(批号:110709-201206),对照品购自于中国食品药品检定研究院, 甲醇为色谱纯(美国Fisher公司); 蒸馏水; 其他试剂均为分析纯。
夏枯草种子2014年购于陕西商州, 经西北大学房敏峰鉴定为唇形科植物夏枯草Prunella vulgaris L.的种子。当年开春种植于西北大学种植园大棚中(2014年4月27日), 该棚顶对太阳可见光波辐射透过率在80 %以上, 棚内外温差±5℃, 模拟大田条件。选择长势一致的幼苗为待处理材料。新鲜材料用于生理指标的测定; 干燥后材料用于化学成分含量测定(植株105 ℃杀青20 min, 80 ℃烘干至恒重, 粉碎, 过2号筛, 保存于干燥器中备用。)
2 实验方法 2.1 增强UV-B辐射的处理方法待夏枯草幼苗长至6~8片真叶时, 进行UV-B辐射处理, 40 W中波紫外灯管模拟UV-B辐射增加, 双通道紫外辐射计测297 nm处的辐射强度, 实验分为高强度UV-B辐射组(强度为15.8 μW/cm2)、低强度UV-B辐射组(强度为7.2 μW/cm2)、空白对照组(自然条件下), 分别记作UV-B++,UV-B+,CK。每日9:30~17:30进行辐射处理, 分别于处理第0 d,10 d,20 d,30 d,40 d,50 d,60 d进行各指标测定与样品采集, 整个UV-B增强处理时间为60 d。
2.2 生理指标测定紫外吸收物、花青素含量测定分别参考Teklemariam[8]法、Mancinelli[9]法; 光合色素含量测定参考Wellburn[10]法; 过氧化氢酶(CAT)、过氧化物酶(POD)活性测定参考Dhindsa的愈创木酚法[11]。
2.3 7种黄酮及有机酸类成分测定 2.3.1 对照品溶液的制备取各对照品适量, 精密称定, 分别制备500 μg/mL迷迭香酸、150 μg/mL咖啡酸、200 μg/mL芦丁、300 μg/mL槲皮素、200 μg/mL金丝桃苷、250 μg/mL木犀草素、250 μg/mL山奈酚甲醇溶液, 4℃下保存。
2.3.2 供试品溶液的制备取夏枯草样品干燥粉末约1 g, 精密称定, 置于具塞锥形瓶中, 精密加入80 %(体积分数)甲醇50 mL, 超声处理(300W, 70kHz) 40 min, 滤过, 滤液蒸干, 残渣加5 mL甲醇溶解, 0.45 μm微孔滤膜滤过, 4 ℃下保存。
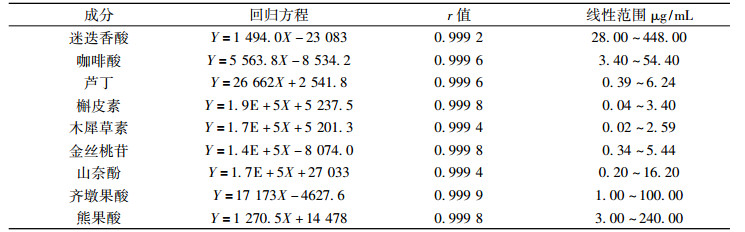
2.3.3 色谱条件依利特Hypersil BDS C18 (250 mm×4.6 mm, 5 μm); 流动相乙腈-0.01 %磷酸水溶液, 洗脱梯度(0~5 min, 体积分数为10 %乙腈; 5~70 min, 体积分数为55 %乙腈); 流速0.8 mL/min; 柱温30 ℃; 检测波长360 nm; 进样量10 μL。结果见图 1。
|
1咖啡酸;2芦丁;3金丝桃苷;4迷迭香酸;5槲皮素;6山奈酚;7木犀草素 图 1 夏枯草中7种黄酮和有机酸类成分的混标(A)及样品(B)色谱图 Fig. 1 HPLC chromatograms of 7 kinds flavonoids and phenolic acids of standerd(A) and sample(B) in Prunella vulgaris L |
取各对照品适量, 精密称定, 分别制备200 μg/mL齐墩果酸和280 μg/mL熊果酸对照品甲醇溶液, 4℃下保存。
2.4.2 供试品溶液的制备同2.3.2项下方法。
2.4.3 色谱条件依利特Hypersil BDS C18 (250 mm×4.6 mm, 5 μm); 流动相为甲醇-0.03 %磷酸水(84 %甲醇); 流速0.8 mL/min; 柱温20 ℃; 检测波长210 nm; 进样量10 μL。见图 2。

|
1熊果酸; 2齐墩果酸 图 2 夏枯草中2种三萜皂苷成分的混标(A)及样品(B)色谱图 Fig. 2 HPLC chromatograms of 2 kinds of triterpenoid saponins of standerd(A) and sample(B) in Prunella vulgaris L |
利用Excel 2010软件对实验数据进行统计, 用SPSS 20.0软件对结果进行方差分析, 使用Origin 8.5软件作图。
3 结果与分析 3.1 有效成分测定方法学考察结果 3.1.1 线性关系将9种成分对照品稀释成系列浓度并进行测定, 考察线性关系, 结果如表 1。
|
|
表 1 线性关系考察结果 Tab. 1 The results of linear relationship investigation |
按上述制备供试品溶液方法制备夏枯草30 d样品溶液, 各5份, 在拟定色谱条件下测定, 9种成分含量测定结果RSD(%)均小于2%。
3.1.3 精密度精密吸取夏枯草30 d样品溶液10 μL, 按拟定色谱条件连续进样5次, 9种有效成分峰面积的RSD(%)均小于2%。
3.1.4 稳定性取夏枯草样品30 d溶液分别在0 h,2 h,4 h,6 h,8 h,10 h,12 h进样10 μL测定, 得样品溶液峰面积RSD(%)均小于2%。
3.1.5 加样回收率精密称定夏枯草30 d样品, 共9组每组各5份, 精密加入9种对照品溶液, 按上述供试品溶液制备方法制备待测溶液, 在拟定色谱条件下进样分析, 记录峰面积测定回收率, 得9种有效成分的加样回收率均大于96%。
3.2 夏枯草相关生理指标对增强UV-B辐射的动态响应 3.2.1 增强UV-B辐射对夏枯草光合色素的影响叶绿素与类胡萝素是参与光合作用中光能吸收、传递和转化的两大重要光合色素, 增强UV-B辐射对其含量影响结果见图 3。

|
图 3 增强UV-B辐射对夏枯草光合色素含量的影响(x±s, n=3) Fig. 3 Effects of UV-B radiation enhanced on photosynthetic pigments content in leaves of Prunella vulgaris L. (x±s, n=3) |
由图 3可知, UV-B+与UV-B++组对叶绿素a含量影响呈相反趋势, 0~10 d时UV-B+组显著(P<0.01)高于CK组, 之后均低于CK组, UV-B++组仅0~10 d显著低于CK组, 之后均高于CK组; 整个处理周期中, 高、低强度UV-B辐射均使类胡萝卜素含量均有极显著(P<0.01)增加, 且增长幅度与辐射强度呈正相关; 相较CK组, 增强UV-B辐射对叶绿素b与总叶绿素含量的影响不显著(P>0.05)。
3.2.2 增强UV-B辐射对夏枯草紫外吸收物质的影响紫外吸收物(包括花青素)主要成分为黄酮类、花青素苷等, 增强UV-B辐射对其含量影响结果见图 4。

|
图 4 增强UV-B辐射对夏枯草花青素与紫外吸收物含量的影响(x±s, n=3) Fig. 4 Effects of UV-B radiation enhanced on UV-absorbing compounds in leaves of Prunella vulgaris L.(x±s, n=3) |
由图 4可知, UV-B+组与CK组相比, 紫外吸收物含量在10 d时UV-B++组含量有极显著(P<0.01)增加; 处理后期(≥40 d), UV-B辐射组中花青素含量逐渐上升且高于CK组, 第50 d UV-B+组高出CK组133.33 %。
3.2.3 增强UV-B辐射对夏枯草抗氧化酶的影响过氧化物酶(POD)与过氧化氢酶(CAT)是一类在植物体内能够利用氧化还原反应将过氧化物转换为另一种低毒或无害物质的抗氧化酶, 增强UV-B辐射对抗氧化酶活性的影响见图 5。

|
图 5 增强UV-B辐射对夏枯草抗氧化酶含量的影响(x±s, n=3) Fig. 5 Effects of UV-B radiation enhanced on POD and CATin leaves of Prunella vulgaris L.(x±s, n=3) |
由图 5可知, 相较CK组, POD酶活力在UV-B辐射下整体显著增加, 且UV-B+与UV-B++组差异不明显, 仅在50 d时UV-B+的影响强度显著强于UV-B++组; CAT酶活力在高强度UV-B长期(≥50 d)处理后有极显著增加, 提示增强UV-B辐射会增加夏枯草抗氧化酶活性, 提升植物体内抗氧化水平。
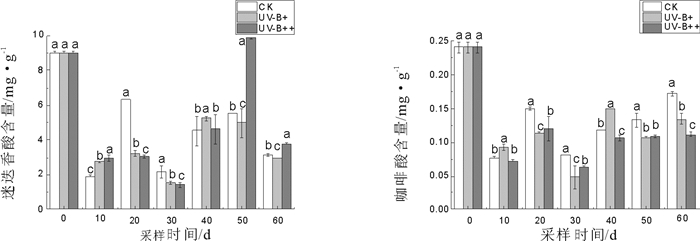
3.3 夏枯草中9种主要有效成分含量对增强UV-B辐射的动态响应 3.3.1 增强UV-B辐射对夏枯草迷迭香酸、咖啡酸成分量的影响2015版《中国药典》规定夏枯草的含量测定项为迷迭香酸, 增强UV-B辐射对2种成分的含量影响见图 6。
|
图 6 增强UV-B辐射夏枯草对迷迭香酸与咖啡酸含量的影响(x±s, n=3) Fig. 6 Effects of UV-B radiation enhanced on rosmarinic acid and caffeic acid content in leaves Prunella vulgaris L.(x±s, n=3) |
图 6显示, 迷迭香酸含量处理至20~30 d, UV-B组显著(P<0.01)低于CK组, 且第20 d, UV-B++组含量极显著(P<0.01)低于CK组133.33 %, 处理至50 d时UV-B++组有极显著增加, 高于CK组81.82 %; 咖啡酸在整个处理周期中, UV-B++组含量整体低于CK组, UV-B+组仅在第40 d显著(P<0.05)高于CK组28 %。提示低强度UV-B处理能在一定时间内促进咖啡酸含量积累, 迷迭香酸含量随处理时间的延长及UV-B辐射强度增强而升高。
3.3.2 增强UV-B辐射对夏枯草5种黄酮类成分含量的影响增强UV-B辐射对5种成分含量的影响见图 7。

|
图 7 增强UV-B辐射对夏枯草黄酮类成分含量的影响(x±s, n=3) Fig. 7 Effects of UV-B radiation Enhanced on flavonoids content in leaves of Prunella vulgaris L. (x±s, n=3) |
由图 7可知, UV-B辐射下的芦丁含量普遍呈下降趋势, 仅在40 d时的UV-B组极显著(P<0.01)高于CK组, 其中UV-B+组含量高出CK组66.67 %。金丝桃苷含量在整个处理期中UV-B组普遍高于CK组, 仅在60 d时UV-B组含量显著低于CK组, 50 d时UV-B++组高出CK组132.25 %。槲皮素、木犀草素、山奈酚含量受UV-B辐射的影响变化相似, 即在整个处理期的一定时间内呈现含量积累的增加:20 d,40 d时槲皮素含量UV-B组高出CK组, UV-B++在20 d高出CK组239.13 %, 40 d时UV-B+组高出CK组198.35 %; 木犀草素的UV-B+组含量在20 d与40 d分别高出CK组381.28 %和395.26 %; 40 d时山奈酚UV-B+组含量极显著(P<0.01)高出CK组613.33 %。
3.3.3 增强UV-B辐射对夏枯草2种三萜类成分含量的影响熊果酸为2010版《中国药典》规定夏枯草的含量测定项, 2种成分在增强UV-B辐射下含量变化见图 8。

|
图 8 增强UV-B辐射对夏枯草三萜类成分含量的影响(x±s, n=3) Fig. 8 Effects of UV-B radiation Enhanced on ursolic acid and oleanolic acid content in leaves of Prunella vulgaris L.(x±s, n=3) |
由图 8可见, 相较CK组与UV-B+组, 在整个处理周期内UV-B++组对齐墩果酸含量增长的影响更为显著, 前40 d时UV-B++组均高于CK组, 10 d时UV-B++组的熊果酸与齐墩果酸含量均极显著(P<0.01)高出CK组, 60 d时二者的UV-B+组含量有极显著(P<0.01)增加, 分别高出CK组498.23 %和695.21 %。
4 讨论研究发现,增强UV-B辐射对植物光合作用会产生显著影响, 增强UV-B辐射的环境下会抑制光系统PSII反应过程, 并破坏叶片中叶绿体片层膜使叶绿素合成受阻[12], 方兴等[13]研究发现增强UV-B辐射后类胡萝卜素含量的增加会有效预防植物叶绿素不受UV-B辐射的损伤。本实验中, 不同强度UV-B辐射均可显著增加夏枯草中类胡萝卜素含量, 叶绿素含量未见有明显降低, 与上述研究结果一致。对于夏枯草幼苗叶片中POD与CAT抗氧化酶的活性, 在受到UV-B辐射增强后有显著提升, Claudio等[14]的研究表明植物本身的抗氧化体系可减轻一定强度UV-B辐射产生的氧化损伤, 减少UV-B辐射对其生长发育的影响, 与李良博等[15]实验中艾草(Artemisia argyi Levl)对UV-B辐射增强的响应结果一致, 可见夏枯草会通过增加抗氧化酶活力清除UV-B辐射对植物产生的活性氧和自由基。研究表明增强UV-B可提高蓝莓中花青素含量[16], 本实验中夏枯草在处理后期叶片中的花青素含量显著增加, 这是因为植物在受到UV-B辐射增强时, 会通过积累花青素类成分吸收部分紫外线使植物免收更大的伤害。
通常酚类、黄酮类含量的增加被认为是植物体内响应UV-B辐射增强的普遍特征之一[17], 本实验中发现, UV-B处理后的夏枯草中有机酸及黄酮类成分含量在一定时间内均有增加, 迷迭香酸、槲皮素、金丝桃苷的增幅更显著。这与刘景玲等[18]的研究结果相一致, 表明夏枯草可通过提高酚类、黄酮类含量, 进而形成一道天然屏障来修复UV-B对植物造成的损伤。此外,许多研究表明UV-B辐射会提高萜类成分的含量, 本实验在处理后期低强度的UV-B辐射会显著增加夏枯草中齐墩果酸与熊果酸含量, 于景华等[19]的研究表明适度增加UV-B辐射可诱导红豆杉(Taxus chinensis var. maitei)中紫杉醇含量的提升, 也验证了上述观点。
植物的抗氧化酶活力是评价自身抗氧化系统的重要指标, 酚类成分作为一种天然抗氧化剂反应植物的抗氧化能力, 研究发现短期UV-B辐射即可快速提升抗氧化酶活性[14], 但次生代谢产物的积累是在长期进化过程中产生。本文中UV-B组的抗氧化酶与酚类成分呈现出近似此消彼长的变化趋势, 且对抗氧化酶的增长更为显著, 这可能与幼苗期处理有关, 是夏枯草在不同发育阶段提高自身适应能力来应对环境胁迫的表现。紫外吸收物质包括酚类、黄酮类和花青素等, 本文7种有机酸及黄酮类成分在增强UV-B辐射后含量变化较大, 但紫外吸收物含量仅在10 d有显著增长, 其他时间无显著增长, 这可能与各有效成分含量的增长时间阶段不同有关, 各成分交错式的变化趋势削弱了紫外吸收物质UV-B组的增加, 导致其含量增长不明显。提示上述成分对增强UV-B辐射响应具有不同的时间选择性, 可为夏枯草药材品质的定向调控提供一定资料。
综上所述, 夏枯草幼苗对UV-B辐射可以产生积极的响应, 适度增强UV-B辐射可调节夏枯草生长, 激活其对UV-B辐射的防御保护机制, 进而促进有效成分积累, 提高药用价值。
| [1] |
徐佳妮, 雷梦琦, 鲁瑞琪, 等. UV-B辐射增强对植物影响的研究进展[J]. 基因组学与应用生物学, 2015, 34(6): 1347-1352. |
| [2] |
吴洋, 房敏峰, 岳明, 等. UV-B辐射对药用植物次生代谢的影响研究进展[J]. 中国中药杂志, 2012, 37(15): 2247-2251. |
| [3] |
GU Xiaojie, LI Youbin, MU Jun, ZHANG Yi. Chemical constituents of Pruenlla vulgaris[J]. J Environ Sci, 2013, 25: 161-163. DOI:10.1016/S1001-0742(14)60648-3 |
| [4] |
CHEUNG Honyeung, ZHANG Qingfeng. Enhanced analysis of triterpenes, flavonoids and phenolic compounds in Prunella vulgaris L. by caplillary zone electrophoresis with the addition of running buffer modifiers[J]. J Chromatogr A, 2008, 1213: 231-238. DOI:10.1016/j.chroma.2008.10.033 |
| [5] |
LI Chao, HUANG Qiang, XIAO Jie, et al. Preparation of Prunella vulgaris polysaccharide-zinc complex and its antiproliferative activity in HepG2 cells[J]. Int J Biol Macromol, 2016, 91: 671-679. DOI:10.1016/j.ijbiomac.2016.06.012 |
| [6] |
严东, 谢嘉驰, 周亚敏, 等. 基于液质联用技术及抗炎与抗氧化活性研究夏枯草茎叶和果穗的替代性[J]. 中国药学杂志, 2016, 51(10): 792-797. |
| [7] |
陈慧泽, 韩榕. 植物响应UV-B辐射的研究进展[J]. 植物学报, 2015, 50(6): 790-801. |
| [8] |
TEKLEMARIAM T, BLAKE T J. Effects of UV-B preconditioning on heat tolerance of cucumber (Cucumis Sativus L.)[J]. Environ Exp Bot, 2003, 50: 169-182. DOI:10.1016/S0098-8472(03)00024-8 |
| [9] |
MANCINELLI A, YANG C, LINDQUIST P, et al. Photocontrol of anthocyanin synthesis: Ⅲ. The action of streptomycin on the synthesis of chlorophyll and anthocyanin[J]. Plant Physiol, 1975, 55: 251-254. DOI:10.1104/pp.55.2.251 |
| [10] |
WELLBURN A. The spectral determination of chlorophyll a and chlorophyll b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution[J]. J Plant Physiol, 1994, 144: 307-313. DOI:10.1016/S0176-1617(11)81192-2 |
| [11] |
DHINDSA R S, PLUMB-DHINDSA P, THORPE T A. Leaf senescence: Correlated with increased levels of membrane permeability and lipid peroxidation, and decreasedlevels of superoxide dismutase and catalase[J]. J Exp Bot, 1981, 32: 93-101. DOI:10.1093/jxb/32.1.93 |
| [12] |
Dobrikova ANELIA G., Apostolova Emilia L.. Damage and protection of the photosynthetic apparatus from UV-B radiation Ⅱ. effect of quercetin at different pH[J]. J Plant Physiol, J2015, 184: 92-105. |
| [13] |
方兴, 钟章成. 增强UV-B辐射和氮对谷子叶光合色素及非酶促保护物质的影响[J]. 生态学报, 2012, 32(23): 7411-7420. |
| [14] |
BLANCHETEAU C I, ACEVEDO P, LOYOLA R, et al. Short-term UV-B radiation affects photosynthetic performance and antioxidant gene expression in highbush blueberry leaves[J]. Plant Physiol. Biochem, 2016, 107: 301-309. DOI:10.1016/j.plaphy.2016.06.019 |
| [15] |
李良博, 张连根, 唐天向, 等. UV-B辐射增强对紫茎泽兰和艾草抗性生理特性的影响[J]. 西北植物学报, 2016, 36(2): 343-352. |
| [16] |
COSTA D, GALVAO A M, PAOLO R E D, et al. Photochemistry of the hemiketal from of anthocyanis and its potential role in plant protectin from UV-B radiation[J]. Tetrahedron, 2015, 71: 3157-3162. DOI:10.1016/j.tet.2014.06.092 |
| [17] |
ALONSO M D C, DIAGO M P, HERAS R T L, et al. Effects of ambient solar UV radiation on grapevine leaf physiology and berry phenolic composition along one entire season under Mediterranean filed conditions[J]. Plant Physiol Biochem, 2016, 109: 374-386. DOI:10.1016/j.plaphy.2016.10.018 |
| [18] |
刘景玲, 齐志鸿, 郝文芳, 等. UV-B辐射和干旱对丹参生长和叶片中酚酸类成分的影响[J]. 生态学报, 2015, 35(14): 4642-4650. |
| [19] |
于景华, 李德文, 庞海河, 等. UV-B辐射对南方红豆杉生活史型和紫杉烷类含量的影响[J]. 生态学报, 2011, 31(1): 75-81. |
 2017, Vol. 47
2017, Vol. 47