乙二醇(Ethylene glycol简称EG)是一种最简单的二元醇, 作为重要的有机化工原料, 被广泛应用于合成聚酯树脂、防冻液、增塑剂、非离子表面活性剂以及涂料油墨等化工产品[1]。乙二醇的主要生产工艺为环氧乙烷水合法[2-4], 针对我国“富煤、缺油、少气”的能源现状, 开发煤基合成气制乙二醇工艺符合我国的实情[5-7], 也符合碳一化工的清洁生产工艺。合成气制备乙二醇主要分为两步[8-9],在第二步反应中, 为了提高DMO的转化率, 通常的方法是过度加氢[10], 但会产生1, 2-丁二醇等副产物, 与乙二醇形成了共沸[2], 使分离提纯乙二醇成为难题。已有的研究报道表明, 二异丁基甲酮与1, 2-丁二醇可以形成共沸[11], 但与乙二醇不互溶。因此, 将二异丁基甲酮作为共沸剂加入到1, 2-丁二醇和乙二醇的混合体系中, 可以实现乙二醇的分离精制。然而二异丁基甲酮+1, 2-丁二醇二元物系的汽液平衡数据很少报道。因此本文采用双循环汽液平衡釜测定了该物系在不同压力下的汽液平衡数据。采用面积检验法对实验数据进行热力学一致性检验, 用Aspen plus对实验数据进行回归关联。其中, 分别选用Wilson, NRTL和UNIQUAC活度系数模型计算了二元交互作用参数及活度系数。最后, 将汽液平衡数据的理论计算值与实验数据进行了比较。
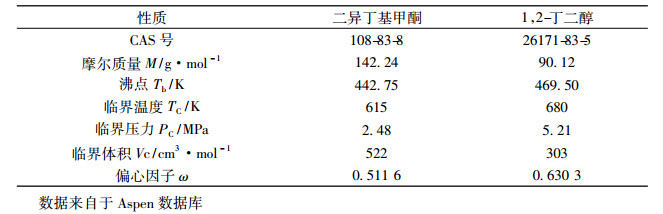
1 实验部分 1.1 实验试剂表 1列出了实验所用试剂的规格和生产厂家的信息。其试剂的纯度均通过气相色谱检验, 其结果亦列于表 1中。色谱结果表明除了二异丁基甲酮(2, 6-二甲基-4-庚酮)之外, 附近又出现了一个峰, 通过与该峰位置的标准曲线对比, 得知为2, 6-二甲基-4-庚酮的同分异构体2, 4-二甲基-6-庚酮, 前者质量分数为75.0%, 后者质量分数为24.0%。已有的研究表明, 该同分异构体对汽液平衡数据测定没有影响[12]。本文之后都用二异丁基甲酮代表 2, 6-二甲基-4-庚酮和2, 4-二甲基-6-庚酮。表 2列出了二异丁基甲酮和1, 2-丁二醇的热力学物性。
|
|
表 1 实验试剂 Tab. 1 Experimental reagents |
|
|
表 2 纯物质的热力学性质 Tab. 2 Physical properties of the pure components |
利用汽液相双循环平衡装置来测定汽液平衡数据, 装置如图 1所示, 其中汽液平衡釜(ZPH-1型)由烟台天一化工有限公司制造。本研究对汽化室进行了改造, 将加热釜换成了三口烧瓶, 加热仪器换为调温磁力搅拌电热套, 这样可以防止暴沸现象发生。
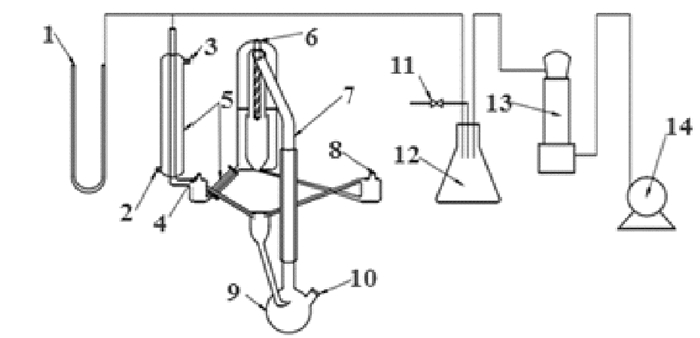
|
1 U型压差计;2冷凝液进口;3冷凝液出口;4汽相取样口;5冷凝器;6热电偶;7提升管;8液相取样口;9加热釜;10注样口;11放空阀;12缓冲灌;13干燥瓶;14真空泵 图 1 实验装置 Fig. 1 Experimental device |
实验过程如下:①将提前配置好的一定量的混合样品加入到汽化室9中, 将系统密封, 保持压力稳定; ②打开冷却水(注意不要开得太大); ③打开电源, 调节加热电压和伴热电压, 加热混合样品; ④混合溶液汽化后, 经汽液相循环1.5~2h, 充分回流(此时体系达到平衡); ⑤分别取出液相和汽相样品5mL; ⑥用气相色谱测定样品的含量。
1.3 分析方法本文采用气相色谱仪(GC 3420A)对汽液相样品中1, 2-丁二醇、二异丁基甲酮进行定量分析, 采用校正后的面积归一化法测定组分含量, 色谱的分析条件如下:
色谱柱:PEG-20M(30m×0.25mm×0.33μm) 载气:氮气
检测器:氢火焰(FID)检测器
柱温:200℃
气化温度:210℃ 检测温度:220℃
进样量:0.5μL 柱前压:0.04MPa
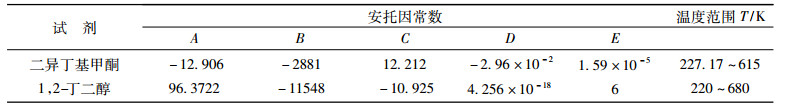
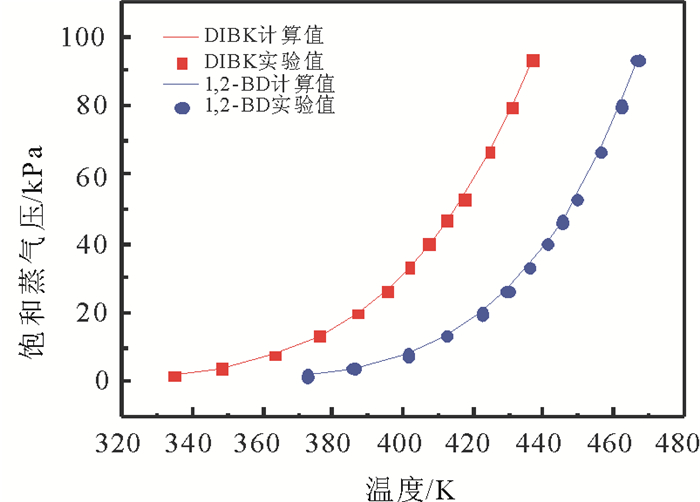
1.4 实验装置可靠性检验为了检验装置的可靠性, 为后期实验作保障, 本文利用此装置测定了二异丁基甲酮和1, 2-丁二醇在不同温度下的饱和蒸气压, 并用安托因方程(1)和(2)计算了对应温度下的饱和蒸气压数据。其中, 二异丁基甲酮采用方程(1), 参数已有报道[13], 1, 2-丁二醇采用方程(2), 安托因常数来自于Aspen数据库, 见表 3。图 2列出了二异丁基甲酮和1, 2-丁二醇的饱和蒸汽压实验值与计算值, 对比表明, 平均相对偏差分别为0.45(二异丁基甲酮)和0.43(1, 2-丁二醇), 误差很小, 实验装置可靠。
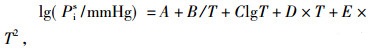
|
(1) |
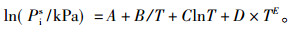
|
(2) |
|
|
表 3 纯物质的安托因常数 Tab. 3 Antoine constants of the pure components |
|
图 2 二异丁基甲酮和1, 2-丁二醇纯组分的饱和蒸气压实验值与计算值对比 Fig. 2 Comparison of experimental and calculated values of saturated vapor pressure for DIBK and 1, 2-BD |
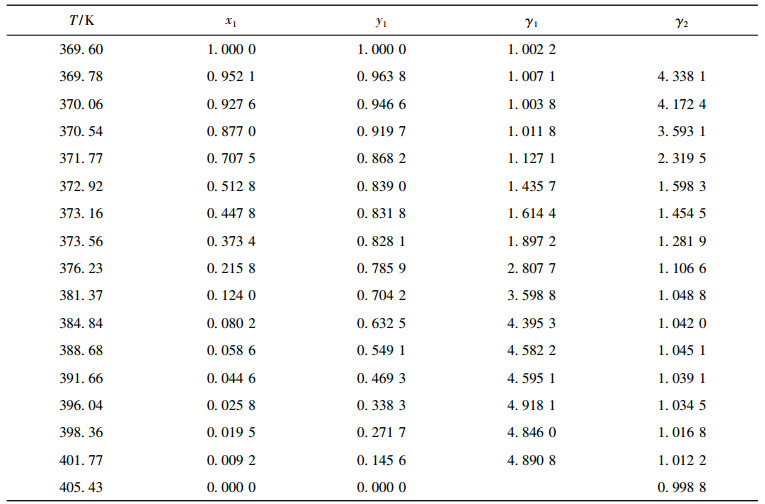
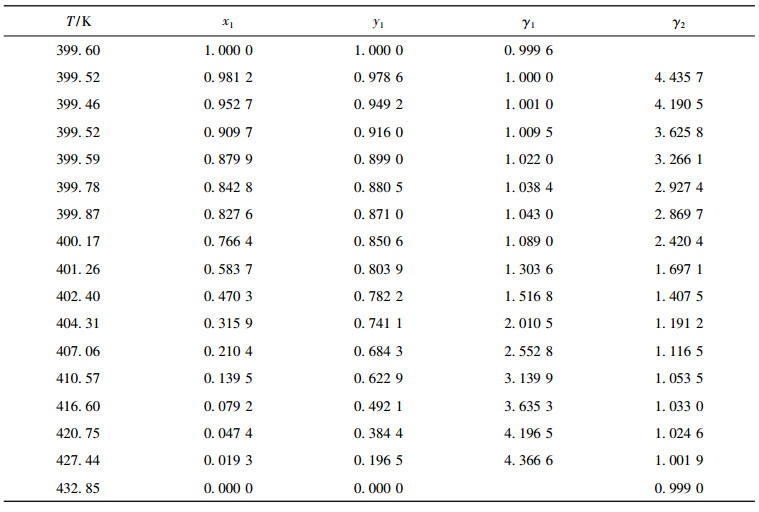
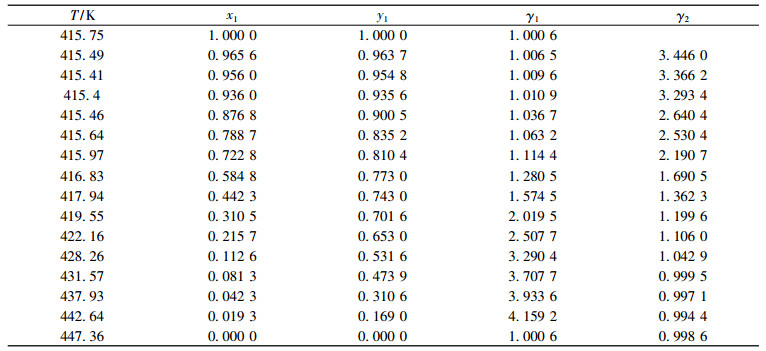
实验测定了二异丁基甲酮+1, 2-丁二醇体系在10kPa, 30kPa, 50kPa的汽液平衡数据, 结果列于表 4~6。低压情况下, 汽相被视为理想气体, 组分活度系数可以表示为:
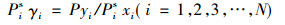
|
(3) |
|
|
表 4 10 kPa下二元体系二异丁基甲酮(1)+1, 2-丁二醇(2)的汽液平衡数据 Tab. 4 Vapor-liquid equilibrium data for binary system DIBK(1)+1, 2-BD(2) at 10 kPa |
|
|
表 5 30 kPa下二元体系二异丁基甲酮(1)+1, 2-丁二醇(2)的汽液平衡数据 Tab. 5 Vapor-liquid equilibrium data for binary system DIBK(1)+1, 2-BD(2) at 30 kPa |
|
|
表 6 50 kPa下二元体系二异丁基甲酮(1)+1, 2-丁二醇(2)的汽液平衡数据 Tab. 6 Vapor-liquid equilibrium data for binary system DIBK(1)+1, 2-BD(2) at 50 kPa |
式中:P代表系统压力, Pa; Pis代表纯组分的饱和蒸气压, Pa; i代表组分; xi代表组分i液相的摩尔分数; yi组分i汽相的摩尔分数, 饱和蒸气压用安托因方程计算。
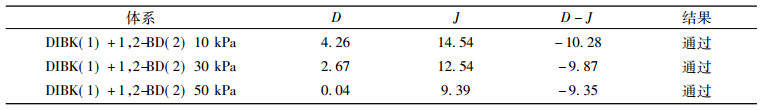
2.2 热力学一致性检验利用面积检验法[14]对实验数据进行热力学一致性检验, 即, 以ln(γ1/γ2)对x1作图, 令:
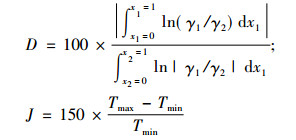
|
(4) |
式中: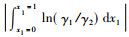
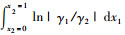
|
|
表 7 热力学一致性检验结果 Tab. 7 Results of thermodynamic consistency test |
分别选用Wilson, NRTL, UNIQUAC 3个活度系数模型[15-18]关联二元汽液平衡数据。
其中Wilson:
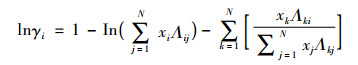
|
(5) |
式中:模型参数
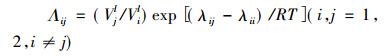
|
也可用式(6)计算
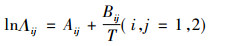
|
(6) |
NRTL:
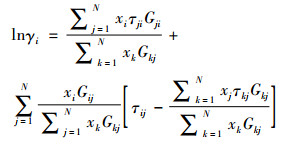
|
(7) |
式中:模型参数
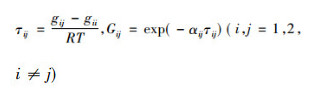
|
也可用式(8)计算
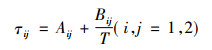
|
(8) |
UNIQUAC:
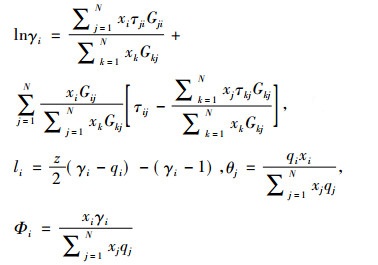
|
(9) |
式中:模型参数
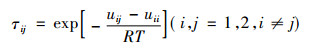
|
也可用式(10)计算
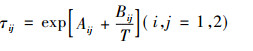
|
(10) |
式中:N表示组分。
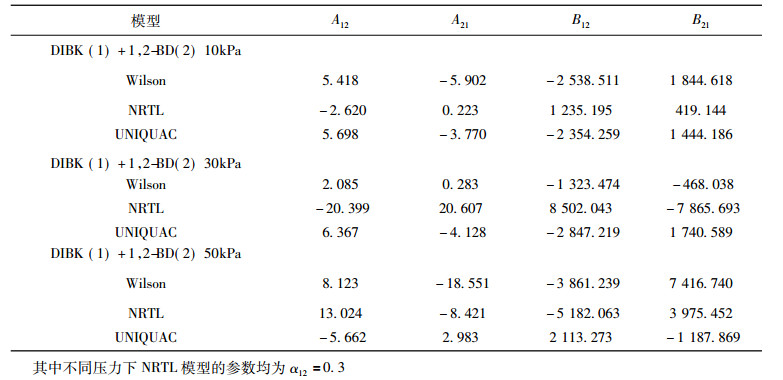
采用Aspen Plus 8.4化工软件回归平衡数据, 3个模型的交互作用参数列于表 8中。二元物系采用最大似然函数法进行汽液平衡计算, 选择目标函数为
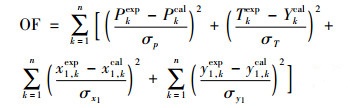
|
(11) |
|
|
表 8 Wilson, NRTL和UNIQUAC活度系数模型的参数 Tab. 8 Parameters of Wilson, NRTL and UNIQUAC activity-coefficient models |
式中:P, T, x1和y1分别为二元体系的压力、温度、液相物质的量分数和汽相物质的量分数,n代表实验数据点数, σ表示各参数的标准偏差, exp代表实验数据, cal代表模拟计算值。
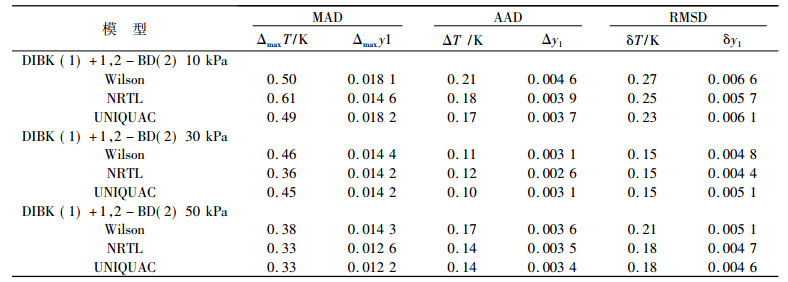
表 9中列出了测定温度和物质的量分数与模型预测值的比较结果, 包含最大绝对偏差MAD、平均绝对偏差AAD[17]和均方根偏差RMSD[18], 其表达式分别为
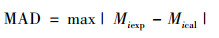
|
(12) |
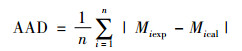
|
(13) |
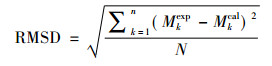
|
(14) |
|
|
表 9 温度物质的量分数实验值与计算值的偏差 Tab. 9 The deviation of temperature and vapor compositions between experimental and calculated values |
式中:M表示温度或汽相物质的量分数, n代表实验数据点数, exp代表实验数据, cal代表模拟计算值。
可以看出, 温度和汽相物质的量分数的最大绝对偏差的最大值分别为0.61K, 0.018 1, 平均绝对偏差分别小于0.21K,0.46%, 均方根偏差分别小于0.27K,0.66%, 可见偏差均不大, 表明所用3个模型适合此二元体系的关联。
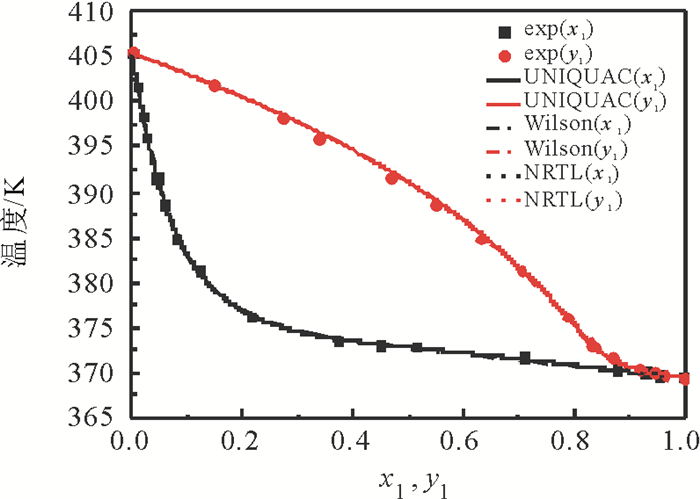
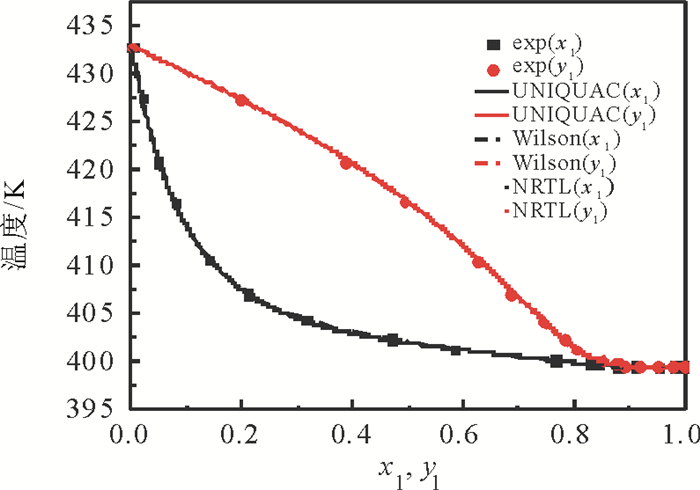
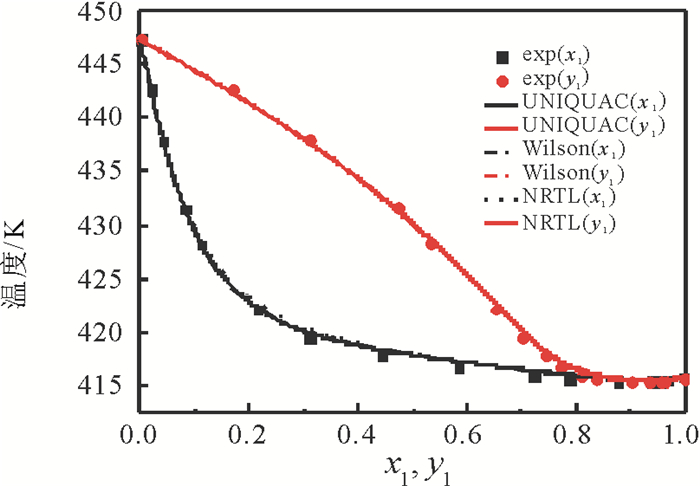
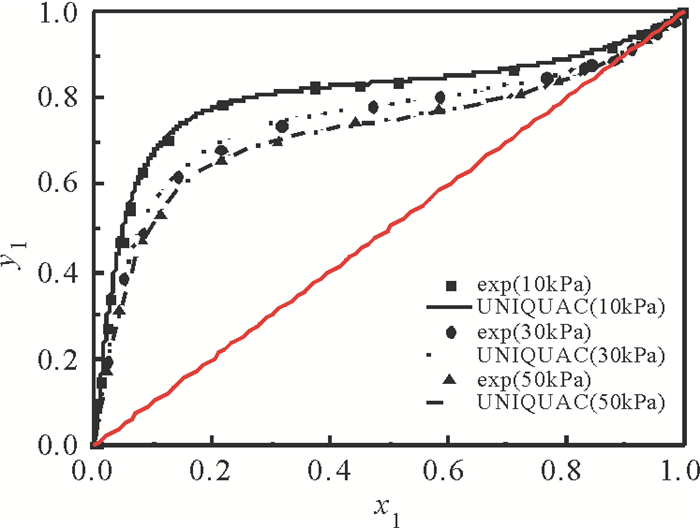
2.4 汽液平衡相图图 3~5列出了利用关联的二异丁基甲酮+1, 2-丁二醇模型参数计算的汽液平衡数据与实验数据。由图看出, 当压力为50 kPa时, 二元体系的共沸点组成(摩尔分数)为:二异丁基甲酮为0.924 8, 共沸温度为415.53K, 当压力为30kPa时, 二异丁基甲酮为0.965 6, 共沸温度399.55K, 而当压力降为10kPa, 不存在共沸现象。二异丁基甲酮+1, 2-丁二醇体系不仅存在共沸现象, 而且共沸组成随压力变化而改变。图 6列出了10kPa, 30kPa, 50kPa条件下二异丁基甲酮+1, 2-丁二醇二元体系的x-y图。可以看出, 随着压力的减小, 平衡曲线离对角线越远, 相对挥发度越大, 表明分离此二元体系越容易。
|
图 3 10 kPa下二异丁基甲酮(1)+1, 2-丁二醇(2)二元体系平衡相图(T-x1-y1) Fig. 3 Equilibrium diagram (T-x1-y1) for the binary system {DIBK(1)+1, 2-BD (2)} at 10 kPa |
|
图 4 30 kPa下二异丁基甲酮(1)+1, 2-丁二醇(2)二元体系平衡相图(T-x1-y1) Fig. 4 Equilibrium diagram (T-x1-y1) for the binary system {DIBK(1)+1, 2-BD (2)} at 30 kPa |
|
图 5 50 kPa下二异丁基甲酮(1)+1, 2-丁二醇(2)二元体系平衡相图(T-x1-y1) Fig. 5 Equilibrium diagram (T-x1-y1) for the binary system {DIBK(1)+1, 2-BD (2)} at 50 kPa |
|
图 6 不同压力下二异丁基甲酮(1)+1, 2-丁二醇(2)二元体系的(y1-x1)图 Fig. 6 The diagram (y1-x1) of the binary system {DIBK (1)+1, 2-BD(2)} at different pressures |
用汽液相双循环平衡装置测定了10, 30, 50kPa条件下二异丁基甲酮+1, 2-丁二醇二元体系的等压汽液平衡数据, 实验结果表明, 二异丁基甲酮+1, 2-丁二醇存在共沸点, 且共沸点随着压力的变化而改变, 二异丁基甲酮的含量随压力的减小而增大, 当压力低至10kPa时, 不存在共沸现象, 实验数据很好的通过了热力学一致性检验。
利用Aspen模拟软件分别关联了Wilson, NRTL和UNIQUAC活度系数模型的二元交互作用参数, 通过模拟计算, 理论值与实验数据基本一致, 表明Wilson, NRTL和UNIQUAC活度系数模型适用于二异丁基甲酮+1, 2-丁二醇二元体系。
本文测定的实验数据与理论模拟的结果为乙二醇和1, 2-丁二醇体系的分离提供了重要的参考。
| [1] |
YUE H, ZHAO Y, MA X, et al. Ethylene glycol: properties, synthesis, and applications[J]. Chemical Society Reviews, 2012, 41(41): 4218-4244. |
| [2] |
崔小明. 我国乙二醇行业现状及发展前景分析[J]. 石油化工技术与经济, 2013, 29(5): 28-33. DOI:10.3969/j.issn.1674-1099.2013.05.006 |
| [3] |
何文军, 费泰康, 王嘉华, 等. 环氧乙烷直接催化水合制乙二醇技术经济性探讨[J]. 化工进展, 2016, 35(7): 2268-2273. |
| [4] |
黄格省, 李振宇, 李顶杰, 等. 石油和煤生产乙二醇技术现状及产业前景分析[J]. 化工进展, 2011, 30(7): 1461-1465. |
| [5] |
李芸. 中国煤制乙二醇的现状及发展[J]. 化学工程与装备, 2015(5): 181-182. |
| [6] |
李清, 蒋美芬. 煤制乙二醇生产工艺技术进展及技术经济分析[J]. 上海化工, 2016, 41(3): 23-31. DOI:10.3969/j.issn.1004-017X.2016.03.007 |
| [7] |
杨帅龙. 煤制乙二醇进展及问题分析[J]. 河南化工, 2016, 33(1): 7-9. DOI:10.3969/j.issn.1003-3467.2016.01.004 |
| [8] |
赵晖. 草酸二甲酯气相催化加氢合成乙二醇研究[J]. 科技资讯, 2015, 13(4): 90-90. DOI:10.3969/j.issn.1672-3791.2015.04.068 |
| [9] |
杨亚玲.草酸二甲酯加氢合成乙二醇过程的研究[D].上海: 华东理工大学, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1650858
|
| [10] |
文峰, 黄维捷, 肖文德. 草酸二甲酯加氢催化剂Cu/SiO2的制备研究[J]. 广东化工, 2008, 35(4): 5-8. DOI:10.3969/j.issn.1007-1865.2008.04.003 |
| [11] |
BERG L. Separation of 2, 3-butanediol from propylene glycol by azeotropic distillation: US, 4935102 [P]. 1990-06-19.
|
| [12] |
ÇEHRELI S, BASHOĜLU B. Phase equilibrium of water+formic acid+acetic acid+solvent (amyl acetate or diisobutyl ketone or diisopropyl ether) quaternary liquid systems[J]. Journal of Chemical & Engineering Data, 2008, 53(7): 1607-1611. |
| [13] |
YAWS C L. Physical, Thermodynamics, Environmental Transport, Safety and Health Related Properties for Organic and Inorganic Chemicals[M]. New York: McGraw-Hill Handbooks, 1999.
|
| [14] |
HERINGTON E F G. Tests for consistency of experimental isobaric vapor liquid equilibrium data[J]. Journal of the American Chemical Society, 1951, 37: 457-470. |
| [15] |
WILSON G M. Vapor-liquid equilibrium. XI. A new expression for the excess free energy of mixing[J]. Journal of the American Chemical Society, 1964, 86(2): 127-130. DOI:10.1021/ja01056a002 |
| [16] |
RENON H, PRAUSNITZ J M. Local compositions in thermodynamic excess functions for liquid mixtures[J]. Aiche Journal, 1968, 14(1): 135-144. |
| [17] |
ABRAMS D S, PRAUSNITZ J M. Statistical thermodynamics of liquid mixtures: A new expression for the excess gibbs free energy of partly or completely miscible systems[J]. Aiche Journal, 1975, 21(1): 116-128. |
| [18] |
JONGMANS M T G, LONDOÑO A, SCHUUR B, et al. Isobaric low-pressure vapor-liquid equilibrium data of the system monochloroacetic acid+dichloroacetic acid+diethylene glycol dipentyl ether and the constituent binary systems[J]. Fluid Phase Equilibria, 2012, 334: 15-21. DOI:10.1016/j.fluid.2012.07.027 |
| [19] |
LLADOSA E, MARTÍNEZ N F, MONTÓN J B, et al. Measurements and correlation of vapour-liquid equilibria of 2-butanone and hydrocarbons binary systems at two different pressures[J]. Fluid Phase Equilibria, 2011, 307(1): 24-29. DOI:10.1016/j.fluid.2011.05.004 |
| [20] |
ZHANG L, XU D, GAO J, et al. Measurements and correlations of density, viscosity, and vapour-liquid equilibrium for fluoro alcohols[J]. Journal of Chemical Thermodynamics, 2016, 102: 155-163. DOI:10.1016/j.jct.2016.07.011 |
 2017, Vol. 47
2017, Vol. 47