薄荷酯已广泛应用于食品、医药、日化和烟草等领域[1-5]。传统合成薄荷酯的方法是通过强酸催化合成,但是酸具有强腐蚀性和高污染等缺陷。近年来,随着研究不断深入,相继发展了超强固体酸[5-6]、对甲苯磺酸[7]、吡啶[8-9]、N, N-二甲基- 4-氨基吡啶[10-13]、离子液[14]和酶[15-17]等催化合成薄荷酯的方法。然而, 以上大部分方法反应温度较高、操作复杂, 或反应时间较长且产生大量的副产物。因此,有必要发展一种反应条件温和、毒性小和操作简单的方法来实现薄荷酯的合成。
在有机合成中, Vilsmeier试剂是一种高效的甲酰化试剂。Vilsmeier试剂一直受到极大的关注且在不同的反应进行了广泛的研究[18-25]。同时,本课题组使用Vilsmeier试剂发展一种简洁高效的促进脱水反应的方法, 成功实现了醇的亲核取代反应(图 1(A))[25]。该反应产生的副产物DMAc和HCl均较易除去且毒性小, 从而反应后处理更加简单。尤其在该反应中, Vilsmeier试剂在室温下就可以很容易通过二取代酰胺原位生成得到(图 1(B)),提供了一个全新高效的合成方法。
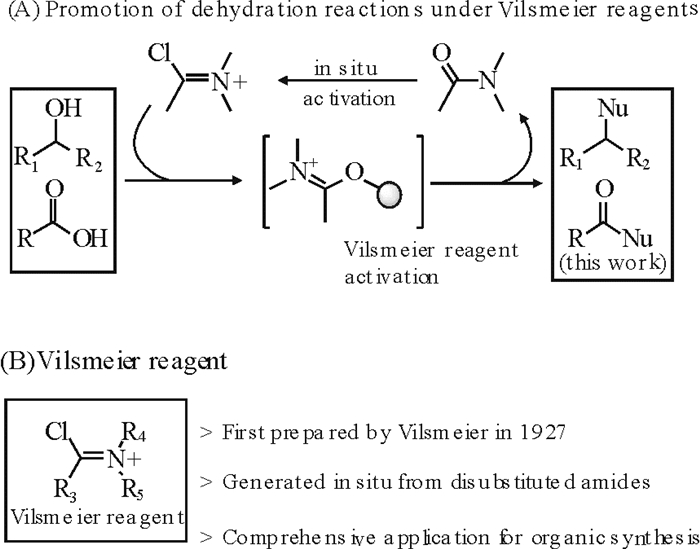
|
图 1 Vilsmeier试剂及其应用 Fig. 1 Vilsmeier reagents and its application |
为了进一步拓展Vilsmeier试剂在薄荷酯合成中的应用,在之前相关工作基础之上,实现了一种简单、高效和经济的合成苯甲酸薄荷酯方法。该方法在室温条件下, SOCl2/DMAc原位生成Vilsmeier盐促进芳基羧酸与薄荷醇反应得到对应的目标产物。
1 实验部分 1.1 主要实验仪器与试剂X-6精密显微熔点测定仪(北京亚力恩机电技术研究院, 温度计未校正), Bruker Avance-Ⅲ核磁共振波谱仪(德国Bruker公司), 赛默飞质谱仪DSQ Ⅱ。
实验中所用羧酸,L-薄荷醇(分析纯), 亚硫酰氯(化学纯)等均为阿拉丁试剂公司; N, N-二甲基乙酰胺(DMAc)(化学纯)和硫酸镁(分析纯)均为国药集团化学试剂有限公司; 二氯甲烷, 石油醚, 乙酸乙酯等均为市售分析纯; 普通柱层析硅胶(200-300目)。
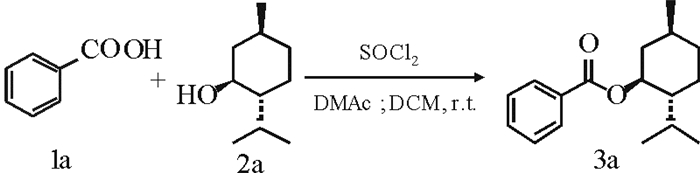
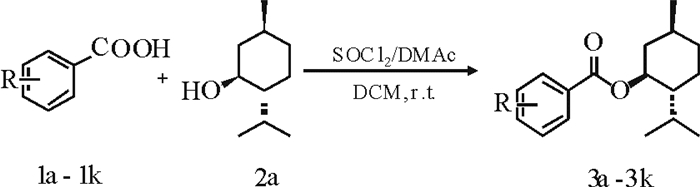
1.2 苯甲酸薄荷酯及其衍生物的合成的一般方法(3a-k)以苯甲酸薄荷酯合成为例(3a)。室温下, 于25 mL圆底烧瓶中加入羧酸(1a) (1.221g), DMAc 4.0 mL和DCM 6.0 mL, 然后在搅拌状态下滴加SOCl2 0.95 mL, 滴加完毕后继续反应1h。而后加入薄荷醇(2.50g)继续反应。用TLC跟踪反应, 直至反应完全为止。待反应完全后, 加水淬灭反应且用乙酸乙酯萃取(3×50 mL)。合并有机相经水和饱和食盐水(2×50 mL)洗至DMAc消失, 用无水硫酸钠干燥。浓缩之后经柱层析分离得到产物3a-3k。
苯甲酸薄荷酯(3a)白色固体, 2.39 g, 产率92%, m.p. 53.8~55.5℃。1H NMR (400 MHz, Chloroform-d) δ 8.06 (d, J=7.2 Hz, 2H), 7.57~7.52 (m, 1H), 7.46~7.41 (m, 2H), 4.94 (dt, J=10.8, 4.4 Hz, 1H), 2.15~2.11 (m, 1H), 2.01~1.93 (m, 1H), 1.75~1.71 (m, 2H), 1.59~1.52 (m, 2H), 1.18~1.05 (m, 2H), 0.97~0.88 (m, 7H), 0.79 (d, J=6.8 Hz, 3H)。13C NMR (101 MHz, Chloroform-d) δ 166.02, 132.65, 130.75, 129.49, 128.23, 74.71, 47.17, 40.88, 34.24, 31.37, 26.38, 23.50, 22.02, 20.74, 16.42。MS (ESI):[M+1]+, 261.3。
4-氯苯甲酸薄荷酯(3b)无色油状液体, 2.50g, 产率85%。1H NMR (400 MHz, Chloroform-d) δ 8.02 (t, J=1.9 Hz, 1H), 7.93 (dt, J=7.7, 1.4 Hz, 1H), 7.48 (ddd, J=8.0, 2.2, 1.1 Hz, 1H), 7.34 (t, J=7.9 Hz, 1H), 4.95 (td, J=10.9, 4.4 Hz, 1H), 2.17~2.04 (m, 1H), 1.94 (pd, J=7.0, 2.7 Hz, 1H), 1.77~1.66 (m, 2H), 1.60~1.49 (m, 2H), 1.11 (tdd, J=12.1, 10.1, 6.1 Hz, 2H), 0.97~0.85 (m, 7H), 0.80 (d, J=7.0 Hz, 3H)。13C NMR (101 MHz, Chloroform-d) δ 164.46, 134.27, 132.47, 132.44, 129.40, 129.39, 127.49, 75.03, 47.02, 40.73, 34.10, 31.26, 26.31, 23.39, 21.86, 20.59, 16.28。MS (ESI):[M+1]+, 295.2。
4-甲基苯甲酸薄荷酯(3c)无色油状液体, 2.41 g, 产率88%。1H NMR (400 MHz, Chloroform-d) δ 7.94 (d, J=8.0 Hz, 2H), 7.22 (d, J=8.0 Hz, 2H), 4.93 (td, J=11.2, 4.0 Hz, 1H), 2.39 (s, 3H), 2.14~2.11 (m, 1H), 2.03~1.93 (m, 1H), 1.73~1.69 (m, 2H), 1.57~1.51 (m, 2H), 1.17~1.04 (m, 2H), 0.96~0.87 (m, 7H), 0.79 (d, J=6.8 Hz, 3H)。13C NMR (101 MHz, Chloroform-d) δ 165.98, 143.13, 129.47, 128.87, 128.01, 74.38, 47.16, 40.89, 34.23, 31.32, 26.39, 23.54, 21.95, 21.49, 20.66, 16.43。MS (ESI):[M+1]+, 275.3。
3-甲基苯甲酸薄荷酯(3d)无色油状液体, (2.39 g, 产率87%。1H NMR (400 MHz, Chloroform-d) δ 7.90~7.80 (m, 2H), 7.39~7.27 (m, 2H), 4.94 (td, J=10.9, 4.4 Hz, 1H), 2.40 (s, 3H), 2.12 (dtd, J=12.0, 4.0, 1.6 Hz, 1H), 1.97 (pd, J=7.0, 2.8 Hz, 1H), 1.79~1.67 (m, 2H), 1.55 (ddt, J=12.5, 11.0, 3.2 Hz, 2H), 1.18~1.05 (m, 2H), 0.96~0.89 (m, 7H), 0.79 (d, J=6.9 Hz, 3H)。13C NMR (101 MHz, Chloroform-d) δ 166.28, 138.06, 133.46, 130.78, 130.08, 128.20, 126.70, 74.69, 47.28, 40.99, 34.35, 31.47, 26.46, 23.60, 22.09, 21.31, 20.82, 16.49。MS (ESI):[M+1]+, 275.3。
2-甲基苯甲酸薄荷酯(3e)无色油状液体, 2.49 g, 产率91%。1H NMR (400 MHz, Chloroform-d) δ 7.90 (dd, J=7.4, 1.8 Hz, 1H), 7.33 (td, J=7.5, 1.5 Hz, 1H), 7.20 (t, J=7.6 Hz, 2H), 4.95 (td, J=10.9, 4.4 Hz, 1H), 2.60 (s, 3H), 2.14 (dtd, J=12.0, 4.0, 1.7 Hz, 1H), 2.00 (dt, J=9.7, 3.1 Hz, 1H), 1.75~1.66 (m, 2H), 1.52 (ddt, J=13.8, 10.8, 3.0 Hz, 2H), 1.16~1.05 (m, 2H), 0.95~0.88 (m, 8H), 0.81 (d, J=7.0 Hz, 3H)。13C NMR (101 MHz, Chloroform- valign="top 166.83, 139.73, 131.42, 130.13, 125.43, 74.21, 47.08, 40.92, 34.15, 31.30, 26.17, 23.24, 21.89, 21.60, 20.68, 16.11。MS (ESI):[M+1]+, 275.3。
2-甲氧基苯甲酸薄荷酯(3f)白色固体, 2.61 g, 产率90%, m.p. 47.8~49.3℃。1H NMR (400 MHz, Chloroform-d) δ 7.76 (dd, J=7.6, 1.8 Hz, 1H), 7.50~7.36 (m, 1H), 7.04~6.87 (m, 2H), 4.92 (td, J=10.9, 4.4 Hz, 1H), 3.87 (s, 3H), 2.17 (dtd, J=12.0, 4.1, 1.7 Hz, 1H), 2.09 (pd, J=7.0, 2.8 Hz, 1H), 1.71 (dq, J=14.8, 3.2 Hz, 2H), 1.53 (tdt, J=14.2, 11.0, 4.0 Hz, 2H), 1.11 (td, J=12.6, 10.1 Hz, 2H), 0.92 (dd, J=6.8, 2.8 Hz, 7H), 0.81 (d, J=7.0 Hz, 3H)。13C NMR (101 MHz, Chloroform-d) δ 132.92, 131.02, 120.83, 119.87, 111.80, 74.42, 55.67, 47.02, 40.76, 34.16, 31.29, 25.90, 23.13, 21.92, 20.78, 16.03。MS (ESI):[M+1]+, 291.3。
2-溴苯甲酸薄荷酯(3g)白色固体, 3.19 g, 产率94%, m.p. 55.8~57.5℃。1H NMR (400 MHz, Chloroform-d) δ 8.13~7.96 (m, 2H), 7.50 (ddd, J=7.5, 4.2, 2.3 Hz, 1H), 7.41 (tdd, J=7.2, 4.8, 2.1 Hz, 2H), 4.95 (td, J=10.9, 4.4 Hz, 1H), 2.13 (dtd, J=12.2, 4.1, 1.9 Hz, 1H), 1.98 (pd, J=7.0, 2.7 Hz, 1H), 1.71 (dt, J=12.9, 3.8 Hz, 2H), 1.63~1.43 (m, 2H), 1.21~1.03 (m, 2H), 1.00~0.83 (m, 7H), 0.80 (d, J=7.0 Hz, 3H)。13C NMR (101 MHz, Chloroform-d) δ 132.49, 130.67, 129.37, 128.09, 74.53, 47.09, 40.81, 34.15, 31.26, 26.32, 23.46, 21.90, 20.62, 16.36。MS (ESI):[M+1]+, 339.3。
2-碘苯甲酸薄荷酯(3h)淡黄色油状液体, 3.36 g, 产率87%。1H NMR (400 MHz, Chloroform-d) δ 7.95 (d, J=8.1 Hz, 1H), 7.74 (dd, J=7.8, 1.8 Hz, 1H), 7.37 (t, J=7.6 Hz, 1H), 7.10 (tt, J=7.8, 1.9 Hz, 1H), 4.97 (dt, J=10.9, 4.3 Hz, 1H), 2.20~2.14 (m, 1H), 2.04~1.98 (m, 1H), 1.78~1.64 (m, 2H), 1.58~1.49 (m, 2H), 1.21~1.04 (m, 2H), 0.95~0.89 (m, 7H), 0.82 (d, J=7.1 Hz, 3H)。13C NMR (101MHz, Chloroform-d)δ 165.74, 140.90, 135.65, 132.03, 130.21, 127.58, 93.69, 75.46, 46.82, 40.58, 34.00, 31.23, 26.02, 23.11, 21.87, 20.64, 16.06。MS (ESI):[M+1]+, 387.2。
2-硝基苯甲酸薄荷酯(3i)黄色油状液体, 2.90 g, 产率95%。1H NMR (400 MHz, Chloroform-d) δ 7.92 (d, J=8.0 Hz, 1H), 7.72~7.60 (m, 3H), 4.96 (td, J=10.8, 4.4 Hz, 1H), 2.24 (m, 1H), 1.96~1.89 (m, 1H), 1.73~1.69 (m, 2H), 1.56~1.42 (m, 2H), 1.16~1.05 (m, 2H), 0.96~0.89 (m, 7H), 0.83 (d, J=6.8 Hz, 3H)。13C NMR (101 MHz, Chloroform-d) δ 165.00, 147.73, 132.84, 131.35, 129.53, 123.79, 76.66, 46.79, 39.89, 34.02, 31.37, 26.05, 23.15, 21.94, 20.71, 16.02。MS (ESI):[M+1]+, 306.3。
2-甲基-5-溴苯甲酸薄荷酯(3j)无色油状液体, 3.10 g, 产率88%。1H NMR (400 MHz, Chloroform-d) δ 7.99 (d, J=2.3 Hz, 1H), 7.47 (dd, J=8.2, 2.3 Hz, 1H), 7.16~7.03 (m, 1H), 4.94 (td, J=10.9, 4.4 Hz, 1H), 2.53 (s, 3H), 2.11 (dtd, J=11.9, 4.0, 1.7 Hz, 1H), 1.94 (pd, J=7.0, 2.8 Hz, 1H), 1.77~1.68 (m, 2H), 1.60~1.50 (m, 2H), 1.17~1.06 (m, 2H), 0.98~0.88 (m, 8H), 0.80 (d, J=7.0 Hz, 3H)。13C NMR (101 MHz, Chloroform-d) δ 138.79, 134.40, 133.16, 132.91, 119.03, 74.96, 47.05, 40.92, 34.18, 31.43, 26.27, 23.30, 21.99, 21.22, 20.79, 16.18。MS (ESI):[M+1]+, 353.2。
2-氯-4-硝基苯甲酸薄荷酯(3k)黄色油状液体, 3.09 g, 产率91%。1H NMR (400 MHz, Chloroform-d) δ 8.31 (d, J=2.2 Hz, 1H), 8.16 (dd, J=8.6, 2.2 Hz, 1H), 7.90 (d, J=8.5 Hz, 1H), 5.01 (td, J=10.9, 4.4 Hz, 1H), 2.18 (dtd, J=11.9, 4.4, 4.0, 1.8 Hz, 1H), 1.98 (pd, J=7.0, 2.7 Hz, 1H), 1.80~1.70 (m, 2H), 1.61~1.49 (m, 2H), 1.17 (td, J=12.0, 10.7 Hz, 2H), 0.94 (dd, J=12.2, 6.8 Hz, 7H), 0.83 (d, J=7.0 Hz, 3H)。13C NMR (101 MHz, Chloroform-d) δ 163.92, 149.09, 134.24, 131.41, 125.79, 121.40, 76.89, 46.93, 40.61, 34.03, 31.43, 26.22, 23.19, 21.92, 20.71, 16.07。MS (ESI):[M+1]+, 340.2。
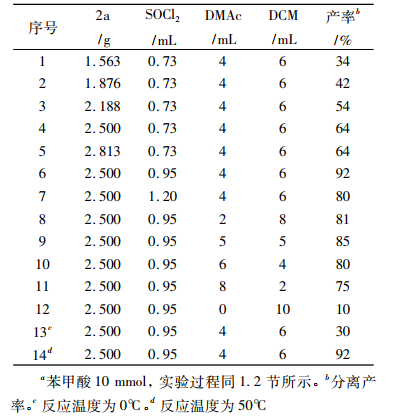
2 结果与讨论 2.1 反应条件优化选用廉价易得的苯甲酸和薄荷醇作为模型底物, 对其反应条件进行了一系列筛选。实验条件及其结果见表 1。
|
|
表 1 反应条件优化a Tab. 1 Screening and optimization of the reaction conditionsa |
基于之前的工作,最初选取的反应体系是:苯甲酸(1.221 g),薄荷醇(1.563 g),SOCl2(0.73 mL),DMAc (4 mL)和DCM (6 mL), 得到目标产物,产率34%(表 1, Entry 1)。考虑到薄荷醇与Vilsmeier试剂反应生成氯代烃[25], 随后考察了薄荷醇的用量对反应的影响。实验结果表明:反应产率随醇的用量增加而增加; 当醇的用量增加到1.6倍之后,再增加醇用量促进反应的效果不明显(表 1, Entries 2-5)。同样,薄荷醇的氯代反应和反应体系中的水会消耗Vilsmeier试剂, 理论上可通过增加氯化亚砜的用量促进Vilsmeier盐的生成以提高产率。故而,考察了氯化亚砜的用量对反应的影响。实验结果表明:当SOCl2用量为0.95mL时,得到目标产物,产率92%;SOCl2用量继续增大为1.20mL时, 反应产率反而降低。其可能的原因是过量的Vilsmeier试剂与薄荷醇发生氯代反应, 使得醇的量相应减少。保持反应物浓度不变的情况下, 考察了DMAc用量对反应的影响。实验结果表明:DMAc用量过多或过少都会降低反应收率。其可能的原因是DMAc过多, 使得反应体系黏性增大不利于反应进行; 反之, 则生成的Vilsmeier试剂不足和DMAc不足而降低反应收率。需要注意的是:若反应体系中不存在DMAc, 则反应收率下降至10%。这说明DMAc在该反应中具有显著的作用。实验结果表明:低温不利于反应的进行, 而提高温度对反应收率影响不大。
综上所述可知,较佳反应条件是:n(苯甲酸):n(SOCl2):n(薄荷醇)=1.0:1.3:1.6, 4 mL DMAc和6 mL CH2Cl2在室温条件下进行(表 1, Entry 11)。
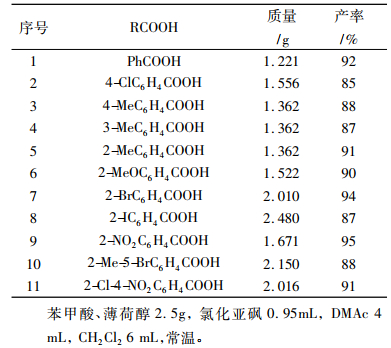
2.2 底物范围的扩展根据已得到的较优反应条件,对反应底物进行了拓展实验,主要选取各种取代苯甲酸为底物, 考察电子效应和空间位阻效应对反应的影响,见表 2。由此可知:不论取代基是给电子基团还是吸电子基团,都以较高的收率得到目标产物。这说明苯环电子效应对反应影响不大。此外, 若取代基分别在邻、间、和对位等位置取代, 反应收率相差不大。由此表明,苯环上的空间位阻效应对反应的影响也不大。
|
|
表 2 DMAc促进的由羧酸和薄荷醇制备薄荷酯的实例a Tab. 2 Some examples of DMAc-promoted synthesis of menthyl esters from carboxylic acid and menthol |
基于实验现象和结果, 该反应可能的反应历程是:①DMAc与氯化亚砜原位生成Vilsmeier试剂(Ⅰ); ②Vilsmeier试剂(Ⅰ)与羧酸反应生成活性中间体(Ⅱ); ③这种活性物种(Ⅱ)进一步与薄荷醇反应, 得到所需的薄荷酯以及循环产生DMAc。此外, 也可能是活性中间体(Ⅱ)原位生成酰氯,进一步与薄荷醇反应而得到薄荷酯(图 2)。为了验证上述机理,使DMAc与SOCl2反应成盐, 并对该盐进行表征。其1H NMR (CDCl3, 400 MHz) δ: 3.26 (s, 6H), 2.65 (s, 3H); DMAc的1H NMR δ: 3.02 (s, 3H), 2.94 (s, 3H), 2.09 (s, 3H)。与DMAc的氢谱相比较, DMAc与SOCl2反应成盐后, 9个H的化学位移均向低场偏移, N原子上的6个甲基H变成了等性H, 与图 4中Ⅰ的结构相符。故而,DMAc可能从两方面促进该反应:①DMAc与SOCl2反应生成Vilsmeier盐Ⅰ, Ⅰ继续与RCOOH反应生成了活性中间体Ⅱ, 活化了羰基, 有利于亲核取代反应的发生, 释放出DMAc。可见, 这一过程只需要催化量的DMAc。②DMAc通过吸收反应副产物HCl, 加速了活性中间体(Ⅱ)的生成和亲核取代反应的进行[25], 因此,该过程中DMAc总的用量很大。
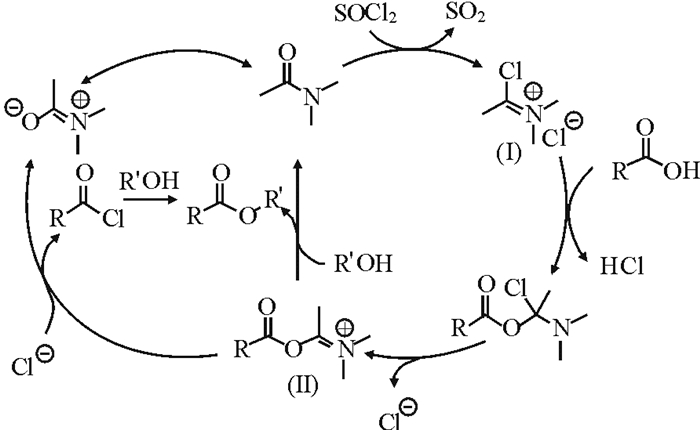
|
图 2 条件优化反应 Fig. 2 Conditional optimization reaction |
|
图 3 底物扩展反应 Fig. 3 Substrate extension reaction |
|
图 4 可能的反应机理 Fig. 4 Proposed mechanism |
报道了一种简便、高效合成薄荷酯的方法。该方法通过SOCl2和DMAc原位生成Vilsmeier试剂,后在其作用下活化羧酸与薄荷醇反应得到目标产物。该方法具有操作简单、条件温和以及底物适用范围广等优点。此外, 该反应可以较高产率扩大到克级规模。
| [1] |
王建义. 新型防晒剂——邻氨基苯甲酸薄荷酯[J]. 日用化学工业, 1984, 13(6): 274-275. |
| [2] |
秦方刚, 刘佩, 方佳成, 等. 丹参素衍生物的合成[J]. 西北大学学报(自然科学版), 2015, 45(3): 418-422. |
| [3] |
吴晓松, 肖飞, 张志东, 等. 砂仁挥发油中乙酸龙脑酯的镇痛作用及其机制研究[J]. 中药材, 2005, 28(6): 505-506. DOI:10.3321/j.issn:1001-4454.2005.06.025 |
| [4] |
郑晓晖, 南叶飞, 赵新锋, 等.取代的苯甲酸衍生物及其合成方法和用途: 中国, 101607907 [P]. 2006-06-22.
|
| [5] |
谢维跃, 佘光前, 冯章明, 等. L-乳酸薄荷酯的合成及其在个人护理用品中的应用研究[J]. 日用化学工业, 2009, 39(4): 253-256. |
| [6] |
杨晴来, 王宏飞, 苏华, 等. 纳米固体超强酸S2O82-/ZrO2催化合成2-四氢呋喃甲酸冰片酯和2-四氢呋喃甲酸薄荷酯[J]. 合成化学, 2010, 18(6): 754-755. DOI:10.3969/j.issn.1005-1511.2010.06.026 |
| [7] |
李红涛, 赵志伟, 王勇, 等. 烟用香精3-甲基戊酸薄荷酯的合成及分析[J]. 安徽农业科学, 2013, 41(28): 11509-11511. DOI:10.3969/j.issn.0517-6611.2013.28.099 |
| [8] |
郝东, 杨欣欣, 张江华, 等. 阿魏酸薄荷酯的合成与体外总抗氧化能力[J]. 中国实验方剂学杂志, 2013, 19(15): 95-98. |
| [9] |
岳海波, 梁娅, 陈义坤, 等. 薄荷基甲酸薄荷酯的合成研究[J]. 日用化学工业, 2014, 44(3): 147-150. |
| [10] |
李前荣, 顾承志, 尹浩, 等. 用DCC/DMAP合成N-苄氧羰基氨基酸薄荷酯[J]. 有机化学, 2015, 25(11): 1416-1419. |
| [11] |
蔡冉, 王浦海, 张根元. 双氯芬酸l-薄荷酯的合成与结构鉴定[J]. 中国现代应用药学, 2015, 32(9): 1084-1086. |
| [12] |
陈芝飞, 芦昶彤, 陈瑨, 等. 尼龙酸薄荷酯的合成及其热裂解[J]. 精细化工, 2016, 33(10): 1118-1124. |
| [13] |
晏日安, 陈磊, 黄雪松, 等. 琥珀酸单薄荷酯合成工艺的研究[J]. 食品与发酵工业, 2008, 34(10): 89-91. |
| [14] |
李明, 方银军, 李在均, 等. 新型对称烷基咪唑离子液体介质中酶催化合成l-乙酸薄荷酯[J]. 化学学报, 2009, 67(11): 1252-1258. DOI:10.3321/j.issn:0567-7351.2009.11.017 |
| [15] |
曾家豫, 梁琼, 廖世奇, 等. AOT反胶束体系中脂肪酶催化合成乙酸薄荷酯[J]. 食品与发酵工业, 2009, 35(11): 9-13. |
| [16] |
李杰梅, 徐娟娟, 黄永平, 等. 无溶剂体系酶法催化合成共轭亚油酸薄荷酯[J]. 中国油脂, 2011, 36(2): 13-15. |
| [17] |
曾家豫, 唐功, 周兴辉, 等. 非水相中脂肪酶催化合成乙酸薄荷酯[J]. 食品工业科技, 2008, 29(11): 232-234. |
| [18] |
VILSMEIER A, HAACK A. Über die einwirkung von Halogenphosphor auf Alkyl-formanilide. Eine Neue methode Zur darstellung sekundärer und tertiärer p-Alkylamino-benzaldehyde[J]. Ber, 1927, 60(1): 119-122. |
| [19] |
SU W, WENG Y, JIANG L, et al. Recent progress in the use of Vilsmeier-Type reagents[J]. Org Prep Proced Int, 2010, 42(6): 503-555. DOI:10.1080/00304948.2010.513911 |
| [20] |
KIKUGAWA K, KAWASHIMA T. Studies on the Vilsmeier-Haack reaction. Ⅱ. Characterization of thionyl chloride-dimethylformamide complexes[J]. Chem Pharm Bull, 1971, 19(12): 2629-2630. DOI:10.1248/cpb.19.2629 |
| [21] |
TRAYNELIS V J, MISKEL J, SOWA J. Notes-formylation of furans[J]. J Org Chem, 1957, 22(10): 1269-1270. DOI:10.1021/jo01361a617 |
| [22] |
CHEN L, ZHAO Y L, LIU Q, et al. Domino reaction of α-acetyl-α-carbamoyl ketene dithioacetals with Vilsmeier reagents:A novel and efficient synthesis of 4-halogenated 2(1H)-pyridinones[J]. J Org Chem, 2007, 72(24): 9259-9263. DOI:10.1021/jo701742q |
| [23] |
ERMILI A, CASTRO A J, WESTFALL P A. Products from attempted Vilsmeier-Haack acylations of pyrroles with select amides[J]. J Org Chem, 1965, 30(2): 339-343. DOI:10.1021/jo01013a007 |
| [24] |
KATRITZKY A R, MARSON C M, ZAO Q W. Reactions of alkyl-substituted 2-cyclohexen-1-ones with Vilsmeier reagents[J]. J Org Chem, 1987, 52(13): 2730-2734. DOI:10.1021/jo00389a017 |
| [25] |
郑大贵, 周安西, 祝显虹, 等. 二甲基乙酰胺高效促进由醇制备氯代烃[J]. 有机化学, 2016, 36(1): 137-142. |
 2017, Vol. 47
2017, Vol. 47