席夫碱由于具有易于控制的空间构型、多齿的配位能力及较强的抗菌[1-2]、抗病毒[3]、抗肿瘤[4]、抗氧化[5]等生物活性,已成为生物化学领域类非常重要的有机配体,具有广阔的应用前景。席夫碱化合物通常包括醛类和酮类席夫碱两大类。近年来,关于水杨醛、邻香草醛等醛类席夫碱及金属配合物的研究很多[6-10],而对酮类席夫碱及配合物的研究却相对较少。其主要是由于空间位阻原因, 通常酮类席夫碱较醛类席夫碱难合成,而选择空间位阻较小的酮类如甲基酮,则有利于形成其席夫碱配体及配合物。目前,关于甲基酮类席夫碱及金属配合物的报道较少。朱传方等[11]通过2,4-二羟基苯乙酮与不同芳胺反应, 合成了6种新的2, 4-二羟基苯乙酮席夫碱化合物, 并利用紫外、红外、核磁共振和元素分析等方法确定了它们的结构。Singh等[12]以2-乙酰呋喃和2-乙酰噻酚为原料,通过和各类氨基酸反应合成了相应的席夫碱及配合物,并从中筛选出了几种抗菌活性较好的配合物。Raut等[13]通过取代乙酰苯酮和取代苯胺在乙醇溶液中缩合反应生成席夫碱。许同桃[14]曾研究了丹皮酚即2-羟基-4-甲氧基苯乙酮与有机多胺衍生物的缩合,并初步研究它们的晶体结构、抑菌性能和抗氧化性能。因此,研究甲基酮类席夫碱的合成及性质等具有重要的意义,也有着广阔的应用前景。
5-氟-2-羟基苯乙酮是一种重要的医药中间体,可作为多种β受体阻滞剂合成中间体[15-17]。本文以5-氟-2-羟基苯乙酮为原料,采用直接合成法,分别与盐酸氨基脲、苄胺、邻苯二胺和4-氨基安替比林,在无水乙醇中进行缩合,合成了4种5-氟-2-羟基苯乙酮席夫碱,并采用元素分析、IR、1H NMR及13C NMR谱分析对其结构进行了表征。这些5-氟-2-羟基苯乙酮席夫碱的合成,不仅丰富了甲基酮席夫碱的种类,而且为进一步研究其应用提供了物质基础。
1 实验部分 1.1 仪器与试剂Bruker Tensor 27-IR红外光谱仪 (德国Bruker公司,KBr压片法);PE-2400型元素分析仪 (美国Perkin-Elmer公司);Bruker AM-400超导傅立叶数字化核磁共振仪 (德国Bruker公司,TMS为内标);X-5显微熔点测定仪 (控温型,北京泰克仪器有限公司)。
5-氟-2-羟基苯乙酮 (上海达瑞有限公司);盐酸氨基脲 (上海达瑞有限公司);苄胺 (北京恒业中远化工有限公司);邻苯二胺 (上海达瑞有限公司);4-氨基安替比林 (上海达瑞有限公司);其他化学试剂均为市售分析纯,使用前未经任何处理。
1.2 5-氟-2-羟基苯乙酮席夫碱的合成称取 (1.54 g,10 mmol)5-氟-2-羟基苯乙酮于50 mL圆底烧瓶中,加20 mL无水乙醇溶解,室温下分别加入盐酸氨基脲 (1.12 g, 10 mmol)、氢氧化钠 (0.4 g, 10 mmol)、苄胺 (1.10 mL,10 mmol)、邻苯二胺 (1.08 g, 10 mmol)、4-氨基安替比林 (2.03 g, 10 mmol),80 ℃油浴加热搅拌下回流4 h,冷却至室温,静置过夜,过滤、烘干,得到粗品。粗品用无水乙醇反复重结晶3次后, 过滤干燥, 最终分别得到5-氟-2-羟基苯乙酮缩盐酸氨基脲 (1)、5-氟-2-羟基苯乙酮缩苄胺 (2)、5-氟-2-羟基苯乙酮缩邻苯二胺 (3) 和5-氟-2-羟基苯乙酮缩4-氨基安替比林 (4)(其合成路线如图 1所示)。化合物1-4采用元素分析、IR、1H NMR及13C NMR谱对其结构进行了表征。
|
图 1 化合物1—4的合成路线 |
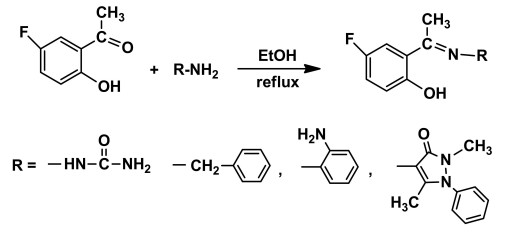
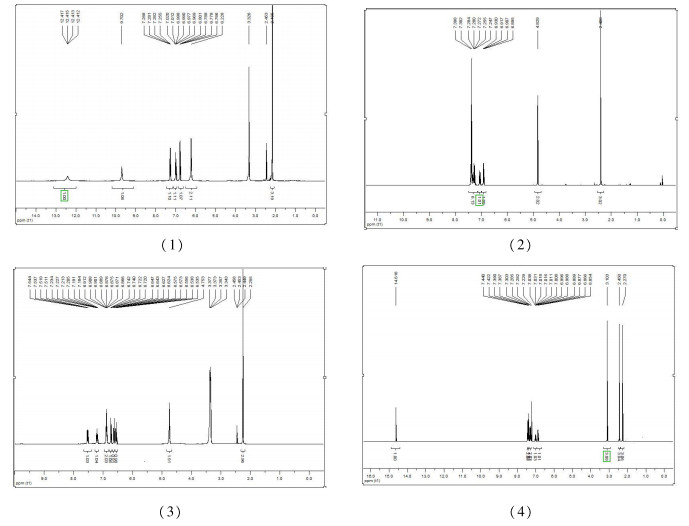
化合物1:白色固体,收率:75.67 %,熔点:237.8 ℃~239.5 ℃; IR (KBr压片),v(cm-1):3 490, 3 236, 3 148, 1 693, 1 572, 1 553, 1 488, 1 463, 1 374, 1 326, 1 274, 1 232, 1 188, 1 152, 915, 853, 783, 712, 671, 577, 482;1H NMR (DMSO-d6), δ(ppm):12.4(s,1H), 9.07(s,1H), 7.29~7.26(m,1H), 7.02~6.97(m, 1H), 6.80~6.77(m, 1H), 6.23(s, 2H), 2.19(s, 3H); 13C NMR (DMSO-d6), δ(ppm):155.6, 153.9, 147.4, 121.3, 117.7, 116.2, 113.6, 18.5。元素分析:按C9H10O2N3F的计算值 (%):C 51.18,H 4.74;实验值 (%):C 52.24, H 4.63。
化合物2:黄绿色晶体,收率:73.42 %,熔点:126.5 ℃~127.8 ℃; IR (KBr压片),v(cm-1):3 412, 3 060, 2 870,1 610,1 578,1 501,1 454,1 453,1 377,1 261,1 230,1 187,1 049,932,880,830,787,698,521; 1H NMR (CDCl3),δ(ppm):7.40~6.90(m,8H),4.82(s,2H),2.49(s,3H); 13C NMR (CDCl3),δ(ppm):171.2,159.5,155.6,153.3,138.3,128.8,127.5,119.3,113.5,53.8,14.9。元素分析:按C15H14ONF的计算值 (%):C 74.07,H 5.76;实验值 (%):C 73.52,H 5.84。
化合物3:深黄色固体,收率:65.73%,熔点:223.7 ℃~225.4 ℃; IR (KBr压片),v(cm-1):3 452,3 328,3 068, 1 624,1 577,1 490,1 457,1 435,1 362,1 328,1 283,1 187,871,819,787,749,705,667,559,514; 1H NMR (DMSO-d6),δ(ppm):7.54~6.53(m,7H),4.75(s,2H),2.26(s,3H); 13C NMR (DMSO-d6),δ(ppm):172.6,157.8,154.9,153.4,139.7,134.9,131.7,126.0,121.2,119.6,118.6,118.3,115.2,17.1。元素分析:按C14H13ON2F的计算值 (%):C 68.85,H 5.35;实验值 (%):C 68.99,H 5.55。
化合物4:黄色晶体,收率:67.80 %,熔点:245.0 ℃~246.3 ℃; IR (KBr压片), v(cm-1):3 460,2 961,1 657, 1 619,1 606,1 579,1 550,1 491,1 435,1 485,1 372,1 328,1 251,1 230,1 135,1 073,938,858,822,771,707,642,572,510,467; 1H NMR (CDCl3),δ(ppm):14.61(s,1H), 7.45~6.85(m,8H), 3.10(s,3H),2.45(s,3H),2.27(s,3H); 13C NMR (CDCl3),δ(ppm):172.3,159.0,158.1,155.7,147.8,135.0,129.3,127.0,124.4,120.2,119.6,118.7,117.7,114.3,36.3,19.4,10.8。元素分析:按C19H18O2N3F的计算值 (%):C 67.26 H 5.31;实验值 (%):C 65.71,H 5.82。
2 结果与讨论 2.1 IR谱分析从化合物1-4的IR谱可看出,所有化合物芳环上的O-H的伸缩振动吸收峰均在3 380 cm-1附近;N-H的伸缩振动峰出现在3 280 cm-1附近;3 035 cm-1附近为Ar-H伸缩振动吸收;3 010~2 850 cm-1为饱和C-H的伸缩振动吸收;1 670~1 600 cm-1为C环上C=O的伸缩振动吸收;在1 480~1 650 cm-1附近产生中等强度的C=N伸缩振动吸收峰,表明反应形成了席夫碱。在1 580~1 440 cm-1附近均有3个较强吸收峰为苯环上C-C的特征峰;-CH3在1 375 cm-1和1 450 cm-1附近同时有吸收峰,分别对应于-CH3的对称弯曲振动和反对称弯曲振动;890~640 cm-1为苯环上C-H的面外弯曲振动吸收,具体视苯环上取代基个数和位置不同发生变化。
2.2 1H NMR和13C NMR谱分析化合物1-4的1H NMR谱见图 2。从1H NMR谱结果可以看出,化合物1和4中,酚羟基 (-OH) 的质子峰分别出现在12.4 ppm和14.6 ppm处,而在化合物2和3中,酚羟基 (-OH) 的质子峰却未呈现出来,可能是该活泼H被溶剂中所含水分子交换的缘故。在化合物1-4中,所有芳基上氢的化学位移在7.54~6.22 ppm之间,随取代基不同略有差异;碳氮双键上的甲基氢处于高场,位于2.3 ppm附近。化合物2中-CH2-的氢的化学位移在4.8 ppm处;化合物1中N-H的氢位于9.7 ppm附近;在化合物1和化合物3中,-NH2的两个氢位于4.8~6.2 ppm之间。根据化合物1-4中氢的数目可验证,所合成产物均为相应的5-氟-2-羟基苯乙酮席夫碱。
|
图 2 化合物1—4的1H NMR谱 |
化合物1-4的13C NMR谱如图 3所示。13C NMR谱结果表明,所有C=N上的碳的化学位移均位于172.6~155.6 ppm间;芳环上碳的化学位移处于113~157 ppm间;C=N上的甲基碳出现在14.9~19.4 ppm间。此外,化合物1中的C=O上的碳化学位移为153.9 ppm。在化合物4中处于172.3 ppm、158.1 ppm的化学位移分别对应C=O和C=C上的碳信号,与氮原子连接的甲基碳化学位移为36.3 ppm,C=C上的甲基碳位移在10.8 ppm处;化合物1-4的13C NMR谱结果也进一步确认了其结构是正确合理的。
|
图 3 化合物1—4的13C NMR谱 |
本文以无水乙醇为溶剂,通过5-氟-2-羟基苯乙酮与盐酸氨基脲、苄胺、邻苯二胺和4-氨基安替比林的缩合合成了4种新型席夫碱,并通过元素分析、IR、1H NMR及13C NMR谱对其结构进行了表征。采用直接法合成5-氟-2-羟基苯乙酮类席夫碱,具有路线简洁、操作简便、产率较高等优点。这些5-氟-2-羟基苯乙酮类席夫碱化合物的合成不仅丰富了甲基酮类席夫碱的种类,更重要的是为深入研究该类化合物的应用提供了物质基础。
| [1] | 张欣, 杜聪, 陈丹, 等. 氨基酸席夫碱镍、钴配合物的合成晶体结构及抑菌活性[J]. 无机化学学报, 2010, 26(3): 489–494. |
| [2] | 毕思玮, 刘树祥. 氨基酸水杨醛席夫碱与铜 (Ⅱ) 配合物的合成及其抗菌活性和稳定性、结构间的关系[J]. 无机化学学报, 1996, 12(4): 423–426. |
| [3] | 胡国强, 董秀丽, 谢松强, 等. 含羧酸侧链蒽醛缩氨基均三唑席夫碱衍生物的合成及抗肿瘤活性[J]. 药学学报, 2008, 43(1): 50–53. |
| [4] | SINGH K, SINGH R V, TANDON J P. Synthesis and characterization of tin (Ⅳ) complexes of biologically active thiosemicarbazones[J]. Synthesis and Reactivity in Inorganic, Metal-Organic and Nano-Metal Chemistry, 1986, 16(10): 1341–1350. DOI:10.1080/00945718608071407 |
| [5] | 朱元成, 姚卡玲, 李英, 等. 稀土与磺胺甲基异唑的席夫碱配合物及其抗氧化作用[J]. 稀土, 2006, 27(3): 24–27. |
| [6] | 秦大斌, 杨海英, 雷刚. 水杨醛缩邻苯二胺Schiff碱及其配合物的合成与催化性能[J]. 西华师范大学学报 (自然科学版), 2003, 24(4): 423–425. |
| [7] | 张震. 3, 5-二氨基苯甲酸缩邻香草醛席夫碱镉配合物的合成及抗肿瘤活性研究[J]. 济宁医学院学报, 2014, 37(3): 153–156. |
| [8] | 贤景春, 王顺文. 5-溴水杨醛缩硫脲Schiff碱及钴 (Ⅱ) 配合物的合成与表征[J]. 泉州师范学院学报 (自然科学版), 2008, 26(6): 55–57. |
| [9] | 蔡奔, 陈露, 罗金岳. 双邻香草醛希夫碱的结构表征与合成工艺[J]. 南京林业大学学报 (自然科学版), 2011, 35(5): 91–94. |
| [10] | 霍红月, 李仲庆, 覃其品, 等. 邻香草醛缩胡椒乙胺席夫碱锌 (Ⅱ) 配合物的研究[J]. 广西师范大学学报 (自然科学版), 2014, 32(3): 65–73. |
| [11] | 朱传方, 吴爱斌, 徐汉红. 2, 4-二羟基苯乙酮席夫碱化合物的合成[J]. 化学试剂, 2001, 23(3): 150–151. |
| [12] | Singh H L, Sharma M, Gupta M K, et al. Coordination behaviour of biologically active Schiff bases of amino acids towards stannous ion[J]. Bull.Pol.Acad.Sci, Chem, 1999, 47(2): 103–110. |
| [13] | Raut A W, Doshi A G. Synthesis and Antimicrobial Activities of New Pyrazolines and Its Derivatives[J]. Orient.J.Chem, 1996, 12(1): 79–81. |
| [14] | 许同桃. 丹皮酚、有机多胺衍生物及其金属配合物的合成、结构及生物活性研究[D]. 南京: 南京理工大学博士学位论文, 2007. |
| [15] | Ellis G P, Lockhart I M, Mssder-Nyce D, et al. In chemistry of Helerocyclic Compounds[M]. New York: Wiley, 1977. |
| [16] | Ellis G P, Lockhart I M. Chromans and tocopherols[M]. New York: Wiley, 1981. |
| [17] | Chandrasekhar S, Reddy M V. Enatioselectire total synthesis of the antihypertensive agent (S, R, R, R)-nebivolol[J]. Tetrahedron, 2000, 56(34): 6339–6344. DOI:10.1016/S0040-4020(00)00572-X |