最近10余年来,通过溶栓或经皮冠状动脉成形术进行早期再灌注治疗已广泛应用于治疗急性心肌梗死(acute myocardial infarction,AMI)。虽然恢复冠状动脉血流能改善心肌梗死后的心室重构和心功能不全,但是再灌注治疗也会引起心肌缺血再灌注(ischemia-reperfusion, I/R)损伤。I/R损伤可能降低再灌注治疗的效果。血管紧张素转换酶(angiotensin converting enzyme,ACE)是肾素-血管紧张素系统(renin-angiotensin system,RAS)中重要的一员,能水解血管紧张素Ⅰ(angiotensin Ⅰ,Ang Ⅰ)生成RAS中的另一重要成员AngⅡ。研究表明,AngⅡ能诱导心脏I/R后的细胞凋亡[1]。
RNA干扰(RNA interference, RNAi)是指通过内源性或外源性双链RNA的介导,特异性降解相应序列的mRNA,导致靶基因的表达沉默,产生相应的功能型缺失的现象,属于转录后水平的基因沉默。本研究拟采用RNAi技术沉默H9C2心肌细胞内的ACE基因,通过调节细胞内的RAS,进而调节细胞内凋亡途径改善缺氧/复氧(anoxia/reoxygenation, A/R)诱导的H9C2心肌细胞凋亡。
1 材料与方法 1.1 材料ACE-shRNA质粒购自上海吉凯基因化学技术有限公司;AnnexinV-FITC细胞凋亡检测试剂盒购自美国Biovision公司;阳离子脂质体2000、TRIzol试剂盒、逆转录试剂盒和SYBR Green mix购自美国Invitrogen公司;兔抗大鼠ACE抗体、兔抗大鼠Bcl-2抗体、兔抗大鼠Bax抗体和兔抗大鼠β-actin抗体等购自美国Santa Cruz公司;大鼠AngⅡ ELISA试剂盒购自北京中杉金桥生物技术有限公司。
1.2 方法 1.2.1 H9C2心肌细胞培养大鼠H9C2心肌细胞(上海基免生物科技有限公司)用含10%的胎牛血清的DMEM培养基培养,细胞在37 ℃,5%CO2的条件下培养,每2-3 d换一次培养基,细胞生长良好,细胞融合率约80%时传代,将传3至5代的细胞用于实验。
1.2.2 细胞转染将2 ml含有2×105个大鼠H9C2心肌细胞的10%的胎牛血清的DMEM培养基加入6孔板,在37 ℃,5%CO2的条件下培养过夜。按说明书用脂质体法进行转染,每孔质粒的量为1 μg,脂质体的量为2.5 μl。4 h后更换培养基,48 h后在荧光显微镜下观察转染效果,测定转染率。
1.2.3 H9C2心肌细胞体外模拟缺血/再灌注模型的制备转染48 h后,更换培养基,参照Chen等[2]建立的方法,将培养的H9C2心肌细胞放入三气孵箱中。模拟缺氧,就是持续通入含95% N2-5% CO2的混合气体孵育心肌细胞,恢复常态培养即为复氧模型。
1.2.4 研究方案及实验分组H9C2心肌细胞随机分为以下4组:正常对照组(Con):H9C2心肌细胞按正常方式培养,且不经任何因素处理;A/R组:H9C2心肌细胞仅经受缺氧3 h再复氧2 h,不经其它因素处理;阴性对照组(negative control,NC组):H9C2心肌细胞转染阴性对照ACE-shRNA质粒后经受缺氧3 h再复氧2 h;ACE-shRNA组(shRNA组):H9C2心肌细胞转染ACE-shRNA质粒后经受缺氧3 h再复氧2 h。各组再培养24 h后测量有关指标。
1.2.5 H9C2心肌细胞存活率测定(CCK-8法)按说明书用CCK-8法测定H9C2心肌细胞存活率。测得吸光度(OD)值的大小可间接反映H9C2心肌细胞活力,细胞存活率(%)=(干预组平均OD值/对照组平均OD值)×100%。
1.2.6 流式细胞仪测定各组H9C2心肌细胞凋亡根据AnnexinV-FITC细胞凋亡检测试剂盒的说明书,将收集的心肌细胞用AnnexinV-FITC和碘化丙啶(Propidium Iodide,PI)进行标记,然后用流式细胞仪检测各组H9C2心肌细胞凋亡率,将488 nm设为激发波长,将530 nm设为发射波长。
1.2.7 实时荧光定量逆转录聚合酶链反应(Real-time RT-PCR)常规方法提取各实验组肥大心肌细胞总RNA后,通过逆转录生成cDNA片段,然后根据SYBR Green试剂盒的说明书扩增这些DNA。ACE (GenBank Accession NM012544)引物序列:上游引物5′-GCCTCCCAACGAGTTAGAAGAG-3′,下游引物5′-CGGGACGTGGCCATTATATT-3′。GAPDH (GenBank Accession No NM017008)引物序列:上游引物5′-GACAACTTTGGCTCGTGGA-3′,下游引物5′-ATGCAGGGGTTCTGG-3′。采用2-ΔΔCT方法计算ACE mRNA的表达(GAPDH作为内参)。
1.2.8 Western-blot法检测ACE、Bcl-2和Bax蛋白表达首先提取细胞内的蛋白和测定蛋白的浓度,然后等量的蛋白样品进行SDS-PAGE凝胶电泳、转膜、洗膜、封闭、杂交,最后进行化学发光及显影、定影。用Leica图像分析软件对每个条带进行灰度分析。一抗的稀释倍数(ACE,1:500;Bcl-2,1:500;Bax,1:500;β-actin,1:1 000)。
1.2.9 酶联免疫吸附测定(ELISA)心肌细胞培养液中Ang Ⅱ的浓度根据Ang Ⅱ ELISA试剂盒的说明书测定心肌细胞培养液中Ang Ⅱ的浓度。
1.2.10 统计学分析所有数据用均数±标准差表示(x±s),组间比较采用单因素的方差分析,所有资料使用SPSS 13.0统计软件处理,P<0.05为差异有统计学意义。
2 结果 2.1 H9C2心肌细胞的转染率ACE-shRNA质粒转染H9C2心肌细胞48 h后,转染率是(76.8±5.1)%(图 1)。
|
图 1 质粒转染H9C2心肌细胞48 h后的效果(×200) |
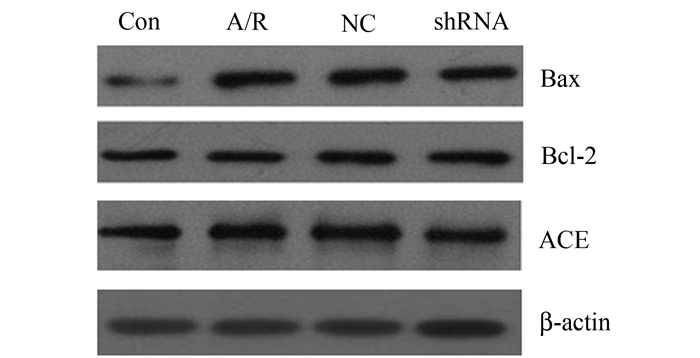
H9C2心肌细胞遭受A/R后,心肌细胞ACE mRNA和蛋白表达明显增加(P<0.05);然而,与A/R组相比,shRNA组H9C2心肌细胞内ACE mRNA和蛋白表达明显降低(P<0.05)(图 2和表 1)。
|
图 2 各组H9C2心肌细胞内ACE、Bax和Bcl-2蛋白表达水平 |
| 表 1 各组H9C2心肌细胞ACE表达水平的变化(x±s) |
在A/R之后,与正常对照组相比,A/R组的H9C2心肌细胞的存活率明显降低(P<0.05);与A/R组比较,shRNA组的H9C2心肌细胞的存活率明显升高(P<0.05) (表 2)。
| 表 2 各组H9C2心肌细胞存活率和凋亡率的变化(x±s) |
H9C2心肌细胞A/R后,心肌细胞AngⅡ水平明显增加(P<0.05);与A/R组相比,ACE-shRNA质粒转染明显抑制了A/R诱导的H9C2心肌细胞内AngⅡ水平的升高(P<0.05)(表 3)。
| 表 3 各组H9C2心肌细胞培养基中Ang Ⅱ水平的变化(x±s) |
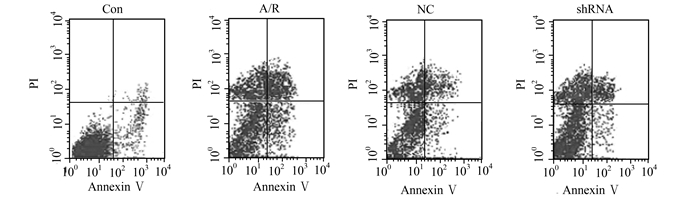
在正常对照组中,H9C2心肌细胞的自发性凋亡是很少的,A/R诱导H9C2心肌细胞凋亡明显增加(P<0.05);与A/R组相比,ACE-shRNA质粒转染明显抑制了A/R诱导的H9C2心肌细胞凋亡(P<0.05)(图 3和表 2)。
|
图 3 各组H9C2心肌细胞凋亡水平 |
H9C2心肌细胞A/R后,H9C2心肌细胞Bcl-2和Bax蛋白水平及Bax/Bcl-2比值明显增加(P<0.05);与A/R组相比,ACE-shRNA质粒转染后明显抑制了A/R诱导的H9C2心肌细胞内Bax蛋白水平及Bax/Bcl-2比值升高,而促进了A/R诱导的H9C2心肌细胞内Bcl-2蛋白表达升高(P<0.05)(图 2,表 4)。
| 表 4 各组H9C2心肌细胞凋亡相关因子Bax和Bcl-2蛋白表达水平的变化(x±s) |
血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)能通过降低AngⅡ的水平来抑制I/R诱导的心肌细胞凋亡。虽然ACEI能降低心肌梗死患者的发病率和死亡率,但是在长期使用ACEI后,血浆和心脏内的ACE水平会反馈性的升高[3],因此ACEI难以完全阻断ACE的作用。RNAi是一种基因沉默的新技术,能减少对疾病不利的基因和蛋白的表达,从而可用于治疗疾病。本研究发现A/R使H9C2心肌细胞的活性明显降低,而抑制ACE基因表达减轻了A/R诱导的H9C2心肌细胞损伤和凋亡。这说明H9C2心肌细胞内的ACE基因沉默对A/R诱导的H9C2心肌细胞损伤和凋亡有保护作用。因此,为了避免使用ACEI时ACE水平反馈性的升高和更加全面的阻断ACE对心肌梗死的不良影响,ACE基因沉默可能是一种更好的方式。
心肌梗死后不久心肌细胞开始凋亡,在再灌注的过程中,心肌细胞的凋亡会更加明显。Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中Caspase-3为关键的执行分子。Caspase-3的活性在I/R损伤中明显增加。在本研究中也发现的H9C2心肌细胞的凋亡和Caspase-3的活性在A/R后明显增加。在A/R前48 h用ACE-shRNA质粒转染H9C2心肌细胞可降低ACE基因表达和AngⅡ水平,从而抑制A/R诱导的H9C2心肌细胞凋亡和Caspase-3的活性升高。这说明细胞内的RAS在A/R诱导的心肌细胞凋亡中发挥了重要作用。沉默细胞内的ACE基因有抗细胞凋亡作用,保护A/R诱导的心肌细胞损伤。虽然ACE基因沉默和ACEI都能降低AngⅡ水平,但是ACE基因沉默不会像ACEI那样反馈性的引起ACE水平升高[3]。这可能是在I/R中,ACE基因沉默与ACEI抗凋亡作用的本质区别。这也说明,除了抑制全身的ACE外,沉默心肌细胞内的ACE基因也可能是另一种抑制心肌细胞I/R损伤的方法。
Bcl-2家族是细胞内凋亡途径的主要调节者。Bcl-2是抗凋亡家族中的一员,能通过防止线粒体细胞色素C的释放而抑制细胞凋亡,相反,Bax是促凋亡家族中的一员,能通过促进线粒体细胞色素C的释放而诱导细胞凋亡。在线粒体凋亡途径中,Bcl-2与Bax的比值很重要。与一般的小鼠相比,过表达Bcl-2或Bax基因敲除的小鼠在I/R后心肌梗死面积和细胞凋亡均明显减少[4, 5]。缺氧通过上调心肌细胞内Bax的水平而诱导P53的表达,从而促进细胞凋亡。本研究也发现,在A/R后,随着H9C2心肌细胞内Bcl-2与Bax比值升高,细胞凋亡明显增加,而ACE基因沉默明显抑制了A/R诱导的Bcl-2与Bax的比值升高,相应地抑制了Caspase-3的活性和降低了A/R诱导的细胞凋亡。这说明心肌细胞内ACE基因沉默抑制A/R诱导的细胞凋亡与调节心肌细胞内的线粒体凋亡途径有关。
除了全身的RAS外,一些研究已证实在心肌细胞、成纤维细胞和血管平滑肌细胞等细胞内也存在自身的RAS[6, 7]。Singh等发现糜蛋白酶负责高糖状态下AngⅡ生成[8],而ACE和糜蛋白酶均参与了心肌细胞I/R损伤中AngⅡ生成[9]。本研究发现,ACE基因沉默明显减少了A/R诱导的H9C2心肌细胞内ACE表达和AngⅡ水平升高,这说明ACE参与了H9C2心肌细胞A/R后的AngⅡ生成。体内的研究往往很难区别抑制细胞内RAS和全身RAS在防止I/R损伤中作用,而本次体外研究证实了抑制细胞内RAS在减轻I/R损伤中作用和可能的机制。
| [1] | Burniston JG, Saini A, Tan LB, et al. AngiotensinⅡ induces apoptosis in vivo in skeletal, as well as cardiac, muscle of the rat[J]. Exp Physiol, 2005, 90(5): 755-761. DOI: 10.1113/expphysiol.2005.030908. |
| [2] | Chen H, Li D, Roberts GJ, et al. Eicosapentanoic acid inhibits hypoxia-reoxygenation-induced injury by attenuating upregulation of MMP-1 in adult rat myocytes[J]. Cardiovasc Res, 2003, 59(1): 7-13. DOI: 10.1016/S0008-6363(03)00349-3. |
| [3] | Costerousse O, Allegrini J, Clozel JP, et al. Angiotensin Ⅰ-converting enzyme inhibition but not angiotensinⅡ suppression alters angiotensin Ⅰ-converting enzyme gene expression in vessels and epithelia[J]. J Pharmacol Exp Ther, 1998, 284(3): 1 180-1 187. |
| [4] | Brocheriou V, Hagege AA, Oubenaissa A, et al. Cardiac functional improvement by a human Bcl-2 transgene in a mouse model of ischemia/reperfusion injury[J]. J Gene Med, 2000, 2(5): 326-333. DOI: 10.1002/(ISSN)1521-2254. |
| [5] | Hochhauser E, Kivity S, Offen D, et al. Bax ablation protects against myocardial ischemia-reperfusion injury in transgenic mice[J]. Am J Physiol Heart Circ Physiol, 2003, 284(6): H2 351-H2 359. DOI: 10.1152/ajpheart.00783.2002. |
| [6] | Re R. Intracellular renin-angiotensin system: the tip of the intracrine physiology iceberg[J]. Am J Physiol Heart Circ Physiol, 2007, 293(2): H905-H906. DOI: 10.1152/ajpheart.00552.2007. |
| [7] | Kumar R, Singh VP, Baker KM. The intracellular renin-angiotensin system in the heart[J]. Curr Hypertens Rep, 2009, 11(2): 104-110. DOI: 10.1007/s11906-009-0020-y. |
| [8] | Singh VP, Le B, Bhat VB, et al. High-glucose-induced regulation of intracellular ANG II synthesis and nuclear redistribution in cardiac myocytes[J]. Am J Physiol Heart Circ Physiol, 2007, 293(2): 939-948. DOI: 10.1152/ajpheart.00391.2007. |
| [9] | Kumar R, Boim MA. Diversity of pathways for intracellular angiotensin Ⅱ synthesis[J]. Curr Opin Nephrol Hypertens, 2009, 18(1): 33-39. DOI: 10.1097/MNH.0b013e32831a9e20. |
 2016, Vol. 37
2016, Vol. 37

