压力性尿失禁(stress urinary incontinence, SUI)是指在逼尿肌松弛的状态下由于腹压增加导致不自主的尿液溢出,严重影响患者生活质量。目前认为其发病机制与盆底结缔组织和韧带的支持力减弱及尿道高移动性有关[1]。胶原(collagen, Col)是韧带起支持作用的主要成分,具有抗拉伸和控尿作用,其含量、强度和网状排列是维持其功能的重要影响因素[2]。研究发现SUI患者盆底胶原含量较正常妇女明显减少,提示盆底支持组织中胶原蛋白的异常改变与女性压力性尿失禁有关[3]。多项临床研究发现[4, 5],盆底电刺激(pelvic electrical stimulation, PES)对于中轻度的SUI患者具有较好的临床疗效。本研究旨在通过电刺激治疗SUI模型小鼠,观察其对SUI小鼠盆底组织中Ⅰ、Ⅲ型胶原(ColⅠ, ColⅢ)代谢的变化,以探讨电刺激治疗SUI的有效性及其机制,为临床治疗和预防SUI提供理论依据。
1 材料与方法 1.1 实验动物与分组选用8-10周龄SPF级健康未生育C57BL/6雌鼠40只(由武汉大学实验动物中心提供),体质量(19±10) g。采用随机数字法将小鼠分为4组,根据处理方法分为正常对照组(Con)、阴道扩张组(VD)、阴道扩张+电刺激频率为20 Hz(VD+ES20)、阴道扩张+电刺激频率为50 Hz(VD+ES50) 4组,每组各10只。
1.2 动物模型及处理方法 1.2.1 压力性尿失禁模型制备参照本课题组既往研究基础[6],采用球囊阴道扩张法模拟产伤。小鼠适应性喂养1周后进入实验。使用水合氯醛(4%)腹腔注射麻醉,采用校正6-Fr弗利导尿管,润滑后插入阴道,用5/0丝线缝合阴道口固定并输注生理盐水制备阴道扩张球囊,向其灌注0.3 ml生理盐水直至球囊直径达8 mm。1 h后放水并拔除。
1.2.2 电刺激装置搭建参照文献[7, 8],自制Y型阴道电极,将电极长端插入小鼠阴道内(约1.5 cm深),其余两头接电夹分别为正负极并固定,接入Power Lab生理信号采集系统,使用LabChart7.2(Windows 7)软件调整参数为恒流2 mA,频率分别为20 Hz(低频电刺激)和50 Hz(高频电刺激)。见图 1。15 min后拔除电极,每日电刺激治疗1次,连续治疗7 d。

|
图 1 电刺激小鼠装置模式图 |
磷酸盐缓冲液(PBS)(吉诺生物医药技术有限公司);BCA蛋白检测试剂盒(上海碧云天生物技术研究所);抗体β-actin、ColⅠ和ColⅢ(英国,Abcam);Ⅰ型胶原单克隆鼠抗(英国,abcam,ab6308);Ⅲ型胶原单克隆兔抗(Proteintech,13548-1-AP);羊抗小鼠IgG绿色荧光FITC标记抗体(武汉博士德生物工程有限公司,BA1101);羊抗兔IgG红色荧光Cy3标记抗体(武汉博士德生物工程有限公司,BA1032);PowerLab生理信号采集系统(澳大利亚ADInstrument,PTB4868/1);0.35 mm×50 mm华佗牌针灸针(苏州医疗用品厂);正置荧光显微镜(日本,Olympus);Odyssey红外荧光扫描成像系统。
1.4 试验方法 1.4.1 干预措施空白对照组(Con)置于普通笼中饲养,不予任何干预措施。阴道扩张组(VD)采用1.2.1中球囊扩张法制备。阴道扩张+电刺激频率为20 Hz(VD+ES20)和阴道扩张+电刺激频率为50 Hz(VD+ES50)在VD组基础上,连续于同一时间段进行电刺激治疗7 d,两组分别选用20 Hz(低频电刺激)和50 Hz(高频电刺激)进行治疗。第8天时4组小鼠进行膀胱置管,在4%水合氯醛腹腔浸润麻醉后,以活力碘消毒腹壁皮肤,沿腹中线于耻骨联合上方作1.5 cm纵切口打开腹壁及腹膜,用平镊轻柔暴露膀胱,先以6/0带针缝合线沿膀胱底部作荷包缝合,然后用注射器针头于荷包中央区域行膀胱造口,并将硬膜外导管置入膀胱,最后打结固定。检查缝合处有无漏液,确保尿道口通畅。将硬膜外导管沿腹部皮下穿刺至颈后,并将导管末端封闭后,包埋于皮下并缝合皮肤,待尿动力检测时连接三通使用。置管后第2天4组共同行尿动力学检测,之后处死取材。
1.4.2 尿动力学检测膀胱置管后第2天,使用4%水合氯醛进行腹腔浸润麻醉,消毒颈部皮肤后取出皮下埋置的膀胱硬膜外导管,通过三通管与尿动力学检测仪(Nidoc 970A+金锐)相连,三通管的另一接口与微量输液泵(3MAVI270 infusionpump,美国)相连。用无菌生理盐水充满管道,保证管道内无空气。排空小鼠膀胱后,微泵向膀胱内注入美蓝染色生理盐水,以尿道口出现第1滴蓝色液体为准,记录当时的膀胱容量和膀胱内压分别为最大膀胱容量(MBC)和膀胱漏点压(BLPP);排空膀胱,灌注至MBC体积一半时,用手指缓缓按压大鼠上腹部使腹压逐渐上升来模拟Valsalva动作,若有尿液溢出,此时膀胱压即为腹压漏尿点压(ALPP),取3次测量的平均值。
1.4.3 取材取小鼠阴道前壁和尿道组织为标本,用生理盐水冲洗干净后冻存于-80 ℃冰箱低温保存。
1.4.4 免疫荧光双标记采用常规顺序标记法,取切片放于室温,复温水化后,5%羊血清室温封闭30 min,加入Ⅰ型胶原单克隆鼠抗(1:200)4 ℃过夜,加入二抗羊抗小鼠IgG绿色荧光FITC标记抗体(1:100),37 ℃孵育1 h。然后用5%羊血清再次封闭30 min,加入Ⅲ型胶原单克隆兔抗(1:100),37 ℃孵育2 h,加入羊抗兔IgG红色荧光Cy3标记抗体(1:100),37 ℃孵育1 h。随后滴加DAPI避光孵育5 min,对标本进行染核,PBST 5 min×4次洗去多余的DAPI。用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。采用Image pro plus软件对胶原荧光值和面积比进行分析。实验独立重复3次。
1.4.5 Western-blot检测取小鼠阴道前壁组织约100 mg,液氮研磨后加入PMSF蛋白裂解液,充分混匀后4 ℃、12 000 r/min离心5 min,取上清,采用BCA蛋白浓度测定试剂盒(上海碧云天生物技术研究所)检测样品的蛋白浓度,加入适量5×蛋白上缓冲液(谷歌生物技术有限公司)后煮沸8 min使蛋白变性,使用12%的SDS-PAGE凝胶电泳分离蛋白样本,然后将凝胶上分离的蛋白电转至PVDF膜上,5%脱脂奶粉封闭1 h,加入一抗4 ℃孵育过夜,Col Ⅰ(1:500)、Col Ⅲ(1:500)、β-actin(1:1 000)。PBS漂洗3遍后,二抗室温孵育1 h,再次用PBS漂洗3遍,使用Odyssey红外荧光扫描成像系统扫膜并分析条带。实验独立重复3次。
1.4.6 统计学方法应用SPSS 22.0和GraphPad Prism 5.0统计软件进行分析,多组间整体差异采用单因素方差分析,两两比较采用Dunnet t检验,多重比较采用Tukey检验,实验数据均以x±s表示,采用平均值±1.96倍标准差(x±1.96s)初步估计小鼠尿流动力学指标参考值的正常范围,以P<0.05表示差异有统计学意义。
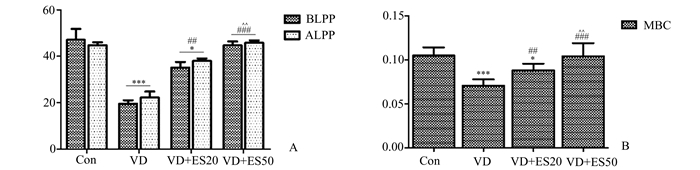
2 结果 2.1 对照组小鼠尿流动力学指标正常参考值范围评估为确定对照组小鼠MBC、BLPP及ALPP的正常参考值范围,取95%为百分界限范围内尿动力学参数用于分析。MBC、BLPP、ALPP的95%百分范围、x±1.96s、95%CI如表 1所示。经K-S检验,MBC(D=0.136, P=0.164)、BLPP(D=0.152, P=0.095)、ALPP(D=0.121, P=0.200)三组数据均符合正态分布。以±1.96 s初步估计对照组小鼠MBC、BLPP及ALPP的正常参考值范围,结果显示,对照组小鼠的正常参考值范围为MBC 0.076-0.161 ml、BLPP 35.950-62.803 cmH2O、ALPP 36.066-57.784 cmH2O;而VD小鼠(10只)尿动力学指标分别为MBC(0.049±0.071) ml、BLPP(19.576±5.504) cmH2O、ALPP(22.719±5.620) cmH2O,明显低于正常参考值。
| 表 1 对照组小鼠尿动力学指标正常参考值范围 |
尿动力学检测可用来评估膀胱尿道肌肉功能,从而能鉴定VD小鼠的造模效果和反映电刺激治疗的疗效。VD组小鼠的MBC和LPPs较Con组明显降低(P<0.001),提示经球囊阴道扩张后的小鼠造模成功。与VD组相比,VD+ES20组和VD+ES50组小鼠的MBC和LPPs值明显升高(P<0.001),其中VD+ES20组与Con组相比差异有统计学意义(P<0.05)。这提示对SUI小鼠进行电刺激治疗能延缓或改善尿失禁的症状,改善SUI小鼠膀胱尿道肌肉功能。同时,高频电刺激(50 Hz)对SUI小鼠膀胱尿道肌肉的治疗效果更佳。见表 2和图 2。
|
图 2 4组小鼠尿动力学检测变化 A.4组小鼠LPPs值;B.4组小鼠MBC值;与Con组相比,*P<0.05,***P<0.001;与VD组相比,##P<0.01,###P<0.001;与VD+ES20组相比,^P<0.05,^^P<0.01 |
| 表 2 4组小鼠尿动力学检测值(x±s, N=40) |
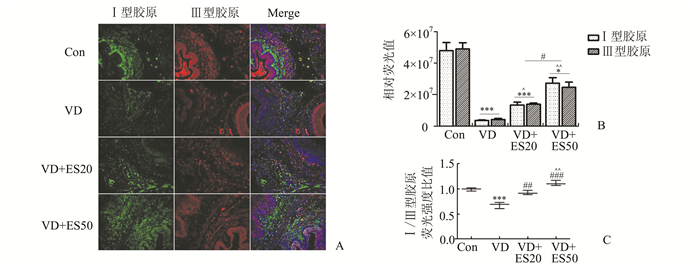
Ⅰ型胶原标记为绿色,Ⅲ型胶原标记为红色,Ⅰ、Ⅲ型胶原共同标记复合为黄色。结果显示,Ⅰ、Ⅲ型胶原共同表达于粗纤维,位于胞膜和细胞外基质中,呈线性表达;Ⅲ型胶原主要表达于细纤维,但细纤维中也有少量Ⅰ型胶原表达。Con组小鼠盆底组织样本中,尿道周围被一层平滑肌包围,其中Ⅰ、Ⅲ型胶原纤维密集有序,胶原纤维细长、排列紧密成束。而VD组小鼠盆底组织中,Ⅰ、Ⅲ型胶原阳性产物明显变弱(P<0.001),且形态脆裂、排列变得稀疏紊乱,Ⅰ/Ⅲ型胶原比明显下降(P<0.001)。当VD组小鼠经过7 d的电刺激治疗后,VD+ES20组和VD+ES50组较VD组小鼠盆底组织中Ⅰ、Ⅲ型胶原纤维数量明显增多(P<0.05,P<0.01)、阳性反应也较强,排列由松散变连续,在局部呈线性表达,Ⅰ/Ⅲ型胶原比升高(P<0.01,P<0.001)。其中,VD+ES50组的小鼠盆底组织样本中胶原纤维含量较VD+ES20组多(P<0.05),Ⅰ/Ⅲ型胶原比也较高(P<0.01)。
|
图 3 4组小鼠盆底组织Ⅰ/Ⅲ型胶原免疫荧光双标结果(×200) A.FITC绿色荧光标记Ⅰ型胶原,Cy3红色荧光标记Ⅲ型胶原,DAPI染核,Merge为FITC、Cy3与DAPI的融合图;B.相对荧光值;C. Ⅰ/Ⅲ型胶原相对荧光值比值; 与Con组相比,*P<0.05,***P<0.001;与VD组相比,##P<0.01,###P<0.001;与VD+ES20组相比,^P<0.05,^^P<0.01 |
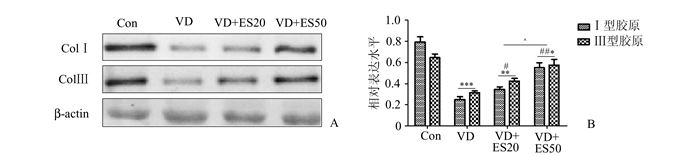
与Con组相比,VD组小鼠盆底组织中ColⅠ、Ⅲ蛋白表达显著降低(P<0.001);经电刺激干预后的VD+ES20组和VD+ES50组较VD组小鼠盆底组织中ColⅠ、Ⅲ蛋白表达明显增多(P<0.05,P<0.01),但其蛋白表达与Con组比仍存在统计学差异(P<0.01)。此外,VD+ES50组的小鼠盆底组织样本中ColⅠ、Ⅲ蛋白表达较VD+ES20组多(P<0.05)。
|
图 4 4组小鼠盆底组织Ⅰ/Ⅲ型胶原蛋白表达结果 A:蛋白电泳图;B:Ⅰ/Ⅲ型胶原蛋白表达相对灰度值(蛋白表达水平/内参);与Con组相比,*P<0.05,***P<0.001;与VD组相比,#P<0.05,##P<0.01, ###P<0.001;与VD+ES20组相比,^P<0.05 |
女性控尿机制包括主动机制、解剖结构的支持和尿道黏膜闭合机制。控尿的主动机制由尿道括约肌和平滑肌的主动收缩来完成。盆底支持系统由肌肉群、筋膜、韧带及神经构成,韧带主要成分是平滑肌和结缔组织,而结缔组织中胶原纤维是韧带起支持作用的主要成分,具有抗拉伸和控尿作用,其含量、强度和网状排列是维持其功能的重要影响因素[9]。既往研究表明[10],膀胱、尿道的韧带和盆底筋膜主要由Ⅰ、Ⅲ型胶原组成,Ⅰ型胶原直径较粗,具有很高的抗张强度,主要起支持作用;Ⅲ型胶原直径较细,与弹性作用有关。Ⅰ/Ⅲ型胶原比例可控制胶原纤维的粗细。胶原蛋白的含量、比例、形态结构和代谢异常均会减弱盆底结缔组织及尿道周围组织的支持力[11]。压力性尿失禁患者盆底组织中胶原纤维变萎缩,导致盆底筋膜组织松弛、膀胱和尿道解剖位置改变、尿道阻力降低,从而发生排尿功能障碍。
电刺激治疗SUI患者是一种新兴的非手术治疗方法,主要利用脉冲电流刺激盆底肌肉及周围神经。电刺激对膀胱也有一定的影响,能改善膀胱颈的闭合功能,从而有效预防尿失禁[12]。研究证实[5],盆底电刺激(PES)对轻中度SUI的治疗中,绝经前患者有效率可达84%,绝经后患者总有效率则高达100%。目前临床上对SUI的评价方法主要为尿失禁生活质量问卷(I-QOL)和尿动力学分析,包括检测膀胱最大容量、尿道最大测量压、最大尿流率时逼尿肌压、尿道最大闭合压力以及Valsalva漏尿点压。本实验利用野生型C57BL/6雌鼠通过阴道球囊扩张法(VD)制备SUI小鼠模型,并测量尿动力学,结果显示VD组小鼠平均LPPs和MBC值与Con组相比明显下降(P<0.001),与临床研究结果相符,提示本方法造模成功;而经7 d的电刺激治疗后,VD+ES20和VD+ES50组小鼠尿动力学指标与VD组相比均有明显提高(P<0.01,P<0.001)。该尿动力学分析结果证明了盆底电刺激能有效减轻SUI小鼠的症状,改善其膀胱尿道肌肉功能。此外,我们发现采用50 Hz的高频电刺激疗效较20 Hz的低频电刺激好,这与文献中针对快肌收缩的电刺激最佳参数为50-66 Hz方波脉冲[13]结果一致,但该研究表明针对慢肌收缩的电刺激最佳参数为20-33 Hz方波脉冲。这可能与本实验中SUI造模采用急性损伤(VD法)而更多诱导快肌(Ⅱ型肌纤维)代偿和损伤相关,而其内在机制值得我们进一步研究。
目前关于PES治疗SUI的作用机制报道不多,主要认为其机制与改善阴部神经功能、激活肌肉纤维和影响细胞外基质的代谢及重构有关[14]。电刺激疗法已被发现[15]可促进皮肤成纤维细胞增殖、TGF β1蛋白表达增多、α平滑肌肌动蛋白及Ⅰ型胶原的沉积和重塑,从而加速皮肤伤口愈合。目前认为盆底胶原含量减少、连接减弱、Ⅰ/Ⅲ型胶原比降低使尿道周围组织支持力减弱,而电刺激可调节与组织重塑相关的一系列因素,如上调细胞活性、迁移和蛋白合成速率[14]。本实验中,我们发现与Con组相比,SUI模型小鼠盆底组织中Ⅰ、Ⅲ型胶原含量下降(P<0.001)、Ⅰ/Ⅲ型胶原比值下降(P<0.001),且荧光显微镜下其胶原纤维形态变脆裂、稀疏和无序。但VD+ES20和VD+ES50组小鼠盆底组织中Ⅰ、Ⅲ型胶原含量较VD组上升(P<0.05,P<0.01)、Ⅰ/Ⅲ型胶原比值上升(P<0.01,P<0.001),胶原纤维排列由松散变为连续和束状。且VD+ES50组小鼠盆底组织中Ⅰ、Ⅲ型胶原含量上升较VD+ES20组多(P<0.05)。提示盆底电刺激治疗能增加SUI小鼠盆底支持组织中Ⅰ、Ⅲ型胶原含量及Ⅰ/Ⅲ型胶原比值,从而使盆底组织的支持作用增强,改善尿失禁症状。
综上,本实验通过尿动力学指标检测证实了PES对SUI小鼠具有显著治疗作用,经ES治疗后的SUI小鼠膀胱尿道肌功能明显上升,以高频电刺激(50 Hz)显著,这与组织病理学观察一致,从在体实验层面证实了ES对SUI的疗效。其机制可能与上调Ⅰ、Ⅲ型胶原表达、改变Ⅰ/Ⅲ型胶原比例,从而促进胶原代谢,加强盆底支持组织结构有关。
| [1] | Medina CA, Costantini E, Petri E, et al. Evaluation and surgery for stress urinary incontinence: A FIGO working group report[J]. Neurourol Urodyn, 2017, 36(2): 518-528. DOI: 10.1002/nau.v36.2. |
| [2] | Boraschi-Diaz I, Wang J, Mort JS, et al. Collagen type Ⅰ as a ligand for receptor-mediated signaling[J]. Frontiers in Physics, 2017, 5: 12. DOI: 10.3389/fphy.2017.00012. |
| [3] | Chen BH, Wen Y, Li H, et al. Collagen metabolism and turnover in women with stress urinary incontinence and pelvic prolapse[J]. Int Urogrnecól J Pelvic Floor Dysfunct, 2002, 13(2): 80-87. DOI: 10.1007/s001920200020. |
| [4] | Schmitt JJ, Singh R, Weaver AL, et al. Prospective outcomes of a pelvic floor rehabilitation program including vaginal electrogalvanic stimulation for urinary, defecatory, and pelvic pain symptoms[J]. Female Pelvic Medicine & Reconstructive Surgery, 2017, 23(2): 108-113. |
| [5] | Xu H, Liu B, Wu J, et al. A pilot randomized placebo controlled trial of electroacupuncture for women with pure stress urinary incontinence[J]. PLoS One, 2016, 11(3): e0150821. DOI: 10.1371/journal.pone.0150821. |
| [6] |
李洋, 洪莉, 刘成, 等. 压力性尿失禁小鼠模型造模方法的对比[J].
中华实验外科杂志, 2017, 34(1): 158-161.
Li Y, Hong L, Liu C, et al. Comparison and analysis of three types of stress urinary incontinence mice models[J]. Chinese Journal of Experiment Surgery, 2017, 34(1): 158-161. |
| [7] | Dobberfuhl AD, Spettel S, Schuler C, et al. A novel cystometric model of pelvic floor dysfunction after rabbit pelvic floor noxious electrical stimulation[J]. Female Pelvic Medicine & Reconstructive Surgery, 2016, 22(4): 248-253. |
| [8] | Luttrell IP, Swee M, Starcher B, et al. Erectile dysfunction in the type Ⅱ diabetic db/db mouse: impaired venoocclusion with altered cavernosal vasoreactivity and matrix[J]. American Journal of Physiology Heart & Circulatory Physiology, 2008, 294(2): 2204-2211. |
| [9] | Seth J, Naaseri S, Solomon E, et al. Correlation of MRI features of urethral diverticulum and stress urinary incontinence[J]. European Urology Supplements, 2017, 16(3): e1 775-e1 776. DOI: 10.1016/S1569-9056(17)31070-9. |
| [10] | Pantatosakis E, Karandrea D, Liapis E, et al. Immunohistochemical expression of hormonal receptors, collagen, elastin, and proteoglycans in genuine urinary incontinence[J]. Clinical & Experimental Obstetrics & Gynecology, 2016, 43(6): 849-852. |
| [11] | Rechberger T, Postawski K, Jakowicki JA, et al. Role of fascial collagen in stress urinary incontinence[J]. American Journal of Obstetrics & Gynecology, 1998, 179(6 Pt 1): 1511-1514. |
| [12] | Robert T, Bozena D, Maciej K, et al. Transvaginal electrical stimulation with surface-EMG biofeedback in managing stress urinary incontinence in women of premenopausal age: a double-blind, placebo-controlled, randomized clinical trial[J]. International Urogynecology Journal, 2013, 24(10): 1631-1638. DOI: 10.1007/s00192-013-2071-5. |
| [13] | Wyndaele JJ. Study on the influence of the type of current and the frequency of impulses used for electrical stimulation on the contraction of pelvic muscles with different fibre content[J]. Scandinavian Journal of Urology, 2016, 50(3): 228-233. DOI: 10.3109/21681805.2016.1142473. |
| [14] | Richmond CF, Martin DK, Yip SO, et al. Effect of supervised pelvic floor biofeedback and electrical stimulation in women with mixed and stress urinary incontinence[J]. Female Pelvic Medicine & Reconstructive Surgery, 2016, 22(5): 324-327. |
| [15] | Wang Y, Rouabhia M, Lavertu D, et al. Pulsed electrical stimulation modulates fibroblasts′ behaviour through the Smad signalling pathway[J]. J Tissue Eng Regen Med, 2017, 11(4): 1110-1121. DOI: 10.1002/term.2014. |
 2018, Vol. 39
2018, Vol. 39


