糖尿病心肌病以其独立于动脉粥样硬化、心肌肥厚、间质纤维化等[1, 2]的特性,发病机制尚待深入探讨。血栓素蛋白-1(thrombospondin-1, TSP-1)作为细胞外基质蛋白,主要调节细胞增殖、迁移与凋亡,因此在组织炎症、血管生成中发挥重要作用[1]。高糖血症与高血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)均为心肌纤维化的关键调节因素,能诱导TSP-1表达并激活转化生长因子(transforming growth factor-β1,TGF-β1),后者是胶原沉积纤维化的主要因素[2]。研究表明,TSP-1抑制血管生成,促进糖尿病性血管并发症例如动脉粥样硬化、糖尿病肾病或者糖尿病心肌病的发生。
尼可地尔(nicorandil),一种ATP敏感钾通道激活剂,因其类硝酸酯作用以及对微循环较好改善效果在冠心病领域已得到较广泛应用,尤其能有效缓解心肌梗死阶段的微血管痉挛[3]。研究显示,尼可地尔有效改善慢性阻塞性肺疾病心功能,增加氧供、通过MAPK途径抑制内皮素激活的血管平滑肌细胞增殖效应。本研究使用尼可地尔干预措施,比较糖尿病大鼠心肌TSP-1等指标以探讨其对心肌纤维化的影响。
1 材料与方法 1.1 试剂链脲佐菌素(Streptozocin,STZ)购自Sigma (St. Louis, USA)公司;兔抗鼠TSP-1抗体购自Neomarker公司(California, America),兔抗鼠TGF-β1多克隆抗体均购自Bioworld公司;DAB显色试剂盒及免疫组化SP试剂盒购自武汉博士德公司,血糖试纸及血糖仪购自拜耳公司;Ang Ⅱ放免试剂盒、HE染色试剂盒购自武汉博士德公司;Masson染色试剂盒购自福州迈新生物技术开发公司;动物高频彩色超声仪器(HRQ-2308A)。尼可地尔原药及安慰剂由默克雪兰诺公司友情赠予。
1.2 动物分组及动物模型复制雄性SD大鼠30只,体重210-250 g,购自湖北省疾病预防控制中心。动物随机分成3组:正常对照组,糖尿病空白对照组,尼可地尔处理组,每组10只。用0.1 mol/L, pH 4.2柠檬酸缓冲液将STZ配成1%的溶液,动物禁食12 h后,糖尿病空白对照组和尼可地尔处理组大鼠按50 mg/kg的剂量单次腹腔注射,正常对照组大鼠腹腔注射等剂量的柠檬酸缓冲液。72 h后断尾采血,用拜安捷血糖仪(拜尔公司)测血糖值,血糖值≥16.7 mmol/L者确定为糖尿病模型大鼠。模型成功后平均分为两组,一组糖尿病大鼠组每天给予10 mg/kg尼可地尔灌胃,另一组每天给予等量10 mg/kg安慰剂灌胃,饲养12周。
1.3 观察指标及方法 1.3.1 心功能及基本指标测定实验于12周时动物彩超获取心脏指标后断尾测定每只大鼠的血糖并称量体重。予2%戊巴比妥钠针左下腹腔注射麻醉大鼠,开胸取出心脏,用生理盐水清洗并分离左右心室,测量大鼠心脏重量、左心室重量。
1.3.2 HE染色观察心肌结构的变化4%甲醛溶液固定心肌组织石蜡包埋。左室心尖半平面制成4微米病理切片。切片二甲苯脱蜡,乙醇至水洗:苏木素染色盐酸乙醇分化;浸泡伊红液染色,透明封片观察。
1.3.3 Masson染色观察心肌组织中胶原纤维的表达及含量切片常规脱蜡至水;滴加100 μl Masson复合染色液染色脱水,二甲苯透明,中性树胶封片后显微镜下观察并摄片;随机选取5个视野,OlympusBX50显微镜摄像系统摄像,胶原纤维呈蓝色,肌肉呈红色,细胞核呈蓝褐色。用高清晰彩色图文报告分析系统分析,计算每个视野的心肌胶原面积与心肌总面积比值即心肌胶原容积分数。
1.3.4 免疫组化测定心肌组织ColⅠ、ColⅢ、TGF-β1和TSP-1蛋白的含量石蜡组织切片脱蜡后抗原修复封闭后;分别滴加ColⅠ(1:500稀释), ColⅢ(1:500稀释), TGF-β1 (1:500稀释)和TSP-1(1:500稀释)兔抗鼠多克隆抗体,4℃冰箱过夜;PBS缓冲液洗后滴加生物素标记的二抗IgG山羊抗兔工作液;DAB显色,苏木素复染,脱水透明,封片。阴性对照用PBS替代一抗。显微镜观察阳性结果组织染色呈棕黄色。OlympusBX50显微镜摄像系统摄像,采用高清晰彩色图文报告分析系统分析,以5个视野的光密度值(OD值)的平均值作为各标本的蛋白表达。
1.3.5 放免法检测心肌AngⅡ含量取左心室心尖100 mg心肌组织在1 mol/L冰乙酸匀浆后,按照放免法说明书检测心肌AngⅡ浓度。
1.3.6 RT-PCR检测心肌组织TSP-1 mRNA水平提取心肌组织RNA,RT-PCR反应严格按试剂盒说明书进行。引物序列如下:TSP1上游:5′-AAAGCGTCTTCACCAGAGACC,下游:5′-GCAGATGGTAACTGAGTTCTGA CA,产物长度496 bp;GAPDH上游:5′-CCATGGAAGGCTGGGG -3′,下游:5′-CAAAG TTGTCATGACC-3′,产物长度250 bp。引物由上海生工生物工程公司合成。PCR反应条件为94℃,3 min,35个循环包括94℃变性60 s,55℃复性60 s,72℃延伸90 s,最后72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳(含0.5℃ 5 mg/ml溴乙锭),3-5 V/cm电压下电泳约30 min, 采用Q550IW图像分析系统(Leica,德国)分析结果,将图像量化处理,以(目的基因面积×平均OD值)/(GAPDH面积×平均OD值)比值作为TSP-1 mRNA的表达量。
1.3.7 Western检测p38MAPK水平取-70℃保存的心肌组织约100 mg,加入预冷的蛋白裂解液0.5 ml充分裂解。4℃ 3 000 r/min离心10 min取上清。测定p38MAPK蛋白质含量。取100 μg蛋白加入上样缓冲液,煮沸3 min后进行12% SDS-聚丙烯酰胺凝胶电泳。转PVDF膜(Millipore corporation, Bedford, MA, USA),TTBS封闭液37℃封闭2 h,分别与兔抗小鼠p38MAPK多克隆抗体和兔抗小鼠P-p38MAPK单克隆抗体,4℃过夜,加入1:2 500稀释的辣根过氧化物酶标记的羊抗兔IgG二抗,37℃2 h,DAB显色。每组重复3次。Western blot条带信号强度(V)应用Kodak 1D图像分析软件进行定量分析。目的条带的相对含量=V目的条带/V对照组。对照组的相对含量为1.0,>1.0为表达阳性。
1.4 统计学处理采用SPSS 13.0软件进行分析。所有数据以均数±标准差(x±s)表示,两组比较采用t检验,多组间采用单因素方差分析One-way Anova,P<0.05认为差异有统计学意义。
2 结果 2.1 糖尿病大鼠基础指标糖尿病性心肌病发生与长期高血糖和AngⅡ的过度激活有关。实验结果支持模型组成功复制出高糖与高AngⅡ水平。结果显示糖尿病组体重显著下降,心脏指数增高,左室重构过度,心脏超声证实心功能下降。如表 1所示,心脏超声显示糖尿病组左室重构明显,左室射血分数下降[(71.6±3.5) mmol/L vs (83.5±3.1) mmol/L,P<0.05]。尼可地尔组LVEF与对照组比较有效被逆转,P<0.05,提示尼可地尔对改善糖尿病性心肌重构与提高心功能有一定作用。
| 表 1 3组大鼠心脏超声基本指标比较(n=10, x±s) |
表 2显示糖尿病组血糖明显高于对照组(P<0.05),体重明显低于对照组(P<0.05),心脏指数明显高于对照组(P<0.05),糖尿病组和尼可地尔组之间无明显差别(P>0.05)。
| 表 2 3组大鼠基本指标比较(x±s) |
HE染色显示,对照组心肌纤维走行正常,排列整齐、致密,结构清晰;而糖尿病组心肌间质纤维走行较为紊乱,心肌细胞肥大,扭曲,细胞间质界限不清;尼可地尔组仍可见心肌细胞水肿,肌纤维排列较稀疏,少量纤维组织变性。
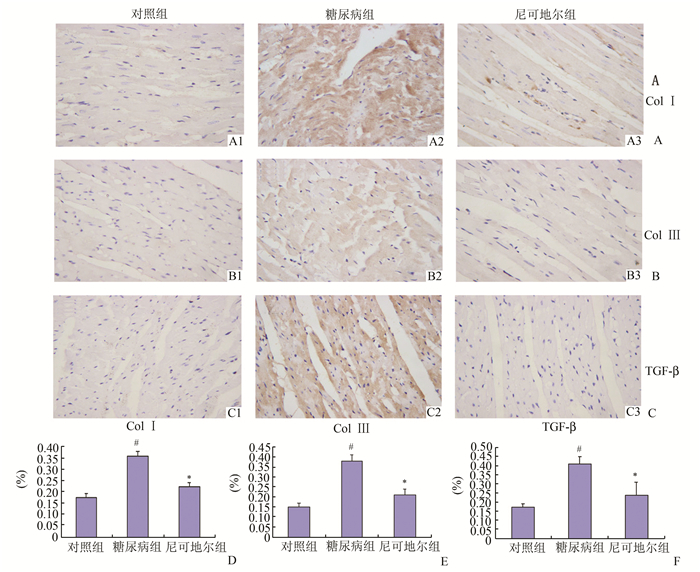
Masson染色,对照组心肌间质少量胶原纤维均匀分布,糖尿病组心肌间质胶原纤维和血管周围胶原纤维丰富,胶原纤维明显增加。尼可地尔组心肌间质和血管周围胶原纤维与糖尿病组比较减少(见图 1);半定量分析结果支持糖尿病组胶原含量明显增多(0.235 5±0.001 6 vs 0.137 4±0.001 7, P<0.01);与糖尿病对照组相比,尼可地尔组胶原含量明显降低(0.198 6±0.003 4 vs 0.235 5±0.001 6, P<0.01)(见图 2)。

|
图 1 糖尿病大鼠左室Masson’s染色结果 |
|
图 2 心肌组织Col Ⅰ, Col Ⅲ,TGF-β1免疫染色结果(×100) |
心肌组织胶原蛋白Ⅰ、Ⅲ以及TGF-β1特异性染色,结果进一步证实,糖尿病组TGF-β1蛋白表达与心肌间质胶原含量一样均显著增加(见图 2),对照组心肌组织TGF-β1呈弱阳性表达,糖尿病组心肌组织TGF-β1呈强阳性表达;尼可地尔处理后TGF-β1呈弱阳性表达,提示尼可地尔处理后心肌TGF-β1蛋白下调。
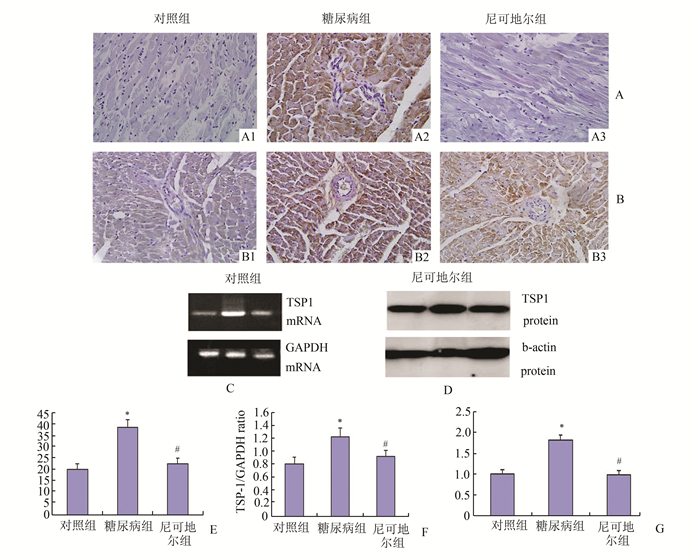
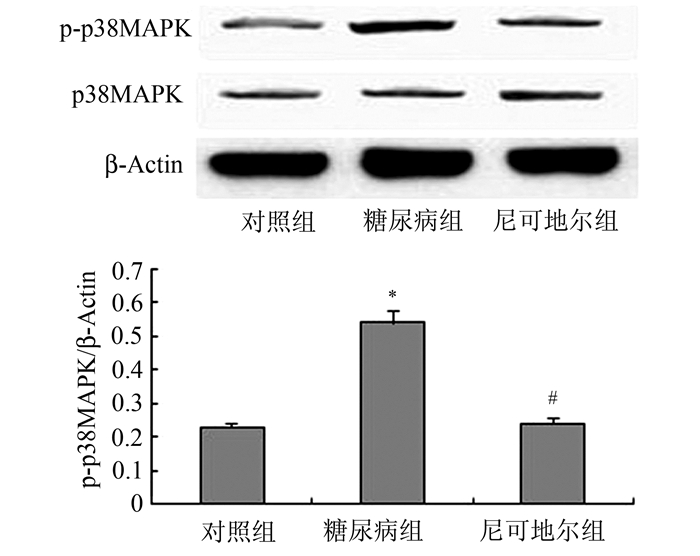
2.3 TSP-1在糖尿病心肌病发展中的调控作用检测糖尿病心肌组织中TSP-1mRNA (RT-PCR)及蛋白质水平(Western blot)(图 3)的表达以及与p38MAPK的关联(图 4)。与对照组比较,糖尿病组TSP-1 mRNA水平上调(P<0.05),但尼可地尔组TSP-1 mRNA下调,结果与Western blot检测的TSP-1蛋白质水平一致(图 3)。与糖尿病组比较,尼可地尔组TSP-1 mRNA与蛋白质水平均减轻(P<0.05),提示尼可地尔减轻糖尿病心肌组织TSP-1过表达。实验进一步检测p38MAPK磷酸化变化。与对照组比较,糖尿病组p38MAPK磷酸化上调(P<0.05),但尼可地尔组p38MAPK磷酸化比值下调,与糖尿病组比较有显著差异(P<0.05,图 4)。
|
图 3 尼可地尔对糖尿病大鼠心肌组织TSP-1表达的影响 A、B:TSP-1免疫组化染色结果(×400);C:RT-PCR检测TSP-1 mRNA结果;D:Western blot检测TSP-1蛋白质水平。E、F、G分别显示TSP-1免疫组化、mRNA水平及蛋白质水平及各组间水平比较。与对照组比较, *P<0.05;与糖尿病组比较, #P<0.05 |
|
图 4 Western blot检测心肌组织p38MAPK水平 与对照组比较, *P<0.05;与糖尿病组比较, #P<0.05 |
本研究结果显示,TSP-1以及p38MAPK途径在糖尿病心肌病心肌纤维化过程中发挥重要作用,尼可地尔通过干预该途径有效缓解心肌受损过程。实验成功建立糖尿病模型,心脏超声、免疫组化及生化指标均支持所建立模型,左室功能受损,左室重构明显,心肌间质纤维化丰富。尼可地尔有效缓解糖尿病心肌纤维化过程。
糖尿病心肌病因其高糖带来的损害,其发病机制不同于动脉粥样硬化过程,临床特点也有其独特之处,尚无明显冠脉病变时,已经出现心室重构、心肌凋亡明显,心肌间质纤维化程度较重,微循环障碍更为突出[1, 2]。研究使用STZ诱导糖尿病左室重构,其心脏指数从基础2.64±0.09增加至12周时的3.68±0.06。左室指数(mg/g)亦明显增加(2.00±0.09 vs 2.65±0.09)。糖尿病组心肌组织免疫组化进一步揭示左室纤维化程度加重,同时TSP-1 mRNA与蛋白质与TGF-β1、胶原蛋白Ⅰ、Ⅲ的高阳性率一样,均呈现明显阳性结果。
血浆中高糖与高Ang Ⅱ是心肌纤维化的强促进因素,实验中也检测到糖尿病组Ang Ⅱ高表达,心肌损害加重。肾素-血管紧张素-醛固酮(RAS)系统的激活在心肌病的发生中至关重要。心肌间质纤维化与心肌细胞肥大,均引致心脏功能障碍[4]。早先研究发现,抑制TSP-1和CD47的结合,缺血组织的血流及血管生成会增强;抑制胰腺TSP-1可以改善胰腺的再血管化与功能。之前有研究证实高糖与Ang Ⅱ两者均能诱导TSP-1表达,而TSP-1是体内激活TGF-β1[5]最强的因子,后者抑制血管生成,是糖尿病并发症的重要因素。体外实验证实高糖诱导内皮细胞TSP-1 mRNA表达。本实验进一步证实,TSP-1通过激活p38MAPK磷酸化,促进TGF-β1更强发挥促胶原间质增殖,下调胶原酶活性,减少降解,胶原在心肌组织堆积更为显著,过表达引起的细胞外基质过度沉积,严重影响心肌供血及收缩功能。
实验结果显示TSP-1在心肌纤维化过程中的重要作用,因此干预这一靶目标可能缓解糖尿病心肌病变进展。尼可地尔,是目前唯一在临床应用的KATP通道激活剂,能有效缓解冠心病尤其急性心肌梗塞微循环痉挛等临床情况,但少有研究报道其在心肌病的治疗效果。本实验结果提示尼可地尔在缓解糖尿病心肌纤维化进程中的作用。实验中尼可地尔对血糖无影响,但改善心功能指标,下调TSP-1和AngⅡ, 与Lu等的报道一致[6]。其减少心肌纤维化以及改善心功能可能与下调TSP-1和p38MAPK过程、上调ColⅠ、Ⅲ降解有关。胶原过度沉积促进纤维化进程,心肌组织硬化,心功能受损。尼可地尔开通线粒体KATP通道是其作用的关键机制,减少活性氧(ROS)生成,增加胶原沉积,增加冠脉血流[7]。
实验观察到尼可地尔对心肌纤维化的有益之处,但对深层药理机制尚需进一步研究。线粒体KATP通道是保护心肌缺血损伤极其重要的环节,有效维持微血管完整、减少顿抑[8]。尼可地尔除了钾通道开放作用,另一重要特点即类硝酸酯作用,能诱导NO, 增加细胞内cGMP表达。不仅扩张大的外周血管,也扩张冠脉微血管。本实验亦观察到心室功能的改善与Serizawa的报道一致[8]。研究分析这一作用与其内皮NO生成有关[9],其剂量依赖性抑制ROS生成,具有一定抗凝作用。线粒体ROS生成加重糖尿病大鼠心肌胶原沉积与纤维化,尼可地尔的保护效应更多来源于其对线粒体KATP通道的开放。
尼可地尔已经用于冠心病、慢性心衰、心肌梗死以及糖尿病肾病。本实验结果显示,尼可地尔一定程度抗纤维化作用与其抑制Ang Ⅱ水平、下调TSP-1及其后TGF-β1的致纤维化效应相关,使得高糖刺激下的心肌细胞间质胶原沉积改善、组织纤维化程度减轻,这一过程被认为有p38MAPK磷酸化参与。TSP-1在糖尿病大鼠心肌纤维化进展中的中心作用得到进一步证实,尼可地尔的有益效应亦通过这一途径,尼可地尔开通线粒体钾通道机制与这一途径之间的联系需要更进一步研究。
| [1] | Aragno M, Mastrocola R, Alloatti G, et al. Oxidative stress triggers cardiac fibrosis in the heart of diabetic rats[J]. Endocrinology, 2008, 149(1): 380-388. DOI: 10.1210/en.2007-0877. |
| [2] | Belmadani S, Bernal J, Wei CC, et al. A thrombospondin-1 antagonist of transforming growth factor-β activation blocks cardiomyopathy in rats with diabetes and elevated angiontensin Ⅱ[J]. The American Journal of Pathology, 2007, 171: 777-789. DOI: 10.2353/ajpath.2007.070056. |
| [3] | Zuo XR, Wang Q, Cao Q, et al. Nicorandil prevents right ventrivular remodeling by inhibiting apoptosis and lowering pressure overload in rats with pulmonary arterial hypertension[J]. Plos One, 2012, 7(9): e44485. DOI: 10.1371/journal.pone.0044485. |
| [4] | Sun Y, Zhang J, Zhang JQ, et al. Local angiotensin Ⅱ and transforming growth factor β1 in renal fibrosis of rats[J]. Hypertension, 2000, 35(5): 1078-1084. DOI: 10.1161/01.HYP.35.5.1078. |
| [5] | Zhang XM, Shi PH, Cao SH, et al. Expression changes of transforming growth factor-beta1 and thrombospondin-1 in cavernous tissues of diabetic rats[J]. Urologia Internationlis, 2010, 84(2): 221-225. DOI: 10.1159/000277602. |
| [6] | Lu C, Minatoguchi S, Arai M, et al. Nicorandil improves post-ischemic myocardial dysfunction in association with opening the mitochondrial KATP channels and decreasing hydroxyl radicals in isolated rat hearts[J]. Circ J, 2006, 70: 1650-1654. DOI: 10.1253/circj.70.1650. |
| [7] | Colombo G, Margosio B, Ragona L, et al. Non-peptidic thrombospondin-1 mimics as fibroblast growth factor-2 inhibitors.An integrated strategy for the development of new antiangiogenic compounds[J]. Journal of Biological Chemistry, 2010, 285(12): 8733-8742. DOI: 10.1074/jbc.M109.085605. |
| [8] | Serizawa K, Yogo K, Aizawa K, et al. Nicorandil prevents endothelial dysfunction due to antioxidative effects via normalization of NADPH oxidase and nitric oxide synthase in streptozocin diabetic rats[J]. Cardiovasc Diabetol, 2011, 10: 105-110. DOI: 10.1186/1475-2840-10-105. |
| [9] | Nakae I, Takaoka A, Mitsunami K, et al. Cardioprotective effects of nicorandil in rabbits anaesthetized with halothane: potentiation of ischaemic preconditioning via KATP channels[J]. Clinical and Experimental Pharmacology and Physiology, 2000, 27: 810-817. DOI: 10.1046/j.1440-1681.2000.03347.x. |
| [10] | Garside SA, Harlow CR, Hillier SG, et al. Thrombospondin-1 inhibits angiogenesis and promotes follicular atresia in a novel in vitro angiogenesis assay[J]. Endocrinology, 2010, 151(3): 1280-1289. DOI: 10.1210/en.2009-0686. |
 2016, Vol. 37
2016, Vol. 37
