白色脂肪细胞具有内分泌功能,可分泌大量的脂肪因子(adipokines),其数量、结构、功能等的变化将影响全身能量平衡、改变体液脂肪因子的分布与水平,与胰岛素抵抗、肥胖、糖尿病、心血管疾病、肿瘤等疾病的发生、发展密切相关[1-4]。因此,探寻控制脂肪细胞分化和脂肪因子合成与分泌的生物活性物质,研究其分子基础,在白色脂肪相关代谢紊乱的治疗模式中具有潜在的意义。
乌地那非(Udenafil)是磷酸二酯酶5型(phosphodiesterase type 5,PDE5)特异性抑制剂,被用于治疗勃起功能障碍[5]。近年研究表明,乌地那非可改善2型糖尿病患者的勃起功能障碍[6],也可改善脂肪细胞的胰岛素抵抗[7]。但迄今为止,对其调节脂肪细胞分化和脂肪因子合成与分泌的作用未见报道。本研究拟对此进行研究,并探讨其可能的机制。
1 材料与方法 1.1 细胞3T3-L1前脂肪细胞(preadipocytes)购自美国模式菌种收集中心(American Type Culture Collection,ATCC),在含有10%胎牛血清(fetal bovine serum,FBS)和1% penicillin/streptomycin(P/S)的DMEM培养基、37 ℃、5% CO2条件下培养。
1.2 主要试剂DMEM液体培养基、FBS、P/S等购自Gibco公司;PPARγ抑制剂GW9662(M6191)和油红O(O0625)购自Sigma-Aldrich公司;Udenafil(Synonyms: DA8159)购自MedChemExpress公司;各种抗体均购自Cell Signaling Technology公司;PPARγ Transcription Factor Assay Kit(ab133101)和小鼠Adiponectin ELISA Kit (ab108785)购自Abcam公司;小鼠PPARγ siRNA(MSS276435)购自Thermo Fisher Scientitic公司。
1.3 主要方法 1.3.1 脂肪细胞的分化3T3-L1前脂肪细胞在100%汇合后继续生长3 d;随后,细胞在含1 μmol/L地塞米松,0.5 mmol/L异丁基甲基黄嘌呤(IBMX),1.67 μmol/L胰岛素和10% FBS的新鲜DMEM中孵育3 d,诱导其分化;然后,将细胞在含有0.41 μmol/L胰岛素和10% FBS的培养基中再培养3 d;最后,在生长培养基(含有10% FBS和1% P/S的DMEM)中培养4 d;此时,获得成熟的3T3-L1脂肪细胞。
1.3.2 油红染色脂肪细胞分化后,细胞用1×PBS洗涤,并在室温下用10%多聚甲醛固定1 h;去除多聚甲醛后,加入油红O染料染色30 min;蒸馏水洗涤平板4次,并通过奥林巴斯显微镜(日本东京)以50倍放大率观察并拍照获得细胞中脂质积聚的形态特征。为了量化脂质积聚,用异丙基洗脱染色的油滴乙醇,并在酶标仪上、490 nm处测量其吸光度值。
1.3.3 siRNA转染工作浓度为120 pmol/L的siRNA利用Lipofectamine RNAi MAX转染试剂(Invitrogen公司)转染至细胞,操作按试剂说明书进行,转染效率经蛋白免疫印迹评估。
1.3.4 RT-PCR使用TRIzol试剂提取3T3-L1脂肪细胞总RNA;为分析基因表达,使用M-MLV逆转录酶从总RNA中合成cDNA;SYBR Premix Ex TaqTM Ⅱ完成半定量实时PCR(RT-PCR);本研究中使用的引物如下:小鼠脂肪蛋白2(adipocyte protein 2, aP2) mRNA (forward 5′- GCGTAAATGGGGATTTGGTC-3′, reverse 5′-CTCCTGT CGTCTGCGGTGATT-3′)、小鼠β-肌动蛋白(β-actin) mRNA (forward, 5′-CCACGATGGAGGGGCCGGACTCATC-3′, reverse 5′-CTAAAGACCTCTATGCCAACACAGT-3′)。
1.3.5 PPARγ活性和培养液中脂联素含量的测定分别利用PPARγ转录因子分析试剂盒和脂联素ELISA试剂盒测定,按试剂盒说明操作。
1.3.6 蛋白免疫印迹(Western Blot)实验结束,洗涤并收集3T3-L1脂肪细胞,用含有20 mmol/L HEPES(pH 7.9)、350 mmol/L NaCl、500 mmol/L KCl、0.5 mmol/L EDTA、0.5 mmol/L EGTA、1 mmol/L MgCl2、10%甘油、1% Nonidet P-40、10 mmol/L NaF、0.1 mmol/L NaV、8 mmol/L β-甘油磷酸酯、磷酸酶抑制剂混合物Ⅰ和Ⅱ (Sigma-Aldrich公司)的裂解缓冲液裂解细胞;14 000 r/min、4 ℃离心10 min,分离保留上清,BCA(bicinchonininc acid)法测定蛋白浓度,并调整蛋白浓度为2 μg/μl;加入等量的2×SDS上样缓冲液,100 ℃加热10 min,14 000 r/min、4 ℃离心10 min,分离取上清用于SDS-PAGE胶分离蛋白,转移蛋白到硝化纤维素膜,并用特异性抗体检测蛋白和磷酸化蛋白的表达。
1.4 统计学处理数据以平均值±标准差(x±s)表示。组间的差异使用单因素方差分析(ANOVA)进行测试,并进行配对t检验,以P<0.05为差异有统计学意义。所有实验至少重复4次,并具有类似的结果。
2 结果 2.1 乌地那非促进3T3-L1脂肪细胞分化、脂联素生成和分泌在3T3-L1前脂肪细胞分化为脂肪细胞的过程中,加入5,10,20 μmol/L的乌地那非。结果发现,乌地那非可显著促进脂肪细胞的分化,表现为脂滴形成增加、脂肪细胞分化标志基因aP2的表达增加,且变化呈现剂量依赖性。见图 1。
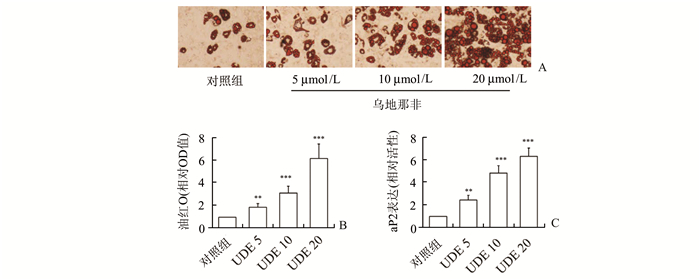
|
图 1 乌地那非对3T3-L1脂肪细胞分化的影响 A:油红染色;B:油红染色的定量分析;C:脂肪分化标志基因aP2的表达,n=4, 与对照组比较,**P<0.01, ***P<0.001; UDE 5,UDE 10,UDE 20分别表示乌地那非浓度为5,10,20 μmol/L |
同时,乌地那非也以剂量依赖方式显著提高了3T3-L1脂肪细胞内脂联素蛋白的表达、以及培养液中脂联素的含量。见图 2。
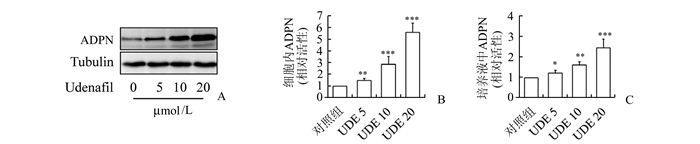
|
图 2 乌地那非对3T3-L1脂肪细胞内和培养液中脂联素含量的影响 A:乌地那非对3T3-L1脂肪细胞内脂联素表达的影响;B:图A中脂联素含量的定量分析;C:乌地那非对培养液中脂联素含量的影响;n=4;与对照组比较,*P<0.05, **P<0.01, ***P<0.001;UDE 5,UDE 10,UDE 20分别表示乌地那非浓度为5,10,20 μmol/L; ADPN:脂联素 |
为观察乌地那非对PPARγ的影响,在3T3-L1前脂肪细胞培养分化为脂肪细胞的过程中,加入5,10,20 μmol/L的乌地那非。结果发现,与正常对照组比较,乌地那非以剂量依赖方式显著增加了PPARγ蛋白表达量、以及PPARγ的活性。当同时用100 μmol/L的特异性蛋白激酶G(protein kinase G, PKG)抑制剂和10 μmol/L的乌地那非处理时,发现PKG抑制剂可逆转乌地那非对PPARγ活性的影响。见图 3。
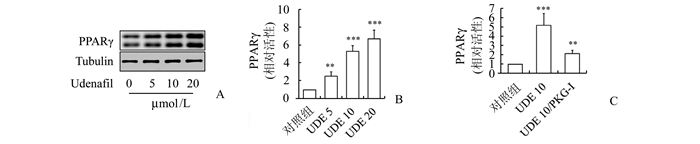
|
图 3 乌地那非对PPARγ的蛋白表达和活性的影响 A:乌地那非对3T3-L1脂肪细胞PPARγ蛋白含量的影响;B:乌地那非对3T3-L1脂肪细胞PPARγ活性的影响;C: PKG抑制剂对乌地那非诱导的PPARγ活性的影响, n=4;与对照组比较,**P<0.01, ***P<0.001;UDE 5,UDE 10,UDE 20分别表示乌地那非浓度为5,10,20 μmol/L |
为证实乌地那非对脂肪细胞分化、以及脂联素合成和分泌的影响经由PPARγ介导,3T3-L1前脂肪细胞在诱导分化的过程中,同时接受1 μmol/L的PPARγ特异性抑制剂GW9662和10 μmol/L的乌地那非处理。结果发现,GW9662消除了乌地那非对脂滴形成、脂肪细胞分化标志基因aP2表达、细胞内脂联素含量以及培养液中脂联素浓度的促进作用。见图 4。
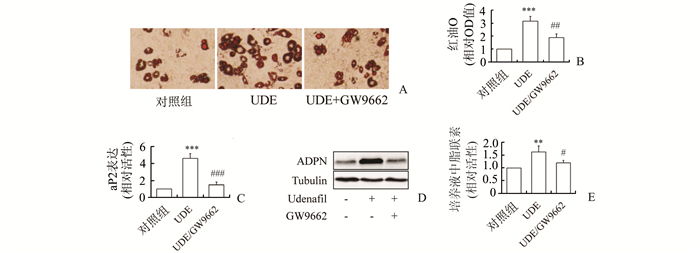
|
图 4 PPARγ抑制剂降低乌地那非对3T3-L1脂肪细胞分化、脂联素合成与分泌的影响 A:PPARγ抑制剂对乌地那非促进的脂滴聚集的影响;B:图A中脂滴聚集的定量分析;C:PPARγ抑制剂对乌地那非促进的aP2 mRNA表达的影响;D:PPARγ抑制剂对乌地那非促进的细胞内脂联素表达的影响;E:PPARγ抑制剂对乌地那非促进的培养液中脂联素表达的影响,n=4;与对照组比较,** P<0.01, ***P<0.001;与乌地那非组比较,#P<0.05, ##P<0.01, ###P<0.001;UDE:乌地那非 |
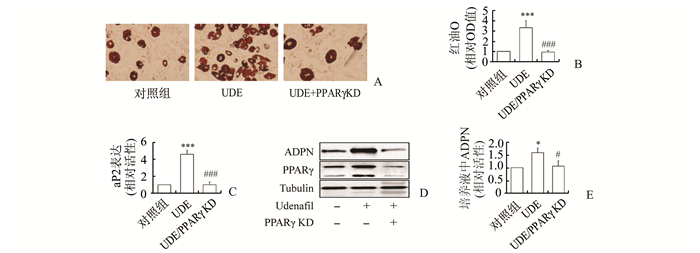
采用siRNA技术敲低3T3-L1前脂肪细胞中的PPARγ,并在前脂肪细胞分化的过程中加入10 μmol/L的乌地那非处理。结果发现,PPARγ siRNA可有效地降低PPARγ的蛋白表达,显著抑制乌地那非对脂滴形成、脂肪细胞分化标志基因aP2表达、细胞内脂联素含量以及培养液中脂联素浓度的促进作用。见图 5。
|
图 5 敲低PPARγ降低乌地那非对3T3-L1脂肪细胞分化、脂联素合成与分泌的影响 A:敲低PPARγ对乌地那非促进的脂滴聚集的影响;B:图A中脂滴聚集的定量分析;C:敲低PPARγ对乌地那非促进的aP2 mRNA表达的影响;D:敲低PPARγ对乌地那非促进的细胞内脂联素表达的影响;E:敲低PPARγ对乌地那非促进的培养液中脂联素表达的影响,n=4,与对照组比较,*P<0.05, ***P<0.001;与乌地那非组比较,#P<0.05, ###P<0.001;UDE:乌地那非;KD:敲低 |
本研究结果发现,乌地那非可增强3T3-L1脂肪细胞的脂滴形成、提高脂肪细胞分化标志基因aP2 mRNA的表达、增加细胞内和培养液中脂联素的含量(图 1和图 2),表明乌地那非具有促进脂肪细胞分化、增强脂联素合成与分泌的作用。
前脂肪细胞分化为脂肪细胞的过程受多种转录因子的调控,其中PPARγ和C/EBPα起着关键的作用[8]。研究表明,C/EBPα的异位表达可诱导成纤维细胞转化为脂肪细胞[9],基因敲除小鼠的结果也证实C/EBPα是白色脂肪形成所需的[10]。但由于①不表达PPARγ的前脂肪细胞不会分化为脂肪细胞;②在C/EBPα缺陷细胞中强制表达PPARγ也可诱导脂肪的生成;PPARγ因而被认为是脂肪细胞形成的主要调节因子[11-13]。本研究结果表明:乌地那非可增加PPARγ的蛋白表达和活性,而采用特异性抑制剂和基因沉默方法抑制PPARγ可逆转乌地那非对脂肪细胞分化的影响,表现为脂滴形成的减少和脂肪细胞分化基因表达量的降低(图 3-5),从而证实PPARγ介导了乌地那非促进脂肪细胞分化的作用。
PPARγ除具有在发育过程中诱导脂肪形成基因表达、促进脂肪重塑、调节脂肪细胞脂质储存功能外,还可调控脂肪因子合成与分泌,包括脂联素的合成与分泌[14, 15]。此外,研究也表明:PPARγ的激活依赖于PKG [16]。与这些观点一致,本研究的结果证实,乌地那非通过PKG对PPARγ的调节而促进3T3-L1脂肪细胞的脂联素生成与分泌(图 2-5)。
总之,本研究结果证实,乌地那非通过增加PPARγ蛋白表达和提高PPARγ的活性,促进脂肪细胞的分化、以及脂联素的合成与分泌。由于脂联素的分子作用以及PPARγ的激活可提高骨骼肌和肝脏的胰岛素敏感性,乌地那非极有可能具备抗胰岛素抵抗、糖尿病、糖尿病相关疾病的生物学功能。
| [1] | Gustafson B, Hedjazifar S, Gogg S, et al. Insulin resistance and impaired adipogenesis[J]. Trends Endocrinol Metab, 2015, 26(4): 193-200. DOI: 10.1016/j.tem.2015.01.006. |
| [2] | Tandon P, Wafer R, Minchin JEN. Adipose morphology and metabolic disease[J]. J Exp Biol, 2018, 221(Suppl 1): pii: jeb164970. DOI: 10.1242/jeb.164970. |
| [3] | Luo L, Liu M. Adipose tissue in control of metabolism[J]. J Endocrinol, 2016, 231(3): R77-R99. DOI: 10.1530/JOE-16-0211. |
| [4] | Gadde KM, Martin CK, Berthoud HR, et al. Obesity: pathophysiology and management[J]. J Am Coll Cardiol, 2018, 71(1): 69-84. DOI: 10.1016/j.jacc.2017.11.011. |
| [5] | Cho MC, Paick JS. Udenafil for the treatment of erectile dysfunction[J]. Ther Clin Risk Manag, 2014, 10: 341-354. |
| [6] | Park SH, Park SW, Cha BY, et al. Comparison of the efficacy and safety of once-daily dosing and on-demand use of udenafil for type 2 diabetic patients with erectile dysfunction[J]. Asian J Androl, 2015, 17(1): 143-148. DOI: 10.4103/1008-682X.135983. |
| [7] | Yu HM, Chung HK, Kim KS, et al. PDE 5 inhibitor improves insulin sensitivity by enhancing mitochondrial function in adipocytes[J]. Biochem Biophys Res Commun, 2017, 493(1): 631-636. DOI: 10.1016/j.bbrc.2017.08.140. |
| [8] | Mota de Sá P, Richard AJ, Hang H, et al. Transcriptional regulation of adipogenesis[J]. Compr Physiol, 2017, 7(2): 635-674. |
| [9] | Freytag SO, Paielli DL, Gilbert JD. Ectopic expression of the CCAAT/enhancer-binding protein alpha promotes the adipogenic program in a variety of mouse fibroblastic cells[J]. Genes Dev, 1994, 8(14): 1654-1663. DOI: 10.1101/gad.8.14.1654. |
| [10] | Wang ND, Finegold MJ, Bradley A, et al. Impaired energy homeostasis in C/EBP alpha knockout mice[J]. Science, 1995, 269(5227): 1108-1112. DOI: 10.1126/science.7652557. |
| [11] | Feng S, Reuss L, Wang Y. Potential of natural products in the inhibition of adipogenesis through regulation of PPARγ expression and/or its transcriptional activity[J]. Molecules, 2016, 21(10): pii: E1278. DOI: 10.3390/molecules21101278. |
| [12] | Loft A, Schmidt SF, Mandrup S. Modulating the genomic programming of adipocytes[J]. Cold Spring Harb Symp Quant Biol, 2015, 80: 239-248. DOI: 10.1101/sqb.2015.80.027516. |
| [13] | Astapova O, Leff T. Adiponectin and PPARγ: cooperative and interdependent actions of two key regulators of metabolism[J]. Vitam Horm, 2012, 90: 143-162. DOI: 10.1016/B978-0-12-398313-8.00006-3. |
| [14] | Hino K, Nagata H. Screening for adiponectin secretion regulators[J]. Vitam Horm, 2012, 90: 125-141. DOI: 10.1016/B978-0-12-398313-8.00005-1. |
| [15] | Zhang X, Ji J, Yan G, et al. Sildenafil promotes adipogenesis through a PKG pathway[J]. Biochem Biophys Res Commun, 2010, 396(4): 1054-1059. DOI: 10.1016/j.bbrc.2010.05.064. |
| [16] | Han YY, Song MY, Hwang MS, et al. Epimedium koreanum Nakai and its main constituent icariin suppress lipid accumulation during adipocyte differentiation of 3T3-L1 preadipocytes[J]. Chin J Nat Med, 2016, 14(9): 671-676. |
 2018, Vol. 39
2018, Vol. 39


