2. 武汉大学人民医院病理科 湖北 武汉 430060;
3. 武汉大学人民医院内分泌科 湖北 武汉 430060
2. Dept. of Pathology, Renmin Hospital of Wuhan University, Wuhan 430060, Hubei, China;
3. Dept. of Endocrinology, Renmin Hospital of Wuhan University, Wuhan 430060, Hubei, China
甲状腺癌(thyroid cancer, TC)是最常见的内分泌恶性肿瘤,每年在美国有超过50 000例新病例[1]。此外,TC的发病率仍在增加。据估计,到2019年,TC将成为美国所有年龄段女性中第三大常见癌症[2]。在TC的各种亚型中,分化型TC(differentiated thyroid cancer, DTC)是最常见的亚型,由乳头状和滤泡型TC组成。在大多数DTC患者中,标准治疗(手术后放射性碘或随访和甲状腺激素抑制治疗)非常有效[3]。因此,对于诊断为局限性疾病的患者,DTC的预后良好,5年疾病特异性生存率为98%,近68%的患者存活率接近100%[4, 5]。鉴于DTC患者远期生存率良好,相当多的患者可能死于其他原因[6]。因此,在评估DTC的预后时,应考虑导致患者死亡的其他原因,如心血管疾病(cardiovascular disease, CVD)。
CVD仍是西方国家死亡率最常见的原因,并且在癌症幸存者中也出现严重的晚期效应[7]。研究表明,癌症患者CVD风险增加[8, 9]。甲状腺激素和CVD有广泛的联系。甲状腺功能亢进症或甲状腺功能减退症对CVD死亡率有明显影响[10]。然而,亚临床甲亢对CVD存活率的影响仍存在争论[11-13]。Klein等人进行了一项病例对照研究。表明DTC患者心血管死亡风险增加,独立于年龄、性别和心血管危险因素[14]。然而,这个结论是基于一个小样本量的病例对照研究,并没有完全反映现实世界的情况。因此,我们通过SEER(Surveillance, Epidemiology, and End Results)数据库中的数据来评估DTC患者的心血管疾病死亡风险是否增加,我们还进一步阐明了与DTC诊断后心血管死亡率相关的危险因素。
1 方法 1.1 研究对象病例列表使用SEER * Stat版本8.3.4生成。在SEER-18数据库中获得了2000-2014年诊断为DTC的患者的信息,包括了所有DTC患者的随访时间。对于那些死亡年龄或随访结束时的年龄小于15岁的患者排除在外。患者选择过程的流程图如图 1所示。
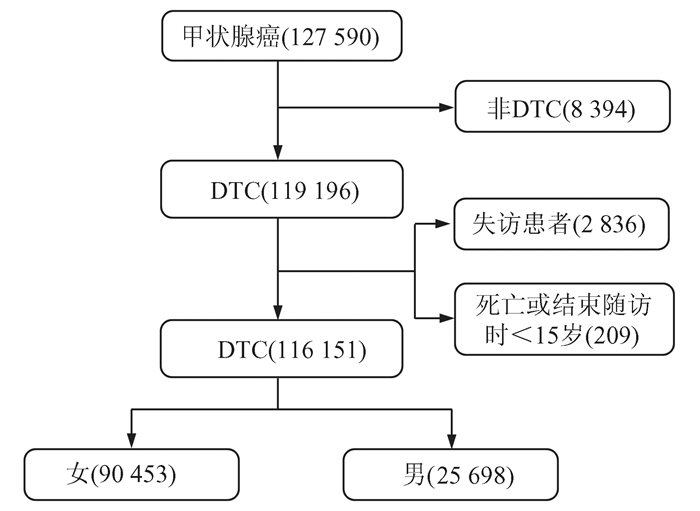
|
图 1 患者选择过程的流程图 |
记录以下人口统计学特征和临床特征:诊断年龄; 种族(白人,黑人或其他人); 肿瘤直径(≤10,11-20,21-40,≥40 mm); 阳性淋巴结(是,否,未知); 肿瘤位置(甲状腺内,甲状腺外,未知); 疾病阶段(局限性疾病,局部疾病,远处转移,未知); 手术(腺叶部分切除术,腺叶切除术,次全切或全甲状腺切除术,未知); 放疗(是,否,未知); 生存期,死亡原因(甲状腺,心血管疾病,其他)。放疗类型包括放射性同位素、束辐射、放射性植入物以及束与植入物或同位素的组合。应该指出的是,放疗数据存在两个局限性:①治疗信息的完整性; ②与接受放疗或未接受放疗的未记录原因有关的偏倚。然而,放疗的整体预测价值很高(>85%)[15]。CVD死亡率包括心脏疾病(国际疾病分类第10版[ICD-10]=I00-I09,I11,I13,I20-I51),无心脏病高血压(ICD10=I10),脑血管疾病(ICD10=I60-169),动脉粥样硬化(ICD10=I70),主动脉动脉瘤(ICD10=I71)和其他动脉,小动脉和毛细血管疾病(ICD10=I72-I78)。从SEER推导出美国年龄特异性CVD风险和全因死亡风险。这项研究的主要结果是CVD死亡。从DTC诊断日期到随访或死亡结束时计算出生存时间。
1.2 统计分析采用描述性统计的方法比较不同性别组患者的人口学特征和临床特征。用卡方检验比较分类变量的频率分布,并且在适当的情况下进行双尾t检验或Wilcoxon秩和检验以比较连续变量。使用标准死亡率(SMR)来比较SEER队列中DTC患者与美国人群的CVD和全因死亡率。每个年龄和性别类别的预期死亡人数是通过将每个年龄阶层的DTC患者的人年乘以一般人群中年龄性别原发性风险来计算的。SMR为实际观察到的死亡总人数与预期死亡总人数的比值。使用John等人介绍的方法计算SMR的95%置信区间(CI)[16]。使用相对风险模型和竞争风险模型来检测患者特征与CVD死亡之间的关联。在相对风险模型中使用Cox比例风险回归计算单变量和多变量校正风险比(HR),在患者死亡时比较造成患者死亡的原因:TC或其他原因。Fine-Gray模型是一种半比例模型,估计每个事件的累积发生率函数作为对数分布风险率(SHR),用于计算竞争风险模型中的竞争风险[17]。我们使用参数估计和Fine-Gray模型中的基线生存函数提供单变量和多变量校正的心血管死亡率SHR。在这个模型中,来自TC或其他原因的死亡被视为竞争事件。使用SEER * Stat(版本8.3.4)和Stata软件(版本14,STATA Corp.,TX)进行统计分析。P < 0.05认为差异有统计学意义。
2 结果 2.1 人口特征图 1显示了患者选择过程的流程图。最后,我们纳入了116 151名合格的DTC患者(90 453名女性和25 698名男性)。平均年龄为49.96岁,中位随访时间为70.87个月(1-179个月不等)。此外,大多数患者的肿瘤直径小于40 mm,淋巴结阴性,肿瘤局限于甲状腺。大多数患者接受次全切或全甲状腺切除术,仅有一半患者接受了放射治疗。男性和女性患者的肿瘤特征也显著不同。如表 1所示,我们比较了男性和女性之间的肿瘤特征。在随访期间共有6 283例患者死亡:1 593例死于TC,1 303例死于CVD,3 387例死于其他原因。图 2显示了不同性别的不同年龄段的特定死因率。年轻患者中,70%以上死于其他原因而不是DTC或CVD。然而,随着年龄的增加,死于DTC或CVD的患者比例逐渐增加,约占死亡总数的一半。
| 表 1 分化型甲状腺癌患者的队列研究[n(%)] |
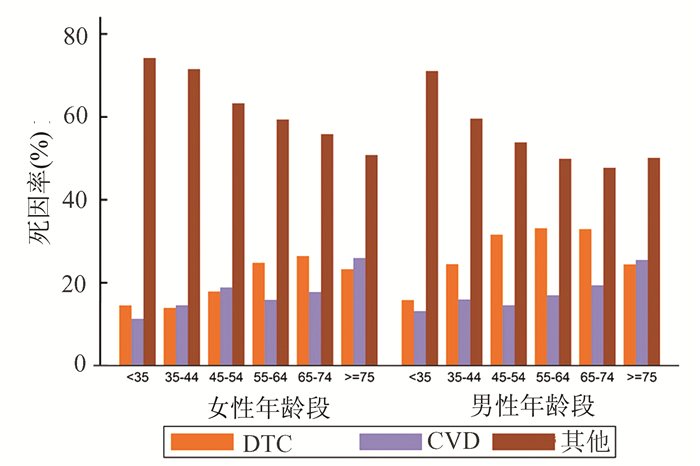
|
图 2 不同性别中各年龄段的特定死因率 |
将DTC病例中的年龄和性别特异性CVD风险和全因死亡风险与普通人群进行比较(表 2)。有趣的是,与一般人群相比,DTC患者CVD死亡率和全因死亡率降低(CVD:SMR=0.54, 95%CI:0.51-0.57;全因死亡率:SMR=0.87, 95%CI:0.81-0.89)。由于女性DTC患者比男性患者多,我们进行了亚组分析以避免性别组成偏差。在不同性别的亚组分析中,我们分析DTC女性患者CVD死亡率和全因死亡率下降(CVD:SMR=0.55, 95%CI:0.51-0.59;全因死亡率:SMR=0.85, 95%CI:0.83-0.88)。DTC男性的CVD死亡率也有所下降,但全因死亡率没有下降(CVD:SMR=0.67, 95%CI:0.61-0.73;全因死亡率:SMR=1.11, 95%CI:1.06-1.15)。更重要的是,不同年龄的DTC患者其CVD死亡率和全因死亡率也不同。对于35岁以下的患者,不管是男性患者还是女性患者,他们的CVD死亡率风险都比正常人群高。对于35-44岁的患者,DTC患者与一般人群之间的CVD死亡率风险无差异。对于45岁以上的患者,不论是男性还是女性,其心血管疾病死亡风险均下降。至于全因死亡率风险,与普通男性人群相比,年龄在75岁以下的DTC男性患者的全因死亡率更高,而与普通人群中的女性相比,小于75岁的DTC女性患者的全因死亡风险并没有增高。对于年龄超过75岁的患者,与一般人群相比,女性全因死亡率风险降低。
| 表 2 DTC病例中的年龄和性别特异性CVD风险和全因死亡风险 |
表 3显示了患者因素与心血管疾病死亡率风险之间的关系。在Cox比例回归模型中,年龄较大、黑人种族、肿瘤直径超过40 mm、甲状腺外肿瘤与CVD死亡率增加相关,而与腺叶部分切除术相比,甲状腺全切或次全切术的CVD死亡率更低。放疗也是CVD死亡率的有利预测指标。更重要的是,在多变量Cox进展模型中,年龄较大、黑人种族、肿瘤直径超过40 mm、甲状腺外肿瘤仍是CVD死亡率增加的危险因素。与腺叶部分切除术相比,腺叶切除术、甲状腺全切或次全切和放疗仍然是心血管疾病死亡率的有利预后因素。同时,如表 3所示,竞争风险模型中结果相似。我们还用多变量Fine-Gray模型对不同亚组患者建立了CVD的累积发病率函数曲线(图 3)。如图 3所示,肿瘤直径大于40 mm的男性、淋巴结阳性、腺叶部分切除术和未接受放疗的患者CVD死亡的累积发生率更高。
| 表 3 Cox比例风险回归模型和Fine-Gray模型评估患者特征与CVD死亡率之间的关系 |
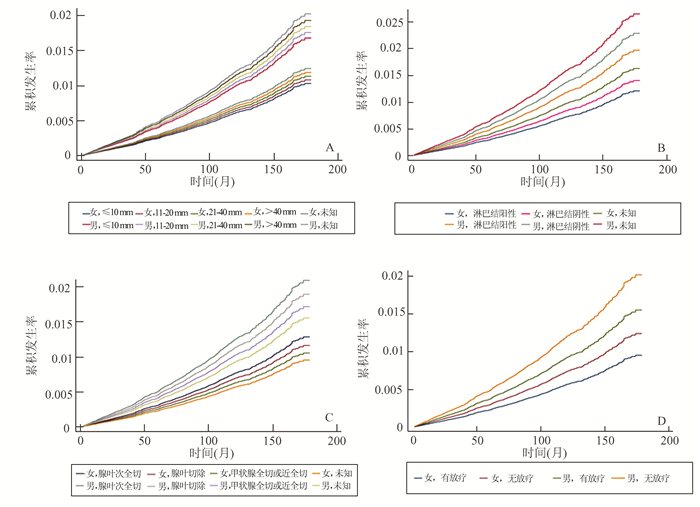
|
图 3 多变量Fine-Gray模型中不同亚组患者的CVD累积发病率函数曲线 A:基于性别和肿瘤大小的CVD死亡率; B:基于性别和阳性淋巴结的CVD死亡率; C:基于性别和手术方式的CVD死亡率; D:基于性别和放疗的CVD死亡率 |
很少有关于DTC诊断后的CVD死亡风险的研究。在本研究中,我们探究了DTC诊断后的CVD死亡率。这项研究表明,与对照组相比,DTC患者心血管疾病死亡风险降低了46%(SMR=0.54, 95%CI:0.51-0.57)。然而,在年轻患者中,DTC是CVD死亡率的危险因素。年龄较大、黑人种族、肿瘤直径大于40 mm、甲状腺外肿瘤与CVD死亡率增加有关。
这是一个有趣的结论。Klein等发现DTC患者的心血管死亡风险和全因死亡率增加,独立于年龄、性别和心血管危险因素[14]。我们怀疑这种不一致可能是源于对照组的选择差异。本研究中的对照组是美国普通人群,而他们的对照组包括来自基线人群的选定人群。我们从研究中的生存曲线估计了CVD死亡率的粗略风险。DTC患者CVD死亡率的粗略风险为每10万人249例,与本研究中的粗略风险相似(每10万人中有190例CVD死亡)。然而,对照组CVD死亡率的粗略风险为每10万人61例,远远低于本研究对照组的CVD死亡率风险(每10万人中有348例心血管疾病死亡率)。Eustatia-Rutten等人的研究是一项病例对照研究,对照组可能存在选择偏倚。Eustatia-Rutten等人的另一项研究中,366例DTC患者平均随访时间为8.3年,未发现心血管死亡风险增加[18]。
对于这个有趣的现象的解释还不清楚。然而,我们认为DTC术后的甲状腺激素替代疗法在CVD死亡率下降中发挥重要作用。以前的研究表明,甲状腺激素与心血管疾病密切相关[19-21]。甲状腺激素不仅对心血管系统有重要作用,而且对脂质、碳水化合物、蛋白质、矿物质和氧能代谢也有重要作用[22, 23]。大多数TC患者服用甲状腺激素以维持正常的甲状腺功能并抑制促甲状腺激素水平。理论上,甲状腺激素替代疗法可以帮助改善血脂谱并减少体内脂肪量,这将有助于降低CVD死亡率风险。在一项关于左旋甲状腺素治疗对亚临床甲状腺功能减退症患者血清胆固醇浓度影响的13项研究的荟萃分析中,左旋甲状腺素替代疗法的效果与甲状腺功能减退症的严重程度和血脂增加成正比[24]。然而,DTC术后甲状腺激素替代疗法,尤其是相对高剂量替代疗法是否会导致CVD死亡率下降尚不清楚。目前的证据是基于甲状腺功能与CVD死亡率之间的关联。一些研究表明,亚临床甲状腺功能亢进症患者CVD死亡风险增加[25-27],而另一些研究则未提示风险增加[28, 29]。
另一种可能的解释是由于普通人群中甲状腺功能减退症或亚临床甲状腺功能减退症的高发病率。在美国人群中,4%-20%的成年人患有甲状腺功能减退或亚临床甲状腺功能减退[30]。另外,这些人大部分都没有接受甲状腺激素替代疗法。据报道,甲状腺功能减退症和亚临床甲状腺功能减退与CVD死亡率增加密切相关[25, 31, 32]。甲状腺功能减退症和亚临床甲状腺功能减退可能导致一般人群心血管疾病死亡率增高的风险。
本研究存在一些局限性。我们用SMR比较DTC患者和一般人群之间的CVD死亡风险,没有调整其他CVD风险因素,如高血压史或吸烟史。另一个限制是很难在SMR分析中考虑竞争性死亡的影响,这可能导致偏差。第三,SEER数据库由来自地理和人口多样的美国人口的数据组成,其中包括来自农村和城市社区的居民,这可能导致分析中的异质性。
最后,本研究的结论是:在真实世界中,DTC患者的CVD死亡率风险低于一般人群,独立于性别因素。年龄较大、黑人种族、肿瘤直径超过40 mm、甲状腺外肿瘤是CVD死亡率的危险因素。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30. DOI: 10.3322/caac.21387. |
| [2] | Aschebrook-Kilfoy B, Kaplan EL, Chiu BC, et al. The acceleration in papillary thyroid cancer incidence rates is similar among racial and ethnic groups in the United States[J]. Ann Surg Oncol, 2013, 20(8): 2 746-2 753. DOI: 10.1245/s10434-013-2892-y. |
| [3] | Cabanillas ME, McFadden DG, Durante C. Thyroid cancer[J]. Lancet, 2016, 388(10 061): 2 783-2 795. |
| [4] | Pellegriti G, Frasca F, Regalbuto C, et al. Worldwide increasing incidence of thyroid cancer: Update on epidemiology and risk factors[J]. J Cancer Epidemiol, 2013, 2013: 965 212. |
| [5] | Lubitz CC, Sosa JA. The changing landscape of papillary thyroid cancer: Epidemiology, management, and the implications for patients[J]. Cancer, 2016, 122(24): 3 754-3 759. DOI: 10.1002/cncr.v122.24. |
| [6] | Yang L, Shen W, Sakamoto N. Population-based study evaluating and predicting the probability of death resulting from thyroid cancer and other causes among patients with thyroid cancer[J]. J Clin Oncol, 2013, 31(4): 468-474. DOI: 10.1200/JCO.2012.42.4457. |
| [7] | Nichols M, Townsend N, Scarborough P, et al. Cardiovascular disease in Europe: Epidemiological update[J]. Eur Heart J, 2013, 34(39): 3 028-3 034. DOI: 10.1093/eurheartj/eht356. |
| [8] | Rugbjerg K, Mellemkjaer L, Boice JD, et al. Cardiovascular disease in survivors of adolescent and young adult cancer: a Danish cohort study, 1943-2009[J]. J Natl Cancer Inst, 2014, 106(6): dju110. |
| [9] | Gudmundsdottir T, Winther JF, de Fine LS, et al. Cardiovascular disease in adult life after childhood cancer in Scandinavia: A population-based cohort study of 32 308 one-year survivors[J]. Int J Cancer, 2015, 137(5): 1 176-1 186. DOI: 10.1002/ijc.v137.5. |
| [10] | Biondi B. Mechanisms in endocrinology: Heart failure and thyroid dysfunction[J]. Eur J Endocrinol, 2012, 167(5): 609-618. DOI: 10.1530/EJE-12-0627. |
| [11] | Moura NA, Parisi MC, Tambascia MA, et al. Relationship of thyroid hormone levels and cardiovascular events in patients with type 2 diabetes[J]. Endocrine, 2014, 45(1): 84-91. DOI: 10.1007/s12020-013-9938-6. |
| [12] | Selmer C, Olesen JB, Hansen ML, et al. Subclinical and overt thyroid dysfunction and risk of all-cause mortality and cardiovascular events: A large population study[J]. J Clin Endocrinol Metab, 2014, 99(7): 2 372-2 382. DOI: 10.1210/jc.2013-4184. |
| [13] | Cooper DS, Biondi B. Subclinical thyroid disease[J]. Lancet, 2012, 379(9 821): 1 142-1 154. |
| [14] | Klein HE, Klein HM, de Bock GH, et al. Long-term cardiovascular mortality in patients with differentiated thyroid carcinoma: An observational study[J]. J Clin Oncol, 2013, 31(32): 4 046-4 053. DOI: 10.1200/JCO.2013.49.1043. |
| [15] | Noone AM, Lund JL, Mariotto A, et al. Comparison of SEER treatment data with Medicare claims[J]. Med Care, 2016, 54(9): e55-e64. DOI: 10.1097/MLR.0000000000000073. |
| [16] | John RT, Mark JR, Paul CL. Age-period-cohort modeling[J]. Stata Journal, 2010, 10: 606-627. |
| [17] | Fine JP, Gray RJ. A Proportional hazards model for the subdistribution of a competing risk[J]. J Amer Statist Assoc, 1999, 94(446): 496-509. DOI: 10.1080/01621459.1999.10474144. |
| [18] | Eustatia-Rutten CF, Corssmit EP, Biermasz NR, et al. Survival and death causes in differentiated thyroid carcinoma[J]. J Clin Endocrinol Metab, 2006, 91(1): 313-319. DOI: 10.1210/jc.2005-1322. |
| [19] | Iervasi G, Nicolini G. Thyroid hormone and cardiovascular system: From basic concepts to clinical application[J]. Intern Emerg Med, 2013, 8(Suppl 1): S71-S74. |
| [20] | Grais IM, Sowers JR. Thyroid and the heart[J]. Am J Med, 2014, 127(8): 691-698. DOI: 10.1016/j.amjmed.2014.03.009. |
| [21] | Vargas-Uricoechea H, Bonelo-Perdomo A, Sierra-Torres CH. Effects of thyroid hormones on the heart[J]. Clin Investig Arterioscler, 2014, 26(6): 296-309. |
| [22] | Klein I, Ojamaa K. Thyroid hormone and the cardiovascular system[J]. N Engl J Med, 2001, 344(7): 501-509. DOI: 10.1056/NEJM200102153440707. |
| [23] | Tatar E, Kircelli F, Ok E. The contribution of thyroid dysfunction on cardiovascular disease in patients with chronic kidney disease[J]. Atherosclerosis, 2013, 227(1): 26-31. DOI: 10.1016/j.atherosclerosis.2012.10.068. |
| [24] | Danese MD, Ladenson PW, Meinert CL, et al. Clinical review 115: Effect of thyroxine therapy on serum lipoproteins in patients with mild thyroid failure: A quantitative review of the literature[J]. J Clin Endocrinol Metab, 2000, 85(9): 2 993-3 001. |
| [25] | Iervasi G, Molinaro S, Landi P, et al. Association between increased mortality and mild thyroid dysfunction in cardiac patients[J]. Arch Intern Med, 2007, 167(14): 1 526-1 532. DOI: 10.1001/archinte.167.14.1526. |
| [26] | Gussekloo J, van Exel E, de Craen AJ, et al. Thyroid status, disability and cognitive function, and survival in old age[J]. JAMA, 2004, 292(21): 2 591-2 599. DOI: 10.1001/jama.292.21.2591. |
| [27] | Selmer C, Olesen JB, Hansen ML, et al. Subclinical and overt thyroid dysfunction and risk of all-cause mortality and cardiovascular events: A large population study[J]. J Clin Endocrinol Metab, 2014, 99(7): 2 372-2 382. DOI: 10.1210/jc.2013-4184. |
| [28] | Cappola AR, Fried LP, Arnold AM, et al. Thyroid status, cardiovascular risk, and mortality in older adults[J]. JAMA, 2006, 295(9): 1 033-1 041. DOI: 10.1001/jama.295.9.1033. |
| [29] | Boekholdt SM, Titan SM, Wiersinga WM, et al. Initial thyroid status and cardiovascular risk factors: The EPIC-Norfolk prospective population study[J]. Clin Endocrinol(Oxf), 2010, 72(3): 404-410. DOI: 10.1111/cen.2010.72.issue-3. |
| [30] | Cooper DS, Biondi B. Subclinical thyroid disease[J]. Lancet, 2012, 379(9 821): 1 142-1 154. |
| [31] | Rotondi M, Magri F, Chiovato L. Risk of coronary heart disease and mortality for adults with subclinical hypothyroidism[J]. JAMA, 2010, 304(22): 2 481-2 482. DOI: 10.1001/jama.2010.1786. |
| [32] | McQuade C, Skugor M, Brennan DM, et al. Hypothyroidism and moderate subclinical hypothyroidism are associated with increased all-cause mortality independent of coronary heart disease risk factors: a PreCIS database study[J]. Thyroid, 2011, 21(8): 837-843. DOI: 10.1089/thy.2010.0298. |
 2018, Vol. 39
2018, Vol. 39


