香菇多糖是卵巢癌化疗中最常见的辅助药物,可显著提高其疗效并降低并发症发生率,可能与香菇多糖提高T淋巴细胞免疫有关[1, 2]。顺铂为卵巢癌综合治疗最常见的化疗药物,但其获得性继发性耐药发生率极高[3]。有研究发现香菇多糖体外与肿瘤细胞共培养时可降低耐药基因表达,此外有研究发现香菇多糖自身可能对肿瘤细胞具有抑制作用。本研究采用香菇多糖联合顺铂作用于顺铂耐药A2780卵巢癌细胞,研究香菇多糖体外对卵巢癌细胞顺铂耐药的影响及可能机制。
1 材料与方法 1.1 细胞与试剂顺铂耐药A2780卵巢癌细胞系购于美国典型培养物储藏中心(ATCC);新生牛血清(NCS)、PBS和MTT购于上海碧云天生物科技有限公司;DMEM购于武汉博士德生物工程有限公司;香菇多糖购自南京绿叶思科药业有限公司;顺铂购自美国Sigma公司。A2780卵巢癌细胞培养基配置为10% NCS加90% DMEM,培养37 ℃、5% CO2恒温培养箱。
1.2 细胞分组及药物处理香菇多糖冻干粉剂用纯水配制,顺铂用纯水配,根据药物处理方法将A2780卵巢癌细胞分为CON组(未行香菇多糖或顺铂处理)、DDP组(仅用顺铂处理,顺铂浓度为5 μg/ml)、LEN组(仅用香菇多糖处理,香菇多糖浓度0.5 μmol/L)及D+L组(香菇多糖联合顺铂处理,香菇多糖终浓度0.5 μmol/L,顺铂终浓度5 μg/ml)。CON组、DDP组、LEN组和D+L组细胞均设5组对照,药物处理6 h后用PBS洗涤3次,加入培养基培养待后续实验。
1.3 细胞增殖将CON组、DDP组、LEN组和D+L组细胞分别培养于24孔板(D0),每组细胞各设3孔。采用MTT法检测四组细胞增殖,酶标检测仪检测波长490 nm下每孔细胞吸光度,吸光度=测得值-空白值,连续检测7 d (D1-D7)。以吸光度为纵坐标、时间为横坐标,绘制细胞增殖曲线。
1.4 细胞周期检测采用BD FACSC anto Ⅱ流式细胞仪检测四组细胞药物作用6 h后周期(G0/G1期、S期和G2/M期)及细胞凋亡率,并计算增殖指数(PI)=(S+G2/M)/(G0/G1+S+G2/M)。
1.5 耐药基因检测四组细胞药物作用6 h后均采用RT-PCR法检测耐药基因(MDR1和MRP1基因) mRNA表达,以β-actin为对照,引物序列见表 1,反应条件为:94 ℃预变性5 min,94 ℃变性60 s,退火30 s, 72 ℃延伸30 s, 共32个循环,最后一轮72 ℃延伸10 min, 扩增产物经琼脂糖凝胶电泳后显影照相检测。分别统计四组细胞耐药基因光密度值,与内参对照计算比值。
| 表 1 MDR1、MRP1和β-actin基因RT-PCR引物序列 |
采用Sigmaplot 12.5统计软件进行数据处理与统计学分析。计量资料采用x±s表示。四组细胞相关指标对比采用单因素方差分析(SNK法分别两两比较计算P值)。P < 0.05认为差异具有统计学意义。
2 结果 2.1 细胞增殖对比CON组、DDP组、LEN组和D+L组A2780顺铂耐药卵巢癌细胞D0的吸光度无明显差异(均P>0.05);CON组、DDP组和LEN组细胞D1-D7的吸光度均无明显差异(均P>0.05),D+L组细胞D1-D7的吸光度均显著低于CON组、DDP组和LEN组细胞(均P < 0.05)(图 1)。
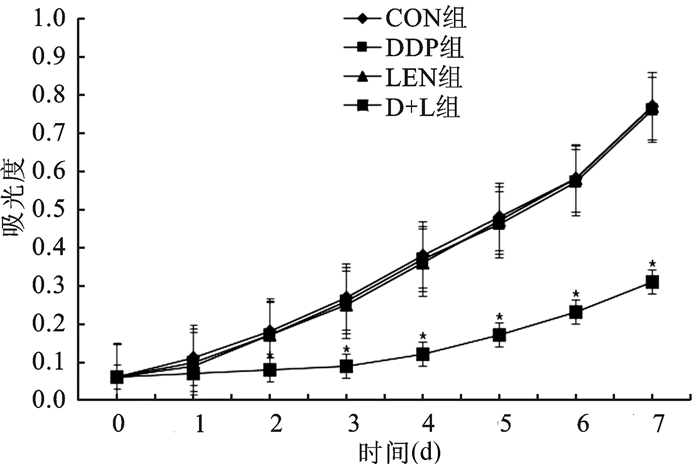
|
图 1 四组A2780细胞D0-D7吸光度对比 D+L组分别与CON组、DDP组和LEN组比较, *P < 0.05 |
CON组、DDP组和LEN组A2780顺铂耐药卵巢癌细胞G0/G1期、S期、G2/M期、PI和细胞凋亡率的差异均无统计学意义(均P>0.05),D+L组细胞G0/G1期和细胞凋亡率均显著高于CON组、DDP组和LEN组细胞(均P < 0.05),S期、G2/M期和PI均显著低于CON组、DDP组和LEN组细胞(均P < 0.05)(表 2)。
| 表 2 四组细胞细胞周期、PI和细胞凋亡率对比(x±s) |
CON组和DDP组A2780细胞MDR1和MRP1基因mRNA表达无明显差异(均P>0.05),LEN组和D+L组细胞MDR1和MRP1基因mRNA表达无明显差异(均P>0.05),CON组和DDP组细胞MDR1和MRP1基因mRNA表达显著高于LEN组和D+L组细胞(均P < 0.05)(图 2和图 3)。
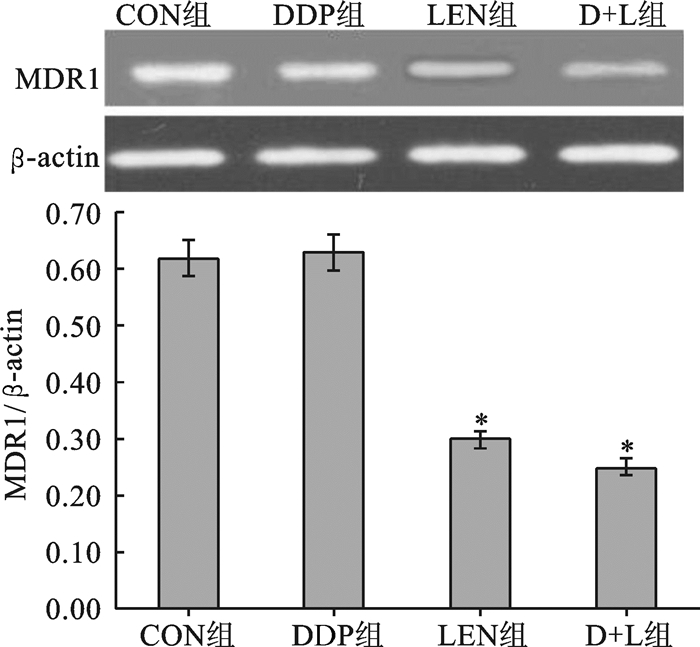
|
图 2 四组A2780细胞MDR1基因mRNA表达对比 LEN组、D+L组分别与CON组、DDP组比较,*P < 0.05 |
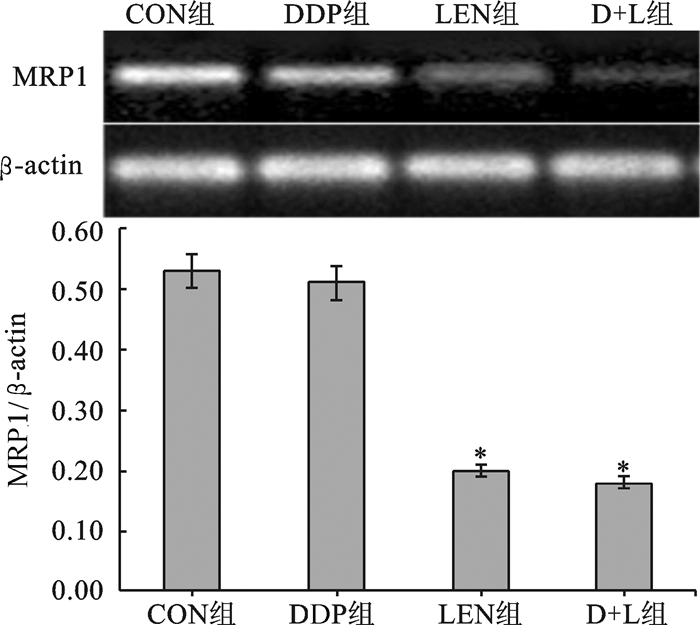
|
图 3 四组A2780细胞MRP1基因mRNA表达对比 LEN组、D+L组分别与CON组、DDP组比较,*P < 0.05 |
顺铂是目前临床上卵巢癌综合治疗的一线用药,疗效显著且不良反应较少,但其极易发生继发性获得性耐药导致化疗失败,故降低顺铂的耐药性对提高卵巢癌的疗效至关重要。研究发现顺铂的耐药性与多药耐药基因和相关蛋白、凋亡相关基因、原癌基因及抑癌基因密切相关,其中多药耐药基因和相关蛋白是继发性获得性耐药最主要的机制[4, 5]。目前发现与顺铂耐药相关的基因包括MDR1和MRP1,其中MDR1属于P-糖蛋白,含有二个ATP结合位点,与抗肿瘤药物结合后ATP结合位点结合ATP释放能量,可将抗肿瘤药物泵出细胞外,降低细胞内抗肿瘤药物水平而产生耐药[6];MRP1属于ATP依赖性扩膜转运蛋白,可将抗肿瘤药物逆浓度泵出到细胞外而降低抗肿瘤药物浓度,同时可抑制抗肿瘤药物与靶点结合,降低其作用效果[7]。A2780卵巢癌细胞为目前公认的顺铂耐药细胞系,本研究中顺铂作用后对其细胞增殖及凋亡无明显影响,表明A2780卵巢癌细胞为研究顺铂耐药的理想细胞系。
香菇多糖为最常见的抗肿瘤辅助用药,目前认为香菇多糖抗肿瘤机制与其提高机体T淋巴细胞免疫有关,随着研究的深入,发现香菇多糖可能存在其他途径提高抗肿瘤药物疗效。本研究中,D+L组细胞D1-D7的吸光度、S期、G2/M期和PI均显著低于CON组、DDP组和LEN组细胞(均P < 0.05),G0/G1期和细胞凋亡率均显著高于CON组、DDP组和LEN组细胞(均P < 0.05);LEN组和D+L组细胞MDR1和MRP1基因mRNA表达无明显差异(均P>0.05),CON组和DDP组细胞MDR1和MRP1基因mRNA表达显著高于LEN组和D+L组细胞(均P < 0.05),这些证据表明香菇多糖体外共培养可逆转A2780卵巢癌细胞对顺铂的耐药性,其作用机制可能与香菇多糖降低耐药基因MDR1及MRP1表达有关,该现象与袁昌劲等[8]发现的香菇多糖可降低耐药基因表达基本一致,为临床应用中香菇多糖改善抗肿瘤药物耐药提供理论依据。
本研究中CON组、DDP组和LEN组细胞增殖、细胞周期及凋亡无明显差异,说明香菇多糖自身并未对A2780卵巢癌细胞表现出直接抑制作用,但有研究发现香菇多糖自身对肿瘤细胞具有直接抑制作用。桂明杰等[9]发现香菇多糖对HepG2及H22肿瘤细胞具有良好的细胞毒性,对体内肿瘤的抑制率高于环磷酰胺;樊瑞新[10]发现香菇多糖对卵巢癌细胞株SKOV3增殖具有显著的抑制作用,但具体作用机制不明确;郑琼[11]研究发现香菇多糖可能通过升高Bax表达、降低Bcl-2和PCNA表达而抑制HEC-1B细胞的增殖。此外有发现香菇多糖可能通过诱导细胞周期阻滞和激活ERK1/2信号通路显著抑制SGC-7901胃癌细胞生长[12]。结合目前研究进展,推测香菇多糖可能通过改善多药耐药基因表达而降低A2780卵巢癌细胞对顺铂的耐药性,而与自身直接抑制肿瘤细胞无关,与香菇多糖对其他肿瘤细胞具有直接抑制作用不同。值得注意的是,目前香菇多糖抑制肿瘤的研究主要集中在香菇多糖对免疫的影响,但笔者认为香菇多糖可能具有多种作用机制抑制肿瘤,其改善抗肿瘤药物的耐药性可能同样存在多种作用机制,这些机制有待于进一步研究。
| [1] | Yoshino S, Nishikawa K, Morita S, et al. Randomised phase Ⅲ study of S-1 alone versus S-1 plus lentinan for unresectable or recurrent gastric cancer (JFMC36-0701)[J]. Eur J Cancer, 2016, 65(3): 164-171. |
| [2] |
阎蓓, 邸石, 王罡, 等. 香菇多糖对Ⅲ期卵巢癌术后TP方案辅助化疗疗效的影响[J].
武汉大学学报:医学版, 2014, 35(3): 462-464, 473.
Yan B, Di S, Wang G, et al. Impact of lentinan on adjuvant chemotherapy with TP regimen in phase Ⅲ ovarian cancer cases after surgery[J]. Medical Journal of Wuhan University, 2014, 35(3): 462-464, 473. |
| [3] | Ai Z, Lu Y, Qiu S, et al. Overcoming cisplatin resistance of ovarian cancer cells by targeting HIF-1-regulated cancer metabolism[J]. Cancer Letters, 2016, 373(1): 36-44. DOI: 10.1016/j.canlet.2016.01.009. |
| [4] | Yan C, Yang F, Zhou C, et al. MCT1 promotes the cisplatin-resistance by antagonizing Fas in epithelial ovarian cancer[J]. Int J Clin Exp Pathol, 2015, 8(3): 2710-2718. |
| [5] | Xu S, Fu GB, Tao Z, et al. MiR-497 decreases cisplatin resistance in ovarian cancer cells by targeting mTOR/P70S6K1[J]. Oncotarget, 2015, 6(28): 26457-26471. DOI: 10.18632/oncotarget. |
| [6] | Li W, Jiang M, Cao Y, et al. Turning ineffective transplatin into a highly potent anticancer drug via a prodrug strategy for drug delivery and inhibiting cisplatin drug resistance[J]. Bioconjug Chem, 2016, 27(8): 1802-1806. DOI: 10.1021/acs.bioconjchem.6b00302. |
| [7] | Zhang Z, Xie Z, Sun G, et al. Reversing drug resistance of cisplatin by hsp90 inhibitors in human ovarian cancer cells[J]. Int J Clin Exp Med, 2015, 8(5): 6687-6701. |
| [8] |
袁昌劲, 孔庆志, 卢宏达, 等. 香菇多糖增强5-FU抑制结肠癌细胞增殖机制研究[J].
中国实验诊断学, 2012, 16(6): 992-994.
Yuan CJ, Kong ZQ, Lu HD, et al. Study of lentinan's enhance effect on 5-Fu against colon cancer[J]. Chin J Lab Diagn, 2012, 16(6): 992-994. |
| [9] |
桂明杰, 亢学平, 王鑫, 等. 香菇多糖对HepG2及H22肿瘤细胞的抑制研究[J].
食用菌, 2015, 37(5): 63-65.
Gui MJ, Kang XP, Wang X, et al. Inhibition effect of lentian on HepG2 and H22 cancer cells[J]. Edible Fungi, 2015, 37(5): 63-65. |
| [10] |
樊瑞新. 香菇多糖对卵巢癌细胞株SKOV3增殖及其裸鼠移植瘤生长抑制作用的研究[J].
中国医药导刊, 2010, 12(3): 461-462.
Fang RX. The study of the inhibition effect of lentinan on proliferation of ovarian carcinoma SKOV3 cell line and growth of xenograft in nude Mice[J]. Chinese Jounal of Medical Guide, 2010, 12(3): 461-462. |
| [11] |
郑琼. 香菇多糖对人子宫内膜癌细胞HEC-1B增殖的影响[J].
临床合理用药杂志, 2009, 2(15): 19-21.
Zhen Q. Inhibition effect of lentian on HEC-1B cancer cell[J]. Chinese Jounal of Clinical Rational Drug Use, 2009, 2(15): 19-21. |
| [12] |
王嵘, 易敏, 潘贤英, 等. 香菇多糖的体外抗肿瘤活性研究[J].
重庆医科大学学报, 2011, 36(5): 572-574.
Wang R, Yi M, Pan XY, et al. Study of lentinan against tumor in vitro[J]. Medical Journal of Chongqing Medical University, 2011, 36(5): 572-574. |
 2017, Vol. 38
2017, Vol. 38
