2. 口腔基础医学省部共建国家重点实验室培育基地和口腔生物医学教 育部重点实验室 湖北 武汉 430079;
3. 武汉大学基础医学院 湖北 武汉 430071
2. Key Laboratory for Oral Biomedical Engineering of the Ministry of Education, Wuhan University, Wuhan 430079, China;
3. School of Basic Medical Sciences, Wuhan University, Wuhan 430071, China
口腔上皮异常增生(oral epithelial dysplasia,OED)是口腔黏膜癌变的一个重要组织学改变,根据异常增生的程度可分为轻度、中度和重度[1]。在此过程中涉及众多重要因素和分子机制,包括:抑癌基因表达的缺失[2],上皮-间充质转化(epithelial to mesenchymal transition,EMT)[3],杂合性缺失[4],表观遗传学的改变[5]等。其中上皮-间充质转化是上皮恶性转变的一个重要环节,其特点是上皮细胞逐渐失去其上皮细胞特征,而获得间充质细胞特征的现象[6]。目前已明确与口腔黏膜上皮EMT过程相关的因子包括细胞表面蛋白、细胞骨架蛋白、细胞外基质蛋白以及各种转录因子等[7]。研究发现肿瘤中上皮标记物E-钙黏素(E-cadherin)表达降低是EMT的一个重要分子特征,有研究表明,启动子区高甲基化是E-cadherin表达下调的重要原因[8]。Twist1作为E-cadherin的抑制剂,促进EMT进程[9],而且Twist1启动子区甲基化与结肠直肠癌、乳腺癌、扁桃体癌等肿瘤的发生发展关系密切[8, 10, 11]。目前,在口腔黏膜上皮异常增生中Twist1的表达以及启动子甲基化状态还未见研究报道。因此,本研究通过检测Twist1与E-cadherin在上皮异常增生过程中的表达水平和甲基化状态探讨其在病变发展过程中的变化趋势及意义。
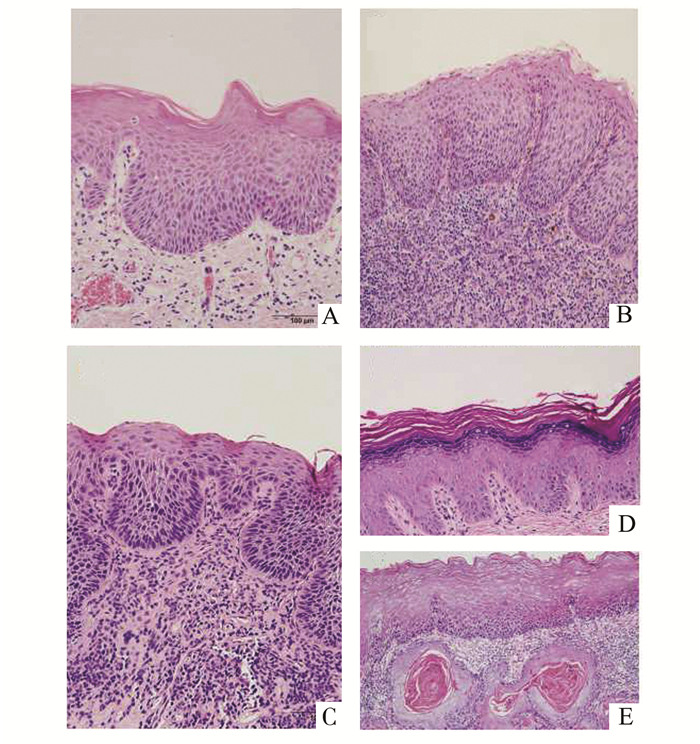
1 材料与方法 1.1 临床资料来自武汉大学口腔医院2007年10月至2011年4月间口腔黏膜上皮异常增生54例(其中轻度19例,中度17例,重度18例),以口腔单纯过度角化9例和口腔鳞癌8例作为阴性或阳性对照,口腔上皮异常增生的诊断与分级参照2005年WHO的标准[12](图 1)。
|
图 1 不同程度口腔上皮异常增生的HE染色切片(×200) A.口腔上皮轻度异常增生; B.口腔上皮中度异常增生; C.口腔上皮重度异常增生; D.口腔单纯过度角化; E.鳞癌 |
组织切片常规烤箱烘烤、脱水,免疫荧光按照说明书提示进行,滴加生物素化山羊抗兔IgG (中杉金桥,北京)后,37℃孵育2 h,TBS-T冲洗切片3次,每次5 min。在2%BSA缓冲液中37℃孵育10 min,TBS-T冲洗切片3次,每次5 min,然后滴加链霉素共轭量子点QDs605(稀释比例1:100,武汉珈源量子点有限公司),使用90%甘油进行边缘封闭。使用荧光显微镜进行观察。结果计分标准:阴性(0)或弱阳性(+)记为低表达,阳性(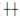

将组织块切成10 μm厚,依组织块大小切取50-70片,舍弃暴露在空气中的前3片。根据石蜡包埋组织DNA提取试剂盒(E.Z.N.A. FFPE DNA Kit,OMEGA Bio-tek公司,美国)说明提取基因组DNA,-80℃保存备用。
1.4 细胞培养本实验所用细胞系为实验室购买并长期保存,包括SCC-9,SCC-15,SCC-23,SCC-25以及Cal27五种细胞系。将冻存的细胞复苏后常规培养在含10%胎牛血清的DMEM培养基中,培养环境为37℃,5% CO2。待细胞生长至80%-90%单层融合时用胰酶消化或用干净的细胞刮子以顺时针方向将细胞刮下,提取细胞基因组DNA。
1.5 PCR以基因组DNA为模板,进行Twist1与E-cadherin的PCRTwist1上游引物:5′-AGAGACTCTGGAGCTGGATAACT-3′; 下游引物:5′-CAGAATGCAGAGGTGTGGG-3′。E-cadherin上游引物:5′-CCACCCCCAAAGAAAATACA-3′; 下游引物5′-GGGGGTTAAGTTGAGGGGTA-3′(生工生物,上海)。扩增条件如下:98℃, 10 s; 55℃30 s; 72℃, 30 s; 30个循环(Takara TaqTM hot start Version日本)。取10 μl的PCR产物加入2 μl的6×Loading buffer在1.5%的琼脂糖凝胶中电泳后用Bio-rad的凝胶成像仪拍照。
1.6 甲基化特异性PCR反应(MSP)首先对gDNA进行甲基化修饰(EZ DNA Methylation-LightingTMkit,美国)。甲基化修饰后的DNA进行甲基化特异性PCR反应,检测所研究的对象是否存在目的基因甲基化现象。甲基化特异性引物序列见表 1。Twist1(TM)上游引物:5′-TTTCGGATGGGGTTGTTATC-3′; 下游引物:5′-AAACGACCTAACCCGAACG-3′。非甲基化Twist1(TUM)上游引物:5′-TTTGGATGGGGTTGTTATTGT-3′; 下游引物:5′-CCTAACCCAAACAACCAACC-3′。甲基化E-cadherin (EM)上游引物:5′-GGTGAATTTTTAGTTAATTAAGCGGTAC-3′; 下游引物:5′-CATAACTAACCGAAAACGCCG-3′。非甲基化E-cadherin (EUM)上游引物:5′-GGTAGGTGAATTTTTAGTTAATTAGTGGTA-3′; 下游引物5′-ACCCATAACTAACCAAAAACACCA-3′。MSP反应条件:95℃,10 min;95℃,30 s,55℃,40 s,72℃,40 s,38个循环(Zymo TaqTMPreMix, 美国)。取25 μl MSP引物加入5 μl 6×Loading buffer,用1.5%的琼脂糖凝胶电泳后用Bio-rad的凝胶成像仪拍照。
| 表 1 MSP的引物序列TUM-Twist1非甲基化、TM-Twist1甲基化、EUM-E-cadherin非甲基化、EM-E-cadherin甲基化 |
MSP电泳后结果判定标准:只出现甲基化条带,表示为完全甲基化,记为甲基化阳性(+);既出现甲基化条带又出现非甲基化条带,表示为不完全甲基化,记录为甲基化阳性(+);只出现非甲基化条带,未出现甲基化条带,表示为非甲基化,记为甲基化阴性(-)。甲基化率(%)=甲基化样本例数/全部样本例数×100%。
采用SPSS 17.0软件进行统计学分析,所有计数资料采用卡方检验,结果用χ2和P表示,当P≤0.05时为差异有统计学意义。
2 结果 2.1 Twist1在口腔黏膜异常增生中表达异常Twist1在口腔黏膜中表达情况如图 2。Twist1在细胞核中表达,其在不同病变程度中的表达结果见表 2。Twist1在单纯过度角化中全部为低表达,在轻、中、重度异常增生中,高表达的比例依次为37.5%、57.1%、65%,在口腔癌中全部为高表达。Twist1在口腔黏膜单纯过度角化与异常增生中表达程度的差异,与中、重度异常增生,口腔癌中表达程度的差异均具有统计学意义(P<0.05)。
|
图 2 量子点免疫荧光检测 A、B、C、D、E分别为Twist1在口腔上皮轻、中、重度异常增生、口腔单纯过度角化和鳞癌中的表达 |
| 表 2 量子点免疫荧光检测Twist1在组织中的表达 |
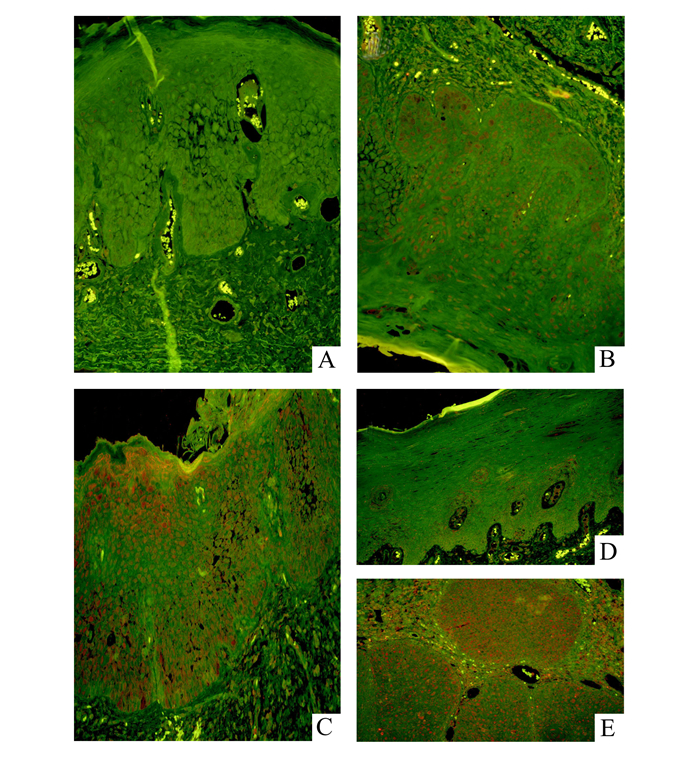
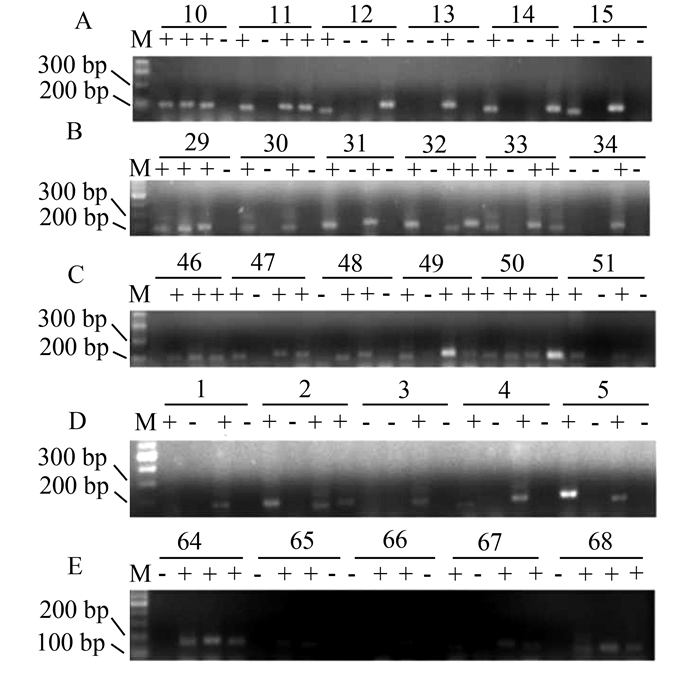
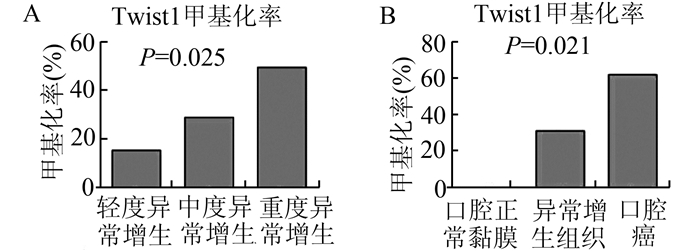
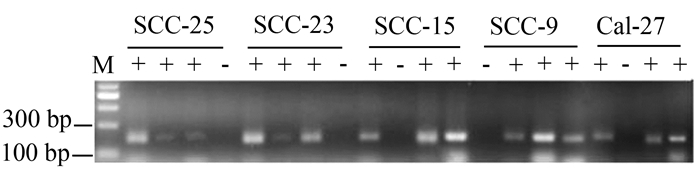
口腔黏膜异常增生中Twist1启动子甲基化率见图 3A-3C。在口腔黏膜轻、中、重度异常增生中,甲基化率依次为15.8%,29.4%,50%,具有统计学差异(P<0.05,图 4A)。而在口腔黏膜良性病变单纯过度角化中(图 3D),并没有检测到Twist1启动子甲基化的改变。口腔癌的组织中Twist1启动子的甲基化为62.5%(图 3E);口腔癌细胞系中Twist1甲基化率60%(图 5)。上述3组之间,Twist1甲基化率差异有统计学意义(图 4B,P<0.05)。
|
图 3 MSP检测口腔黏膜异常增生Twist1和E-cadherin甲基化琼脂糖凝胶电泳部分结果 A、B、C:分别为口腔黏膜轻、中、重的异常增生;D:口腔黏膜单纯过度角化;E:口腔癌。每一例组织结果从左至右分别为TUM (Twist1非甲基化)、TM (Twist1甲基化)、EUM (E-cadherin非甲基化)、EM (E-cadherin甲基化)。 |
|
图 4 Twist1甲基化在口腔黏膜中表达结果的统计 A:口腔黏膜轻、中、重度异常增生中的甲基化率依次为15.8%、29.4%、50%,P=0.025;B:Twist1在口腔单纯过度角化、异常增生组织、口腔癌中的甲基化率依次为0, 31.5%, 62.5%,P=0.021。 |
|
图 5 MSP检测口腔鳞癌细胞系Twist1和E-cadherin甲基化琼脂糖凝胶电泳结果 每一例组织结果从左至右分别为TUM (Twist1非甲基化)、TM (Twist1甲基化)、EUM (E-cadherin非甲基化)、EM (E-cadherin甲基化) |
口腔黏膜黏膜良性单纯过度角化病变中(图 3D)、口腔黏膜异常增生(图 3A-3C)及口腔癌(图 3E)中,E-cadherin启动子甲基化率随着病变程度加重而呈升高趋势,分别为33.3%、50%、62.5%,但差异无显著性(P>0.05),随着病变程度加重而呈不断升高趋势; 口腔癌细胞系和组织中,E-cadherin启动子甲基化率分别为60%,62.5%(图 5,3E)。在口腔黏膜轻、中、重度异常增生中(图 3A-3C),E-cadherin启动子区的甲基化率依次为52.6%,47.1%,50%,但均未显示统计学意义差异(P>0.05)。
2.4 Twist1启动子甲基化与E-cadherin启动子甲基化间的关系对Twist1及E-cadherin启动子区甲基化的Spearman相关性研究表明,相关系数r=0.574,双侧Pearson检验P=0.312,无统计学意义。
3 讨论口腔癌的发生是一个多阶段的过程,涉及到若干因素的相互作用,例如吸烟相关的口腔内致癌物,咀嚼槟榔、饮酒、病毒感染等[13, 14],最终导致癌基因活化与抑癌基因失活。口腔癌常由潜在的恶性病损(癌前病变)发展而来,如口腔上皮异常增生(OED),故对此研究有重要意义。我们前期的研究表明,在EMT过程中发挥重要作用的两个基因-Twist1和E-cadherin,随口腔黏膜异常增生程度加重其表达升高。目前虽无研究报道Twist1在不同程度上皮异常增生中的表达趋势,但Ohba [15]等人在156例肾细胞癌中检测Twist1的表达,发现其随着肿瘤临床分级的升高而升高,这与我们的结果相似。在口腔异常增生及口腔癌中表达异常(文章待发表)。Alvarado等人[16]显微切割了两种细胞-上层的角化细胞和下一半的基底层细胞,从两种细胞中提取DNA并使用MSP检测E-cadherin甲基化水平。结果表明,在免疫组织化学染色确定E-cadherin低表达的基底层细胞呈过甲基化状态,角化细胞相反。因此,该结果提示及其上皮异常增生中E-cadherin表达缺失可能与其启动子过甲基化相关。Twist1启动子甲基化与肿瘤发生的关系已在多种肿瘤中被证实,但在口腔上皮异常增生还未见文献报道。本文针对在EMT过程中发挥重要作用的两个基因-Twist1及E-cadherin的启动子甲基化状态与口腔黏膜上皮癌前病变的不同阶段进行了研究。
本研究结果显示,Twist1启动子区甲基化随口腔黏膜异常增生程度加重而升高,提示Twist1启动子甲基化与肿瘤的发生密切相关,这一结果与Kwon等[11]在口咽癌中的研究结果相一致,同时他们的结果证明,Twist1启动子甲基化是衡量肿瘤的预后及淋巴结转移的一个指标。在乳腺肿瘤中,良性叶状肿瘤的Twist1甲基化率明显低于恶性叶状肿瘤及临界瘤[17],这也与我们对口腔黏膜异常增生、口腔黏膜上皮单纯过度角化及口腔癌中Twist1启动子甲基化的检测结果相一致。姜凤全等人[18]对膀胱肿瘤组织及癌旁组织进行检测,结果表明在肿瘤组织中Twist1甲基化率为88.5%(69/78),癌旁组织为11.5%(9/78),但在本研究中口腔黏膜良性病变并未检测到Twist1甲基化,其原因可能为本研究中所检测的口腔黏膜上皮良性病变单纯过度角化并非与口腔癌组织来源于同一个体,而在口腔癌的癌旁正常组织中是否有Twist1甲基化出现仍需进一步研究。
本研究中,尽管E-cadherin启动子甲基化在口腔正常组织、异常增生组织、口腔癌中的差异不具有显著性,但E-cadherin启动子甲基化率仍呈升高趋势,该结果与Guo[19]在食管黏膜病变中的研究一致。此外,本研究结果显示,E-cadherin甲基化率在口腔黏膜单纯过度角化与口腔癌中分别为33.3%和62.5%,未显示统计学差异; 在不同程度的口腔黏膜异常增生E-cadherin启动子甲基化也未显示显著差异。究其原因可能与本实验样本数量有关;其次石蜡包埋组织中基因组DNA发生了不同程度的降解;再次,尽管肿瘤中E-cadherin启动子甲基化的研究报道很多,但口腔黏膜异常增生中研究报道较少,对本研究的这种现象有待进一步深入研究证实。此外,E-cadherin启动子在口腔正常上皮黏膜上皮单纯过度角化中就出现甲基化,意味着E-cadherin与Twist1不同,它并不是在病变早期才开始出现甲基化。
| [1] | Napier SS, Speight PM. Natural history of potentially malignant oral lesions and conditions: an overview of the literature[J]. J Oral Pathol Med, 2008, 37: 1-10. |
| [2] | Kong CS, Cao H, Kwok S, et al. Loss of the p53/p63 target PERP is an early event in oral carcinogenesis and Correlates with Higher Rate of Local relapse[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2013, 115(1): 95-103. DOI: 10.1016/j.oooo.2012.10.017. |
| [3] | Tsai JH, Yang J. Epithelial-mesenchymal plasticity in carcinoma metastasis[J]. Genes Dev, 2013, 27(20): 2192-2206. DOI: 10.1101/gad.225334.113. |
| [4] | Bradley G, Odell EW, Raphael S, et al. Abnormal DNA content in oral epithelial dysplasia is associated with increased risk of progression to carcinoma[J]. Br J Cancer, 2010, 103(9): 1432-1442. DOI: 10.1038/sj.bjc.6605905. |
| [5] | Yang Y, Li YX, Yang X, et al. Progress risk assessment of oral premalignant lesions with saliva miRNA analysis[J]. BMC Cancer, 2013, 13: 129. DOI: 10.1186/1471-2407-13-129. |
| [6] | Weinberg RA. Twisted epithelial-mesenchymal transition blocks senescence[J]. Nat Cell Biol, 2008, 10: 1021-1023. DOI: 10.1038/ncb0908-1021. |
| [7] | Scanlon CS, Van Tubergen EA, Inglehart RC, et al. Biomarkers of Epithelial-Mesenchymal Transition in Squamous Cell Carcinoma[J]. J Dent Res, 2013, 92(2): 114-121. DOI: 10.1177/0022034512467352. |
| [8] | van Roy F, Berx G. The cell-cell adhesion molecule E-cadherin[J]. Cell Mol Life Sci, 2008, 65(23): 3756-3788. DOI: 10.1007/s00018-008-8281-1. |
| [9] | Galván JA, Helbling M, Koelzer VH, et al. TWIST1 and TWIST2 promoter methylation and protein expression in tumor stroma influence the epithelial-mesenchy-mal transition-like tumor budding phenotype in colorectal cancer[J]. Oncotarget, 2015, 6(2): 874-885. DOI: 10.18632/oncotarget. |
| [10] | Pang JM, Dobrovic A, Fox SB. DNA methylation in ductal carcinoma in situ of the breast[J]. Breast Cancer Res, 2013, 15(3): 206. DOI: 10.1186/bcr3420. |
| [11] | Kwon MJ, Kwon JH, Nam ES, et al. TWIST1 promoter methylation is associated with prognosis in tonsillar squamous cell carcinoma[J]. Hum Pathol, 2013, 44(9): 1722-1729. DOI: 10.1016/j.humpath.2013.03.004. |
| [12] | Driemel O, Hertel K, Reichert TE, et al. Current classification of precursor lesions of oral squamous cell carcinoma principles of the WHO classification 2005[J]. Mund Kiefer Gesichtschir, 2006, 10(2): 89-93. DOI: 10.1007/s10006-006-0675-3. |
| [13] | Campo-Trapero J, Cano-Sánchez J, Palacios-Sánchez B, et al. Update on molecular pathology in oral cancer and precancer[J]. Anticancer Res, 2008, 28: 1197-1205. |
| [14] | Franceschi S, Bidoli E, Herrero R, et al. Comparison of cancers of the oral cavity and pharynx worldwide, etiological clues[J]. Oral Oncol, 2000, 36: 106-115. DOI: 10.1016/S1368-8375(99)00070-6. |
| [15] | Ohba K, Miyata Y, Matsuo T, et al. High expression of Twist is associated with tumor aggressiveness and poor prognosis in patients with renal cell carcinoma[J]. Int J Clin Exp Pathol, 2014, 7(6): 3158-3165. |
| [16] | Alvarado CG, Maruyama S, Cheng J, et al. Nuclear translocation of beta-catenin synchronized with loss of E-cadherin in oral epithelial dysplasia with a characteristic two-phase appearance[J]. Histopathology, 2011, 59(2): 283-291. DOI: 10.1111/his.2011.59.issue-2. |
| [17] | Do SI, Kim JY, Kang SY, et al. Expression of TWIST1, Snail, Slug, and NF-κB and methylation of the TWIST1 promoter in mammary phyllodes tumor[J]. Tumour Biol, 2013, 34(1): 445-453. DOI: 10.1007/s13277-012-0569-y. |
| [18] |
姜凤全, 杨春, 陈阵. 膀胱肿瘤组织及尿液标本中TWIST1基因的甲基化水平研究[J].
中华癌症杂志, 2014, 24 (3): 161-164.
Jiang FQ, Yang C, Chen Z. Hypermethylation of TWIST1 gene in tumor tissues and voided urine in bladder cancer patients[J]. China Oncology, 2014, 24(3): 161-164. |
| [19] | Guo M, Ren J, House MG, et al. Accumulation of promoter methylation suggests epigenetic progression in squamous cell carcinoma of the esophagus[J]. Clin Cancer Res, 2006, 12(15): 4515-4522. DOI: 10.1158/1078-0432.CCR-05-2858. |
 2016, Vol. 37
2016, Vol. 37

 ,
,  )或强阳性(
)或强阳性( )记为高表达
)记为高表达