2. 武汉市第五医院 血液内分泌科 湖北 武汉 430050
2. Dept. of Endocrinology, The Fifth Hospital of Wuhan, Wuhan 430050, China
恶性肿瘤的发病率逐年上升,全球每年新增大约400 000例头颈部肿瘤患者,按照治疗原则,早期患者可采用单纯根治性放疗,而局部晚期患者同步放化疗是确切有效的治疗手段[1, 2]。在头颈部肿瘤治疗中,无论是同步放化疗还是单纯放疗,都将对外周血细胞产生影响,本文就同步放化疗和单纯放疗患者外周血常规中各主要指标的变化进行回顾性分析,探讨其临床意义,并为临床治疗提供依据。资料来自我院肿瘤中心2008年7月1日-2013年8月10日入院的118例头颈部肿瘤患者,具体报告如下。
1 临床资料 1.1在118例头颈部肿瘤中,鼻咽癌64例,喉癌10例,下咽癌5例,腮腺癌5例,舌癌5例,副鼻窦癌8例,口咽癌3例,其他18例; 同步放化疗组共54例,其中男性46例,女性8例,中位年龄46岁; 单纯放疗组共64例,其中男性47例,女性17例,中位年龄55岁。
1.2 治疗方案两组病例放疗均采用医用直线加速器调强放疗,常规分割,放疗剂量为60-74 Gy,6-7周完成放疗。同步放化疗组化疗方案为单药顺铂100 mg/m2,21 d一个周期。治疗期间每周查一次外周血常规。
1.3 统计方法采用SPSS 18.0对数据进行统计分析,计量资料采用均数±标准差表示(x±s),均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果 2.1 同步放化疗组外周血常规各主要指标变化情况同步放化疗组白细胞从放疗第2周开始有显著下降(P<0.05),在第6周时达最低(P<0.05)最低值2.40×109/L。中性粒细胞在放疗第5周时出现显著下降,疗末达最低(P<0.05),最低值1.00×109/L。淋巴细胞下降最敏感,从放疗第1周开始就有显著的下降(P<0.05),在放疗后期保持较低水平,最低值0.11×109/L。单核细胞变化不明显,整个治疗过程中无明显变化(P>0.05)。红细胞从治疗第1周开始就有显著下降(P<0.05),第6周时达最低(P<0.05),最低值3.6×1012/L。血小板从第2周开始有显著下降(P<0.05),在放疗后期保持较低水平,最低值94.93×109/L。详细数据见表 1。
| 表 1 同步放化疗对头颈部肿瘤外周血细胞的影响(n=54) |
单纯放疗组白细胞从放疗第4周开始有显著下降(P<0.05),最低值3.73×109/L。中性粒细胞在整个治疗过程中无显著下降(P>0.05);淋巴细胞从放疗第1周开始就有显著下降(P<0.05),并持续性降低,在放疗末保持较低水平,最低值0.3×109/L。单核细胞和红细胞在整个治疗过程中均无显著下降(P>0.05);血小板从放疗第1周开始有显著下降,整个治疗过程中均显著低于疗前(P<0.05),最低值136.32×109/L。详细数据见表 2。
| 表 2 单纯放疗对头颈部肿瘤外周血细胞的影响(n=64) |
从图 1A可见,同步放化疗组白细胞从放疗第2周时明显下降,并呈持续性降低,在放疗末达最低,最低值在2×109/L以上,未出现Ⅲ度以下的白细胞降低; 单纯放疗组白细胞在整个放疗期间下降趋势较缓,最低值在3×109/L以上。从图 1B可见,同步放化疗组中性粒细胞变化呈下降趋势,但中性粒细胞最低值在1×109/L以上,未出现Ⅲ度以下的中性粒细胞降低; 单纯放疗组中性粒细胞变化趋势呈水平样,整个治疗期间变化不明显。从图 1C可见,淋巴细胞无论是同步放化疗组还是单纯放疗组,在放疗期间均持续下降,在放疗后期保持在较低水平。从图 1D可见,单核细胞在同步放化疗组和单纯放疗组均呈波动性改变。从图 1E可见,同步放化疗组红细胞呈持续性下降,在放疗末达最低,而单纯放疗组变化不明显,变化趋势呈水平样。从图 1F可见,同步放化疗组血小板在放疗第2周和第3周时下降较陡,后保持在一个较低水平,但最低值在75×109/L以上; 而单纯放疗组在放疗第1周时下降明显,后一直保持稍低水平,但均在正常范围内。
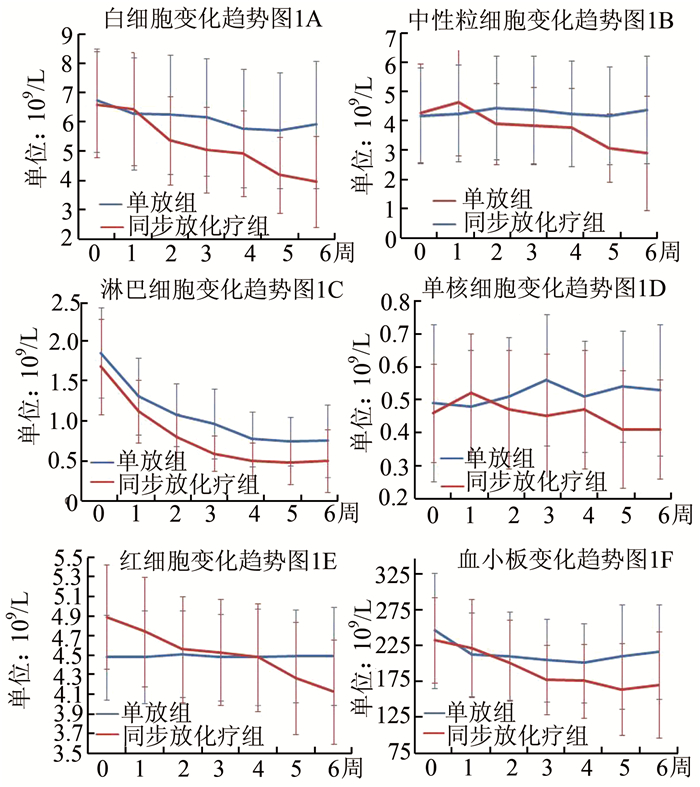
|
图 1 两组外周血常规主要指标变化趋势图 |
外周血细胞主要由白细胞、红细胞和血小板组成,均由骨髓的造血细胞产生[3]。白细胞主要包括中性粒细胞、淋巴细胞和单核细胞等,在机体的免疫功能中起着重要作用。红细胞作为呼吸载体从肺部携带氧输送至全身,并将全身组织中的二氧化碳运送至肺而呼出体外,这一功能主要由其内的血红蛋白完成。血小板来源于骨髓的巨核细胞,在机体止凝血中发挥重要作用。头颈部肿瘤的放、化疗均对以上的血细胞产生一定的影响。
中性粒细胞占白细胞的50%-70%,为免疫细胞,帮助机体清除外来病原体,并通过产生的大量细胞因子和细胞表面分子与机体其他免疫细胞产生交互作用[4]。白细胞减少、尤其中性粒细胞减少是肿瘤化疗的常见并发症,可限制化疗药物的用量和治疗的连续性。本研究显示:单纯放疗组白细胞和中性粒细胞的降低不明显,但在同步放化疗组均呈逐渐下降趋势,这是因为白细胞、特别是中性粒细胞对化疗更为敏感。
在头颈部肿瘤的放疗中,外周血淋巴细胞内的DNA易受放射线的破坏,容易导致淋巴细胞的下降[5]。高力英等[6]应用流式细胞仪对46例头颈部鳞癌患者外周血淋巴细胞亚群进行检测发现:在放化疗综合治疗前后的B细胞、CD4+/CD8+比值在放疗前后变化明显。本研究也表明,无论是单纯放疗组还是同步放化疗组,其淋巴细胞均在放疗1周时开始出现显著下降,整个治疗期间均低于疗前水平,表明淋巴细胞对放射治疗敏感。淋巴细胞是构成机体免疫防御系统的要素之一,肿瘤患者容易出现免疫抑制现象,其免疫细胞活性下降,容易导致肿瘤的复发和转移; 而且淋巴细胞对放化疗敏感,所以治疗期间保护及促进患者的免疫功能显得尤为重要,对肿瘤患者进行免疫调节治疗是必要的[7, 8]。
在头颈部肿瘤放疗期间,外周血红细胞和血小板受辐射的影响不明显[9],本实验显示:在单纯放疗组,红细胞无显著下降,血小板在放疗1周时有轻度降低,但一直保持在正常水平,其受放射治疗的影响不大。
Fadul等[10]的研究显示:放疗联合替莫唑胺治疗脑胶质瘤,单核细胞数在整个治疗期间没有显著意义的变化,并且在放疗完成后单核细胞仍保持分化成熟为树突状细胞的功能。我们的研究也显示单核细胞数无论是同步放化疗组还是单纯放疗组,在整个治疗期间均无显著下降。
顺铂是常见的铂类抗肿瘤药物,与放疗同步治疗头颈部肿瘤,效果明确,其骨髓抑制作用相对较轻,发生几率与疗程及剂量有关[11, 12]。大量研究证明铂类是治疗头颈部鳞癌最为有效的化疗药物,与单药顺铂比较,多药联合化疗虽然提高了治疗反应率,但并没有增加患者生存时间[13]。为了不增加患者毒副反应,尽可能提高局部放疗剂量,提高局控率,本肿瘤中心同步放化疗期间采用单药顺铂方案化疗。我们的研究显示:同步放化疗组白细胞、中性粒细胞、血小板和红细胞均呈下降趋势,最后两周下降较为明显,因此在疗末对外周血的监测更为必要。
综上所述,在头颈部肿瘤放疗中,淋巴细胞受放疗的影响较大,治疗期间保护和促进患者免疫功能是必要的。其他外周血细胞受单纯放疗的影响较小; 单药顺铂方案的同步放化疗除了对淋巴细胞的影响外,其对白细胞、中性粒细胞、红细胞、血小板的影响也较为明显,特别是疗末的下降更为明显,疗末的外周血象监测更为必要。
| [1] | Junn JC, Kim IA, Zahurak ML, et al. Multidisciplinary service utilization pattern by advanced head and neck cancer patients: a single institution study[J]. Int J Otolaryngol, 2012, 2012: 628578. |
| [2] | Pfister DG, Ang KK, Brizel DM, et al. Head and neck cancers, version 2.2013. Featured updates to the NCCN guidelines[J]. J Natl Compr Canc Netw, 2013, 11(8): 917-923. |
| [3] | 陈文彬, 王友赤, 汤美安, 等. 诊断学[M]. 第5版. 北京: 人民卫生出版社, 2001: 236-251. |
| [4] | 念学武, 孙二琳, 韩瑞发. 中性粒细胞免疫调节作用的研究进展[J]. 国际免疫学杂志, 2014, 37(5): 394-397. |
| [5] | Kadam SB, Shyama SK, Almeida VG. Evaluation of the in vivo genotoxic effects of gamma radiation on the peripheral blood leukocytes of head and neck cancer patients undergoing radiotherapy[J]. Mutat Res, 2013, 752(1-2): 42-46. DOI: 10.1016/j.mrgentox.2013.01.003. |
| [6] | 高力英, 田晓刚, 冉俊涛, 等. 头颈部鳞癌同步放化疗患者外周血淋巴细胞亚群变化的研究[J]. 现代肿瘤医学, 2011, 19(4): 666-668. |
| [7] | Motz GT, Coukos G. Deciphering and reversing tumor immune suppression[J]. Immunity, 2013, 39(1): 61-73. DOI: 10.1016/j.immuni.2013.07.005. |
| [8] | Helmy KY, Patel SA, Nahas GR, et al. Cancer immunotherapy: accomplishments to date and future promise[J]. Ther Deliv, 2013, 4(10): 1307-1320. DOI: 10.4155/tde.13.88. |
| [9] | Momm F, Bechtold C, Rudat V, et al. Alteration of radiation-induced hematotoxicity by amifostine[J]. Int J Radiat Oncol Biol Phys, 2001, 51(4): 947-951. DOI: 10.1016/S0360-3016(01)01710-2. |
| [10] | Fadul CE, Fisher JL, Gui J, et al. Immune modulation effects of concomitant temozolomide and radiation therapy on peripheral blood mononuclear cells in patients with glioblastoma multiforme[J]. Neuro Oncol, 2011, 13(4): 393-400. DOI: 10.1093/neuonc/noq204. |
| [11] | Vivek RS, Baludavid M, Mohanram R, et al. Concurrent chemo-irradiation using accelerated concomitant boost radiation therapy in loco-regionally advanced head and neck squamous cell carcinomas[J]. J Cancer Res Ther, 2006, 2(3): 90-96. DOI: 10.4103/0973-1482.27582. |
| [12] | Lin JC, Jan JS, Hsu CY. Pilot study of concurrent chemotherapy and radiotherapy for stage Ⅳ nasopharyngeal cancer[J]. Am J Clin Oncol, 1997, 20(1): 6-10. DOI: 10.1097/00000421-199702000-00002. |
| [13] | Hoffmann TK. Systemic therapy strategies for head-neck carcinomas: Current status[J]. GMS Curr Top Otorhinolaryngol Head Neck Surg, 2012, 11: doc03. |
 2016, Vol. 37
2016, Vol. 37

